Гемостаз. Обновка гемостаза. Лекция35гемостаз pdf До настоящего времени для понимания механизмов гемостаза использовали каскадную
 Скачать 1.65 Mb. Скачать 1.65 Mb.
|
|
Активаторы фибринолиза - превращают плазминоген в плазмин. Делятся на плазменные и тканевые: Плазменные активаторы включают 3 группы веществ: различные фосфатазы плазмы крови - они находятся в активном состоянии - это активные (прямые) активаторы (физиологические). Кроме того, трипсин: вырабатывается в поджелудочное железе, попадает в 12-перстную кишку, там всасывается в кровь. В норме трипсин находится в крови в виде следов. При поражении поджелудочной железы концентрация трипсина в крови резко возрастает. Он полностью расщепляет плазминоген, что приводит к резкому снижению фибринолитической активности. Активность урокиназы - она вырабатывается в юкстагломерулярном аппарате почек. Встречается в моче, поэтому моча может обладать слабой фибринолитической активностью. Активаторы бактериального происхождения - стрепто- и стафиллокиназы. Непрямые активаторы - находятся в плазме в неактивном состоянии, для их активации нужны белки лизокиназы: тканевые мукокиназы - активируются при травме тканей; плазменные лизокиназы - самый важный XII фактор свертывания крови. Тканевые активаторы - находятся в тканях. Их особенности: тесно связаны с клеточной структурой и освобождаются лишь при повреждении ткани; всегда находятся в активном состоянии; сильное, но ограниченное действие. Ингибиторы делятся на: ингибиторы, препятствующие превращению плазминогена в плазмин; препятствующие действию активного плазмина. Сейчас существуют искусственные ингибиторы, которые используются для борьбы с кровотечениями: Е-аминокапроновая кислота, контрикал, трасилол. 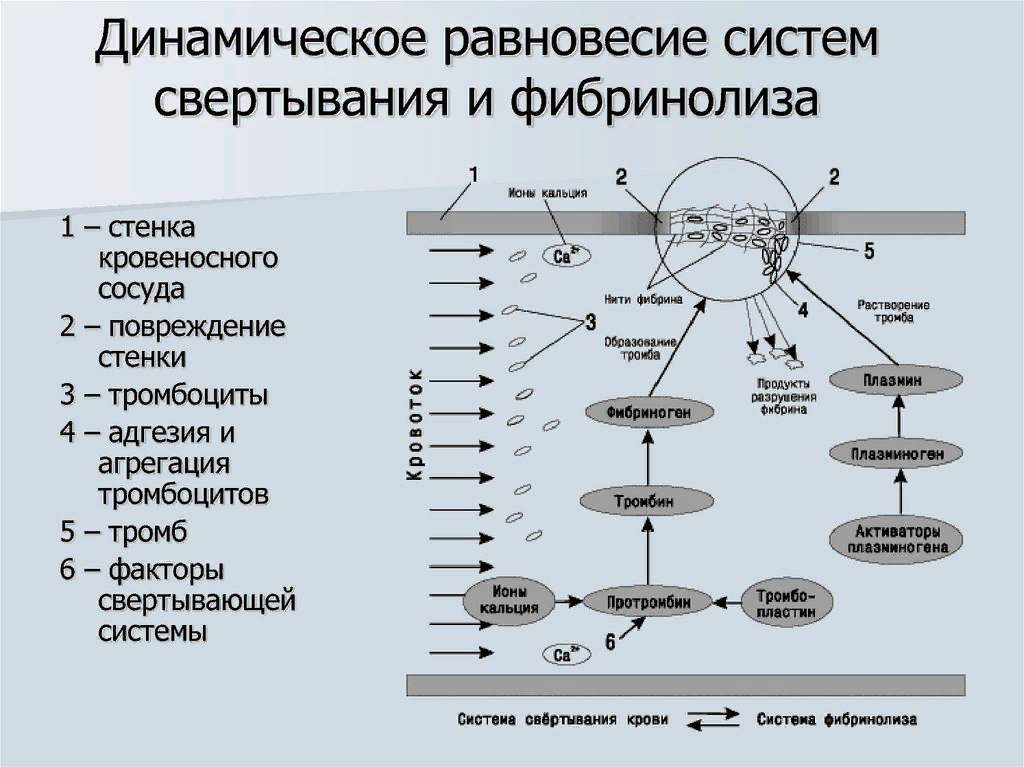 Взаимосвязь системы свертывания крови и системы фибринолиза В нормальных условиях взаимодействие системы свертывания крови и системы фибринолиза происходит таким образом: в сосудах постоянно идет микросвертывание, что вызвано постоянным разрушением старых тромбоцитов и выделением из них в кровь тромбоцитарных факторов. В результате образуется фибрин, который останавливается при образовании фибрина S, который тонкой пленкой выстилает стенки сосудов. Нормализуя движение крови и улучшая ее реалогические свойства. Система фибринолиза регулирует толщину этой пленки, от которой зависит проницаемость сосудистой стенки. При активации свертывающей системы активируется и система фибринолиза.  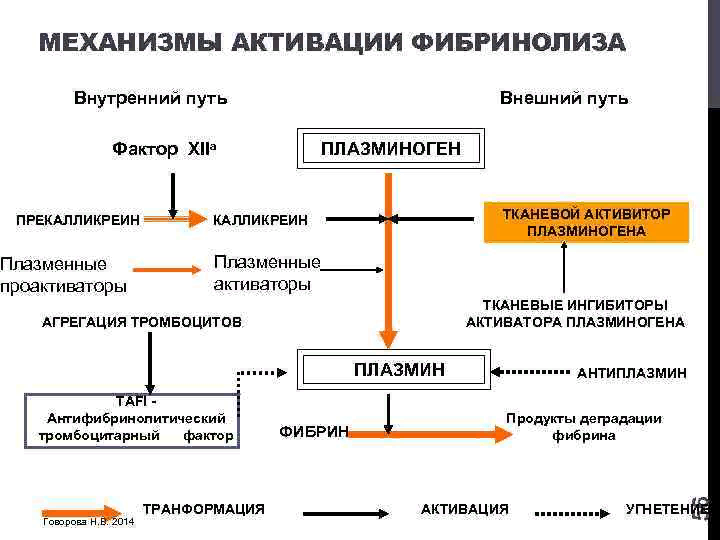 34. Особенности механизмов неспецифической резистентности и иммунной системы у детей. Фагоцитоз.Число фагоцитирующих клеток у плода первых месяцев жизни сравнительно невелико, а поглотительная способность лейкоцитов выражена чрезвычайно слабо. К моменту рождения процент фагоцитирующих клеток возрастает, однако их подвижность и способность к поглощению перед родами и даже во время родов сравнительно низка. После рождения ребенка поглотительная способность лейкоцитов увеличивается. В то же время и нейтрофилы, и моноциты в первые 6 месяцев жизни ребенка не справляются с завершающей фазой фагоцитоза – уничтожением лиганда, что особенно проявляется по отношению к патогенным микроорганизмам. В этом возрасте фагоциты ребенка не способны бороться с пневмококками, что объясняет довольно частое возникновение пневмоний и относительно высокую летальность у грудных детей. У новорожденного ребенка, наряду с несовершенством фагоцитоза, отмечается сравнительно слабая цитотоксичность NK-лимфоцитов, а также низкая способность синтезироватьIfg.В связи с этим у новорожденного имеется склонность к генерализации бактериального воспаления и возникновению сепсиса. При поглощении стафилококков у детей до года, как правило, наблюдается незавершенный фагоцитоз, эти бактерии могут размножаться в фагосоме и даже фаголизосоме. Сказанное объясняется относительной слабостью «кислородного взрыва», а также низким содержанием неферментных катионных белков – лизоцима, миелопероксидазы, лактоферрина и других, участвующих в уничтожении бактерий. Постепенно фагоцитарная активность лейкоцитов увеличивается и к концу первого года жизни приближается к таковой взрослого человека. Система комплемента. Синтез отдельных компонентов системы комплемента у плода осуществляется неравномерно. Уже на 8 неделе гестации у плода можно обнаружить компоненты С2, С4 и С5. В начале 4 месяца беременности у будущего ребенка появляется компонент С1, а в конце 4 месяца – С3, С6, С8 и С9. К этому же сроку у ребенка начинает синтезироваться С1-In, а чуть позже белки В, Р иD. К моменту рождения ребенка концентрация основных компонентов комплемента и регуляторных белков нарастает, однако активность их у плода низка. Остается она также низкой и у новорожденного и составляет не более 50% от активности взрослого человека. Резко снижена у новорожденного активность С1, С2, С3 и С4-компонентов комплемента. Отсюда ясно, что у новорожденных слабо стимулируется как классический, так и альтернативный путь активации системы комплемента. Однако уже к концу первого месяца жизни ребенка уровень и активность основных компонентов комплемента приближается к таковым взрослого человека. Лизоцим. К моменту рождения ребенка содержание лизоцима в сыворотке крови высоко и даже превышает уровень у взрослого человека. Так же велика его активность в слюне и других жидкостях организма. +Интерфероны.У плода перед рождением концентрация интерферонов высока, но в первый год жизни она резко снижается и достигает высоких цифр к моменту полового созревания. Иммунная система у новорожденных У новорождённых иммунная система структурно организована, но функционально несостоятельна. Снижено содержание компонентов комплемента, IgG, IgA и основных популяций иммунокомпетентных клеток. На проникновение инфекционных агентов лимфоидные органы отвечают гиперплазией, проявляющейся лимфаденопатией. В развитии ребёнка выделяют критические периоды, во время которых на антигенный стимул иммунная система даёт неадекватные или парадоксальные реакции. • Первый критический период имунной системы у ребенка — первые 30 сут жизни. Отмечают низкую активность фагоцитов. Лимфоциты способны отвечать на Аг и митогены; гуморальные реакции обусловлены материнскими IgG. • Второй критический период имунной системы у ребенка — 3-6 мес. Материнские AT исчезают из кровотока; в ответ на попадание Аг образуются преимущественно IgM. Дефицит IgA приводит к высокой чувствительности к респираторным вирусным инфекциям (аденовирусы, вирусы парагриппа и др.). Иммунокомпетентные клетки характеризуются низкой активностью. В этот период проявляются ранние наследственные дефекты иммунной системы. • Третий критический период имунной системы у ребенка — 2-й год жизни. Иммунная система полноценно функционирует, появляются значимые количества IgG, но по-прежнему сохраняется дефицит местных защитных факторов, что проявляется в сохранении высокой восприимчивости к бактериальным и вирусным возбудителям. • Четвёртый критический период имунной системы у ребенка — 4-6-й год жизни. Синтез AT, исключая IgA, достигает величин, характерных для взрослых; одновременно повышается содержание IgE. Активность факторов местной защиты остаётся низкой. В этот период проявляются поздние наследственные дефекты иммунной системы. • Пятый критический период имунной системы у ребенка — подростковый возраст. Половые гормоны, синтезируемые в этот период, угнетают иммунные реакции. Как следствие, возможно развитие аутоиммунных и лимфопролиферативных заболеваний, также повышается восприимчивость к микробам. 35.Возрастные изменения физико-химических свойств крови У новорожденных и детей 1-го года жизни кровь по своим физико-химическим свойствам отличается от крови взрослых. Так, у новорожденных выше плотность и вязкость крови, что обусловлено главным образом большей концентрацией эритроцитов. Меньшее количество аминокислот и белков, другой, чем у взрослых, соотношение белковых фракций. К концу первого месяца жизни указанные показатели становятся близкими к таковым у взрослых или даже ниже. Плацентарный кровоток и особенно роды затрудняют газообмен. Поэтому и у плода наблюдается выраженный ацидоз (рН 7,13-7,23). При этом емкость буферных оснований снижена. В течение первых часов (или суток) после рождения ацидоз постепенно исчезает. У новорожденных ниже концентрация белков в плазме (50-56 г / л). Уровня взрослых этот показатель достигает лишь в 3-4 года. Для новорожденных характерна высокая концентрация глобулина, иммунных тел, полученных от матери. До 3 мес содержание их снижается, но со временем за счет образования собственных антител постепенно увеличивается. Концентрация а-и В-глобулинов достигает уровня взрослых к концу 1-го года жизни. В процессе старения физико-химические показатели крови изменяются мало: остаются постоянными рН, осмотическое давление, концентрация Na + и К +, вязкость крови. Но повышаются СОЭ, осмотическая резистентность эритроцитов, уменьшается показатель гематокрита, абсолютная и относительная концентрация альбуминов, уровень глобулинов существенно не меняется (или повышается в основном за счет у-фракций), коэффициент А / Г уменьшается. 36.Возрастные изменения системы гемостаза Система свёртывания крови формируется в процессе внутриутробного развития. Появление коагуляционно-активных белков отмечено на 10-11 неделе беременности. На 4 месяце появляется фибриноген, на 5 - протромбин. По мере внутриутробного развития растёт коагуляционная способность крови. Фибринолитическая активность при этом очень высокая, превышает норму взрослых. У недоношенных детей содержание прокоагулянтов и компонентов фибринолиза ниже, чем у детей, рождённых в срок. У новорожденных почти все факторы свёртывания имеют сниженную или низкую активность по сравнению со взрослыми. Это особенно касается витамин-К-зависимых факторов, уровень которых особенно низок к 3 дню жизни. Затем их активность начинает возрастать за счёт поступления в организм витамина К, синтезируемого бактериальной флорой кишечника, так и созревания белковосинтетической функции гепатоцитов. Содержание же V, VII, XIII факторов плазмы к рождению ребёнка не отличается от их уровня у взрослых. Мало отличаются от взрослых и некоторые показатели общей коагуляционной способности крови: скорость свёртывания крови по Бюркеру, продолжительность кровотечения по Дьюку, время рекальцификации, толерантность плазмы к гепарину. Содержание тромбоцитов у новорожденных равно таковому у взрослых. Однако их функциональная активность (способность к агрегации) снижена. У новорожденных высок уровень гепарина. Гипергепаринемия сохраняется в течение первых 10 дней жизни. Снижена активность у новорожденных тканевого и плазменного антитромбопластинов, антитромбина III, антиактиваторов XI и X факторов. Фибринолитичская активность крови сразу после рождения увеличена, а в течение нескольких дней снижается до уровня взрослых. Уровень плазминогена снижен и нормы взрослых достигает только к 3-6 месяцам. Таким образом, многие факторы свёртывания крови у новорожденных детей имеет сниженную или низкую активность по сравнению со взрослыми. Снижение их активности - явление физиологическое: оно предохраняет новорожденных от тромбозов, которые могут возникнуть в результате повреждения тканей во время родов и попадания в кровь тканевого тромбопластина. Уже к концу первого года жизни показатели свёртывающей и противосвёртывающей систем крови пиближаются к цифрам, свойственным взрослым. Хотя у детей старше 1 года отмечаются индивидуальные колебания, показатели свёртывающей системы крови отличаются относительным постоянством. Большие колебания отмечаются у детей в пре- и пубертатном периодах, что, возможно, объясняется значительной гормональной перестройкой, наблюдаемой в эти периоды жизни. У лиц в возрасте 16-20 до 40-50 лет гемостатический процесс стабилен. В пожилом возрасте происходит сдвиг баланса гемостаза в сторону увеличения прокоагулянтной активности крови и усиления интенсивности внутрисосудистого тромбообразования. Об этом свидетельствует повышение концентрации I, VIII, XIII плазменных факторов свёртывания крови. В ответ на эту перестройку в системе прокоагуляционного гемостаза активируются антикоагулянтное звено и фибринолиз. Однако нарастание фибринолитической и антикоагуляционной активности крови отстаёт от роста её прокоагулянтной способности. В результате коагулянтные свойства крови при старении повышаются. Этому способствует также более выраженное у пожилых, по сравнению с молодыми, повышение прокоагулянтного звена в ответ на активацию симпато-адреналовой системы при стрессе на фоне мало меняющейся фибринолитической активности. С другой стороны, при старении в эндотелии сосудов снижается синтез простациклинов, что вместе с гиперхолистеринемией способствует повышению тромбообразования. Всё это объясняет резкое увеличение с возрастом риска тромбозов и эмболий. Из анализа возрастных изменений крови следует общая закономерность: большая лабильность показателей крови у детей, стабилизация этих показателей с возрастом (от 15 до 60 лет) и вновь "разбалансирование" к старости, когда показатели крови становятся менее устойчивыми и легче отклоняются от нормы при различных воздействиях на организм. |
