Химическое строение моносахаридов. Углеводы Ч2 5 10 2021. Лекция ч 2 5 10 2021 Химическое строение моносахаридов
 Скачать 320 Kb. Скачать 320 Kb.
|
|
Углеводы (лекция ч 2) 5 10 2021 Химическое строение моносахаридов Моносахариды по химической природе являются полигидроксиальдегидами либо полигидроксикетонами. Большинство моносахаридов имеют неразветвленную цепь атомов углерода. Это так называемая открытая форма монозы («оксоформа»). Она представляет собой пятиатомный альдегидоспирт. 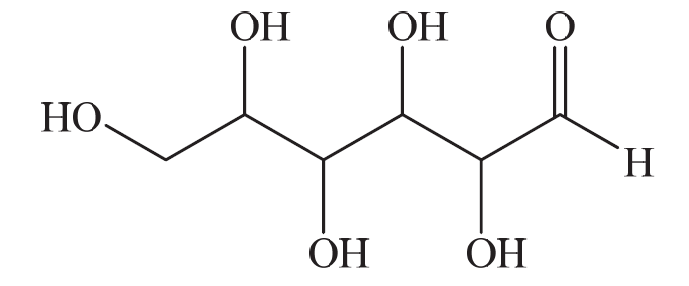 В такой форме монозы существуют в незначительном количестве только в растворах в равновесии с циклическими формами. В кристаллическом состоянии как альдозы, так и кетозы (кроме триоз) имеют другое строение и представляют собой внутренние циклические полуацетали или полукетали полигидроксиальдегидов или полигидроксикетонов. Прежде чем приступить к рассмотрению этих форм моносахаридов, необходимо вспомнить реакцию, ведущую к образованию таких полуацеталей. Они получаются в результате нуклеофильного присоединения молекулы спирта к альдегиду: 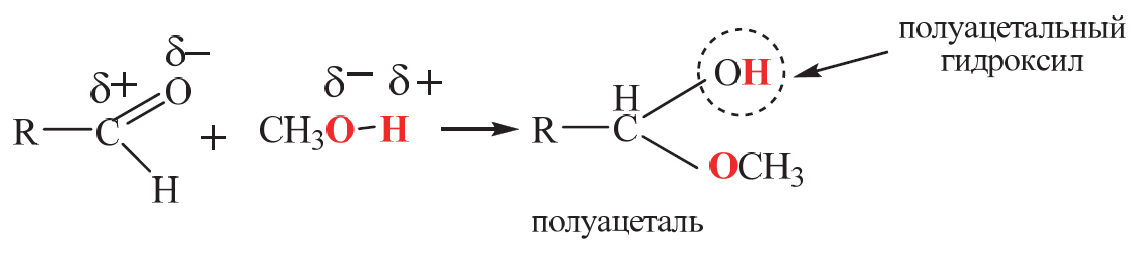 В случае гетерофункциональных соединений, содержащих карбонильную и гидроксильную группы, возможно их внутримолекулярноевзаимодействие с образованием циклического полуацеталя: 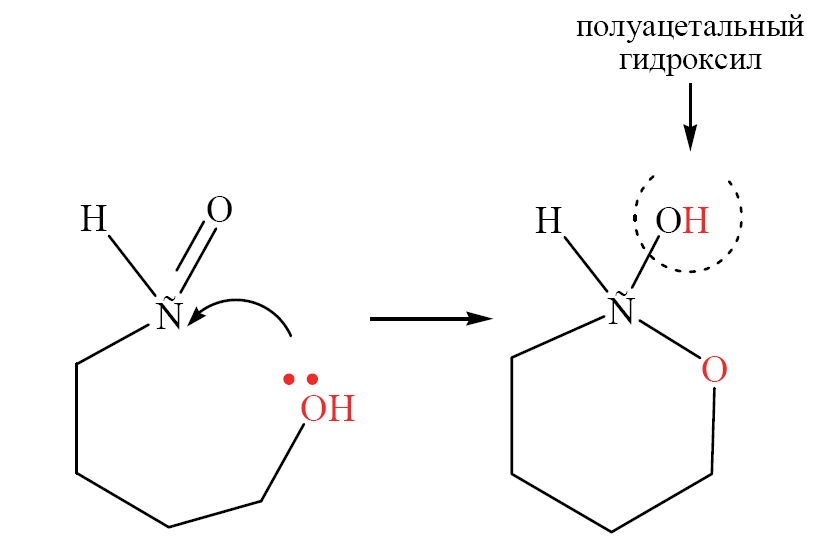 Аналогично циклические формы молекул альдоз образуются в результате взаимодействия альдегидной группы с гидроксильной группой, соединенной с пятым (С5) или четвертым (С4) атомом углерода монозы. Атом кислорода гидроксильной группы образует связь с карбонильным атомом углерода, а к атому кислорода карбонильной группы присоединяется атом водорода. В результате образуются устойчивые циклические полуацетальные формы – пиранозная (шестичленный цикл) либо фуранозная (пятичленный цикл): 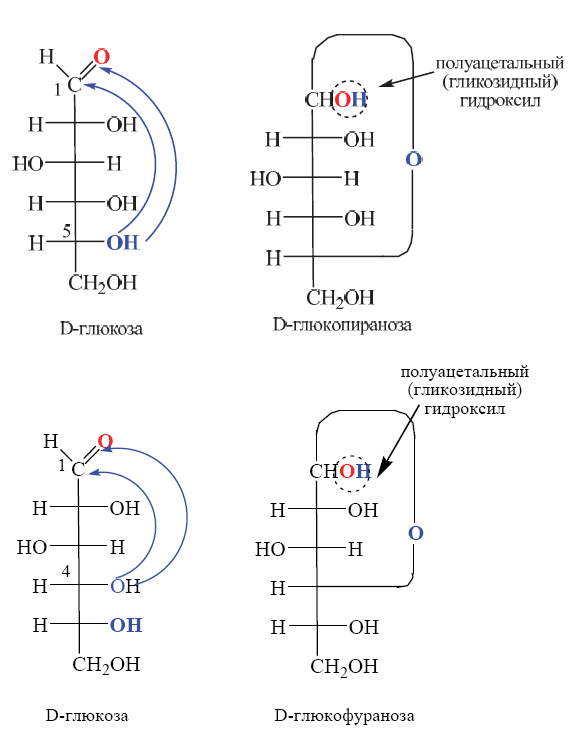 Шестичленный цикл включает 5 атомов углерода и 1 атом кислорода, пятичленный – 4 и 1 соответственно. Для указания размера колец циклических форм моносахаридов две последние буквы в названии «за» заменяют суффиксом «пираноза» для шестичленного цикла, суффиксом «фураноза» для пятичленного цикла. Образование циклических форм моноз сопровождается исчезновением карбонильной группы и появлением простой эфирной связи (внутримолекулярно) и дополнительной гидроксильной группы, которая называется полуацетальной или гликозидной. Стереохимия моноз В молекулах моносахаридов (открытых и циклических) присутствуют асимметрические атомы углерода (хиральные центры). Открытые формы альдотриоз имеют 1 хиральный центр, альдотетроз – 2, альдопентоз – 3, альдогексоз – 4 хиральных центра. Кетозы содержат на 1 хиральный центр меньше, чем альдозы с тем же числом С-атомов. 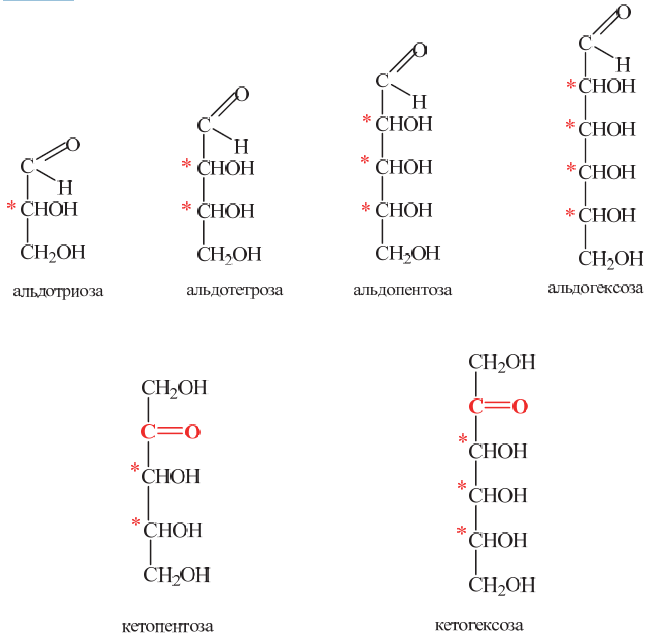 Поэтому индивидуальные формулы различных моноз в оксо-форме принято изображать с помощью проекционных формул Фишера. Очевидно, что для каждого отдельного моносахарида существует его зеркальный антипод (энантиомер), который имеет противоположные конфигурации всех асимметрических атомов углерода. Например: 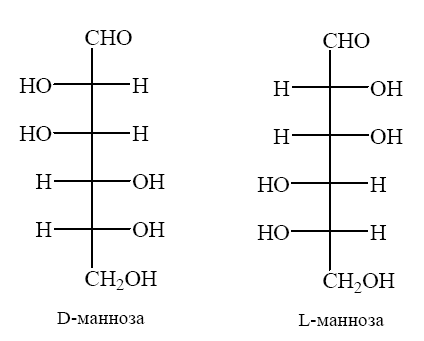 Таким образом, общее количество моноз с одинаковой молекулярной формулой равно рассчитанному в соответствии с формулой N = 2n(n – число асимметрических атомов углерода). Так, для альдогексоз в открытой форме суммарное количество всех моноз как D-, так и L- ряда равно 16 (24), которые представляют собой 8 энантиомерных пар. Стереоизомеры из разных пар энантиомеров относительно друг друга являются диастереомерами, т. е. отличаются конфигурацией хотя бы одного асимметрического атома углерода. Все стереоизомеры относятся к двум генетическим рядам, которые обозначаются соответствующими конфигурационными префиксами D или L. Отнесение моноз к D- или L-рядам основано на конфигурациях простейшей альдотриозы – глицеринового альдегида, являющегося родоначальником семейства альдоз. Глицериновый альдегид содержит один асимметрический атом углерода и представляет собой пару энантиомеров, абсолютная конфигурация которых обозначается с помощью конфигурационных префиксов D и L: 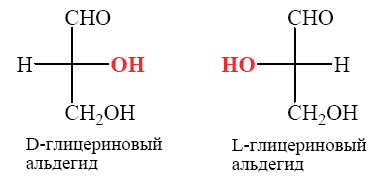 Принадлежность всех остальных моносахаридов к D- или L-генетическим рядам определяется по конфигурационному атому углерода. Конфигурационный атом – наиболее удаленный от карбонильной группы асимметрический атом углерода, по конфигурации которого определяется принадлежность к D- или L-генетическим рядам. Если гидроксильная группа (или другой заместитель), а также атом кислорода, образующий циклическую форму, у конфигурационного атома в проекционной формуле Фишера моносахарида расположены справа, как в формуле D-глицеринового альдегида, то моноза относится к D-ряду, если слева, как у L-глицеринового альдегида, то моноза относится к L-ряду. Например: 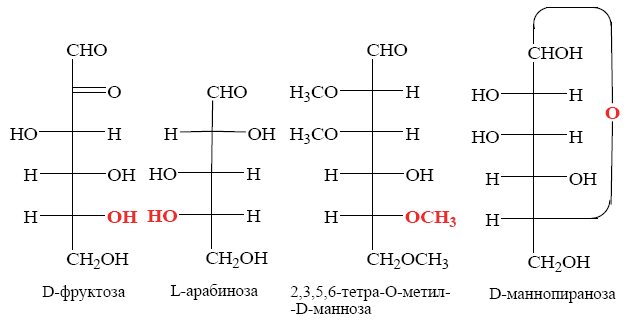 Отнесение моноз к D- или L-рядам указывает только на их конфигурацию и не связано напрямую со знаком оптического вращения. Направление вращения плоскополяризованного света растворами моносахаридов зависит от конфигурации всех асимметрических атомов и определено экспериментально. Направление вращения обычно обозначают знаками (+) – вправо или (-) – влево. Например, D(-)-рибоза. Диастереомерные моносахариды, отличающиеся друг от друга конфигурацией лишь одного асимметрического атома углерода, называются эпимерами. Эпимеры – частный случай диастереомеров. Например, D-рибоза и D-ксилоза являются эпимерами по С3 атому, так как они отличаются только конфигурацией данного хирального центра. Наиболее важными в химии углеводов являются эпимеры, которые отличаются конфигурацией соседнего с карбонильной группой хирального центра (D-глюкоза и D-манноза – эпимеры по С2). 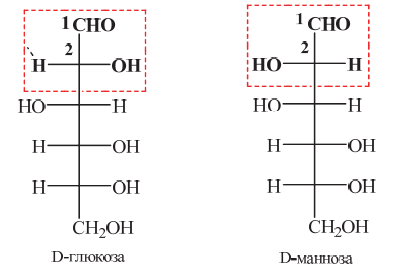 В циклических формах моносахаридов независимо от размера кольца (фуранозное или пиранозное) атом углерода карбонильной группы переходит в sp3-гибридное состояние и становится асимметрическим, а, следовательно, существуют две зеркальные конфигурации такого атома. Таким образом в циклической форме у альдоз и кетоз появляется новый хиральный центр С1 или С2 соответственно, называемый аномерным центром. Две стереоизомерные формы моноз, отличающиеся только конфигурацией атома С1 для альдоз и С2 для кетоз, называются аномерами. Аномеры являются диастереомерами, так как отличаются только расположением гликозидного гидроксила. Для указания конфигурации нового хирального центра используют аномерные префиксы α и β, связанные с взаимным расположением заместителей у аномерного и конфигурационного центров. Аномерные префиксы α- и β- используют только в сочетании с конфигурационными префиксами D, L и в названии указывают перед конфигурационными. α-Аномер (α-форма) – циклическая форма, у которой полуацетальный гидроксил расположен по одну сторону углеродного столба с группой ОН, определяющей принадлежность монозы к D- или L-ряду в проекционной формуле Фишера. β-Аномер (β-форма) – циклическая форма, у которой полуацетальный гидроксил и группа ОН, определяющая принадлежность монозы к D- или L-ряду, расположены по разные стороны углеродного столба в проекционной формуле Фишера. 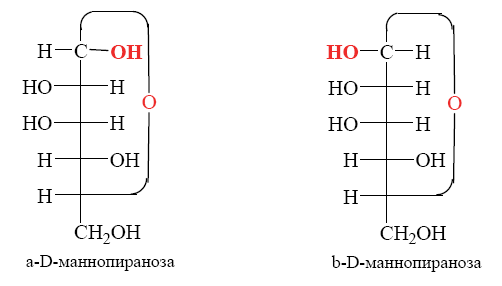 В циклических формах моноз на один асимметрический атом углерода больше, чем в открытых, поэтому у них в 2 раза большее число стереоизомеров (за счет α- и β-форм). Так, для глюкозы N = 25 = 32. Поскольку проекционные формулы Фишера дают слишком искаженное представление о пространственном строении циклических форм моноз, то их изображают в виде более наглядных перспективных формул Хеуорса. Они представляют собой плоские многоугольники, изображенные в перспективе – цикл лежит в горизонтальной плоскости, связи, расположенные ближе к наблюдателю, зачастую изображаются более жирно. Атом кислорода пиранозного цикла располагается в правом «верхнем» углу, фуранозного – за плоскостью цикла (в «верхнем» углу). Атомы углерода, входящие в цикл, как правило, не пишутся и нумеруются от атома кислорода по часовой стрелке. 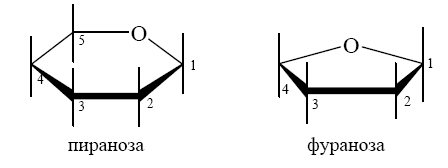 Через атомы углерода цикла проводят вертикальные связи, на концах которых пишут НО-группы и Н-атомы в соответствии с их пространственным расположением в формуле Фишера. Таким образом, Н-, НО- и другие группы формально располагаются над и под плоскостью цикла. При этом группы, которые находятся слева от углеродной цепи в проекционной формуле Фишера, размещают над плоскостью цикла, справа – под плоскостью цикла. Поэтому гликозидная гидроксильная группа у альдоз D-ряда в α-форме находится под плоскостью цикла, а в β-форме – над плоскостью цикла, у альдоз L-ряда в α-форме находится над плоскостью цикла, а в β-форме – под плоскостью цикла: 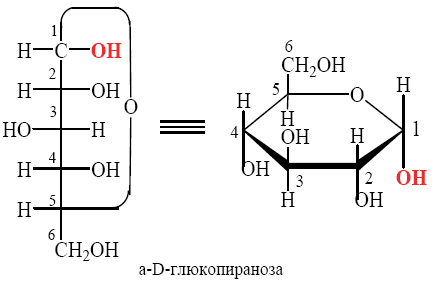 В формулах Хеуорса группа СН2ОН у альдогексоз D-ряда в пиранозной форме и у альдопентоз в фуранозной форме располагается над плоскостью цикла, а атом водорода у С5 – под плоскостью цикла, хотя в формуле Фишера он находится слева. Это объясняется тем, что при данном асимметрическом атоме С5 гидроксильная группа принимает участие в образовании эфирной связи, для чего необходимы две перестановки заместителей (показаны ниже стрелками). 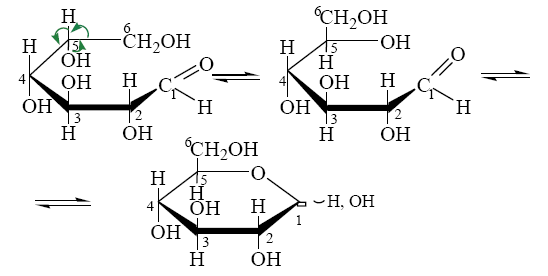 |
