Курс лекций по биохимии. Лекция Введение в дисциплину
 Скачать 0.7 Mb. Скачать 0.7 Mb.
|
|
4. Определение первичной структуры белка Наиболее ответственной процедурой при установлении первичной структуры белков является определение последовательности аминокислотных остатков. В настоящее время эту работу ведут преимущественно либо фенилизотиоцианатным методом Эдмана. Метод Эдмана реализуется в специально созданном для этой цели приборе, получившем название секвенатор (от sequence – последовательность). Метод Эдмана сводится к обработке фенилизотиоцианатом белка или пептида, присоединенного через С-концевую аминокислоту к инертному носителю (полистиролу или пористому стеклу) в колонке секвенатора. После промывки колонки растворителями (метанол, дихлорэтан) образовавшийся фенилтиокарбамилпептид подвергают воздействию безводной трифторуксусной кислоты, в результате чего высвобождается анилинотиозолинон и в его составе N-концевая аминокислота, а укороченный на один аминокислотный остаток пептид или белок остается связанным с носителем. Раздел 3. НУКЛЕОТИДЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ Лекция 4. Строение и функции нуклеотидов 1. Общая характеристика нуклеотидов Нуклеотиды – сложные органические вещества, состоящие из 3-х обязательных компонентов:
Сложные органические соединения, состоящие только из азотистого основания и сахара-пентозы, называются нуклеозидами. Следовательно, нуклеотиды – фосфорнокислые эфиры нуклеозидов. Азотистые основания Азотистые основания являются производными двух гетероциклических соединений – пурина и пиримидина:
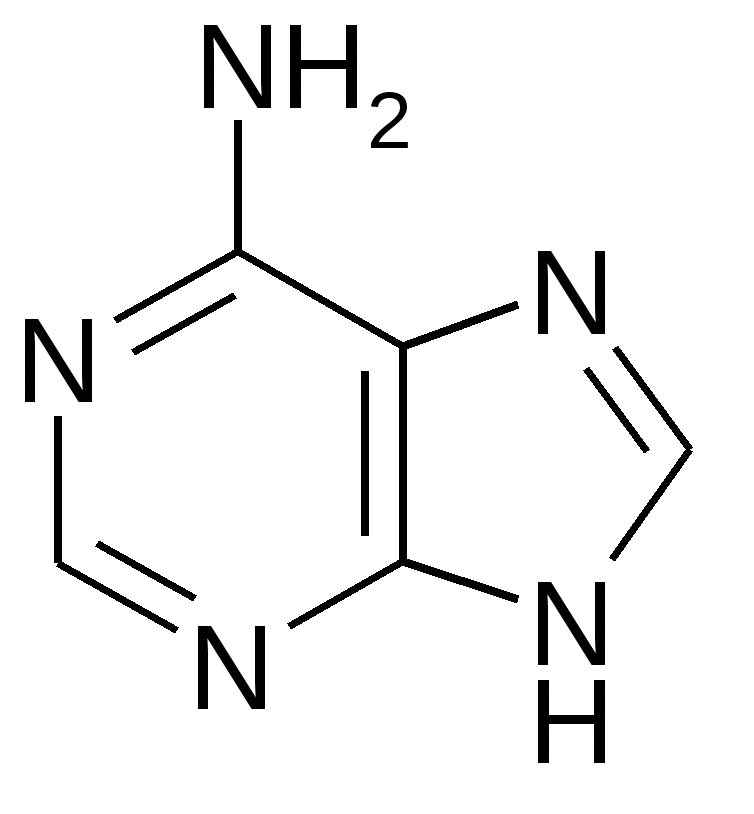 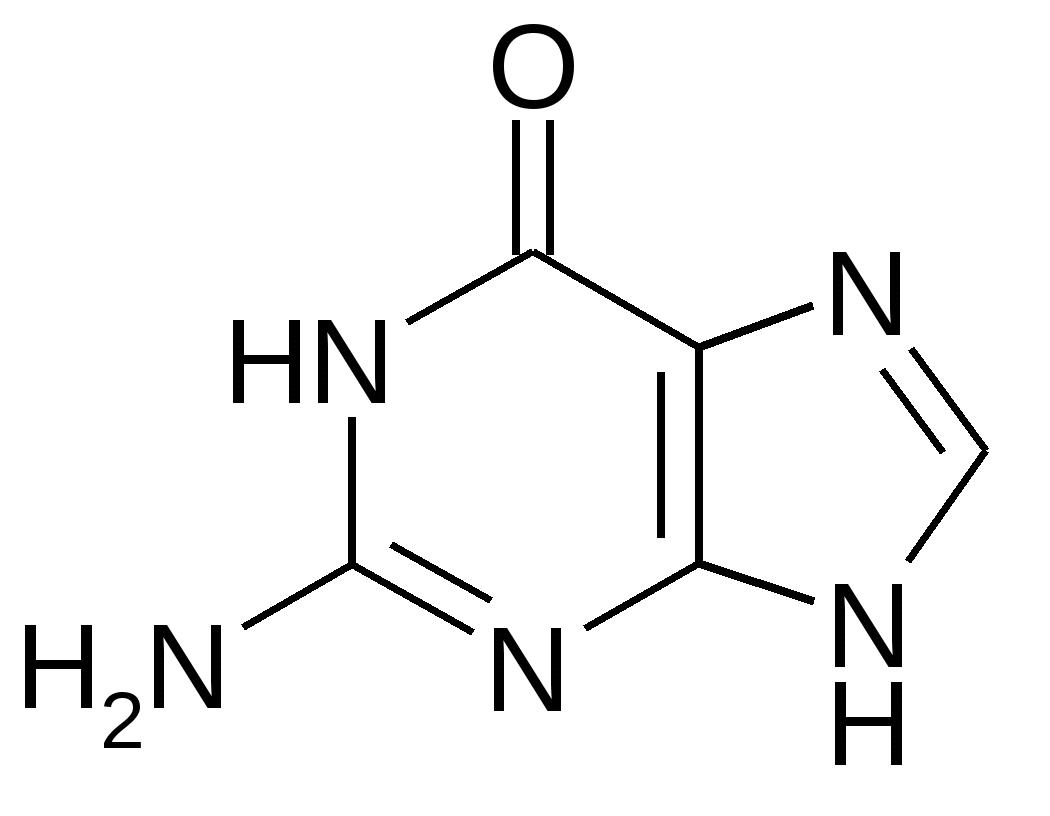 Аденин Гуанин
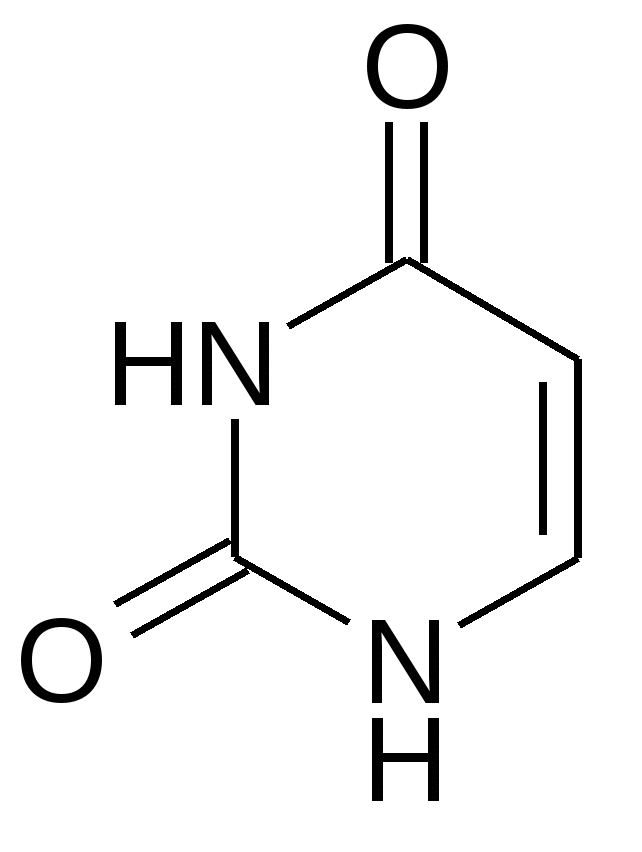 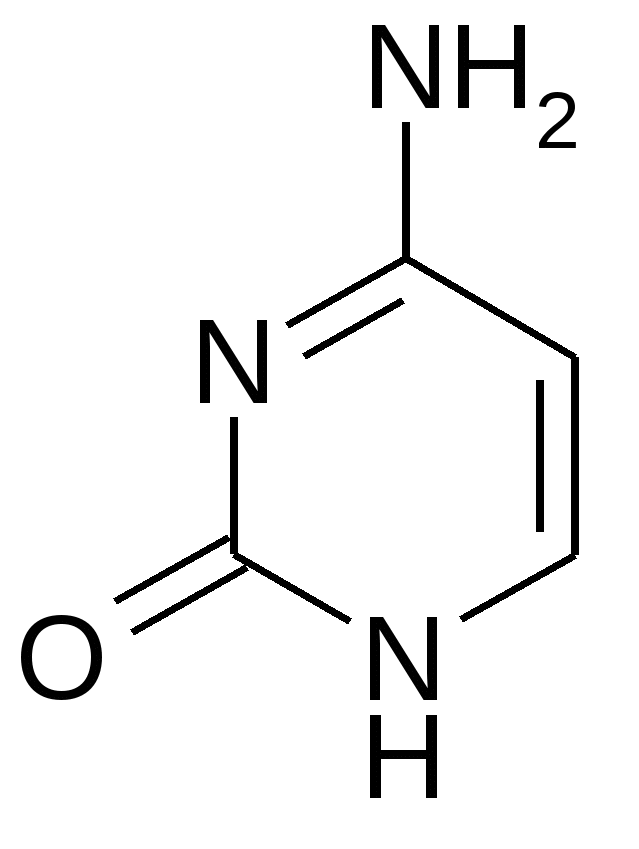 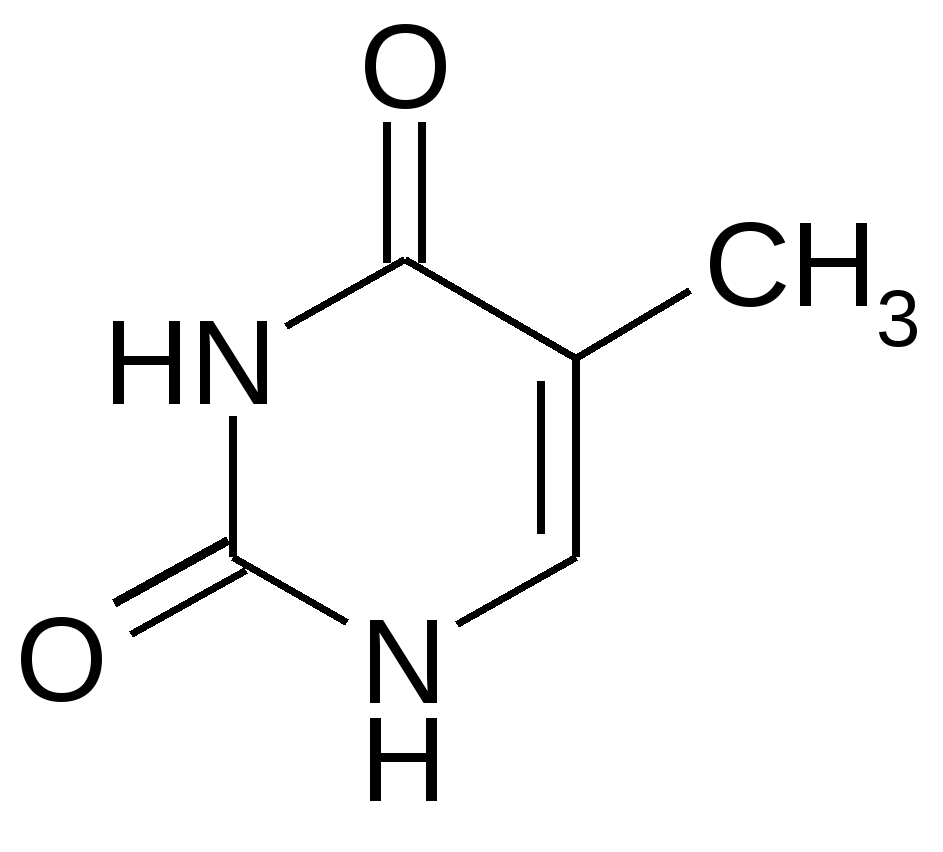 Урацил Цитозин Тимин Пятиуглеродные сахара: 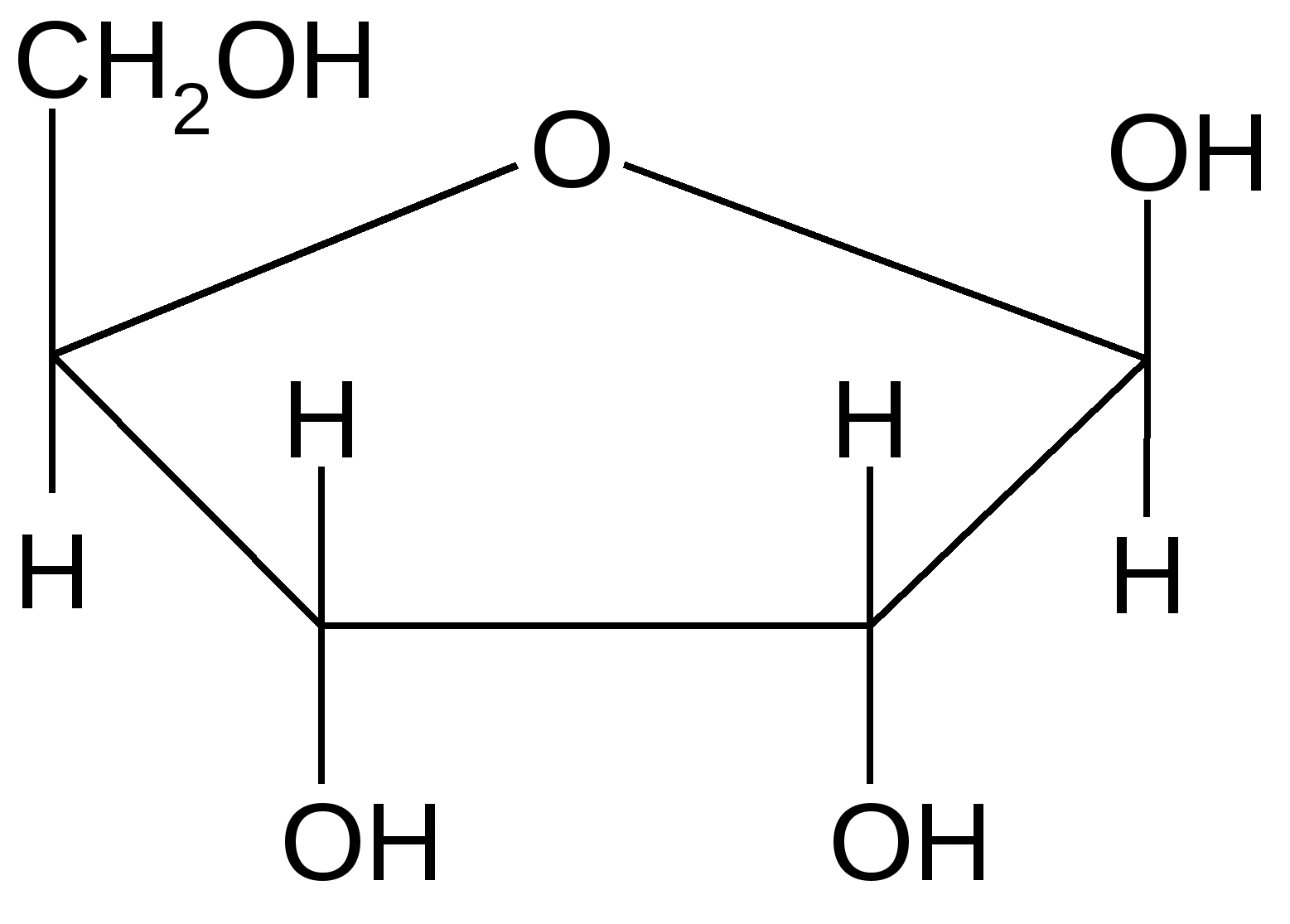  β-рибоза β-дезоксирибоза Фосфорная кислота  В состав нуклеотидов обязательно входит остаток фосфорной (ортофосфорной) кислоты. Помимо указанных выше трех обязательных компонентов, в состав молекул нуклеотидов могут входит и другие функциональные группы. При образовании нуклеозидов первый атом рибозы (дезоксирибозы) связывается с N-1 атомом пиримидинового или N-9 атомом пуринового основания. С рибозой соединяются аденин, образуя аденозин; гуанин, образуя гуанозин; цитозин, образуя цитидин; урацил, образуя уридин. С дезоксирибозой соединяются аденин, гуанин, цитозин и тимин, образуя соответственно дезоксиаденозин, дезоксигуанозин, дезоксицитидин, тимидин. Наиболее распространено в природе присоединение по 5 положению сахара и оно не указывается. В организме нуклеотиды являются мономерами нуклеиновых кислот, либо функционируют самостоятельно. В зависимости от того, в каком количестве в нуклеотидах представлены их основные компоненты, все нуклеотиды подразделяют на мононуклеотиды, динуклеотиды и полинуклеотиды (полинуклеиновые кислоты). 2. Строение и функции моно- и динуклеотидов Моно- и динуклеотиды не входят в состав нуклеиновых кислот; они функционируют самостоятельно. В состав самостоятельных нуклеотидов в качестве сахара всегда входит рибоза. К мононуклеотидам относятся АТФ, АДФ, АМФ, коэнзим А и другие нуклеотиды. АТФ – аденозинтрифосфорная кислота:  АТФ – энергетический эквивалент клетки, она является посредником между реакциями, идущими с выделением энергии (экзергоническими) и реакциями, идущими с поглощением энергии (эндергоническими). Иными словами, в форме АТФ клеткой запасается энергия, которая затем используется для процессов жизнедеятельности. Химические связи между различными атомами в органических соединениях делятся на 2 типа:
Нормальные связи – связи, при возникновении или распаде которых изменение уровня свободной энергии соединений составляет 12,5 Дж/моль. Макроэргические связи – связи, при возникновении или распаде которых уровень свободной энергии соединения составляет 25-50 кДж/моль вещества. Понятие «макроэргическая связь» учитывает энергетический эффект преобразованной связи посредством химической реакции вещества с нормальными свойствами. Связи между остатками фосфорной кислоты являются макроэргическими – при их гидролизе выделяется энергия. Такие связи принято обозначать волнистой черточкой. Энергия 1-й молекулы АТФ может служить только для 1-й реакции. АДФ и АМФ – не способны быть источником энергии. В живых клетках имеются 3 способа образования АТФ:
Коэнзим А (КоА). КоА является переносчиком ацильных групп; участвует во многих процессах. В его состав входит аденин, рибоза, пирофосфат, пантотеновая кислота (витамин В3) и тиоламин. Упрощенно коэнзим А представляют в виде следующей формулы: HS-KoA. При взаимодействии коэнзима А с уксусной кислотой образуется ацетилкоэнзим А, в молекуле которого появляется макроэргическая (высокоэнергетическая): 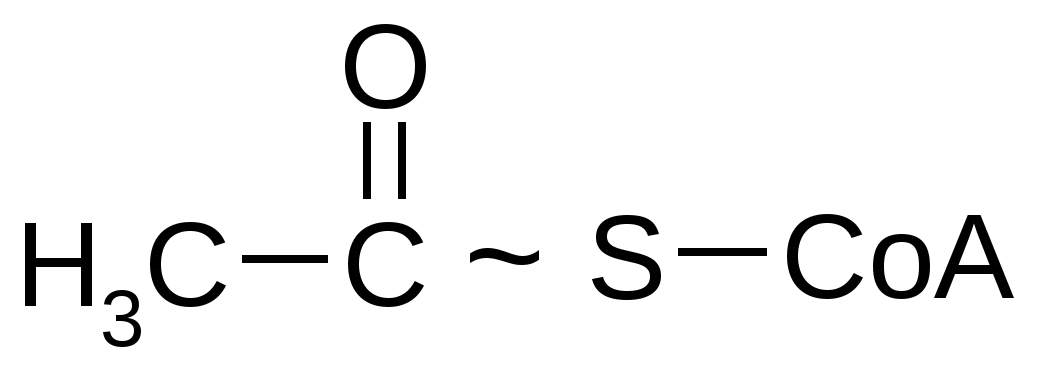 Ацетилкоэнзим А Ацетилкоэнзим А является ключевым метаболитом, благодаря которому осуществляется не только распад и синтез различных веществ, но и взаимосвязь между процессами обмена белков, липидов и углеводов. К динуклеотидам относятся НАД, НАДФ, ФАД и др. НАД – никотинамидадениндинуклеотид; НАДФ – никотинамидаденин динуклеотид фосфат. В состав этих динуклеотидов входит никотинамид (амид никотиновой кислоты, являющееся важным витамином - витамином В5). Молекула НАДФ идентична по структуре НАД с той лишь разницей, что у НАДФ у С-3 атома рибозы ОН-группа замещена остатком молекулы фосфорной кислоты. Молекулы НАД и НФДФ способны к обратимому окислению и восстановлению (благодаря окислительно-восстановительной способности никотинамида), поэтому они участвуют в качестве переносчиков водорода; в реакциях биологического окисления НАД и НАДФ являются кофакторами ферментов дегидрогеназ. 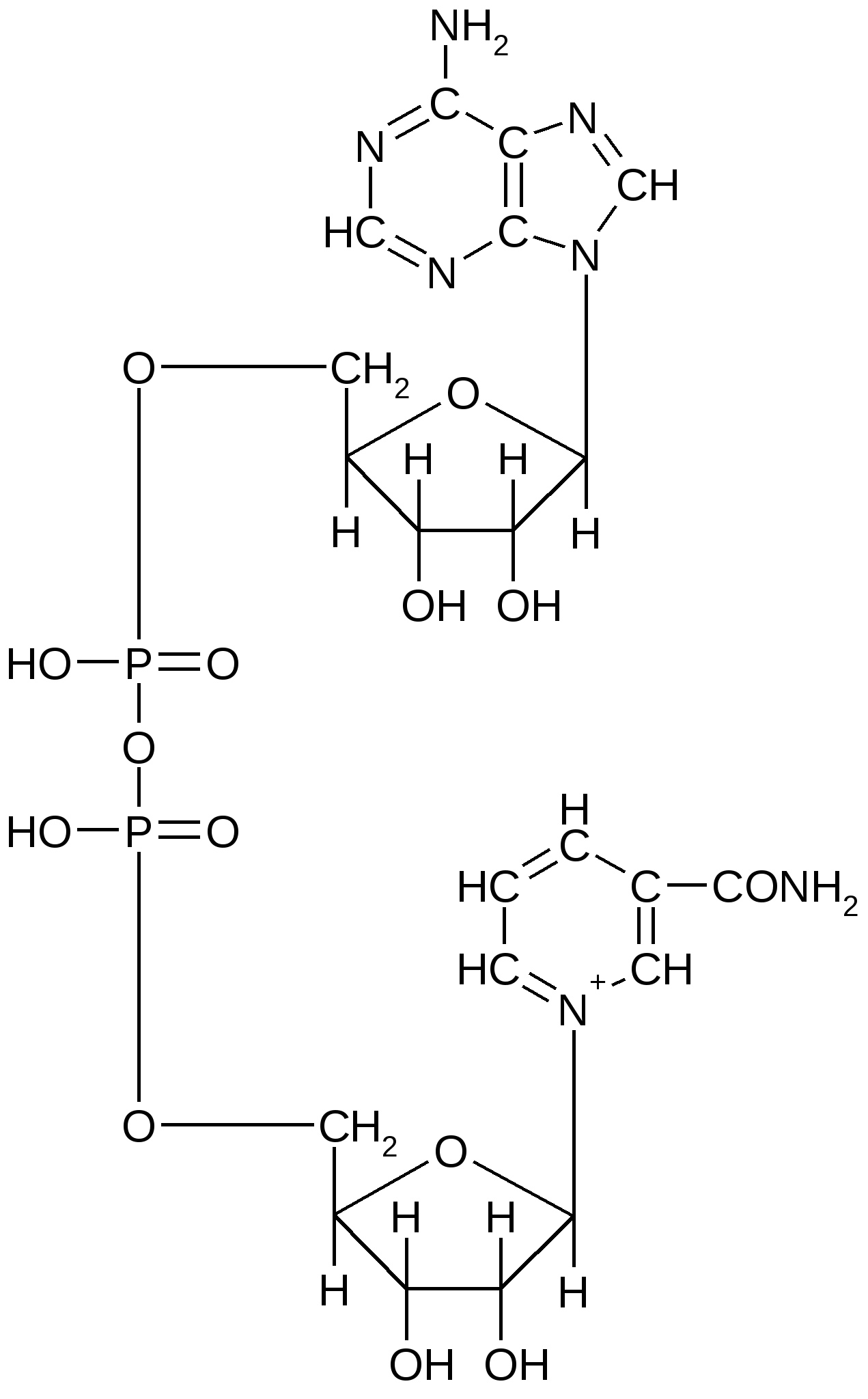 Структура НАД (окисленная форма) ФАД – флавинадениндинуклеотид. В его состав входит рибофлавин (витамин В2). 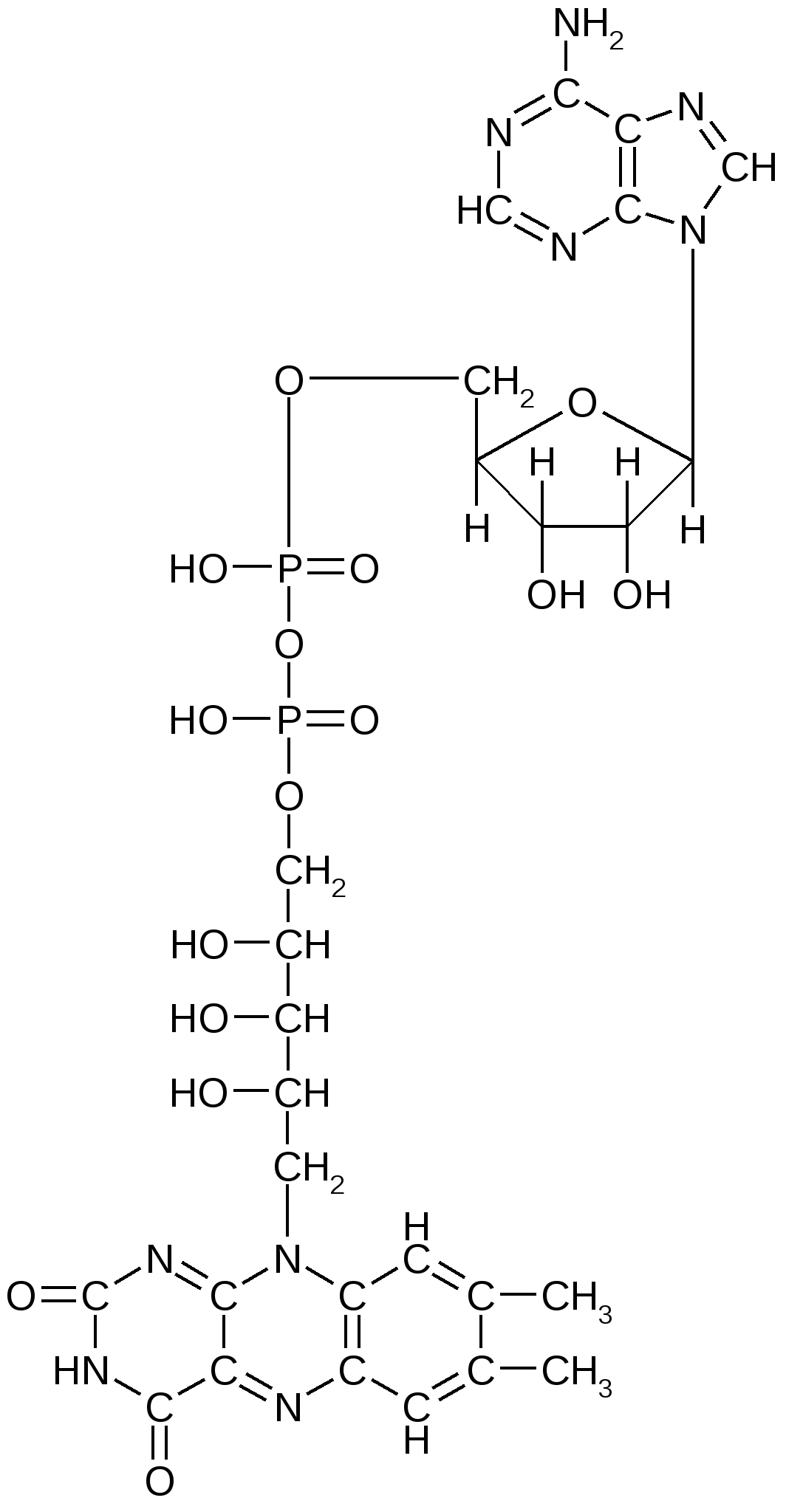 Структура ФАД (окисленная форма) ФАД, как и другие динуклеотиды, способен обратимо окисляться и восстанавливаться, присоединяя к своей молекуле 2 атома водорода, поэтому он участвует в биологическом окислении в качестве переносчика водорода. Является кофактором дегидрогеназ, так же, как и НАД и НАДФ. 3. Строение и функции нуклеиновых кислот Самое замечательное свойство живых клеток – их способность воспроизводить себе подобных с почти предельной точностью и не один-два раза, а в сотнях и тысячах генераций. Живые клетки обладают такой способностью благодаря наличию в них нуклеиновых кислот. ДНК – дезоксирибонуклеиновая кислота; РНК – рибонуклеиновая кислота. ДНК и РНК – высокомолекулярные соединения, которые построены на основе нуклеотидов, соединенных 3, 5 - фосфодиэфирными связями. Их молекулярная масса сильно варьирует (от 15 тыс. до 1 млрд). Нуклеиновые кислоты хорошо растворяются в фенолах; плохо – в слабых растворах кислот. Различия между ДНК и РНК:
в составе РНК – аденин, гуанин, цитозин, урацил.
Особенности структуры ДНК
Спаренные основания являются комплементарными по отношению друг к другу. Комплементарность – пространственная взаимодополняемость поверхностей взаимодействующих молекул или их частей, приводящая к возникновению между ними вторичных связей. Между А и Т возникает 2 водородные связи; между Г и Ц – 3 водородные связи. Остатки сахаров и фосфорные группы остаются на поверхности молекулы и контактируют с водой. Отрицательно заряженные группы остатков фосфорной кислоты легко вступают во взаимодействие с белками, среди которых преобладают гистоны – белки, отличающиеся своей основной природой. 4. Нуклеиновые кислоты отличаются друг от друга по функциям. Функции ДНК – хранение, репликация (удвоение) и передача наследственной информации (наследственная информация – это информация о первичной структуре белков). Функции РНК определяются типом РНК. Типы РНК: а) м-РНК – матричная или и-РНК – информационная. Матричная РНК выполняет функцию переноса наследственной информации из ядра клетки от ДНК в цитоплазму, к месту синтеза белка. Реализация наследственной информации – синтез белка. Существуют сотни тысяч видов м-РНК в клетке. б) т-РНК – транспортная. Переносит к месту синтеза белка необходимые аминокислоты. в) р-РНК – рибосомальная. Рибосомы – органоиды, выполняющие функции синтеза белка. 5. Нуклеиновые кислоты отличаются по локализации. Основное количество ДНК находится в ядре клетки (в составе хромосом). Часть ДНК располагается в митохондриях и хлоропластах (ее называют цитоплазматической ДНК). РНК находится в цитоплазме. 4. Основные биохимические функции нуклеотидов Таким образом, нуклеотиды объединяют группу веществ, которые выполняют самые разнообразные функции: 1. Являются строительными блоками нуклеиновых кислот, участвуют в молекулярных механизмах, с помощью которых генетическая информация хранится, реплицируется и транскрибируется. 2. Выполняют важную роль в энергетическом (фосфорном) обмене, в аккумулировании и переносе энергии. 3. Служат кофакторами ферментов, относящихся к различным классам. 4. Играют важную роль в синтезе и распаде углеводов, жирных кислот и липидов. 5. Некоторые нуклеотиды являются посредниками в сложных процессах сигнальной трансдукции (передачи сигналов в живых клетках). Раздел 4. ФЕРМЕНТЫ Лекция 5. Строение, механизм действия и классификация ферментов 1. Строение и основные свойства ферментов Ферменты (энзимы) – вещества белковой природы, присутствующие во всех живых клетках и выполняющие роль катализаторов биохимических процессов. По своему составу ферменты делятся на: 1) простые – состоят только из аминокислот; 2) сложные – состоят из 2-х частей: - из белковой, которая называется апоферментом и - небелковой части – кофактора. Комплекс апофермента и кофактора называется холоферментом. Ни апофермент, ни кофактор по отдельности не способны катализировать реакцию. Функционально активен только их комплекс. Виды кофакторов: По своей химической природе кофакторы могут быть представлены как органическими, так и неорганическими соединениями. Органические кофакторы можно разделить на две группы: 1) простетические группы – кофакторы, которые прочно соединены с апоферментом и при выделении из организма не отсоединяются от белковой части. Например, ФАД в составе фермента сукцинатдегидрогеназы из цикла Кребса. 2) коферменты – кофакторы, которые соединены с апоферментами слабыми связями и легко от него отщепляются: например, НАД, НАДФ, а иногда и ФАД. Неорганические кофакторы представлены ионами металлов (чаще всего ионами железа, меди, марганца, цинка и т.д.). Ионы металлов как кофакторы либо непосредственно участвуют в акте катализа, либо образуют мостики, связывающие фермент с субстратом. Субстрат (S) – вещество, химические превращения которого катализирует фермент. Строение фермента, или энзима (Е): 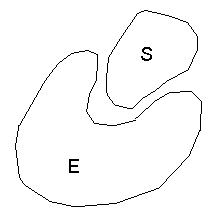 Поскольку молекулы субстрата обычно мельче молекул ферментов, то в непосредственный контакт с субстратом вступает только часть молекулы фермента – активный центр. Причем, геометрическая форма поверхности участка молекулы субстрата является комплементарной поверхности активного центра. Активный центр фермента – уникальная комбинация аминокислотных остатков, обеспечивающая взаимодействие с молекулой субстрата и участвующая в акте катализа. У сложных ферментов в состав активного центра обязательно входит кофактор. Активный центр может иметь 2 участка:
Якорный участок обладает геометрическим сходством (соответствием) молекулы субстрата и обеспечивает специфичность действия фермента. Сходство между ферментами и небиологическими катализаторами 1. Любой катализатор (неорганический и органический) уменьшает энергию активации молекулы. Энергия активации – количество энергии в калориях, необходимая для перевода всех молекул 1-го моля вещества в активированное состояние, т.е. состояние, при котором они способны вступить в химическую реакцию. 2. Любой катализатор может ускорять только химические реакции, возможные с точки зрения термодинамики. 3. Катализаторы не изменяют направление химической реакции. 4. Катализаторы не расходуются в процессе реакции. Отличия ферментов от неорганических катализаторов
в 1010 - 1012 раз. Пример: в организме есть фермент каталаза (кофактор - Fe). 1 мг железа в каталазе действует как 10 т неорганического железа.
- абсолютная (1 фермент действует только на 1 субстрат, например, фермент уреаза катализирует гидролиз мочевины); - относительная (1 фермент может действовать на группу сходных по строению субстратов).
Для каждого фермента есть свой температурный оптимум. Пример: температура тела – 36,6 град.; при Т=40-41град. может быть необратимая денатурация. При низких температурах наблюдается снижение скорости ферментативного катализа (из-за броуновского движения молекул). Ферменты очень чувствительны к изменению кислотности среды, в которой они действуют. Активность фермента проявляется в пределах довольно узкой зоны рН, называемой оптимумом рН. Можно считать, что для каждого фермента имеется определенная оптимальная концентрация протонов, при которой он наиболее активен. Изменение рН приводит к изменению зарядов на активном центре и на молекуле в целом; в результате этого изменяется конформация белковой молекулы, вследствие чего нарушается пространственное соответствие активного центра и субстрата, а значит, скорость реакции снижается.
2. Механизм действия ферментов Действие фермента основано на образовании фермент-субстратного комплекса. Под действием субстрата изменяется конформация фермента, затем изменяется субстрат. Механизм действия ферментов можно представить в виде следующей схемы: E+S → ES → EZ → EP → E+P Можно выделить 4 фазы:
2. Субстрат под действием присоединенного фермента претерпевает изменения (S→Z), делающие его более доступным для соответствующей реакции. 3. Происходит химическая реакция с образованием фермент-продуктного комплекса (EP). 4. Продукты реакции высвобождаются из фермент-продуктного комплекса. 3. Номенклатура и классификация ферментов Номенклатура ферментов (правила образования их названий)
Пример: папаин (carica papaja – из дерева).
Классификация ферментов Принята в 1961 году. В основу классификации положен тип катализируемой реакции:
Каждый фермент имеет 4-х-значный шифр: класс-подкласс-подподкласс- индивидуальный номер фермента. 4. Кинетика ферментативных реакций Особенностью кинетики ферментативной реакции является насыщение фермента субстратом, при котором дальнейшее увеличение [S] не приводит к увеличению скорости реакции. Эмпирическим путем установлено, что кинетика ферментативной реакции может быть выражена следующим графиком:  Концентрация субстрата, при которой фермент достигает насыщения, является постоянной характеристикой для каждого конкретного фермента. Кинетику ферментативной реакции можно описать с помощью уравнения, которое было выведено теоретическим путем учеными Михаэлисом и Ментен, и именно в честь них было названо. Уравнение Михаэлиса - Ментен Км – константа Михаэлиса. Это такая концентрация субстрата, при которой скорость реакции равна половине максимальной. Константа Михаэлиса характеризует сродство фермента к субстрату: чем меньше эта константа, тем больше сродство фермента к субстрату, тем эффективнее реакция. 5. Регуляция ферментативных процессов в клетке Многочисленные способы регуляции ферментативных процессов можно разделить на две группы: 1. Регуляция содержания фермента за счет изменения скорости его синтеза и распада. Следует отметить следующие процессы: репрессия – процесс подавления (или снижения) скорости синтеза фермента; индукция – процесс ускорения синтеза ферментов под действием специфических низкомолекулярных соединений – индукторов. 2. Регуляция активности имеющихся в клетке ферментов. а) путем изменения температуры, значения рН, количества субстрата, кофакторов и т.д.; б) аллостерическая регуляция (характерна только для аллостерических ферментов). Аллостерическими называют ферменты, имеющие кроме активного центра дополнительный центр связывания (аллостерический центр). Активность аллостерических ферментов регулируется путем изменения конформации молекул ферментов, вызванного присоединением специального метаболита к аллостерическому центу. Метаболит-регулятор (аллостерический эффектор) выполняет функции либо активатора, либо ингибитора; в) ковалентная модификация ферментов – регуляция каталитической активности ферментов может осуществляться за счет ковалентного присоединения фосфатной группы или нуклеотида. Например, фосфорилированная форма гликогенфосфорилазы обладает более высокой каталитической активностью; г) изменение активности ферментов с помощью активаторов – химических соединений, повышающих активность ферментов (например, аминокислота цистеин и трипептид глутатион активируют действие многих протеаз). д) изменение активности ферментов с помощью ингибиторов – химических соединений, подавляющих активность ферментов. Ингибирование Ингибирование – снижение или полное подавление активности ферментов под действием определенных веществ (ингибиторов). Ингибирование может быть двух основных видов: небратимое и обратимое. При необратимом ингибировании фермент и ингибитор образуют недиссоциирующий комплекс. Необратимое ингибирование в организме встречается редко и если оно есть, то из-за веществ, поступающих извне. При обратимом ингибировании фермент и ингибитор образуют диссоциирующий комплекс. Обратимое ингибирование, в свою очередь, делится на конкурентное и неконкурентное. Конкурентное ингибирование – ингибирование, при котором субстрат и ингибитор обладают сходным строением и конкурируют за активный цент фермента. Конкурентное ингибирование в организме часто встречается и является способом регулирования активности фермента. Скорость реакции при конкурентном ингибировании зависит от соотношения концентраций субстрата и ингибитора. Чем выше концентрация субстрата, тем выше вероятность формирования комплекса, тем выше скорость реакции. Таким образом, конкурентное ингибирование можно подавить путем увеличения концентрации субстрата. Неконкурентное ингибирование – ингибирование, при котором субстрат и ингибитор взаимодействуют с разными частями молекулы фермента. При этом ингибитор, соединяясь с молекулой фермента, так модифицирует его структуру, что достижение максимальной скорости реакции невозможно. При неконкурентном ингибировании увеличение концентрации субстрата не приводит к устранению действия ингибитора. Неконкурентное ингибирование в организме, как правило, связано с поступлением в организм тяжелых металлов. Раздел 5. УГЛЕВОДЫ И ИХ ОБМЕН Лекция 6. Химическое строение и свойства углеводов 1. Общая характеристика и классификация углеводов К углеводам относятся соединения, обладающие разнообразными и часто совершенно противоположными свойствами. Среди них есть вещества низкомолекулярные и высокомолекулярные, кристаллические и аморфные, хорошо растворимые в воде и совершенно в ней нерастворимые, способные окисляться и сравнительно устойчивые к действию окислителей. Общая формула, характерная для подавляющего числа углеводов, Сn(Н2О)m По химической природе углеводы делятся на:
Моносахариды содержат 3-8 атомов углерода и не подвергаются гидролизу с образованием простых углеводородов. Олигосахариды – полимеры моносахаридов, которые содержат 2-10 остатка моносахаров. Полисахариды – полимеры моносахаридов, которые содержат более 10 остатков моносахаров. 2. Строение, свойства и функции моносахаридов Моносахариды делятся на следующие группы:
Все моносахариды являются спиртами, либо альдегидоспиртами, либо кетоспиртами. В их молекулах, как правило, количество атомов углерода равно количеству молекул воды (т.е. m = n). 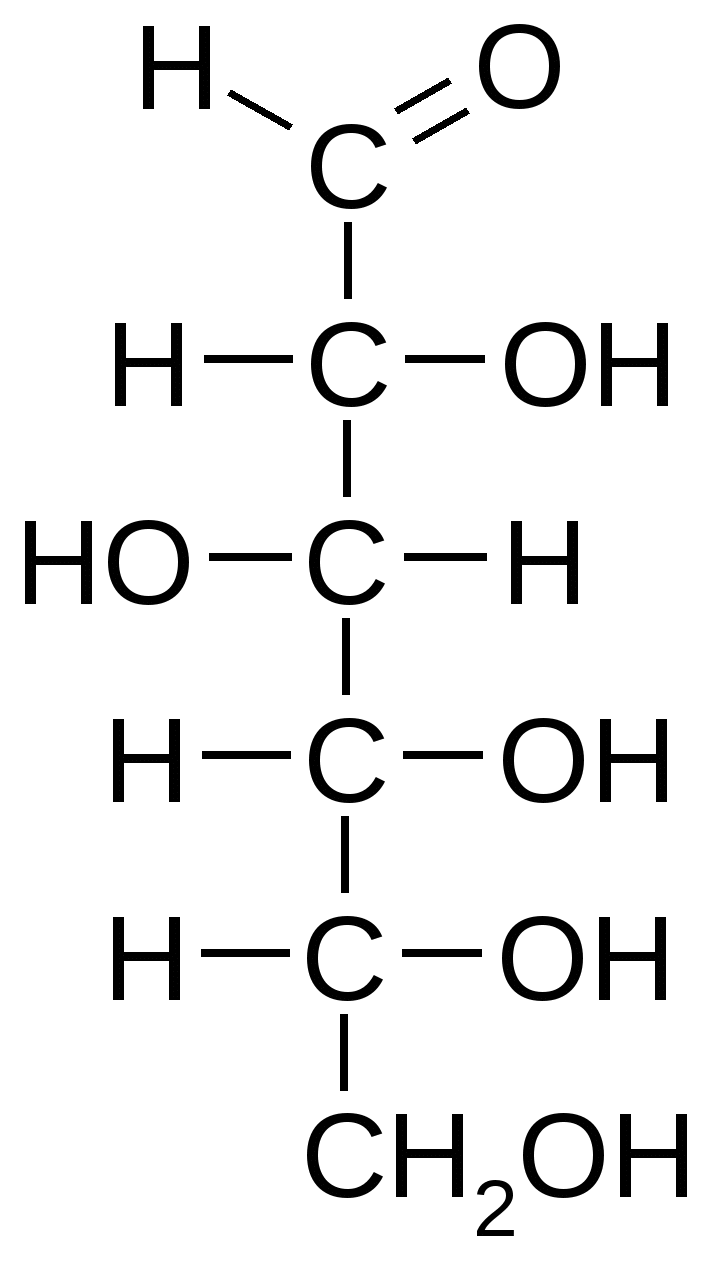 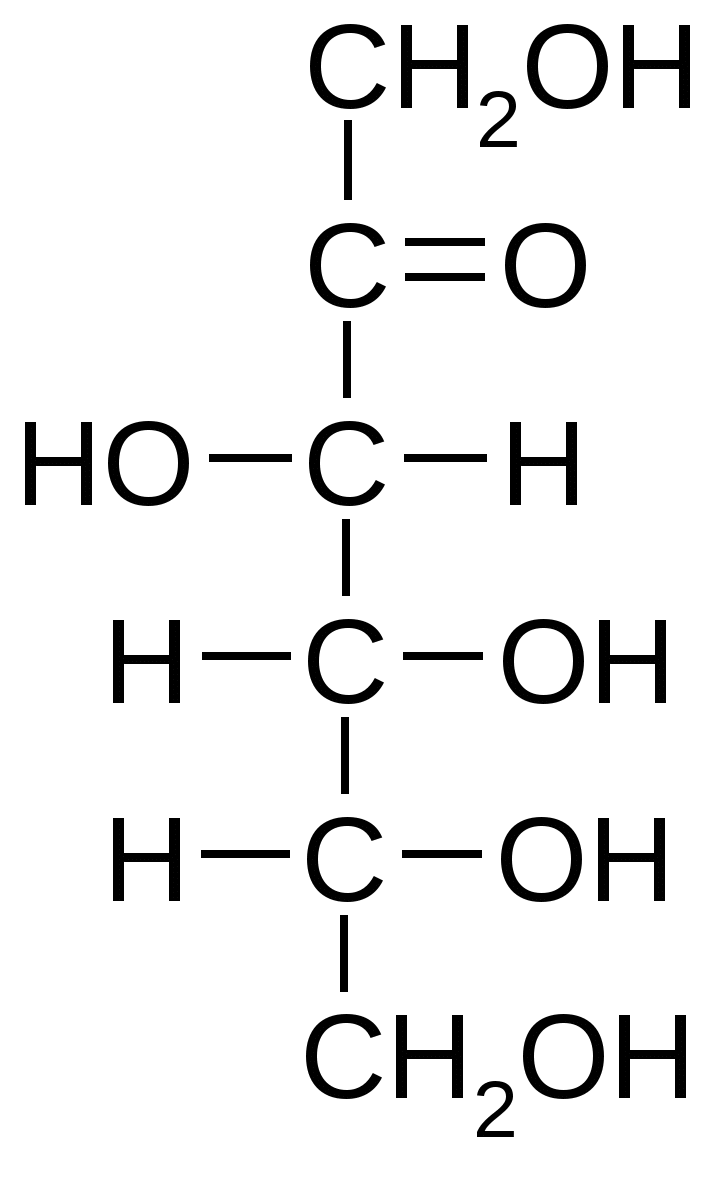 D-глюкоза (альдоза) D-фруктоза (кетоза) Альдозы и кетозы являются изомерами. Основные химические свойства моносахаридов: 1.Мутаротация – переход аномера из одной формы в другую (например, α-глюкоза →β-глюкоза). Аномерами называют энантиомерные формы моносахаридов, различающиеся положением полуацетального гидроксила. 2. Восстановление до многоатомных спиртов (например, глюкоза восстанавливается до сорбита, рибоза – до рибита). 3. Окисление с образованием соответствующих кислот (например, в зависимости от окисляемой группы глюкоза может образовывать глюконовую, глюкуроновую и глюкаровую кислоты). 4. Эпимеризация (например, в слабощелочной среде D-глюкоза находится в равновесии с кетогексозой (D-фруктозой) и альдогексозой (D-маннозой). 5. Образование гликозидов. Конденсация аномерной ОН-группы со спиртовой группировкой молекулы приводит к образованию О-гликозидов. Именно за счет этих связей построены олиго- и полисахариды. При взаимодействии аномерной ОН-группы с NH2-группой образуются N-гликозиды. 6. Этерификация. Гидроксильные группы моносахаридов образуют эфиры с различными кислотами. В метаболизме особо важную роль играет фосфорилирование сахаров. 7. Способность реагировать с азотсодержащими соединениями при высокой температуре с образованием специфических окрашенных веществ – меланоидинов. 8. Способность глюкозы (и других гексоз) подвергаться расщеплению (путем гликолиза) и сбраживанию микроорганизмами. Основные функции моносахаридов: 1. Энергетическая (моносахариды легко расщепляются с выделением энергии, которая затрачивается на образование АТФ). 2. Пластическая (метаболическая). Моносахариды являются предшественниками для образования многих важных веществ: резервных и структурных полисахаридов, аминокислот, жирных кислот, глицерина и др. 3. Строение, свойства и функции олигосахаридов Олигосахариды различаются по следующим показателям:
В растворах моносахариды всегда присутствуют в циклической форме; в состав олиго- и полисахаридов они также входят в циклической форме. Первый углеродный атом, соединенный с кислородом, является наиболее реакционноспособным. Как правило, связь образуется за счет гликозидного (полуацетального) гидроксила. Для олигосахаридов характерны некоторые свойства, отмеченные для моносахаридов. Следует также отметить, что олигосахариды, поступающие в организм человека с пищей, в желудочно-кишечном тракте подвергаются гидролизу до своих структурных блоков – моносахаридов. Поэтому в клетки они попадают уже в виде простых сахаров и, соответственно, выполняют те же функции, что и моносахариды. Из олигосахаридов наибольшее распространение получили дисахариды. Рассмотрим химический состав наиболее важных из них. Сахароза состоит из остатков α-глюкозы и β-фруктозы, соединенных β-гликозидной (или фруктозидной) связью. Гидролиз сахарозы происходит при участии фермента инвертазы (сахаразы): 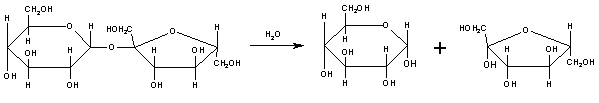 сахароза α-глюкоза β-фруктоза Инвертаза в больших количествах содержится в дрожжах и в кишечнике организмов. Смесь глюкозы и фруктозы в равных количествах, которая образуется при гидролизе сахарозы, называется инвертным сахаром. Мальтоза – дисахарид, состоящий из 2-х остатков α-глюкозы. Это основной продукт гидролиза крахмала. Мальтоза → α-глюкоза + α-глюкоза Гидролиз мальтозы проходит при участии фермента мальтазы. Мальтаза есть в слюне и поджелудочном соке. Лактоза – молочный сахар, образуется в организме животных. Лактоза = β-галактоза + α-глюкоза.Гидролиз лактозы катализируется ферментом лактазой. Лактаза очень активна у младенцев; у некоторых взрослых лактаза не сохраняется, что влечет за собой непереносимость молока. 4. Строение, свойства и функции полисахаридов Полисахариды подразделяются на гомосахариды и гетеросахариды. В состав гомосахаридов входят моносахариды одного типа. Если мономер–фруктоза, то полисахарид нзывается фруктан; галактоза – галактан; глюкоза – глюкан. Мономерами гетерополисахаридов являются моносахариды 2-х или нескольких типов. К примеру, арабиноза и глюкоза входят в состав арабиноглюканов; арабиноза и ксилоза – арабиноксиланов. Крахмал (гомосахарид) – запасной полисахарид растений; существует в 2-х формах: амилоза и амилопектин. Амилоза – линейный полисахарид, состоит из остатков α-глюкозы, соединенных α –1, 4 связью. Амилопектин – разветвленный полисахарид, в котором на каждые 12 остатков глюкозы, соединенных α –1, 4 связью, приходится α –1, 6 связь. Эти вещества сильно различаются по своим физическим и химическим свойствам. Так, например, от йода амилоза окрашивается в синий цвет, а амилопектин – в красно-фиолетовый. Они различаются и по растворимости: амилоза легко растворяется в теплой воде и дает растворы со сравнительно невысокой вязкостью, в то время как амилопектин растворяется в воде лишь при нагревании под давлением и дает очень вязкие растворы. Гликоген(«животный крахмал») – по строению сходен с крахмалом, но характеризуется большей разветвленностью. Является резервным питательным веществом (образуется главным образом в печени и мышцах). Целлюлоза (клетчатка) – полисахарид, состоящий из большого количества остатков β-глюкопиранозы. Функции полисахаридов:
5. Углеводы зерна и продуктов его переработки В зерне злаков углеводы составляют подавляющую часть всего зерна. Пентозы в свободном виде в зерне, крупе и муке практически не содержатся. Они содержатся в довольно большом количестве в зерне в виде пентозанов. Их особенно много в оболочках зерна, отрубях, «лузге» различных семян, кукурузных кочерыжках. Значительная часть сахара, содержащегося в нормальном непроросшем зерне, состоит из сахарозы. В нормальном непроросшем зерне мальтоза почти не содержится; она накапливается в зерне лишь при прорастании. В зародышах зерна в заметном количестве содержится рафиноза – трисахарид, состоящий из остатков глюкозы, фруктозы и галактозы. Крахмал – главное из веществ, содержащихся в зерне злаков. Среднее содержание крахмала в зерне кукурузы, ржи, риса и пшеницы составляет от 60 до 75%, у ячменя – от 50 до 60%; особенно много крахмала в рисовом зерне – от 75 до 80%. В зерне он содержится в виде крахмальных зерен различного размера и формы. Крахмальные зерна пшеницы, ржи и ячменя простые, в то время как у кукурузы, овса и риса сложные, состоящие из отдельных, как бы склеенных между собой мелких крахмальных зернышек. Как было уже отмечено, крахмал состоит из амилозы и амилопектина. В картофельном крахмале содержится от 19 до 22 % амилозы и от 78 до 91% амилопектина; в пшеничном и кукурузном – соответственно 25 и 75%. Гликоген – близкий к крахмалу полисахарид – содержится в зерне некоторых сортов и видов кукурузы и в дрожжах. Гликоген имеет структуру, сходную со структурой амилопектина, т.е. он также представляет собой разветвленный полисахарид; однако в отличие от амилопектина молекула гликогена построена как бы более компактно. Слизи (гумми). Содержащиеся в зерне слизи представляют собой полисахариды, в большинстве случаев растворимые в воде. Сравнительно много слизей в зерне ржи – около 2,5 и даже 3% от сухого веса зерна. Слизи ржи легко набухают в воде и образуют очень вязкие растворы. Повышенная по сравнению с пшеничным зерном вязкость ржи при размоле объясняется именно содержанием слизей в ржаном зерне. В зерне многих культур (ржи, пшеницы, овса, ячменя) содержатся левулезаны – полисахариды, состоящие из остатков левулезы (фруктозы). Гемицеллюлозы – нерастворимые в воде полисахариды, которые не усваиваются человеческим организмом. Они содержатся главным образом в отрубях, в периферических, оболочечных частях зерна. При гидролизе гемицеллюлозы зерна образуют либо гексозы, например, глюкозу, либо пентозы (арабинозу и ксилозу). В зерне ржи и пшеницы содержится от 8 до 10% гемицеллюлозы. Клетчатка (целлюлоза) представляет собой полимер β-D-глюкопиранозы. Она также не усваивается человеческим организмом. Содержится главным образом в оболочках зерна и в стенках клеток алейронового слоя. Лекция 7. Основные пути распада и синтеза углеводов. Гликолиз и брожение 1. Процессы распада олиго- и полисахаридов Процессы расщепления сложных углеводов являются обязательными подготовительными процессами при их использовании и как источников энергии и как пластического материала. При распаде олиго- и полисахаридов возникают свободные монозы и их фосфорные эфиры. Дальнейший обмен моносахаридов идет такими путями, что используются только их фосфорные эфиры, свободные же монозы превращаются в фосфорные эфиры (фосфорилируются). Таким образом, фосфорилирование свободных моносахаридов – обязательная реакция на пути их использования для нужд организма. Она приводит к возникновению более реакционных, чем свободные моносахариды, фосфорных эфиров и поэтому часто рассматривается как реакция активирования. Существует 2 способа расщепления сложных углеводов: фосфоролиз и гидролиз. Фосфоролиз Фосфоролиз – расщепление сложных углеводов под действием фосфорной кислоты. Фосфоролиз – наиболее эффективный процесс в энергетическом отношении; это процесс подготовки к участию в обмене веществ крахмала и гликогена. В результате фосфоролиза крахмала и гликогена образуется не просто глюкоза, а фосфорилированная глюкоза (глюкозо-1-фосфат) – исходная форма для всех преобразований глюкозы. Для того чтобы получить фосфорилированную глюкозу из обычной глюкозы, которая образуется при гидролизе крахмала и гликогена, необходимо затратить молекулу АТФ. А при фосфоролизе фосфорилированная глюкоза образуется без дополнительной затраты энергии. Фосфоролиз имеет место и в животных, и в растительных организмах. Однако следует отметить, что таким способом расщепляются только собственные углеводы (например, гликоген, образующийся в организме человека). Тогда как сложные углеводы, поступающие с пищей, всегда расщепляются путем гидролиза при участии гидролитических ферментов пищеварительной системы. Гидролиз Как уже было показано, олигосахариды, поступающие с пищей, в желудочно-кишечном тракте расщепляются путем гидролиза до своих мономеров, которые уже способны всасываться в кровь. Гидролиз каждого из дисахаридов катализируется собственным ферментом и поскольку в их молекулах всего одна гликозидная связь, процесс протекает достаточно просто. Однако гидролиз полисахаридов, особенно с высокой молекулярной массой, протекает путем многоступенчатого процесса. Рассмотрим этот процесс на примере крахмала. Гидролиз крахмала осуществляется несколькими ферментами, которые называются амилазами. Амилаза осуществляет гидролиз только α –1, 4 связи. Их несколько типов: 1) α–амилазы – содержатся в слюне, в поджелудочном соке, в прорастающих семенах растений, синтезируется грибами. α–амилаза– эндофермент, т.е. разрывает без определенного порядка внутренние связи в молекуле крахмала. В результате гидролиза образуются α-мальтоза, немного глюкозы, низкомолекулярные декстрины (продукты гидролиза крахмала, обогащенные α-1, 6 связями). 2) β -амилазы, встречаются только в растениях. Являются экзоферментами, гидролизующего внешние связи со стороны нередуцирующего конца молекулы крахмала; с образованием β-мальтозы, немного глюкозы и высокомолекулярных декстринов. 3) γ–амилазы (глюкоамилазы), встречаются и у растений, и у животных (входят в состав кишечного сока). Являются экзоферментами, которые отщепляют от декстринов и олигосахаридов α-глюкозу. 4) α -1,6-гликозидаза, имеется у разных организмов, гидролизует α-1,6 связи в амилопектине и гликогене. Редуцирующий конец – конец полисахарида, на котором находится гликозидный (полуацетальный) гидроксил в свободном состоянии. Амилазы действуют на крахмал следующим образом. Во-первых, они разжижают крахмал. Далее, амилазы обладают декстринирующим действием, т.е. они способны превращать крахмал в различные декстрины, что можно легко проследить по изменению окраски с йодом. И наконец, поскольку при действии амилаз на крахмал образуется сахар (мальтоза), они обладают осахаривающим действием. Чем различаются между собой -амилаза и -амилаза? -амилаза, действуя на крахмал, образует главным образом мальтозу и мало декстринов; -амилаза расщепляет крахмал с образованием главным образом декстринов и небольшого количества мальтозы. -амилаза как бы дробит молекулу крахмала на крупные части, на декстрины, которые при этом образуются. Что касается -амилазы, то она как бы шелушит частицу крахмала с поверхности, отщепляя от нее молекулы мальтозы, причем остается молекула высокомолекулярного декстрина – амилодекстрина, который по своим свойствам приближается к первоначальному крахмалу. Эти два вида амилазы существенно различаются по своим свойствам, а именно: -амилаза интенсивнее действует в более кислой среде. Если подкислять тесто, то -амилаза будет быстро терять свою активность. Это имеет большое значение при переработке муки из проросшего зерна, в которой как раз много -амилазы, ухудшающей ее хлебопекарные качества. Амилазы различаются также по своей термостабильности, устойчивости к действию высоких температур. Зерновая -амилаза термостабильнее; она может действовать во время выпечки хлеба. В нормальном непроросшем зерне пшеницы, ржи и ячменя содержится только -амилаза, -амилазы нет; в зерне этих культур -амилаза образуется только лишь при прорастании. В зерне некоторых других культур, например сои, содержится только -амилаза, и даже при прорастании -амилаза не образуется. Амилазы имеют очень большое значение в оценке качества зерна и муки: процесс накопления сахара во время брожения теста и сам процесс брожения зависят от скорости накопления в тесте мальтозы, что в свою очередь зависит от действия этого фермента. Амилазы имеют очень большое значение в спиртовой и пивоваренной промышленности, где применяется солод, представляющий собой проросшее и осторожно высушенное зерно, которое и является источником активной амилазы. При кипячении с кислотами и крахмал, и гликоген гидролизуются: образуется глюкоза, а не мальтоза. 2. Синтез олиго- и полисахаридов Долгое время предпринимались безуспешные попытки доказать, что синтез олигосахаридов, в частности, дисахаридов, представляет собой реакцию обращения их гидролиза. Однако, несмотря на многочисленные эксперименты такого рода, никто не сумел подобрать условия, при которых удалось бы направить вспять реакцию гидролиза, например, сахарозы, протекающей при участии фермента инвертазы. Оказалось, что биосинтез олиго- и полисахаридов осуществляется путем реакций трансгликозилирования: перенос гликозильного остатка на один моносахарид идет с фосфорного эфира другого сахара и ускоряется специфическим ферментом – гликозилтрансферазой. Исходными соединениями, с которых в процессе синтеза олигосахаридов гликозильный остаток переносится на моносахарид, как правило, служат нуклеозиддифосфатсахара (НДФ-сахара). Они были открыты в середине 20-го века и очень быстро привлекли к себе внимание как наиболее вероятные метаболиты в биосинтезе углеводов. Будучи широко распространенными в природе, НДФ-сахара синтезируются из фосфорных эфиров моносахаридов и соответствующих ннуклеозидтрифосфатов. Подобно синтезу олигосахаридов, новообразование полисахаридов происходит также путем трансгликозилирования. Синтез амилозы, целлюлозы и подобных им глюканов может происходить путем переноса гликозильных остатков с глюкозо-1-фосфата или аналогичных фосфорных эфиров моносахаридов. Эта реакция представляет собой обращение реакции фосфоролиза указанных соединений. Однако более существенное значение имеет биосинтез полисахаридов из соответствующих НДФ-сахаров при участии соответствующих трансгликозидаз. Перенос гликозильного остатка идет на невосстанавливающий конец молекулы синтезируемого полисахарида. Эта реакция может повторяться многократно, что обеспечивает многоступенчатый синтез молекул полисахаридов, содержащих огромное число мономеров. Характерная особенность реакций такого типа состоит в необходимости «затравки», т.е. наличия в реакционной среде небольшого количества молекул полисахарида. Она как бы предопределяет тот тип связи, который возникает в процессе трансгликозилирования. 3. Анаэробные процессы расщепления моносахаридов. Гликолиз Гликолиз – процесс анаэробного расщепления глюкозы до двух молекул пировиноградной кислоты. Он происходит и у анаэробных, у аэробных организмов. Гликолиз открыт в 1933 году (Эмбденом и Мейергофом). Это один из наиболее древних биохимических путей (предполагают, что возник он 2,5-3 млрд. лет). У анаэробов гликолиз – основной способ получения энергии в форме АТФ. У аэробов гликолиз является подготовительным этапом для аэробного дыхания. Гликолиз локализуется в цитоплазме. Этот процесс включает 2 фазы: 1 фаза – накопление простых сахаров и их превращение в глицероальдегидфосфат (сопровождается расходом энергии). 2 фаза – окисление глицероальдегидфосфата (ФГА) до пировиноградной кислоты (ПВК), сопровождается высвобождением энергии и образованием АТФ. Энергетический выход гликолиза: + 4 АТФ + 2 НАД Н →6 АТФ (1 молекула НАД Н →3 АТФ) - 2 АТФ Итого: 8 АТФ Образование АТФ в процессе гликолиза осуществляется путем субстратного фосфорилирования. Субстратное фосфорилирование – это фосфорилирование АДФ с образованием АТФ, идущее за счет энергии макроэргических связей субстратов. Суммарное уравнение гликолиза выглядит следующим образом: С6Н12О6 + 2 АДФ + Н3РО4 + 2НАД+ → 2 С3Н4О3+2 НАДН+Н++2АТФ +2 Н2О |
