Левомицетин - получение, качественные и количественные реакции. Левомицетин получение, качественные и количественные реакцции
 Скачать 155 Kb. Скачать 155 Kb.
|
|
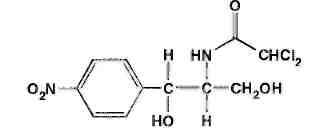
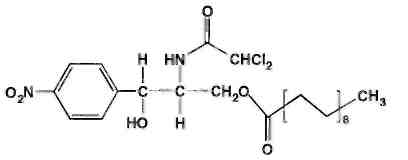
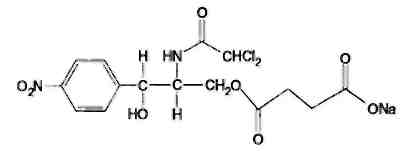
Левомицетин: получение, качественные и количественные реакцции Из большого числа антибиотиков, являющихся ароматическими соединениями (производными нитрофенилалкиламинов), в медицинской практике применяют хлорамфеникол, или левомицетин, обнаруженный впервые в 1947 году в культуральной жидкости актиномицета Streptomyces venezuelae. В 1949 году установлена его химическая структура и осуществлен синтез. Хлорамфеникол был первым антибиотиком, химический синтез которого внедрен в промышленном масштабе, в то время как большинство других антибиотиков получают биосинтезом. Этому в значительной степени способствовала сравнительно простая химическая структура хлорамфеникола. Он относится к числу производных n-нитробензола: 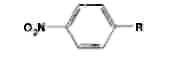 По химическому строению хлорамфеникол представляет собой n-нитрофенил-2-дихлорацетиламинопропандиол-1,3: 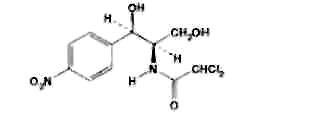 Молекула этого соединения включает два асимметрических атома углерода, поэтому возможно существование четырех пространственных изомеров: D-трео, L-трео, D-эpuтpo, L-эритро. Трео- и эритро-изомеры отличаются пространственным расположением функциональных групп в молекуле: 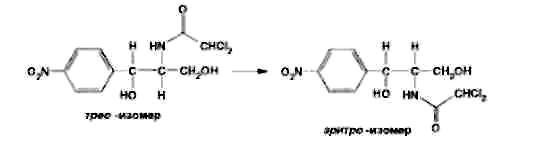 Этот вид изомерии наблюдается также у эфедрина. Хлорамфеникол является трео-изомером, т.е. соответствует в отношении изомерии псевдоэфедрину. По характеру конфигурации асимметрического атома углерода в положении 1 оптически активные соединения относят к D- и L-ряду. D-ряд составляют соединения, имеющие конфигурацию, подобную d-глицериновому альдегиду, а L-ряд – соответственно l-глицериновому альдегиду: 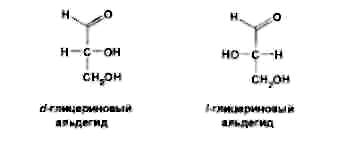 Оптическая активность зависит от конфигурации всех асимметрических атомов углерода, поэтому как в D-ряду, так и в L-ряду могут быть и левовращающие, и правовращающие изомеры. Знак вращения плоскости поляризованного света (+)или (–) указывается в скобках после обозначения конфигурации. Геометрические и оптические изомеры n-нитрофенил-2-дихлорацетиламинопропандиола-1,3 отличаются по физиологической активности. D-(–)- и L-(+)-эритро-формы представляют собой токсичные вещества и поэтому в медицине не применяются. Природный хлорамфеникол соответствует D-(–)-трео-изомеру. т.е. является левовращающим изомером трео-формы. Ввиду этого он получит название левомицетин. L-(+)-трео-изомер (правовращающий антипод хлорамфеникола) – физиологически неактивное вещество. Смесь D-(-)- и L-(+)-трео-изомеров известна под названием синтомицина. Необходимо отмстить, что удельное вращение раствора хлорамфеникола в этилацетате равно -25,50. Однако его растворы в этаноле вращают плоскость поляризованного света вправо (табл. 41.6). Это свойство ФС рекомендует для подтверждения его подлинности. Получают хлорамфеникол синтетическим путем, выделяя на определенных этапах синтеза необходимые изомеры. Из многочисленных исходных продуктов синтеза наиболее экономичен и доступен n-нитроацетофенон. Вначале синтезируют так называемое основание хлорамфеникола (D, L-трео-1 -n-нитрофенил-2-аминопропандиол-1,3): 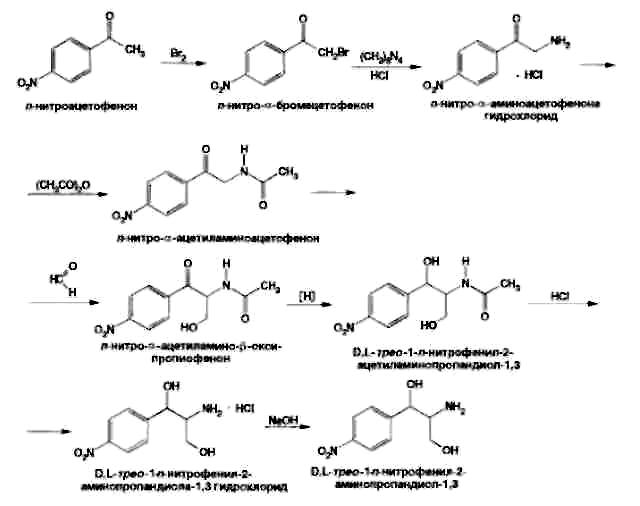 Полученное «основание» разделяют на оптические антиподы последовательной кристаллизацией из водного раствора или с применением D-винной кислоты. Затем на D-(-)-трео-изомер действуют метиловым эфиром дихлоруксусной кислоты и получают хлорамфеникол: 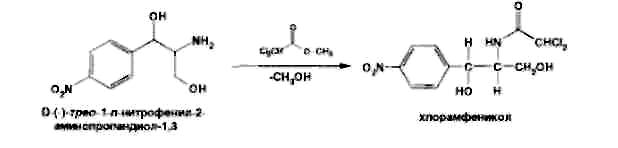 В медицинской практике применяют хлорамфеникол, хлорамфеникола стеарат, хлорамфеникола сукцинат натрия (растворимый). Они представляют собой белые или с желтоватым оттенком кристаллические вещества без запаха (см. табл. 41.6). Различить их можно по удельному вращению растворов Хлорамфеникола стеарат отличается от хлорамфеникола отсутствием горького вкуса. Ом практически нерастворим в воде. 41.6. Свойства хлорамфеникола и его производных
Хлорамфеникол малорастворим в воде, эфире, хлороформе, растворим в этилацетате. В отличие от хлорамфеникола и его эфира стеарата, хлорамфеникола натрия сукцинат очень легко растворим в воде. В этаноле хлорамфеникол легко растворим, стеарат трудно растворим, натрия сукцинат — растворим. Хлорамфеникола натрия сукцинат практически нерастворим в эфире и хлороформе, а хлорамфеникола стеарат легко растворим в хлороформе. Во всех указанных растворителях хлорамфеникола стеарат образует мутные растворы. Хлорамфеникола натрия сукцинат, являясь натриевой солью, дает положительную реакцию на ион натрия. Подлинность хлорамфеникола подтверждают по УФ-спектру 0,002%-ного водного раствора, который в области 220-400 нм имеет максимум поглощения при 278 нм и минимум при 237 нм. ФС рекомендует устанавливать величину удельного показателя поглощения при длине волны 278 нм (от 290 до 305). Водный 0,04%-ный раствор хлорамфеникола натрия сукцината в области 230-350 нм имеет один максимум поглощения при длине волны 276 нм. Для идентификации хлорамфеникола и хлорамфеникола натрия сукцината использованы вторые производные УФ-спектров поглощения, а также значения отношений оптических плотностей в максимумах и минимумах поглощения (растворители вода, этанол). Реакция гидролиза в щелочной среде лежит в основе испытания подлинности хлорамфеникола и его производных. При нагревании в течение 1-2 мин с 15%-ным раствором гидроксида натрия хлорамфеникол и хлорамфеникола стеарат приобретают желтое окрашивание, переходящее и красно-оранжевое. В отличие от хлорамфеникола стеарата хлорамфеникол при дальнейшем нагревании в щелочной среде образует кирпично-красный осадок аци-формы n-нитрофенилпропандиола-1,3. Одновременно ощущается запах аммиака. Фильтрат после подкисления азотной кислотой дает характерную реакцию на хлориды. Это позволяет подтвердить наличие в молекуле хлорамфеникола нитрофенильного радикала, аминогруппы и ковалентно связанного атома хлора, поскольку при щелочном гидролизе образуется «основание» хлорамфеникола, переходящее в аци-форму, выделяются аммиак и натриевая соль глиоксиловой кислоты: 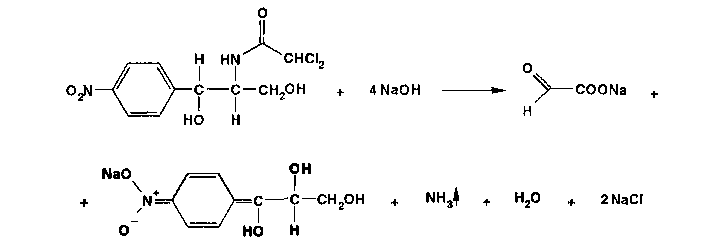 Хлорамфеникол, подобно эфедрину, за счет наличия в молекуле спиртового гидроксида и вторичной алифатической аминогруппы может образовывать окрашенные комплексные соединения с солями тяжелых металлов. С раствором сульфата меди образуется синий осадок, который растворяется в н-бутаноле, окрашивая его слой в фиолетовый цвет. Хлорамфеникола натрия сукцинат идентифицируют также по остатку янтарной кислоты, в частности при нагревании с резорцином и концентрированной серной кислотой. Образуется желтый раствор, имеющий в УФ-свете желтовато-зеленую флуоресценцию. Сели вместо резорцина взять гидрохинон, после охлаждения разбавить водой и смешать с бензолом, то его слой приобретает красную окраску. Хлорамфеникола стеарат, являясь сложным эфиром, гидролизуется в присутствии концентрированной хлороводородной кислоты (при нагревании) с образованием стеариновой кислоты, которая всплывает на поверхность в виде масляных капель, затвердевающих при охлаждении: 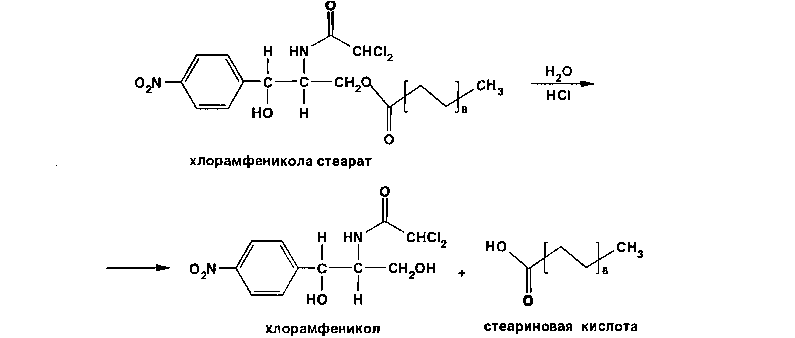 Известны многочисленные способы идентификации и количественного определения, основанные на предварительном гидрировании (цинковой пылью в кислой среде) нитрогруппы и молекуле хлорамфеникола до аминогруппы. Одновременно отщепляются атомы хлора: 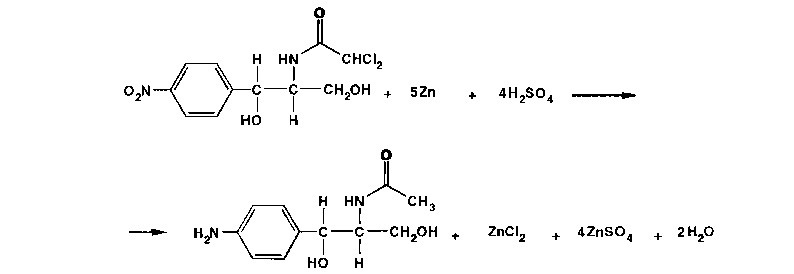 Образовавшийся 1-n-аминофенил-2-ацетиламинопропандиол-1,3 диазотируют и превращают в азокраситель, сочетая с β-нафтолом, α-нафтиламином или другим амином или фенолом. Например, в результате азосочетания с β-нафтолом образуется азокраситель красного цвета: 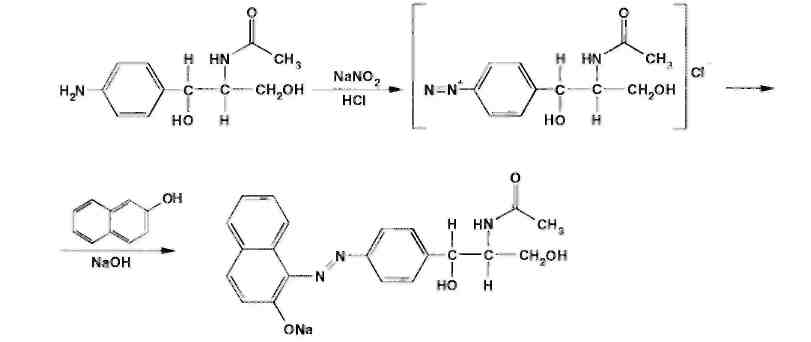 Для идентификации лекарственных веществ, содержащих в молекуле нитрогруппу, используют также испытание, основанное на последовательном гидрировании (цинком в хлороводородной кислоте) до ароматического амина с последующей его конденсацией с n-диметиламинобензальдегидом до образования окрашенной соли основания Шиффа. Хлорамфеникол в этих условиях приобретает ярко-оранжевое окрашивание. Наличие исходных и промежуточных продуктов синтеза в хлорамфениколе устанавливают методом ТСХ на пластинках Силуфол УФ-254 в системе хлороформ-метанол-вода (90:10:1). На хроматограмме допускается наличие не более трех посторонних пятен, каждое из которых не должно превышать пятно свидетеля по величине и интенсивности (не более 0,5% каждой примеси). В хлорамфеникола натрия сукцинате определяют содержание примеси свободного хлорамфеникола (не более 5%) методом диффузии в агар (ГФ XI, в. 2. с. 210), устанавливая антимикробную активность. В хлорамфеникола стеарате количественно определяют примесь свободной стеариновой кислоты (не более 3%) методом нейтрализации по фенолфталеину. Количественное определение хлорамфеникола по ФС выполняют нитритометрическим методом после предварительного гидрирования в кислой среде цинковой пылью: 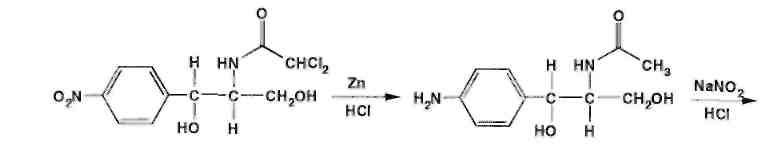 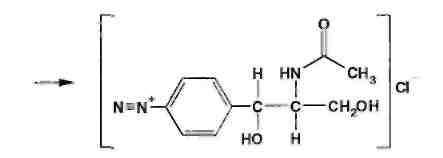 Содержание хлорамфеникола определяют и обратным бромид-броматометрическим методом. Однако этому, как и в случае нитритометрии, должна предшествовать стадия гидрирования нитрогруппы в аминогруппу с помощью цинковой пыли и хлороводородной кислоты при нагревании на кипящей водяной бане. Остаток цинка удаляют фильтрованием и к фильтрату добавляют избыток 0,1 M раствора бромата калия в присутствии бромидов. Количество непрореагировавшего титранта устанавливают с помощью йодида калия. Выделившийся йод оттитровывают 0,1 М раствором тиосульфата натрия. Количественное определение хлорамфеникола стеарата выполняют спектрофотометрическим методом в спиртовых растворах при длине волны 272 нм; он должен содержать 51-55% хлорамфеникола. Хлорамфеникола натрия сукцинат также определяют спектрофотометрическим методом, измеряя оптическую плотность 0,002%-ного водного раствора при длине волны 276 нм. Расчет количественного содержания выполняют относительно 0,002%-ного стандартного раствора, приготовленного из отвечающего требованиям ФС хлорамфеникола. оптическую плотность которого измеряют при той же длине волны. Содержание в нем хлорамфеникола должно быть 65,0-76,5%. Реакция образования комплексного соединения хлорамфеникола с ионом меди (II) использована для прямого титрования хлорамфеникола 0,01 М раствором сульфата меди (индикатор мурексид). Известны также аргентометрическое и меркуриметрическое определение хлорамфеникола по хлорид-иону, образующемуся после его окисления пероксидом водорода в щелочной среде. В результате этой реакции образуются две молекулы хлорида натрия. Хлорид-ион можно получить и при озолении хлорамфеникола в присутствии карбонатов натрия и калия. Хлорамфеникол и его сложные эфиры хранят по списку Б, в хорошо укупоренной таре (хлорамфеникол в склянках оранжевого стекла), а хлорамфеникола натрия сукцинат - в сухом, защищенном от света месте при комнатной температуре. Хлорамфеникол – антибиотик широкого спектра действия. Его применяют длялечения брюшного тифа, паратифов, дизентерии, бруцеллеза, коклюша, пневмонии, различных инфекционных заболеваний. Он легко всасывается из желудочно-кишечного тракта, сохраняя при этом свою активность. Это позволяет использовать хлорамфеникол для назначения внутрь обычно в дозах 0,5 г 3-4 раза в сутки. В детской практике применяют менее горький хлорамфеникола стеарат, который в желудочно-кишечном тракте постепенно гидролизуется с образованием хлорамфеникола. Показания для применения хлорамфеникола стеарата те же, но, поскольку он всасывается медленнее и содержит 51-55% хлорамфеникола, то дозы соответственно увеличивают в 2 раза. Хлорамфеникола натрия сукцинат (растворимый) применяют аналогично, но внутривенно, внутримышечно и подкожно 2-3 раза в сутки по 0,5-1,0 г в виде растворов для инъекций. Источник: Беликов В.Г. Фармацевтическая химия. В 2ч.: Уч. Пособие /В.Г. Беликов – 4-е изд., перераб. и доп. – М.: МЕДпресс-информ. 2007. – 624с. Список литературы 1.Анализ лекарственных смесей. / А.П. Арзамасцев, В.М. Печенников, Г.М. Родионова и др. — М.: Компания Спутник+, 2000. - 275с. 2.Арзамасцев AM. Стандартные образцы лекарственных веществ. / А.П. Арзамасцев, П.Л. Сенов. – М.: Медицина. 1978. – 248с. 3.Бабилев Ф.В. Полиморфизм лекарственных веществ./Ф. В. Бабилев, И.Я. Андроник. – Кишинев: Штиница, 1981. – 239с. 4.Бабилев Ф.В. Применение люминесценции в фармацевтическом анализе./Ф.В. Бабилев. – Кишинев: Штиница, 1977. – 120с. 5.Бычков В.Г. Дифференциальная фотометрия. /В.Г. Беликов. — Ставрополь: Кн. изд-во, 1970. – 136с. 6.Беликов В.Г. Современные синтетические и природные лекарственные средства: Кр. справочник. Изд. 2-е, перераб. и доп. /В.Г. Беликов. - Пятигорск: Пятигорск, гос. фармац. акад.. 2002. - 335с. 7.Белоусов Ю.Б. Клиническая фармакология и фармакотерапия. /Ю.Б. Белоусов, B.C. Моисеев, В.К. Лепахин. – М.: Универсум Паблишинг, 1997. – 531с. 8.Березовский В.М. Химия витаминов. / В.М. Березовский. – М.: Пищевая промышленность, 1973. – 632с. 9.Берштейн И.Я. Спектрофотометрический анализ в органической химии. / И.Я. Берштейн. Ю.Л. Каминский. – Л.: Химия. 1975. – 230с. 10.Булатов М.И. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. /М.И. Булатов, И.П. Калинкин. – Л.: Химия, 1976. – 376с 11.Гауптман З. Органическая химия. /3. Гауптман, Ю. Грефе, X. Ремане. Пер. с нем. – М.: Химия, 1979. – 832с. 12.Государственная фармакопея СССР. /М-во здравоохранения СССР. – 10-е изд. – М.: Медицина, 1968. – 1080с. 13.Государственная фармакопея СССР. /М-во здравоохранения СССР. – 11-е изд. – М.: Медицина, 1987. – вып. 1; 1990 – вып. 2. 14.Государственный реестр лекарственных средств. – М., 2001. – 1277с. 15.Джилкрист Т. Химия гетероциклических соединений. /Т. Джилкрист. Пер. с англ. – М.: Мир, 1996. – 464с. 16.Дорохова Е.Н. Аналитическая химия. Физико-химические методы анализа: Учеб. /Н.И. Дорохова, Г.В. Прохорова. – М.: Высш. шк, 1991. – 256с. 17.Евстигнеева Р.П. Тонкий органический синтез: Учеб. пос. /Р.П. Евстигнеева. – М.: Химия, 1991. – 183с. 18.Егоров Н.С. Основы учения об антибиотиках: Учеб. /Н.С. Егоров. – М.: Высш. шк.. 1986. – 448с. 19.Иванский В.И. Химия гетероциклических соединений. /В.И. Иванский. – М.: Высш. шк.. 1978. – 559с. 20.Идентификация органических соединений. /Р. Шрайнер, Р. Фьюзон, Д. Кертин, Т. Морил. Пер. с англ. – М.: Мир, 1983. – 703с. 21.Кнорре Д.Г. Биологическая химия: Учеб. /Д.Г Кнорре, С.Д. Мызина. – М.: Высш. шк., 1998. – 479с. 22.Крамаренко В.Ф. Химико-токсикологический анализ: Практикум. /В.Ф. Крамаренко. – Киев: Вища шк., 1982. – 272с. 23.Кулешова М.И. Анализ лекарственных форм, изготовляемых н аптеках. /М.И. Кулешова, Л.П. Гусева, O.K. Сивицкая. 2-е изд. – М.: Медицина. 1989. – 287с. 24.Кулешова М.И. Пособие по качественному анализу лекарств. /М.И. Кулешова, Л.Н. Гусева, O.K. Сивицкая. – М.: Медицина, 1980. – 208с. 25.Лабораторные работы по фармацевтической химии: Учеб. пос. для фармац. инт-ов и фармац. фак. мед. ин-тов. /В.Г. Беликов, Е.И. Вергейчик, В.Е. Годяцкий и др. / Под ред. В.Г. Беликова. – М.: Высш. шк., 1989. – 375с. 26.Лакин К.М. Биотрансформация лекарственных веществ. /К.М.Лакин, Ю.Ф. Крылов. – М.: Медицина. 1981. – 344с. 27.Ланчини Д. Антибиотики. /Д. Ланчини, Ф. Паренти. – М.: Мир, 1985. – 272с. 28.Машковский М.Д. Лекарства XX века. /М.Д. Машковский. – М.: Новая Волна, 1998. – 320с. 29.Машковский М.Д. Лекарственные вещества. В 2-х тт. 14 изд. / М.Д. Машковский. – М.: Новая Волна, 2000. – Т. 1-2. 30.Международная фармакопея. /ВОЗ. – 3-е изд. – М.: Медицина, 1981-1995. – Т. 1-4. 31.Мелентьева Г.А. Анализ фармакопейных препаратов по функциональным группам. /Г.А. Мелентьева, А.А. Цуркан, Т.Е. Гулимова. /Под ред. А.П. Арзамасцева. – Рязань, 1990. 32.Мелентьева Г.А. Фармацевтическая химия. В 2-х т. /Г.А. Мелентьева. – М.: Медицина, 1976. – Т. 1-2. 33.Методы анализа лекарств. /Н.П. Максютина, Ф.Е. Каган, Л.А. Кириченко, Ф.А. Митченко. – Киев: Здоров'я. 1984. – 224с. 34.Методы идентификации фармацевтических препаратов. /И.М. Максютина, Ф.Е. Каган, Ф.А. Митченко и др. — Киев: Здоров'я, 1978. – 240с. 35.Некрасов Б.В. Основы обшей химии. В 2-х т. / Б.В. Некрасов, — М.: Химия, 1974. – Т 1-2. 36.Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. – М.: Высш. шк., 1993. – 559с. 37.Орехов AM. Химия алкалоидов растений СССР. /А.П. Орехов. – М.: Наука, 1965. – 391с. 38.Основы аналитической химии: В 2-х кн. /Под ред. Ю.А. Золотова. – М: Высш. шк., 2000. – Кн. 1-2. 39.Пиккеринг У.Ф. Современная аналитическая химия. /У.Ф. Пиккеринг. Пер. с англ. – М.: Химия, 1977. – 559с. 40.Погодина Л.И. Анализ многокомпонентных лекарственных форм. /Л.И. Погодина. – Мн.: Вышейшая школа, 1985. – 240с. 41.Полюдек-Фабини Р. Органический анализ. /Р. Полюдек-Фабини, Т. Бейрих. Пер. с нем. – Л.: Химия, 1981. – 624с. 42.Пономарев В.Л. Математические методы в фармации. /В.Д. Пономарев, ВТ. Беликов, Н.И. Коковкин-Щербак. – М.: Медицина, 1983. –232с. 43.Райлс А. Основы органической химии для студентов биологических и медицинских специальностей. /А. Райлс, К. Смит, Р. Уорд. Пер. с англ. – М.: Мир, 1983. – 352с. 44.Регистр лекарственных средств России: Энциклопедия лекарств: Ежегод. сб. – М.: РЛС, 2002. – Вып. 9. – 1504с. 45.Розенблит А.Б. Логико-комбинационные методы в конструировании лекарств. /А.Б. Розенблит, B.E. Голендер. – Рига: Зинатне, 1983. – 351с. 46.Рубцов М.В. Синтетические химико-фармацевтические препараты: Справочник. /М.В. Рубцов, А.Г. Байчиков. – М.: Медицина, 1971. – 328с. 47.Руководство к лабораторным занятиям по фармацевтической химии: Учеб. пособие. /ЭМ. Аксенова, ОМ. Адрианова, A.M. Арзамасцев и др. – М: Медицина, 2001. – 384с. 48.Синев Д.М. Технология и анализ лекарств. /Д.Н. Синев, И.Я. Гуревич. – Л.: Медицина, 1989. – 366с. 49.Слесарев В.И. Химия. Основы химии живого: Учеб. /В.И. Слесарев. – СПб.: Химиздат, 2000. – 768с. 50.Солдатенков А.Т. Основы органической химии лекарственных веществ. /А.Т. Солдатенков, Н.М. Колядина, И.В. Шендрик. – М.: Химия, 2001. – 192с. 51.Справочник провизора-аналитика. /Д.С. Волох, Н.М. Максютина, Л.А.Кириченко и др. – Киев: Здоровья, 1989. – 200с. 52.Технология и стандартизация лекарственных средств. /Под ред. В.П. Георгиевского, Ф.А. Конева. – Харьков; ООО «Рирег», 1996. – 784с. 53.Тюкавкина Н.А. Биоорганическая химия. /Н.А. Тюкавкина, Ю.И. Бауков. – М.: Медицина, 1985. – 480с. 54.Файгль Ф. Капельный анализ органических веществ./Ф. Файгль. – М.: Госхимиздат, 1962. – 836с. 55.Харитонов Ю.Я. Аналитическая химия (аналитика). В 2-х кн. /Ю.Я Харитонов. – М.: Высш. шк., 2001. – Кн. 1-2. 56.Харкевич Д.А. Фармакология: Учеб. /Д.А. Харкевич. – М.: Издательский дом ГЭОТАР-МЕД, 2001. – 664с. 57.Холодов Л.Е. Клиническая фармакокинетика. /Л.Е. Холодов, В.П. Яковлев. – М.: Медицина, 1985. – 464с. 58.Шаршунова М. Тонкослойная хроматография в фармации и клинической биохимии. В 2-х ч. / М. Шаршунова, В. Шварц, Ч. Михалец. Пер. со словац. – М.: Мир, 1980. – Ч. 1-2. 59.Шашкова Г.В, Справочник синонимов лекарственных средств. /Г.В. Шашкова, В.К. Лепахин, Г.Н. Колесникова. – М.: РЦ «Фармединфо», 2001. – 480с. 60.Энциклопедический словарь лекарственных растений и продуктов животного происхождения. /Под ред. Г.М. Яковлева, К.Ф. Блиновой. – СПб.: Спец. лит., 1999. – 407с. 61.Юинг Г. Инструментальные методы химического анализа. /Г. Юинг. Пер. с англ. – М.: Мир, 1989. – 608с. 62.Яхонтов Л.М. Синтетические лекарственные средства. /Л. Н. Яхонтов, Р.Г. Пашков. – М.: Медицина, 1983. – 272с. |