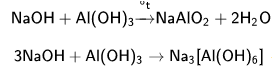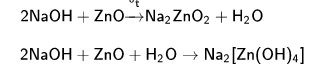Аналитическая Химия Реферат. Литература 37 s элементы Элементы группы I а водород
 Скачать 428.82 Kb. Скачать 428.82 Kb.
|
ОглавлениеЭлементы группы II А 9 Магний 9 Кальций 10 Хлорофилл 12 d-элементы 26 Медь 26 Цинк 28 Литература 37 S-элементы Элементы группы I А Водород Элемент первой группы главной подгруппы, а также седьмой группы главной подгруппы в первом малом периоде. Данный период состоит всего из двух атомов: гелия и водорода. Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %. Физические свойства
Химические свойства Водород способен проявлять как восстановительные, так и окислительные свойства. Возможные степени окисления элемента +1; -1. Поэтому его часто используют в промышленности для синтезов и различных реакций Строение молекулы Состав молекулы водорода представлен двумя атомами, которые, сближаясь, образуют ковалентную неполярную связь, а также одну электронную пару. Строение одного атома представляет: 1 положительно заряженное ядро, вокруг которого передвигается 1 отрицательно заряженный электрон. Этот электрон располагается на 1s орбитали. Н - 1е = Н+ этот ион водорода является положительным. Н + 1е = Н– ион водорода отрицательный. Вода 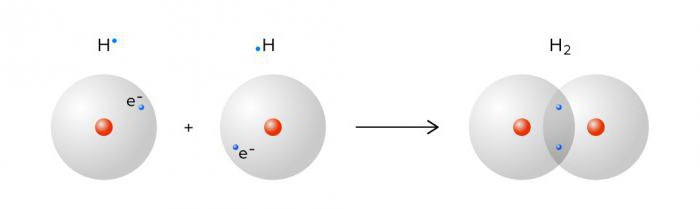 Вода́— бинарное неорганическое соединение, химическая формула Н2O. В твёрдом состоянии называется льдом , а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов. Около 71 % поверхности Земли покрыто водой. Большая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах. Является хорошим растворителем. Химические свойства воды. Молекулы воды отличаются большой устойчивостью к нагреванию. Однако при температурах выше 1000оС водяной пар начинает разлагается на водород и кислород: 2H2 O 2H2 O + O2 В ходе реакций нейтрализации : H2 SO4 + 2KOH = K2 SO4 + 2H2 O Восстановлением водородом оксидов металлов : CuO + H2 = Cu + H2 O Вода реагирует при комнатной температуре:
2H2 O + 2Na = 2NaOH + H2 * со фтором и межгалоидными соединениями 2H2 O + 2F2 = 4HF + O2 H2 O +F2 = HF + HOF (при низких температурах) 3H2 O + 2IF2 = 5HF +HIO3 9H2 O + 5BrF3 = 15HF + Br2 + 3HBrO3
AI2 S3 + 6H2 O = 2AI (OH) 3 + 3H2 S
Вода реагирует при нагревании:
4H2 O + 3 Fe + Fe3O4 + 4H2
Вода реагирует в присутствии катализатора:
Физические свойства воды Вода, или оксид водорода, является химическим веществом, имеет вид бесцветной жидкости, которая не обладает ни запахом, ни вкусом. В нормальных условиях H2O (вода) сохраняется в жидком агрегатном состоянии, в то время как аналогичные соединения водорода являются газами. Все это можно объяснить особыми характеристиками атомов, слагающих молекулы, и присутствием между ними связей. Строение молекулы воды Молекула воды имеет структуру равнобедренного треугольника: в вершине этого треугольника расположен атом кислорода, а в основании его — два атома водорода. Угол при вершине составляет 104°27, а длина стороны — 0,096 нм. Эти параметры относятся к гипотетическому равновесному состоянию молекулы воды без ее колебаний и вращений. Геометрия молекулы воды и её электронные орбиты изображены на рисунке. 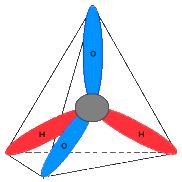 Биологическая ценность воды Значение природного компонента в жизни и быту просто неоценимо, так как без него невозможно существование. Вода необходима для жизни потому, что:
Вода как растворитель Всякий раствор состоит из растворенных веществ и растворителя, тоесть среды, в которой эти вещества равномерно растворены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. В случае водного раствора соли растворители, конечно, являются вода: Na2SO4+H2O=2NAOH+H2SO Натрий Натрий — элемент первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na. Простое вещество натрий — мягкий щелочной металл серебристо- белого цвета. Оксид натрия Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле. Взаимодействие металлического натрия с кислородом: 4Na+O2----2Na2O{\displaystyle {\mathsf {4Na+O_{2}\longrightarrow 2Na_{2}O}}} 1.Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия: 6Na+2O2-----2Na2O+2Na2O2 2. Взаимодействие металлического натрия с нитратом натрия: 10Na+2NaNo3----6Na2O+N2 3. Прокаливание пероксида натрия с избытком натрия: Na2O2+ 2Na----2Na2O {\displaystyle {\mathsf {Na_{2}O_{2}+2\ Na\longrightarrow 2\ Na_{2}O}}}4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C. Гидроксид натрия Самая распространённая щёлочь, химическая формула NaOH. В год в мире производится и потребляется около 57 млн тонн едкого натра. Гидроксид натрия вступает в следующие реакции: с кислотами, амфотерными оксидами и гидроксидами
(кислая соль, при отношении 1:1) 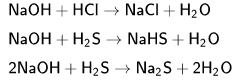 (в избытке NaOH) Общая реакция в ионном виде:
с солями в растворе: c неметаллами: например, с фосфором — с образованием гипофосфита натрия: с серой: с галогенами: 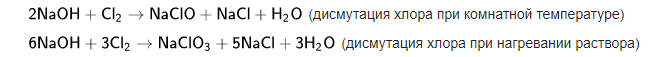 с металлами с эфирами, амидами и алкилгалогенидами (гидролиз): 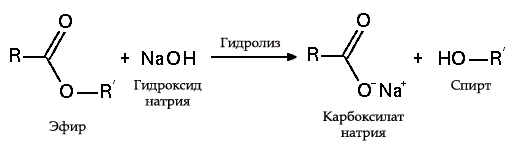 Калий Калий – один из биогенных элементов, постоянна составная часть растений и животных. У животных содержание калия составляет в среднем 2,4 г/кг. В отличии от натрия, калий сосредоточен главным образом в клетках, во внеклеточной среде его много меньше. В клетке калий распределён неравномерно. Оксид калия Оксид калия (K2O) — бледно-жёлтое, иногда бесцветное вещество. Содержится в некоторых видах удобрений и цемента.Химически активное вещество. На воздухе расплывается, поглощает СО2, образуя карбонат калия: {\displaystyle {\mathsf {K_{2}O+CO_{2}\longrightarrow K_{2}CO_{3}}}}Бурно реагирует с водой, образуя гидроксид калия: {\displaystyle {\mathsf {K_{2}O+H_{2}O\longrightarrow 2KOH}}}Реагирует со спиртом, с эфиром. Энергично взаимодействует с галогенами, расплавленной серой, разбавленными кислотами, образуя различные соединения калия. Гидроксид калия. Гидроксид натрия-неорганическое соединение с формулой KOH. Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы KOH имеют сильнощелочную реакцию. Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия. Соли натрия и калия. Натрий и калий образуют соли почти со всеми известными кислотами. Соли можно получить при взаимодействии оксидов или гидроксидов металлов с соответствующими кислотами: K2O+HCl=2KCl+H2O, NaOH+HCl=NaCl+H2O. Соли бескислородных кислот образуются при непосредственном взаимодействии простых веществ: 2K+S=K2S, 2Na+I2=2NaI. Важнейшие соли натрия: хлорид натрия NaCl (каменная соль, поваренная соль), карбонат натрия Na2CO3 (сода, кальцинированная сода) и его кристаллогидрат Na2CO3⋅10H2O(кристаллическая сода), гидрокарбонат натрия NaHCO3 (питьевая сода), сульфат натрия Na2SO4 и его кристаллогидрат Na2SO4⋅10H2O (глауберова соль), нитрат NaNO3 (натриевая селитра). Важнейшие соли калия: хлорид калия KCl (сильвин), карбонат калия K2CO3 (поташ), нитрат калия KNO3 (калийная селитра), сульфат калия K2SO4. Роль элементов в жизнедеятельности живых организмов. Калий: Соединения калия обеспечивают активность всем ферментам, которые являются участниками всех химических реакций, происходящих в организме и без которых невозможно переваривание пищи. Суточная норма калия для организма составляет 2500 мг. Больше всего концентрация этого элемента отмечается в клетках печени и миофибриллах мышечных волокон — до 150 — 180 ммоль/л, они являются своеобразным депо этого микроэлемента, где ион связан с гликогеном, белком и фосфорными соединениями. Недостаток калия можно определить по некоторым отличительным симптомам: судороги, усталость, аритмия, сердцебиение и головокружение. Натрий: Натрий содержится практически во всех продуктах питания в количестве 15-80 мг на 100 г, однако наибольшее количество натрия человек получает с поваренной солью (хлоридом натрия). Натрий является макроэлементом, его содержание в организме взрослого человека составляет около 150-200 граммов. Содержание натрия в межклеточном пространстве в 15 раз выше, чем внутри клеток (разница обеспечивается специальным натрий-калиевый насосом). Обмен регулируется натрия гормонами щитовидной железы: при ее недостаточности натрий задерживается в тканях, а при гиперфункции натрий усиленно выводится из организма. |