Элементы группы II А Магний
Магний – постоянная часть растительных и животных организмов. Концентраторами магния является некоторые водоросли, накапливающие до 3% Mg. Также магний обнаружен в рибосомах всех живых организмов. Магний активирует многие ферменты, вместе с кальцием и магнием обеспечивает стабильность хромосом, участвует в поддержании тургорного давления в клетках. Животные получают магний с пищей. В организме магний накапливается в печени, затем значительная его часть переходит в кости мышцы. Недостаток с организме солей магния наришает нармальную возбудимость нервной системы, сокращение мышц.
Оксид магния
Оксид магния — химическое соединение с формулой MgO, белые кристаллы,нерастворимые в воде, пожаро- и взрывобезопасен. Основная форма — минерал периклаз.
Получение: Оксид магния получают обжигом минералов магнезита и доломита.
Гидроксид магния
Неорганическое вещество, осно́вный гидроксид металла магния, имеет формулу Mg(OH)2. Слабое малорастворимое основание.
Взаимодействие растворимых солей магния с щелочами:
В общем виде:
Примеры: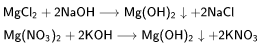
Взаимодействие раствора хлорида магния с обожжённым доломитом:
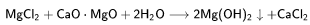
Взаимодействие металлического магния с парами воды:
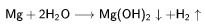
Кальций
Кальций – один из биологических элементов, необходимый для нормального протекания жизненных организмов. Он присутствует во всех тканях и жидкостях животных. Кальций необходим для оброзования ряда клеточных структур, поддержании нормальной проницаемости наружной клеточной мембраны, для оплодотворения яйцеклеток у рыб и др. животных. Ионы Ca+2 передают возбуждение на мышечное волокно, вызывает его сокращение, увеличивает силу сердечных сокращений. В клетках почти весь кальций находиться в виде соединения с белками, нуклеиновыми кислотами, фосфолипидами.
Оксид кальция
Оксиды кальция— основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
CaO + H2O = Ca(OH)2.
Соли кальция.
Соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Ионы магния и кальция как комплексообразователя.
Внутри клетки ионов Mg2+ во много раз больше, чем во внеклеточном про- странствие, тогда как Са2+ преимущественно внеклеточный катион .Ион Mg2+ - более сильный комплексообразователь, чем ион Са2+. Он служит центром некоторых метало ферментов например, катализирует столь важный гидролиз АТФ. Комплекс магния с АТФ входит в субстрат фермента киназы, отвечающей за перенос фосфатных групп. Киназы управляются кальмодулином и другими белками и являются основой сигнальной системы у высших организмов. В стенках сосудов и артерий кальций присутствует в виде СаСО3 или комплекса с холестерином, а в почках в виде оксалатов или уратов (солей мочевой кислоты). Ионы Са2+ , образуя не очень прочные координационные соединения, имеют невысокие значения констант образования переменное координационное число (6 и 8), рыхлую, подвижную координационную сферу, а также высокие скорости обмена лигандами. Поэтому комплексы кальция пригодны для участия в сигнальных системах, регулируют сокращение мышечных волокон, активируют многие ферменты , определяют процесс свертывания крови. Концентрация Са2+ в организме регулируется гормоном паращитовидной железы кальцитонином, а усвоение определяется содержанием в организме витамина D. Недостаток этого витамина приводит к снижению всасывания кальция и проявляется в виде заболевания рахита. Кальций – внеклеточный элемент; его концентрация в клетке мала:
10 –7 моль/л, а вне клетки -
10-3 моль/л, причем этот градиент концентраций сохраняется благодаря кальцию насосу.
Хлорофилл
Зелёный пигмент, окрашивающий хлоропласты растений в зелёный цвет . При его участии осуществляется процесс фотосинтеза. По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и структурно близки гему. Как уже отмечалось выше, хлорофилл – особый пигмент, придающий растениям зеленую окраску и являющийся важнейшим и необходимым элементом в процессе фотосинтеза. Химический состав хлорофилла представляет собой атом магния, окруженный атомами водорода, азота, кислорода и углерода. В 1930 году Х. Фишером было сделано поразительное открытие – химическая структура гемоглобина практически повторяет структуру пигмента хлорофилла, правда, соединение строится не вокруг атома магния, а вокруг железа. С тех пор зеленый пигмент и стали называть «кровью растений», а многие ученые задались целью найти способ использования этого вещества в борьбе за здоровье человеческого организма.
Жесткость воды
Природная вода, содержащая в растворе большое количество солей кальция или магния, называется жесткой водой в противоположность мягкой воде, содержащей мало солей кальция и магния или совсем не содержащей их.Суммарное содержание этих солей в воде называется ее общей жесткостью. Она подразделяется иа карбонатную и некарбонатную жесткость. Первая из них обусловлена присутствием гидрокарбонатов кальция и магния, вторая — присутствием солеи сильных кислот — сульфатов или хлоридов кальция и магния. При длительном кипячении воды, обладающей карбонатной жесткостью, в ней появляется осадок, состоящий главным образом из СаСОз, и одновременно выделяется СO2. Оба эти вещества появляются вследствие разложения гпдрокарбоната кальция:
Са(НСO3)2 = СаСO3 + CO2 + Н2O
Поэтому карбонатную жесткость называют также временной жесткостью.
Жесткая вода не дает пены с мылом, так как содержащиеся в мыле растворимые натриевые соли жирных кислот -пальмитиновой и стеариновой - переходят в нерастворимые кальциевые соли тех же кислот:
2C17H35COONa + CaSO4 = (С17Н35СОО)2Са + Na2SO4
При кипячении гидрокарбонаты кальция и магния превращаются в СаСОз и Mg(OH)2
Са(НСО3)2 = СаСО3 + CO2+ Н2O
Mg(HCO2)2 = Mg(OH)2 + 2CO2
в результате чего устраняется только карбонатная жесткость.
Методы устранения жесткости воды.
Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция имагния разлагаются с образованием накипи: Ca(HCO3)2 → ↓ CaCO3 + CO2 + H2O. Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат: Ca(HCO3)2 + Ca(OH)2 → ↓ 2CaCO3 + 2H2O Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения: 3Ca(HCO3)2 + 2Na3PO4 → ↓ Ca3(PO4)2 + 6NaHCO3 3MgSO4 + 2Na3PO4 → ↓ Mg3(PO4)2 + 3Na2SO4
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки. Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдаёт ионы натрия или водорода. При правильно подобранной ионообменной загрузке жёсткость воды снижается.
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Различают нанофильтрацию и пикофильтрацию. В качестве недостатков данного метода следует отметить: - необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану; - относительно высокая стоимость 1 л получаемой воды (дорогое оборудование, дорогие мембраны); - низкуюминерализацию получаемой воды (особенно при пикофильтрации). Вода становится практически дистиллированной.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Роль кальция и магния в жизнедеятельности живых организмов.
Кальций:
Кальция в организме содержится больше, чем других минералов. Суточная потребность в кальции составляет около 1000 мг или 25 ммоль кальция. При этом в желудочно-кишечном тракте всасывается только 25-50% этого количества, определённое количество кальция выводится из организма с мочой.
Основная масса кальция находится в костях и принимает участие в образовании костной ткани, она не участвует в обменных процессах. Только примерно 1% всей массы кальция организма участвует в обмене веществ и составляет 50-70 тысяч ммоль. Это, так называемый, «обменный» кальций.
Магний:
Жизненно важный микроэлемент, щелочноземельный металл, без которого не обходятся основные этапы метаболизма. Ценными источниками магния являются продукты растительного происхождения: отруби, орехи, крупы, специи, чай, кофе, какао, овощи. Продукты животного происхождения содержат небольшие количества магния, однако из них он усваивается более активно. Суточная потребность организма в магнии составляет 0,05% от массы тела. В среднем это составляет около 400 мг. Для беременных женщин эта цифра возрастает до 450 мг.
P-элементы.
Элементы группы V A
Общая характеристика.
Все элементы главной подгруппы V группы, имеют пять электронов на внешнем электронном уровне. В целом характеризуются как неметаллы. Способность к присоединению электронов выражена значительно слабее, по сравнению с халькогенами и галогенами. Все элементы подгруппы азота имеют электронную конфигурацию внешнего энергетического уровня атома ns2np3 и могут проявлять в соединениях степени окисления от −3 до +5.
Азот
Элемент 15-й группы второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 7. Относится к пниктогенам. Обозначается символом N . Простое вещество азот — двухатомный газ без цвета, вкуса и запаха. Один из самых распространённых элементов на Земле. Азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот.
Водородные соединения азота.
С водородом азот образует два соединения: аммиак NH3 и гидразин N2H4(H2N – NH2). Наибольшее значение имеет аммиак.
В лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом натрия:NH4Cl + NaOH = NaCl + NH3 + H2O
Основным промышленным способом получения аммиака является синтез его из азота и водородаN2 + 3H2 ↔ 2NH3 ∆ Н0 = - 82,4
( Катализатор Pt; t = 450 - 5000С; Р = 250 атм)
Равновесие обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
Аммиак
Аммиак (нитрид водорода) — химическое соединение с формулой NH3, при нормальных условиях — бесцветный газ с резким характерным запахом. Плотность аммиака почти вдвое меньше воздуха
Характерные реакции.
Реакции с изменением степени окисления атома азота (реакции окисления)
N-3→ N0 → N+2
NH3 – сильный восстановитель.
с кислородом
1. Горение аммиака (при нагревании)
4NH3 + 3O3 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O3 → 4NO + 6H2O
с сильными окислителями
2NH3 + 3Cl3 = N2 + 6HCl (при нагревании)
аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N3 + 3H3
Кислородные соединения азота.
Для азота известны окислы, по составу формально отвечающие всем валентностям от . единицы до пяти. Их формулы и названия сопоставлены ниже: N2 O – закись азота NO – окись азота N2 O3 – азотистый ангидрид NO2 – двуокись азота N2O5– азотный ангидрид Закись азота может быть получена разложением азотнокислого аммония, протекающим около 200 °С по уравнению:
NH4 NO3 = 2Н2О + N2O взаимодействие NO2 с водой идет по уравнению:
3NO2 + Н2О = 2HNO3 + NO Наиболее характерны для азотистой кислоты сильно выраженные окислительные свойства, причем восстанавливается она в большинстве случаев до NO. С другой стороны, действием сильных окислителей азотистая кислота может быть окислена до азотной. Типичные примеры характерных для нее окислительно–восстановительных процессов приводятся ниже:2HNO2 + 2HJ = J2 + 2NO + 2Н2О
2НМnО4 + 5HNO2 = 2Mn(NO3 )2 + HNO3 + ЗН2О Обе эти реакции протекают в кислой среде. Нитриты металлов, соли азотистой кислоты HNO2. Бесцветные кристаллические вещества; термически менее устойчивы, чем нитраты. Характер разложения зависит от катиона ,
2AgNO2 = AgNO3 + Ag + NO. Почти все нитриты хорошо растворимы в воде(исключение — AgNO2). Нитриты могут проявлять как окислительные, так и восстановительные свойства.
Азотистая кислота
Слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Кислота высокотоксична. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
Нитриты
Соли азотистой кислоты HNO2, например, нитрит натрия NaNO2, нитрит кальция Ca(NO2)2. Известны нитриты щелочных, щелочноземельных, 3d-металлов, а также нитриты свинца и серебра.
Азотная кислота
Сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Кислота ядовита.
Нитраты
Соль азотной кислоты, содержит однозарядный анион NO3−. Основное применение нитратов — удобрения (селитры), взрывчатые вещества (аммониты), получение стекла, производство лекарств, пищевые добавки при производстве колбас[1], в пиротехнике, компоненты ракетного топлива.
Биологическая роль азоты и фосфора
Азот:
является химическим элементом, необходимым для существования животных и растений, он входит в состав белков аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле — около 2,5 %. В связи с этим значительное количество связанного азота содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. Это количество оценивается примерно в 1,9·1011 т. В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра», норвежская, индийская селитры.
Фосфор:
относится к структурным (тканеобразующим) макроэлементам, его содержание в организме взрослого человека составляет около 700 г.
Большая часть фосфора (85-90%) находится в костях и зубах, остальное – в мягких тканях и жидкостях. Около 70% общего фосфора в плазме крови входит в органические фосфолипиды, около 30% - представлено неорганическими соединениями (10% соединения с белком, 5% комплексы с кальцием или магнием, остальное – анионы ортофосфата).
Водородные и кислородные соединения фосфора.
С водородом фосфор образует газообразный фосфористый водород или фосфин, PH3. Его можно получить кипячением белого фосфора с раствором щелочи или действием соляной кислоты на фосфид кальция Ca3P2:
Ca3P2 + 6HCI = 3CaCI +2PH3
Фосфин- бесцветный газ с чесночным запахом, очень ядовитый. При его горении образуется фосфорный ангидрид и вода:
2PH3 + 4O2 = P2O5 + 3H2O.
Элементы группы VI A
Кислород, сера, селен, теллур и радиоактивный металл полоний. Кислород и сера – неметаллы. Полоний металл серебристо белого цвета, напоминающий по физическимсвойствам свинец, селен и теллур, занимающие промежуточное положение, являются полупроводниками. Кислород, сера, селен, теллур – имеют неметаллический характер, называются «халькогены», т.е. образующие руды. На внешнем уровне атомов этих элементов содержится 6 электронов. В атомах элементов Se, Te и Po электроны внешнего уровня экранируются от ядра десятью d-электронами пред внешнего уровня, что ослабляет их связь с ядром и способствует проявлению металлических свойств этих элементов.
Кислород
Элемент 16-й группы второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода, в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртутив герметично закрытом сосуде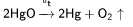
Особенности электронной структуры молекулы кислорода
Отсутствие d-подуровня, поэтому ва- лентность кислорода равна 2, но за счёт не поделённых электронных пар кислород может быть донором электронных пар. У серы и остальных халькогенов возможен переход p и s-электронов в d–состояние. Поэтому валентность их может быть 2,4,6, а значение степени окисления меняется от -2 до +6. 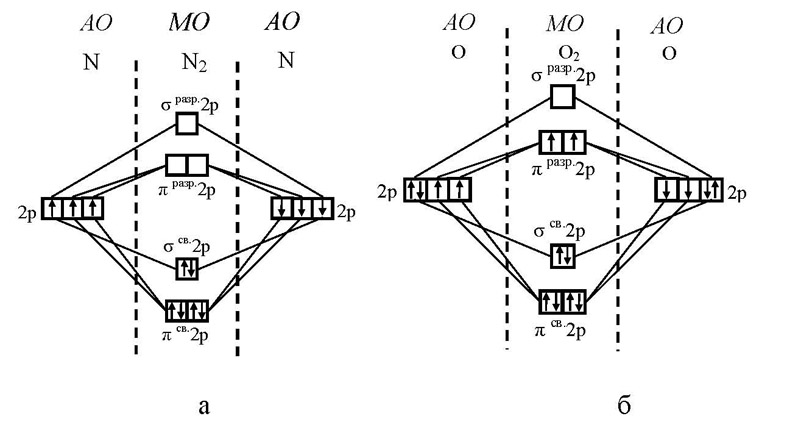
Озо́н
Озо́н — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария: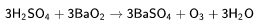
Биологическая роль озона.
Большинство живых существ (аэробы) дышат кислородом. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Сера
Се́ра — элемент 16-й группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S . В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Биологическая роль серы.
Сера — один из биогенных элементов. Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов. Сера участвует в образовании третичной структуры белка (формирование дисульфидных мостиков). Также сера участвует в бактериальном фотосинтезе (сера входит в состав бактериохлорофилла, а сероводород является источником водорода). Окислительно-восстановительные реакции серы — источник энергии в хемосинтезе.В человеке содержится примерно 2 г серы на 1 кг веса.
Кислородные соединения серы
Все кислородные соединения серы являются экзотермическими.
Оксиды: известны как высшие, так и низшие оксиды серы. К последним относятся такие неустойчивые оксиды, как S2O3 и S2O. Например, S2O образуется в зоне электрического разряда, проходящего в атмосфере SO2, и тут же разлагается:
2S2O = 3S + SO2,
аналогично диспропорционирует и S2O3
2S2O3 = S + 3SO2.
Из высших оксидов серы наиболее изучены SO2 - оксид серы IV (сернистый ангидрид) и SO3 -оксид серы VI (ангидрид серной кислоты).
Диоксид серы представляет собой бесцветный газ с резким запахом, Тпл =-75?С, Ткип = -10?С. Он очень термически устойчив (распадается на S и O2 при 2800?С). Диоксид серы растворим в воде причем растворимость его при переходе температуры от 0? до комнатной понижается. При растворении происходит образование гидрата SO2 · хН2О, нестехиометрического по составу, обладающего свойствами слабой кислоты:
SO2 · хН2О + Н2О = Н3О+ + НSO3
Ка= 1,54·10-2
Абсолютно Сера химически активна и особенно легко при нагревании соединяется почти со всеми элементами, за исключением N2, I2, Au, Pt и инертных газов. Она горит на воздухе голубоватым пламенем:
S8 + 8O2 > 8SO2
С концентрированными растворами серной и азотной кислот сера реагирует только при нагревании:
2H2SO4 + S = 3SO2 + 2H2O
6HNO3 + S = H2SO4 + 2H2O + 6NO2
В большинстве реакций он проявляет восстановительные свойства:
2HNO3 + SO2 = H2SO4 + 2NO2
NO2 + SO2 = SO3 + NO; Н2О2 + SO2 = H2SO4
Окислительные свойства диоксида серы проявляются при взаимодействии его с сероводородом и оксидом углерода (II):
2Н2S + SO2 = 3S + 2Н2О;
2СО + SO2 = S+ 2CO2
Селен
Химический элемент 16-й группы, 4-го периода в периодической системе, имеет атомный номер 34, обозначается символом Se , хрупкий блестящий на изломе неметалл чёрного цвета . Относится к халькогенам.
Оксиды. Кислоты. Соли.
К оксидам селена относятся: SeO2 - SeO3, Se2O3. Кислоты Селена: Селеновая кислота — неорганическая кислота, состоящая из катиона водорода и аниона селената. Химическая формула . Соли Селена: Na2SeO4 -селенат натрия (кислотобразующий неметалл), SeCl4- хлорид селена, TeCl4 - хлорид теллура, Na2Te2 - теллурид натрия.
Биологическая роль селена.
В организме человека содержится 10—14 мг селена, бо́льшая его часть сконцентрирована в печени, почках, селезенке, сердце, яичках и семенных канатиках у мужчин. Селен присутствует в ядре клетки.
Суточная потребность человека в селене составляет 70-100 мкг. Повышенное содержание селена в организме может приводить к депрессии, тошноте, рвоте, диареи, поражению ЦНС и др.
Согласно данным эпидемиологических исследований 1990-х годов[24], более чем у 80 % россиян наблюдается дефицит селена.
Селен в организме взаимодействует с витаминами, ферментами и биологическими мембранами, участвует в регуляции обмена веществ, в обмене жиров, белков и углеводов, а также в окислительно-восстановительных процессах. Селен является составным компонентом более 30 жизненно важных биологически активных соединений организма. Селен входит в активный центр ферментов системы антиоксидантно-антирадикальной защиты организма, метаболизма нуклеиновых кислот, липидов, гормонов Селен входит в состав белков мышечной ткани, белков миокарда. Также селен способствует образованию трийодтиронина (гормонов щитовидной железы).
Селен является синергистом витамина E и иода. При дефиците селена иод плохо усваивается организмом. Согласно исследованиям, селен необходим для нормального функционирования иммунной системы. Он задействован в механизмах противодействия вирусным инфекциям, включая ВИЧ. Было доказано, что у пациентов, уже заразившихся ВИЧ, он замедляет переход заболевания в СПИД.
Элементы группы VII A
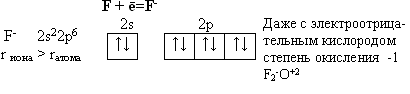
Особые свойства фтора, как наиболее электроотрицательного элемента
Из всех галогенов у фтора наименьший радиус. Относительная электроотрицательность равна 4, это самый электроотрицательный элемент, во всех соединениях имеет степень окисления – 1, остальные галогены от – 1 до + 7.
Водородные соединения галогенов
Бесцветные газы с резким запахом, дымящие во влажном воздухе. Они хорошо растворяются в воде, водные растворы их являются кислотами, носящими общее название - галогеноводородные кислоты. Соли галогеноводородных кислот ( фториды, хлориды, бромиды и йодиды) могут быть получены при непосредственном соединении металлов с галогенами. По составу они однотипны и имеют сходные свойства. Так NaF, NaCl, NaBr, NaJ - белые кристаллические вещества, хорошо растворимые в воде. Наряду со сходством у галогенов наблюдаются и определенные различия как в физических, так и в химических свойствах. Однако изменение этих свойств происходит закономерно с возрастанием атомного веса галогена.
Водородные соединения галогенов - галогеноводороды HF, НС1, НВг и HI представляют собой бесцветные газы, хорошо растворяющиеся в воде. Из них HF - слабая кислота, а остальные галогеноводороды - сильные кислоты в водном растворе.
Соляная кислота
Соляная кислота— HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная ,«дымящая» на воздухе, едкая жидкость. Максимальная концентрация при 20 °C равна 38% по массе, плотность такого раствора 1,19 г/см³. Молярная масса 36,46 г/моль. Соли соляной кислоты называются хлоридами. Хлорноватистая кислота — HClO, очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь в растворах.
Хлориды
Группа химических соединений, соли хлороводородной (соляной) кислоты HCl.
Ионные хлориды — твёрдые кристаллические вещества с высокими температурами плавления, проявляющие основные свойства; ковалентные — газы, жидкости или легкоплавкие твёрдые вещества, имеющие характерные кислотные свойства. Хлориды с промежуточной ионно-ковалентной природой связи проявляют, соответственно, амфотерные свойства.
Основные хлориды практически не подвержены гидролизу, а кислотные гидролизуются полностью и необратимо, образуя кислоты: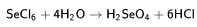
Хлориды разного типа также могут взаимодействовать между собой: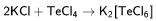
Хлорноватистая кислота.
Очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь в растворах.
В водных растворах хлорноватистая кислота частично распадается на катион {\displaystyle H^{+}}H+ и гипохлорит-анион {\displaystyle ClO^{-}}CLO- 
Неустойчива, постепенно разлагается даже в разбавленных водных растворах на хлороводород и атомарный кислород[1], благодаря которому является сильным окислителем: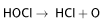
Реагирует с соляной кислотой HCl, образуя газообразный хлор: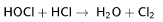
Гипохлориты
Соли и эфиры хлорноватистой кислоты HClO.
Гипохлориты в свободном безводном состоянии являются неустойчивыми соединениями, многие при нагреве разлагаются со взрывом. Гипохлориты щелочных и щелочноземельных металлов хорошо растворимы в воде и образуют кристаллогидраты, разлагающиеся при хранении.
Гипохлорит-анион образуется при окислении хлорид-аниона, катализируемого миелопероксидазой нейтрофильных гранулоцитов и в качестве одного из биоцидных факторов участвует в защите организма от бактериальных и грибковых инфекций. Так, в частности, кроме прямого цитотоксического действия, взаимодействие гипохлорита с перекисью водородаприводит к выделению кислорода в высокотоксичном синглетном состоянии: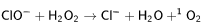
Хлорная известь
Техническая смесь гипохлорита, хлорида и гидроксида кальция. Альтернативное название: белильная известь. В просторечии: хлорка.
Получают взаимодействием хлора с гашёной известью 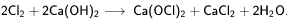 Реальный продукт, получаемый хлорированием гидроксида кальция, является смесью соединений, образованных молекулами Ca(OCl)2, CaCl2, Ca(OH)2 и кристаллизационной воды. Если исходный гидроксид был достаточно чистым, а обработка хлором велась до полного насыщения и с соблюдением температурного режима, то состав свежеприготовленной хлорной извести может быть довольно точно выражен формулой Ca(OCl)2·CaCl2·Ca(OH)2·2H2O, которую для большего удобства можно формализовать как 3Ca(OH)2·2Cl2. Реальный продукт, получаемый хлорированием гидроксида кальция, является смесью соединений, образованных молекулами Ca(OCl)2, CaCl2, Ca(OH)2 и кристаллизационной воды. Если исходный гидроксид был достаточно чистым, а обработка хлором велась до полного насыщения и с соблюдением температурного режима, то состав свежеприготовленной хлорной извести может быть довольно точно выражен формулой Ca(OCl)2·CaCl2·Ca(OH)2·2H2O, которую для большего удобства можно формализовать как 3Ca(OH)2·2Cl2.
Бром и йод, как микроэлементы
Бром усиливает процессы торможения в центральной нервной системе. В отличие от йода, активизирующего функцию щитовидной железы, бром угнетающе действует на неё. Бромом богаты фасоль, горох. Йод входит в состав гормонов щитовидной железы. Недостаточное поступление йода с пищей приводит к угнетению её функций: развивается эндемический зоб, замедляется рост, снижается сопротивляемость организма различным инфекциям. Йод в небольшом количестве содержится в продуктах растительного и животного происхождения: фасоли, пшенице, ячмене, ржи, капусте, кукурузе, картофеле, моркови, луке, огурцах, свекле, щавеле, а также в говядине, мясе птицы, куриных яйцах. Высоко содержание йода в морской рыбе: треске, скумбрии, окуне, сельди, ставриде, хеке.
|
 Скачать 428.82 Kb.
Скачать 428.82 Kb.



