|
|
Аналитическая Химия Реферат. Литература 37 s элементы Элементы группы I а водород
d-элементы Медь
Элемент одиннадцатой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета.
Биологическая ценность.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей.
Оксиды.
Существует три оксида меди:
1.Оксид меди (1) — химическое соединение с формулой . Соединение меди с кислородом, амфотерный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта.
2. Оксид меди(2) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита белого цвета.
3. Оксид меди(3) — неорганическое соединение, высший оксид металла меди с формулой Cu2O3, красные кристаллы, не растворяется в воде. Очень сильный окислитель.
Гидроксиды
Гидроксид меди(I) — неорганическое соединение, гидроокись металла меди с формулой CuOH,
жёлтое вещество, не растворяется в воде.
Гидроксид меди(II) — Cu(ОН)2, голубое аморфное или кристаллическое вещество сромбической кристаллической решеткой.). Cu(ОН)2 практически не растворим в воде. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водных суспензий разлагается до CuО и Н2О
Цинк
Элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn. Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета. Более 400 ферментов содержат цинк. Среди них ферменты, катализирующие гидролиз пептидов, белков и сложных эфиров, образование альдегидов, полимеризацию ДНК и РНК. Ионы Zn2+ в составе ферментов вызывают поляризацию молекул воды и органических веществ, содействуя их депротонированию по реакции:
Zn2+ + H2O = ZnOH+ + H+
Оксиды
Амфотерный оксид, кристаллический бесцветный порошок, желтеющий при постепенном нагревании и сублимирующийся при 1800 градусах. Нерастворим в воде. Степень окисления цинка в этом соединения - 2. Химическая формула ZnO. Данное вещество имеет важное значение для человечества. Оно обладает многогранным воздействием на организм человека.
при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (Na2[Zn(OH)4], Ba2[Zn(OH)6]):
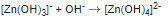
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
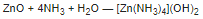
При сплавлении с щелочами и оксидами металлов оксид цинка образует цинкаты: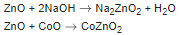
При сплавлении с оксидами бора и кремния оксид цинка образует стекловидные бораты и силикаты:
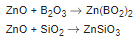
Гидроксиды
Гидроксид цинка — амфотерный гидроксид, имеющий формулу Zn(OH)2. Находит широкое применение в различных отраслях химии.
Взаимодействие растворимых солей цинка с щелочами:
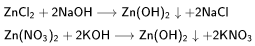
Кислоты
С серной кислотой с образованием различных веществ в зависимости от концентрации кислоты
Zn + 2Н2SО4 (конц.) = ZnSО4 + SО2+ 2Н2О
3Zn + 4Н2SО4(разб.) = 3ZnSО4 + S + 4Н2О
4Zn + 5Н2SО4(сильно разб.) = 4ZnSО4 + Н2S + 4Н2O — с азотной кислотой с образованием разных веществ в зависимости от концентрации кислоты:
Zn + 4НNО3 (конц.) = Zn(NO3)2 + 2NО2 + 2Н2O
4Zn + 10НNО3(разб.) = 4Zn(NО3)2 + N2О + 5Н2О
4Zn + 10НNО3(сильно разб.) = 4Zn(NО3)2 + NН4NО3 + ЗН2О
Биологическая роль
участие в синтезе анаболических гормонов, в том числе и инсулина
участие в синтезе белка
участвует в метаболизме витамина Е, антиоксидантной защите клеток. Это свойство цинка используется в лечении и предотвращении катаракты, дистрофии сетчатки и жёлтого пятна
поддержание нормального функционирования иммунной системы, участие в противоопухолевой защите организма
стимулирует выработку гормонов вилочковой железы
входит в состав алкогольдегидрогеназы, участвующей в метаболизме алкоголя
необходим для нормального функционирования простаты, продукции спермы и мужских половых гормонов
цинк необходим для превращения витамина А в организме в активную форму. Цинк участвует в синтезе белковой молекулы переносчика, которая транспортирует витамин А через стенку кишечника и освобождает его в крови
используется в комплексном лечении депрессии, известно положительное влияние цинка в лечении шизофрении, эпилепсии, рассеянного склероза, острого психоза, слабоумия, анорексии (патологического отвращения к еде), болезни Хангтингтона, дизлексии
добавление цинка в пищу препятствует развитию болезни Альцгеймера
при местном применении в составе мазей способствует быстрому заживлению кожных повреждений, оказывает противовоспалительное воздействие на кожу.
Молибден
Элемент шестой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 42. Обозначается символом Mo. Простое вещество молибден — переходный металл светло-серого цвета. Главное применение находит в металлургии.
Промышленное получение молибдена начинается с обогащения руд флотационным методом. Полученный концентрат обжигают до образования оксида МоО3: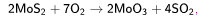
который подвергают дополнительной очистке. Далее МоО3 восстанавливают водородом:
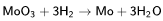
Биологическая роль
Физиологическое значение молибдена для организма животных и человека было впервые показана в 1953 г, с открытием влияния этого элемента на активность фермента ксантиноксидазы. Молибден промотирует работу антиокислителей, в том числе витамина С. Важный компонент системы тканевого дыхания. Усиливает синтез аминокислот, улучшает накопление азота. Молибден входит в состав ряда ферментов, выполняющих важные физиологические функции, в частности, регуляцию обмена мочевой кислоты. Молибденоэнзимы катализируют гидроксилирование различных субстратов. Альдегидоксидаза окисляет и нейтрализует различные пиримидины, пурины, птеридины. Ксантиноксидаза катализирует преобразование гипоксантинов в ксантины, а ксантины — в мочевую кислоту. Сульфитоксидаза катализирует преобразование сульфита в сульфат.
Недостаток молибдена в организме сопровождается уменьшением содержания в тканях ксантиноксидазы. При недостатке молибдена страдают анаболические процессы, наблюдается ослабление иммунной системы. Тиомолибдат аммония (растворимая соль молибдена), является антагонистом меди и нарушает её утилизацию в организме.
Оксид
Оксид молибдена(III) — неорганическое соединение, оксид металла молибдена с формулой Mo2O3, чёрные кристаллы, не растворимые в воде
Оксид молибдена(IV) — неорганическое соединение, оксид металла молибдена с формулой MoO2, коричнево-фиолетовые кристаллы, не растворимые в воде
Оксид молибдена(V) — неорганическое соединение, окисел металла молибдена с формулой Mo2O5, тёмно-фиолетовые кристаллы, не растворимые в воде
Оксид молибдена(VI) — бинарное неорганическое химическое соединение кислорода с молибденом. Химическая формула {\displaystyle {\mathsf {MoO_{3}}}}MoO3. Это соединение производится в крупных масштабах из любого соединения молибдена. Это соединение используется в качестве сырья для производства металлического молибдена.
Соли
Соли молибдена ( VI) с роданидом аммония или калия, в зависимости от концентрации последнего, в присутствии восстановителя образуют несколько роданидных комплексных соединений. Наиболее интенсивно окрашенным из них является роданид молибдена ( V) Mo ( SCN) 5, поэтому при определении нужно обеспечить достаточную концентрацию роданида.
Так как соли молибдена пока еще стоят довольно дорого, они в первую очередь должны быть использованы при возделывании бобовых и наиболее отзывчивых овощных и других культур.
При взаимодействии солей молибдена с ионами родана образуется несколько окрашенных комплексов. Наиболее интенсивно окрашен комплекс пентароданида молибдена Mo ( SCN) 5, который образуется при взаимодействии роданида и восстановителя с шестивалентным молибденом. Пентароданид молибдена относится к малопрочным комплексам
Марганец
Элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементовД. И. Менделеева с атомным номером 25. Обозначается символом Mn . Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
Получение :Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: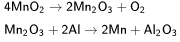
Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (
80 % Mn).
Чистый металлический марганец получают электролизом.
Оксиды
Окси́ды ма́рганца — химические соединения марганца и кислорода с общей формулой MnxOy (кроме пероксидов марганца).
Гидроксиды
Гидроксид марганца (IV) проявляет амфотерный характер– кислотный и основной в равн Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO3)2:
Mn(NO3)2 = MnO2 + 2NO2
Соли
1)Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
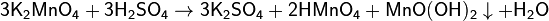
2) При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
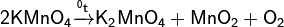
3) Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
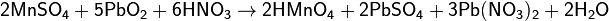
4) Перманганат калия применяется как антисептическое средство. Водные растворы его различной концентрации от 0,01 до 0,5% применяются для дезинфекции ран, полоскания горла и других антивоспалительных процедурах. Успешно 2 – 5% растворы перманганата калия употребляются при ожогах кожи (кожа подсушивается, и пузырь не образуется). Для живых организмов перманганаты являются ядами (вызывают коагуляцию белков). Их обезвреживание производят 3 %-ным раствором Н2О2, подкисленным уксусной кислотой:
2KMnO4+5Н2О2+6СН3СООН→2Mn(СН3СОО)2+2СН3СООК +8Н2О+ 5O2
5)Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
· 2KMnO4 + 3H2SO4 + 5C2H5OH → 2MnSO4 + K2SO4 + 5CH3COH + 8H2O
· 4KMnO4 + 2NaOH + C2H5OH → MnO2↓ + 3CH3COH + 2K2MnO4 +Na2MnO4 + 4H2O
6) MnSO4 + 2NaOH → Mn(OH)2↓ + Na2SO4
7) Все соли марганца (II) в ОВР, протекающих в растворах, являются восстановителями:
3Mn(NO3)2 + 2KMnO4 + 2H2O → 5MnO2 + 4HNO3 + 2KNO3
8) Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
Mn2+ + 6H2O → [Mn(H2O)6]2+
MnCl2 + 6H2O → [Mn(H2O)6]Cl2
9) Mn(CN)2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN)2 = K4[Mn(CN)6] гексоцианоманганат калия
Биологическая роль
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также лёгкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект
Железо
Элемент восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Один из самых распространённых в земной коре металлов: второе место после алюминия.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 %. Считается также, что железо составляет бо́льшую часть земного ядра.
Окислительно-восстановительные свойства.
Соединения железа (II) проявляют достаточно сильные восстановительные свойства, устойчивы только в инертной атмосфере; на воздухе (медленно) или в водном растворе при действии окислителей (быстро) переходят в соединения железа (III):
4 Fe(OH)2 (в осадок)+ O2+ 2H2O→ 4 Fe(OH)3↓
2FeCl2 + Cl2 → 2FeCl3
10FeSO4 + 2KMnO4 + 8H2SO4 → 5 Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8 H2O
Соединения железа (II) могут выступать и в роли окислителей:
FeO+ CO→ (температура) Fe+ CO
Гемоглобин
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра.
Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).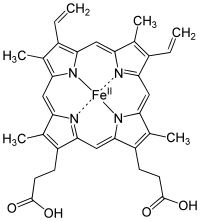
Кобальт
Химический элемент с атомным номером 27[3]. Принадлежит к 9-й группе периодической таблицы химических элементов , находится в четвёртом периоде таблицы. Обозначается символом Co . Простое вещество кобальт — серебристо-белый, слегка желтоватый металл с розоватым или синеватым отливом. Существует в двух кристаллических модификациях: α-Co с гексагональной плотноупакованной решёткой, β-Co с кубической гранецентрированной решёткой, температура перехода α↔β 427 °C.
Оксиды
На воздухе кобальт окисляется при температуре выше 300 °C.
Устойчивый при комнатной температуре оксид кобальта представляет собой сложный оксид Co3O4, имеющий структуру шпинели, в кристаллической структуре которого одна часть узлов занята ионами Co2+, а другая — ионами Co3+; разлагается с образованием CoO при температуре выше 900 °C.
При высоких температурах можно получить α-форму или β-форму оксида CoO.
Все оксиды кобальта восстанавливаются водородом: Co3O4+4H2---- 3Co+4H2O
Оксид кобальта(III) можно получить, прокаливая соединения кобальта (II), например:
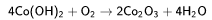
Гидроксиды
Гидроксид кобальта(II) — неорганическое соединение, гидроксид металла кобальта с формулой Co(OH)2, в зависимости от способа получения имеет окраску розовую, синюю, фиолетовую, не растворяется в воде, образует гидраты.
Соли
Сульфид кобальта СоS – черного цвета, выделяется пропусканием сероводорода в нейтральные воды раствора солей кобальта, содержащие ацетат натрия или добавлением раствора сульфида аммония и слабощелочным водным раствором солей кобальта.
Образования, которые можно получить при действии сульфида аммония (или сероводорода) на водные растворы солей кобальта, при прямом соединении элементов при высоких температурах можно также получить сульфид кобальта Со5S4 и др. в природе встречается минерал линнеит Со3S4, который можно получить искусственно.
Сульфат кобальта СоSO4 и СоSO4 ∙ 7 H2O. Безводный сульфат кобальта используется как весовая форма при определении кобальта.
Тиосульфат кобальта СоS2О3 мало диссоциирует.
Биологическая роль
Кобальт — один из микроэлементов, жизненно важных организму. Он входит в состав витамина В12 (кобаламин). Кобальт задействован при кроветворении, функциях нервной системы и печени, ферментативных реакциях. Потребность человека в кобальте — 0,007-0,015 мг, ежедневно. В теле человека содержится 0,2 мг кобальта на каждый килограмм массы человека. При отсутствии кобальта развивается акобальтоз.
Литература
«Общая химия» Глинка
«Неорганическая химия» И.Н.Заозерский 1985
«Неорганическая химия»Ю.В. Ходаков 1972
http://www.newreferat.com/ref-36303-2.html
http://fb.ru/article/318448/kobalt-eto-himicheskiy-element-kobalt-v-organizme-cheloveka
http://fb.ru/article/267061/nitratyi-i-nitrityi-razlojenie-nitratov-nitratyi-v-produktah-i-vode-nitratyi---eto
|
|
|
 Скачать 428.82 Kb.
Скачать 428.82 Kb.