Метод проточной цитофлуориметрии
 Скачать 312.91 Kb. Скачать 312.91 Kb.
|
|
Реферат На тему: «Метод проточной цитофлуориметрии» ОглавлениеВведение 2 1.Устройство и принцип работы проточного цитофлуориметра 3 2.Применение метода проточной цитофлуориметрии в современной клеточной диагностике 7 3.Основные правила и контрольные измерения метода проточной цитофлуориметрии 11 Список литературы 13 ВведениеПроточная цитофлуориметрия или Flow cytometry – функциональный метод диагностики, позволяющий разносторонне анализировать различные популяции клеток, в том числе каждую клетку в отдельности. Проточная цитофлуориметрия – метод регистрации оптических параметров находящихся в потоке клеток или частиц по сигналам светорассеяния и флуоресценции в режиме поштучного анализа [1, 2]. Метод разработан в середине 20 века, на сегодняшний день его используют как ученые, так и врачи-клиницисты, поскольку он является наименее трудоемким, дающим быстрый и информативный результат [1, 6]. Актуальность работы. В сравнении с молекулярными методами диагностики, проточная цитометрия обладает явными преимуществами, а именно возможностью быстрой оценки большого количества параметров при относительной экономичности исследования. Многообразие реагентов и технологических решений (от самых простых клеточных анализаторов до проточных цитометров и цитометров с визуализацией) позволили значительно расширить как прикладные, так и диагностические возможности проточной цитометрии, делая ее одним из мощнейших методов клеточного анализа [1, 7]. Таким образом, цель работы: рассмотреть и проанализировать метод проточной цитофлуориметрии путем изучения современной научной литературы за последние пять лет, в том числе интернет-изданий, по исследуемой теме. Задачи: Ознакомится с устройством и принципом работы проточного цитофлуориметра; Рассмотреть практическое применение метода проточной цитофлуориметрии в современной клеточной диагностике; Рассмотреть основные правила и контрольные измерения необходимые для предотвращения ложных результатов исследования. Устройство и принцип работы проточного цитофлуориметра Проточная цитофлуориметрия – информативный метод одновременных количественных измерений, основанный на анализе параметров светорассеяния и интенсивности флуоресценции каждой индивидуальной клетки в суспензии. Метод включает: подготовку образцов, их обработку и окрашивание, настройку и использование прибора, сбор, анализ и хранение данных, а также соответствующие меры контроля качества. Суспензия предварительно окрашенных флуоресцирующими красителями (моноклональные антитела, конъюгированные с флуоресцентными метками) клеток, при выполнении исследования, через наконечник специальной конструкции под давлением впрыскивается в центр быстро движущегося в том же направлении потока жидкости [1, 7, 9, 10]. Подхваченные потоком жидкости клетки, согласно принципу гидродинамического фокусирования, когда возникают условия ламинарного потока без перемешивания суспензии клеток с обтекающей их жидкостью, выстраиваются друг за другом. Измерения происходят при пересечении клеткой сфокусированного лазерного луча и световые сигналы, получаемые при взаимодействии луча лазера с клетками, регистрируются системой детектирования и преобразуются в элементы данных, которые можно анализировать и объединять с данными, полученными для других клеток в составе того же образца [9, 10]. Проточная цитометрия позволяет проводить анализ морфологических/фенотипических, функциональных свойств клеток и клеточно-подобных структур (изолированных ядер, хромосом и т.п.), а также получать данные о количественном содержании и функциональной активности ДНК и РНК, экспрессии секретируемых и внутриклеточных белков, об изменении уровня рН и др. [3, 4]. Современные проточные цитофлуориметры представляют собой довольно сложные устройства, требующие от оператора хорошего знания как биологии, так и ряда физических дисциплин, в первую очередь оптики и гидродинамики. Высокая производительность приборов позволяет собирать и анализировать большие массивы данных, объединяющие информацию о десятках и сотнях тысяч клеток, при этом для каждой клетки, в зависимости от конструкции прибора, может измеряться от 5 до 14 и более параметров. Анализ собранных данных позволяет выделить популяции клеток, обладающие теми или иными свойствами, определить их относительное и абсолютное содержание в образце [1, 4, 5,]. Таким образом, проточный цитофлуориметр – это прибор, измеряющий оптические свойства индивидуальных клеток в суспензии. Проточный цитометр состоит из трех основных блоков: жидкостного, оптического и блока обработки электронного сигнала (рис. 1). Измерение оптических свойств клетки осуществляется в проточной ячейке – ключевом элементе цитофлуориметра [1, 5, 9]. 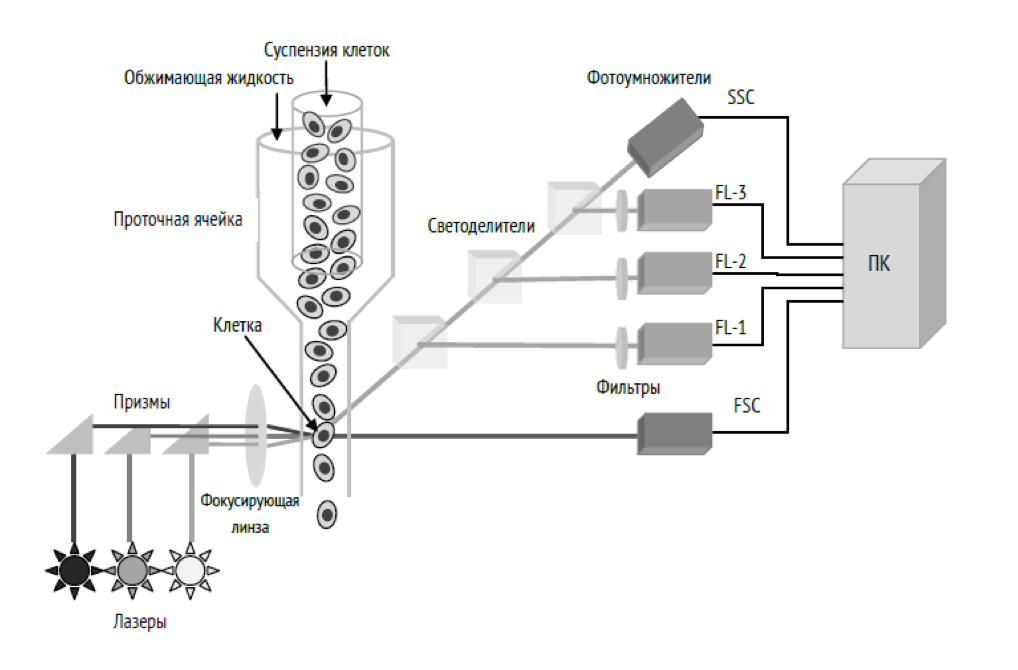 Рисунок 1. Компоненты обобщенного проточного цитометра, включающего пять параметров – 2 детектора светорассеяния (SSC и FSC) и 3 детектора сигналов флуоресценции (FL-1,2,3) Далее, рассмотрим устройство и основные параметры проточного цитометра «MACSQuant» производства Miltenyi Biotec [8]. Анализатор MACSQuant представляет собой компактный настольный проточный цитометр, который можно легко установить в небольшой лаборатории с ограниченным пространством, например в комнате с ламинарным шкафом [8, 10]. Отличительные черты прибора MACSQuant: 10 оптических каналов; мощное программное обеспечение; возможность анализа редких клеточных субпопуляций (технология магнитной сепарации); анализ большого количества образцов (возможность использования 96-луночного планшета); абсолютный подсчет количества клеток [8]. Оптические параметры прибора представлены таблице 1. Таблица 1 Оптические параметры проточного цитометра MACSQuant
Прибор MACSQuant оснащен такими функциями как автоматический забор образца из пробы и анализ клеточных субпопуляций; возможность разработки индивидуального протокола исследования; персонифицированные учетные записи пользователей, настройки и шаблоны [8, 9]. Результаты исследования представлены в удобном для пользователя формате: в виде выбранного пользователем шаблона; вновь созданных окон с графиками; в виде выбранного цитометром шаблона, применяемого автоматически при использовании реагентов MACS Reagents. Проточный цитометр регистрирует два канала светорассеяния и 8 флуоресцентных каналов, проводить чувствительный фенотипический анализ популяции клеток, используя три лазера. В комбинации с интегрированным модулем обогащения клеток (MACS Cell Enrichment Unit), анализатор позволяет проводит достоверный анализ редких клеточных субпопуляций. Например, пробу можно предварительно обогатить антигенспецифичными Т-клетками, циркулирующими опухолевыми клетками, эндотелиальными клетками или стволовыми клетками-предшественниками перед проведением детальной фенотипической характеристикой образца [8, 9]. Протоколы для анализа проб управляются при помощи программного обеспечения анализатора MACSQuant. Трудоемкие и затратные по времени процедуры уже предусмотрены в списке задач, которые может выполнять сам инструмент. Устройство обеспечивает плавный переход от пипетирования проб, до генерации результатов в готовом виде для представления. При использовании фирменных микрочастиц для калибровки (MACSQuant Calibration Beads), каналы флуоресценции и светорассеяния могут быть откалиброваны в автоматическом режиме. Визуальная индикация уровней рабочих жидкостей и состояния инструмента позволяет наблюдать за его состоянием даже с другого конца лаборатории. Результаты, настройки инструмента и программного обеспечения можно автоматически архивировать на другой компьютер сети или записать на DVD-диск. Данные можно сделать доступными или закрытыми для других пользователей, в зависимости от настроек профиля пользователя. Программное обеспечение совместимо с форматом FSC. Данные из архива можно просмотреть из реестра библиотеки [8]. Применение метода проточной цитофлуориметрии в современной клеточной диагностике Спектр областей применения проточной цитофлуориметрии охватывает клеточную и молекулярную биологию, микробиологию, ботанику, иммунологию, эмбриологию, генетику и т.д. [4]. В практической медицине проточная цитофлуориметрия используется в гематологии, бактериологии, вирусологии, онкологии, медицинской иммунологии, причем данный список постоянно расширяется [9]. Применение проточной цитофлуориметрии [7]: Подсчет клеток и оценка их жизнеспособности. Используют классические красители на жизнеспособность (например, наборы LIVE/DEAD kit от Thermo Fisher Scientific или Muse® Count and Viability Kit), которые позволяют отличить мертвые клетки или клетки с нарушенной целостностью клеточной мембраны от живых клеток. Анализ клеточного цикла. Различные стадии клеточного цикла отличаются по содержанию ДНК в клетке. Наборы для анализа клеточного цикла содержат ДНК-связывающие красители, интенсивность флуоресценции которых пропорциональна количеству ДНК. С помощью гистограммы интенсивности флуоресценции можно выделить клетки в G0/G1, S и G2/M фазах клеточного цикла. Анализ апоптоза. Основан на связывании Аннексина V с фосфотидилсерином на поверхности апоптотирующих клеток. На ранних стадиях апоптоза молекулы фосфотидилсерина перемещаются на внешнюю сторону клеточной мембраны и способны связываться с Аннексином V. На поздних стадиях апоптоза клетки теряют целостность клеточной мембраны и поглощают краситель, который иначе не смог бы проникнуть через клеточную мембрану. Для анализа различных стадий апоптоза проводят определение активированных каспаз в сочетании с красителем, окрашивающим мертвые клетки (рис. 2). 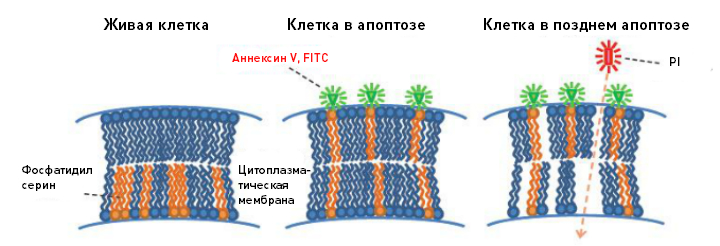 Рисунок 2. Анализ различных стадий апоптоза Иммунофенотипирование клеток крови. Происходит идентификация внутриклеточных белков, оценка степени цитотоксичности и др.. Производится измерение антигенов кластера дифференцировки на поверхности тысяч отдельных клеток, характеристика размеров субпопуляции (например, подтипов лейкоцитов) путем мечения клеток конъюгированными с флуорохромом моноклональными антителами. Клиническая лабораторная диагностика (табл. 2). Проточные цитометры, зарегистрированные Росздравнадзором, в лабораторной диагностике активно применяются: для оценки иммунного статуса пациента (используют такие поверхностные маркеры, как CD3, CD4, CD8, CD 19, CD 20, CD22 и т.д.); оценки иммунологического фенотипа нормальных и опухолевых клеток для своевременной постановки диагноза; для отслеживания острых лейкозов в ходе лечения; для диагностики гемобластозов. Таблица 2 Проточная цитометрия в клинической лабораторной диагностике
Основные правила и контрольные измерения метода проточной цитофлуориметрии Прежде чем приступать к измерениям, необходимо проверить и отладить работу проточного цитофлуориметра. Пренебрежение основными правилами и необходимыми контрольными измерениями может привести к получению ложных результатов исследования [9]. Существуют явления, которые могут повлиять на правдивость полученных данных и привести исследователей к ложноположительным или ложноотрицательным результатам, а именно аутофлуоресценция и неспецифическое связывание антител [7,9]. Некоторые клетки обладают собственной флуоресценцией (аутофлуоресценцией). Перед проведением любых экспериментов обязательно необходимо проверить как выглядит проба, обработанная полностью в соответствии с планируемым протоколом, но в которую не были добавлены красители. Если видна аутофлуоресценция, необходимо принимать за ноль именно ее [1, 7, 9]. Антитела могут не только распознавать целевой белок, но и неспецифически связываться с чем-то еще. Уберечься от ошибок можно с помощью изотипических контролей – антител, содержащих такую же Fc-часть, что и целевое антитело, окрашенных той же меткой, но при этом не специфичных к целевому белку [9]. Для настройки чувствительности прибора к флуоресценции необходимо использовать соответствующие изотипические контроли или образцы, окрашенные по отдельности каждым антителом, калибровочные микросферы, а также не забывать проверять аутофлуоресценцию образцов перед началом работы [1, 9, 10]. Для определения области измерений, а также для проверки корректной работы прибора необходимо использовать отрицательные и положительные контроли. Например, для оценки количества апоптотических клеток в пробе потребуется отрицательный контроль, в котором абсолютное большинство клеток живые. Также пригодится положительный контроль, где большая часть клеток находится в апоптозе под действием любого известного апоптогенного агента. Таким образом можно определить область измерения, чтобы детектировать значимые изменения [1, 7]. Данную часть работы можно сделать и после измерения всех проб, поскольку программное обеспечение всех цитометров позволяет анализировать данные после эксперимента. Главное – сделать пробы с правильными положительными и отрицательными контролями, чтобы было с чем сравнивать [1, 7]. С методом проточной цитометрии наиболее часто связывают следующие трудности: повышенная флуоресценция или бокового светорассеяния, аномальное количество регистрируемых событий, высокая интенсивность флюоресценции и слабая интенсивность флуоресценции. Высокая интенсивность флуоресценции может быть обусловлена чрезмерным мечением антител, ненадлежащей или недостаточной промывкой клеток или ненадлежащим блокированием. Слабую интенсивность флуоресценции может обуславливать множество факторов: параметры приборов, например, плохое лазерное выравнивание, неверная поправка, неправильная настройка, неподходящий коэффициент усиления и низкая выходная мощность лазера могут отрицательным образом сказываться на интенсивности флуоресценции. Помимо этого, вопросы, связанные с клеточной физиологией или подготовкой реагентов, например, недостаточная концентрация антител, лабильный или секретируемый антиген-мишень, реагенты низкого качества или неправильное их хранение (что обуславливает выцветание флуорохромов) также могут приводить к снижению сигнала [1]. Список литературыБалалаева И.В. Проточная цитофлуориметрия. / Учебно-методическое пособие // Нижний Новгород: Нижегородский госуниверситет, 2014. – 75 с. Гальцева И.В., Давыдова Ю.О. и др. Роль и место проточной цитометрии в диагностике и мониторинге минимальной остаточной болезни при множественной миеломе. // Онкогематология № 2. – 2017. – С. 80-94. Демина И.А., Семченкова А.А. и др. Измерение абсолютной длины теломер методом проточной цитометрии. // Вопросы гематологии/онкологии и иммунопатологии в педиатрии Т. 17, № 4. – 2018. – С. 66-72. Зурочка А.В., Хайдуков С.В. и др. Проточная цитометрия в медицине и биологии. // Екатеринбург: РИО УрО РАН. – 2014. – 552 с. Трусов Г.А., Чапленко А.А. и др. Применение проточной цитометрии для оценки качества биомедицинских клеточных продуктов. // БИОпрепараты. Профилактика, диагностика, лечение Т.18, № 1. – 2018. – С. 16-24. Якунина Е.Ю., Мошева А.В. и др. Проточная цитофлуориметрия как современный метод анализа клеточного осадка мочи. // Сибирское медицинское обозрение № 5. – 2016. – С. 111-112. Проточная цитометрия: принципы метода и практическое применение [Электронный ресурс]. Режим доступа: https://helicon.ru/support/methodological/protochnaya-tsitometriya-printsipy-metoda-i-prakticheskoe-primenenie/ (дата обращения 03.04.2019) Проточный цитометр MACSQuant [Электронный ресурс]. Режим доступа: http://www.ld.ru/suppliers/miltenyi-biotec.html (дата обращения 03.04.2019) Проточная цитофлуориметрия [Электронный ресурс]. Режим доступа: https://biomolecula.ru/articles/12-metodov-v-kartinkakh-protochnaia-tsitofluorimetriia (дата обращения 03.04.2019) Introduction to Flow Cytometry [Электронный ресурс]. – Электрон. текстовые дан. – Becton, Dickinson and Company, 2014. Режим доступа: http://www.bdbiosciences.com/eu/services/training/itf_launch.jsp, свободный. |
