методические рекомендации студенту фх №9. Методические рекомендации для самостоятельной работы студентов к занятию 9 по фармацевтической химии
 Скачать 96.78 Kb. Скачать 96.78 Kb.
|
|
Министерство здравоохранения Российской Федерации ГБОУ ВПО Тверская ГМА Минздрава России Кафедра управления и экономики фармации с курсами ботаники, фармакогнозии, фармацевтической технологии, фармацевтической и токсикологической химии Методические рекомендации для самостоятельной работы студентов к занятию №9 по фармацевтической химии Название темы занятия: Введение в фармацевтический анализ органических лекарственных веществ. Элементный и функциональный анализ. Фармакопейный анализ лекарственных веществ, содержащих ковалентно связанный галоген. Тверь, 2013 Тема занятия: Введение в фармацевтический анализ органических лекарственных веществ. Элементный и функциональный анализ. Фармакопейный анализ лекарственных веществ, содержащих ковалентно связанный галоген. Цель занятия: Освоить методы фармацевтического анализа органических лекарственных веществ, изучить элементный анализ. Ознакомиться с методикой проведения фармакопейного анализа лекарственных веществ, содержащих ковалентно связанный галоген. В процессе изучения материала при подготовке к занятию необходимо освоить следующие основные термины: функциональный анализ, элементный анализ, минерализация. План изучения темы 1. Проверка выполнения домашнего задания (письменный контроль) 2. Фронтальный опрос 3. Ознакомление с методикой проведения фармакопейного анализа препаратов: «Йодоформ» и «Билигност». 4. Контроль освоения практических навыков студентами путем проверки протокола и собеседования с преподавателем по методологии проведенных исследований. 5. Выходной контроль в виде тестовых заданий Теоретические вопросы для подготовки к занятию:
Изложение учебного материала: Классификация органических лекарственных веществ
Особенности анализа органических соединений:
В основе фармацевтического анализа органических лекарственных веществ лежат принципы функционального и элементного анализа. Функциональный анализ – анализ по функциональным группам, т.е. атомам, группам атомов или реакционным центрам, которые определяют физические, химические или фармакологические свойства препаратов. Элементный анализ используют для испытания подлинности органических лекарственных веществ, содержащих в молекуле атомы серы, азота, фосфора, галогенов, мышьяка, металлов. Атомы этих элементов находятся в элементоорганических лекарственных соединениях в неионизированном состоянии, необходимым условием испытания их подлинности является предварительная минерализация. Галогенсодержащие органические соединения Галогенсодержащие соединения – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на атомы галогенов – F, Br, Cl или I. Это могут быть жидкие, твердые и газообразные вещества. Газообразные и жидкие соединения в основном обладают наркотическим действием. Эффект снижается от F – Cl – Br – I. Йодопроизводные в основном обладают антисептическим действием. Связь C–F; C–I; C–Br; C–Cl является ковалентной, поэтому для фармацевтического анализа ионные реакции используют после минерализации вещества. Свойства галогенсодержащих соединений
Определение подлинности Подлинность препаратов жидких галогенпроизводных углеводородов устанавливают по физическим константам (температура кипения, плотность, растворимость) и по наличию галогена. Наиболее объективным является способ установления подлинности по идентичности ИК-спектров препарата и стандартных образцов. Для доказательства наличия галогенов в молекуле используют пробу Бейльштейна и различные методы минерализации. Проба Бейльштейна Наличие галогена доказывается путем прокаливания вещества в твердом состоянии на медной проволоке. В присутствии галогенов, образуются галогениды меди, окрашивающие пламя в зеленый или сине-зеленый цвет. Минерализация Галогены в органической молекуле связаны ковалентной связью, степень прочности которой зависит от химического строения галогенпроизводного, поэтому для отщепления галогена перевода его в ионизированное состояние необходимы различные условия. Образовавшиеся галогенид-ионы обнаруживают обычными аналитическими реакциями. Хлорэтил
CH3CH2Cl+KOH c KCl +C2H5OH спирт Образовавшийся хлорид-ион обнаруживают раствором серебра нитрата по образованию белого творожистого осадка. Сl– + AgNO3 → AgCl + NO3– Фторотан
F3C-CHClBr + 5Na + 4H2O→ 3NaF + NaCl + 2NaBr + 2CO2 Образовавшиеся хлорид- и бромид -ионы обнаруживают раствором серебра нитрата по образованию белого творожистого и желтоватого осадков. Фторид-ион доказывают реакциями:
Бромизовал
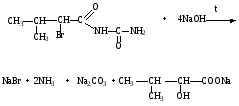 Бромид-ион определяют реакцией с хлорамином Б.
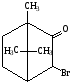
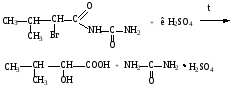 Бромкамфора
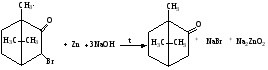 Бромид-ион определяют реакцией с хлорамином Б. Билигност
Йодоформ
1) пиролиз в сухой пробирке, выделяются фиолетовые пары йода 4CHI3 + 5O2 → 6I2 + 4CO2 + 2H2O 2) нагревание с конц. серной кислотой 2CHI3 + H2SO4 → 3I2 + 2CO2 + 2H2O + SO3 Доброкачественность (чистота галогенсодержащих углеводородов). Проверку доброкачественности хлорэтила и фторотана проводят, устанавливая кислотность или щелочность, отсутствие или допустимое содержание стабилизаторов (тимола во фторотане – 0,01%), посторонних органических примесей, примесей свободного хлора (брома во фторотане), хлоридов, бромидов, нелетучего остатка.
2. Недопустимую примесь спирта этилового (реакция образования йодоформа)
2. ИК-спектроскопия
2. t кипения; плотность; показатель преломления 3. не должно быть примесей Cl– и Br– Количественное определение Хлорэтил Количественное определение хлорэтила ГФ не предусматривает, но оно может быть выполнено методом аргентометрии или меркуриметрии. Фторотан Проверка каждые 6 месяцев на подлинность и чистоту. Бромизовал Метод количественного определения - обратное аргентометрическое титрование по Фольгарду после минерализации (реакцию см. в определении подлинности). 1. Реакция перед титрованием: NaBr + AgNO3 → AgBr↓+ NaNO3 избыток 2. Реакция титрования: AgNO3 + NH4SCN → AgSCN ↓ + NH4NO3 3. В точке эквивалентности: 3NH4SCN + Fe(NH4)(SO4)2 → Fe (SCN)3↓ + 2 (NH4)2SO4 fэкв=1, 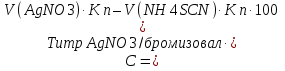 Бромкамфора Метод количественного определения - аргентометрическое титрование по Кольтгоффа после минерализации (реакции см. в определении подлинности). 1. Реакция перед титрованием: 3NH4SCN + Fe(NH4)(SO4)2 → Fe (SCN)3 + 2 (NH4)2SO4 точное количество буровато-красный 2. Реакция титрования: NaBr + AgNO3 → AgBr↓+ NaNO3 3. В точке эквивалентности: AgNO3 + NH4SCN → AgSCN↓ + NH4NO3 обесцвечивание fэкв=1, 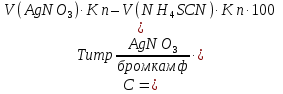 Билигност Метод количественного определения - косвенная йодометрия после окислительного расщепления билигноста до йодата при нагревании с раствором перманганата калия в кислой среде, избыток перманганата калия удаляют с помощью нитрата натрия, а для удаления избытка азотистой кислоты к смеси прибавляют раствор мочевины. Титрант – 0,1 моль/л раствор натрия титсульфата, индикатор – крахмал, в точке эквивалентности наблюдают исчезновение синей окраски крахмала. Схема реакции: t; KMnO4+H2SO4 RI6 → 12 IO3– Реакция выделения заместителя: КIO3 + 5KI + 3H2SO4 →3I2 + 3K2SO4 + 3H2O Реакция титрования: крахмал I2+2Na2S2O3 → 2NaI+Na2S4O6 fэкв=1/36 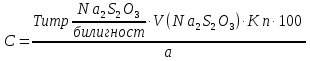 Йодоформ Метод количественного определения - обратное аргентометрическое титрование по Фольгарду после минерализации. Минерализация: CHI3 + 3AgNO3 + H2O→ 3AgI + 3HNO3 + CO2 избыток Реакция титрования: AgNO3 + NH4SCN → AgSCN ↓ + NH4NO3 В точке эквивалентности: 3NH4SCN + Fe(NH4)(SO4)2 → Fe (SCN)3↓ + 2 (NH4)2SO4 fэкв=1/3, 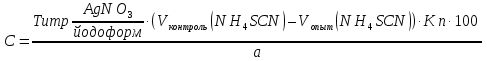 Хранение Хлорэтил в ампулах в прохладном, защищенном от света месте, фторотан и билигност в склянках оранжевого стекла в сухом прохладном, защищенном от света месте. Бромкамфору хранят в склянках оранжевого стекла в сухом прохладном месте. Применение Хлорэтил используют для местной анестезии, фторотан для наркоза. Бромкамфору применяют в качестве седативного средства (иногда для остановки лактации). Бромизовал является снотворным средством, билигност применяют в качестве рентгеноконтрастного вещества в виде смеси солей в растворе. Тестовые задания по теме занятия: 1. Эффект наркотического действия снижается от: а) Br - Cl - F – I б) F - Cl - Br – I в) I - Br - Cl - F 2. Укажите, какие из препаратов галогенпроизводных углеводородов являются твердыми веществами: a) Йодоформ б) Хлорэтил в) Хлороформ 3. От чего зависит наркотическая активность препаратов галогенпроизводных углеводородов? а) От вида галогена б) От числа введенных галогенов в) все верно 4. Укажите растворимость в воде йодоформа: а) трудно растворим б) мало растворим в) практически нерастворим 5.Укажите растворимость в воде билигноста: а) легко растворим б) практически нерастворим в) очень легко растворим 6. Укажите растворимость в эфире билигноста: а) легко растворим б) практически нерастворим в) очень легко растворим 7. Укажите растворимость в эфире йодоформа: а) практически нерастворим б) мало растворим в) растворим 8. Препараты твердых галогенпроизводных углеводородов билингност и йодоформ можно различить: а) по запаху б) по окраске кристаллов в) по растворимости г) все правильно 9. В окислительном расщеплении билигноста для удаления азотистой кислоты используют: а) ализариновый цирконий б) мочевина в) судан III 10. В какой среде проводят окислительное расщепление билигноста: а) щелочная б) нейтральная в) кислая 11. При испытании подлинности билигноста используют: а) кHCl б) кH2SO4 в) кHNO3 12. Укажите, какая примесь является недопустимой в препарате билигност? а) Фосфор б) Йодмонохлорид в) Мышьяк 13. Ненасыщенные соединения по сравнению с насыщенными а) менее активны б) более активны 14. Фармакологическую активность алифатических и ароматических соединений усиливает введение а) альдегидной группы б) аминогруппы в) галогена 15. Введение, какой группы в ароматический цикл повышает их токсичность а) спиртового гидроксила б) фенольного гидроксила в) галогена 16. Введение какой группы в ароматический цикл повышает фармакологический эффект соединений а) гидроксильного радикала б) кетогруппы в) галогена 17. Особенности анализа органических соединений а) протекают быстро б) протекают медленно с образованием промежуточных продуктов в) протекают медленно без образования промежуточных продуктов 18. Синтез хлорэтила осуществляется: а) взаимодействием этанола с кHCl б) путем хлорирования этилена в) электрохимическим методом 19. Синтез фторотана осуществляется: а) путем хлорирования этанола б) путем бромирования 1,1,1-трихлорэтана в) электрохимическим методом 20. Синтез йодоформа осуществляется: а) путем йодирования метанола б) путем йодирования хлороформа в) электрохимическим методом 21. Укажите фармакопейный метод количественного определения хлорэтила а) комплексонометрический б) обратная аргентометрия по Фольгарду в) меркурометрия г) не проводят 22. Какими методами проводят количественное определение йодоформа а) комплексонометрическим б) обратным аргентометрическим по Фольгарду в) меркурометрическим г) не проводят 23. Укажите температуру кипения хлорэтила: а) 12-13 ºС б) 49-51 ºС в) 59,5-62 ºС 24. Укажите температуру кипения фторотана: а) 12-13 ºС б) 49-51 ºС в) 59,5-62 ºС 25. Укажите температуру плавления йодоформа: а) 112-130 ºС б) 116-120 ºС в) 115-120 ºС 26. Какой связью связаны галогены в препарате галогенопроизводных углеводородов: а) Ковалентной б) Ионной в) Координационной 27. Укажите соединение, которое является исходным продуктом для синтеза хлороформа: а) Ацетон б) Спирт этиловый в) Ацетальдегид г) Все правильно 28. Укажите, какому из препаратов галогенопроизводных углеводов соответствует следующее описание: «Прозрачная, бесцветная, подвижная летучая жидкость с характерным запахом и сладким жгучим вкусом»: а) Фторотан б) Хлорэтил в) Хлороформ. 29. Какой индикатор применяется в аргентометрическом методе Мора? а) эозинат натрия б) хромат калия в) бихромат калия 30. Медицинское применение фторотана: а) седативный препарат б) наркозное средство в) рентгеноконтрастное средство г) антисептик Литература для студента: 1. Государственная фармакопея СССР / Министерство здравоохранения СССР. – Х изд. – М.: Медицина, 1968. – С. 78, 134, 141, 143, 186, 373,537 2. Государственная фармакопея СССР Вып. 1. Общие методы анализа. Лекарственное растительное сырье / Министерство здравоохранения СССР. - 11-е изд., доп. - М. : Медицина, 1989. – С. 165-180, 194-199 3. Лекционный материал. 4. Фармацевтическая химия. В 2 ч.: учебное пособие / В. Г. Беликов – 4-е изд., перераб. и доп. – М.: МЕДпресс-информ, 2007. – С. 178-179, 329-332 5. Руководство к лабораторным занятиям по фармацевтической химии. Под редакцией А.П. Арзамасцева, стр.152-156. Приложение 1 Фармакопейные статьи Bilignostum Билигност Adipiodonum * Бис-(2,4,6-трийод-З-карбоксианилид) адипиновой кислоты 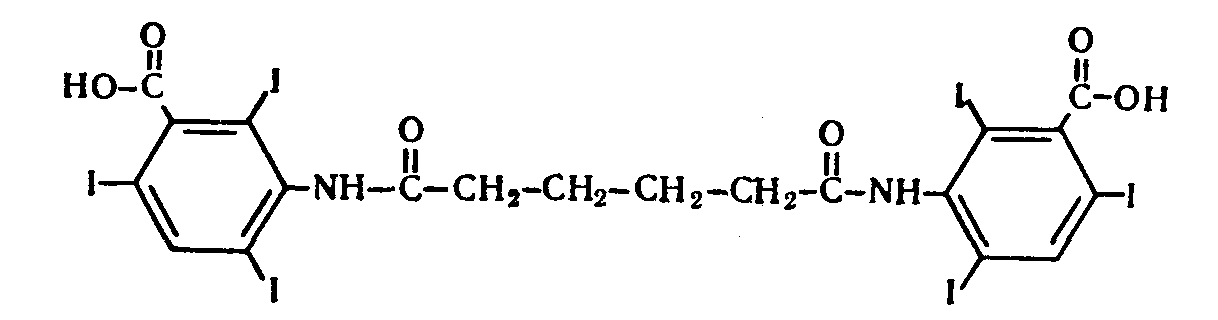 C 20H 14 I 6N 2 O 6 M. в. 1139,8 Описание. Белый или почти белый мелкокристаллический порошок слабо горького вкуса. Растворимость. Практически нерастворим в воде, 95% спирте, эфире и хлороформе, легко растворим в растворах едких щелочей и аммиака. Подлинность. 0,001% раствор препарата в 0,1 н. растворе едкого натра в области от 220 до 300 нм имеет максимум поглощения при длине волны около 236 нм. При нагревании 0,1 г препарата с 1 мл концентрированной серной кислоты выделяются фиолетовые пары йода. Цветность раствора. 2 г препарата растворяют в 4 мл 1 н. раствора едкого натра, фильтруют и промывают фильтр водой до получения 10 мл фильтрата. Окраска полученного раствора не должна быть интенсивнее эталона № 4б или № 4в. Проба с перекисью водорода. К 1 мл полученного раствора прибавляют 1 мл перекиси водорода; в течение 10—15 минут не должна появляться муть. Соединения с открытой аминогруппой. 1 г препарата взбалтывают с 10 мл ледяной уксусной кислоты и фильтруют. К 5 мл прозрачного фильтрата прибавляют 3 капли 0,1 мол раствора нитрита натрия. Через 5 минут появившаяся окраска не должна быть интенсивнее эталона №2ж. Кислотность. 0,2 г препарата встряхивают в течение 1 минуты с кипящей водой (4 раза по 2 мл) и фильтруют до получения прозрачного фильтрата. Объединенные фильтраты титрую! 0,05 н. раствором едкого натра (индикатор—фенолфталеин). На титрование должно расходоваться не более 0,1 мл 0,05 н. раствора едкого натра. Хлориды. 2 г препарата взбалтывают с 20 мл воды и фильтруют до получения прозрачного фильтрата. 5 мл фильтрата, доведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,004% в препарате). Сульфаты. 10 мл того же фильтрата должны выдерживать испытание на сульфаты (не более 0,01% в препарате). Фосфор. 1 г препарата помещают в тигель и озоляют до получения белого остатка. К остатку прибавляют 5 мл разведенной азотной кислоты и упаривают досуха, после чего остаток в тигле хорошо перемешивают с 2 мл горячей воды и фильтруют в пробирку через маленький фильтр. Тигель и фильтр промывают 1 мл горячей воды, собирая фильтрат в ту же пробирку, затем прибавляют 3 мл раствора молибдата аммония и оставляют на 15 минут в бане при температуре 38—40° Испытуемый раствор может иметь желтоватую окраску, но должен оставаться прозрачным (не более 0,0001% в препарате). Иодмонохлорид. 0,2 г препарата взбалтывают с 20 мл воды и фильтруют до получения прозрачного фильтрата. К 10-мл фильтрата добавляют 0,5 г йодида калия, 2 мл соляной кислоты и 1 мл хлороформа. Хлороформный слой должен оставаться бесцветным. Железо. 0,5 г препарата должны выдерживать испытание на железо (не более 0,02% в препарате). Сравнение проводят с эталоном, приго товленным из 3,5 мл эталонного раствора Б и 6,5 мл воды. Сульфатная зола из 1 г препарата не должна превышать 0,1%. Тяжелые металлы. Сульфатная зола из 0,5 г препарата должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Мышьяк. 0,5 г препарата должны выдерживать испытание на мышьяк (не более 0,0001 % в препарате). Количественное определение. Около 0,3 г препарата (точная навеска) помещают в мерную колбу емкостью 100 мл, растворяют в 5 мл раствора едкого натра, доливают водой до метки и перемешивают. 10 мл полученного раствора помещают в колбу емкостью 250 мл, прибавляют 5 мл 5% раствора перманганата калия и осторожно по стенкам колбы, при перемешивании, прибавляют 10 мл концентрированной серной кис лоты по 0,5—1 мл и оставляют на 10 минут. Затем прибавляют медленно, по 1 капле через 2—3 секунды, при энергичном перемешивании. раствор нитрита натрия до обесцвечивания жидкости и растворения двуокиси марганца. После этого сразу прибавляют 10 мл 10% раствора мочевины и перемешивают до полного исчезновения пузырьков, смывая при этом со стенок колбы нитрит натрия. Затем к раствору прибавляют 100 мл воды, 10 мл свежеприготовленного раствора йодида калия и выделившийся йод титруют 0,1 н. раствором тиосульфата натрия (индикатор — крахмал). 1 мл 0,1 н. раствора тиосульфата натрия соответствует 0,003166 г C20H14l6N206, которого в препарате должно быть не менее 99.0%. Хранение. Список Б. В банках оранжевого стекла, в защищенном от света месте. Рентгеноконтрастное средство. lodoformium Йодоформ Трийодметан СНI3 М.в. 393,73 Описание. Мелкие пластинчатые блестящие кристаллы или мелкокри сталлический порошок лимонно-желтого цвета, резкого характерного устойчивого запаха. Летуч уже при обыкновенной температуре, перего няется с водяным паром. Растворы препарата быстро разлагаются от действия света и воздуха с выделением йода. Растворимость. Практически нерастворим в воде, трудно растворим в спирте, растворим в эфире и хлороформе, мало растворим в глицерине. жирных и эфирных маслах. Подлинность, 0,1 г препарата нагревают в пробирке на пламени горелки; выделяются фиолетовые пары йода. Температура плавления 116—120° (с разложением). Красящие вещества. 5 г препарата энергично взбалтывают в течение 1 минуты с 50 мл воды и фильтруют. Фильтрат должен быть бесцветным. Кислотность или щелочность. К 10 мл фильтрата прибавляют 2 капли раствора бромтимолового синего. Появившееся желто-зеленое окрашивание должно перейти в синее от прибавления не более 0,1 мл 0,1 н. раствора едкого натра или в желтое от прибавления не более 0,05 мл 0,1 н. раствора соляной кислоты. Галогены. 5 мл того же фильтрата, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,004% в препарате). Сульфаты. 10 мл того же фильтрата должны выдерживать испытание на сульфаты (не более 0,01% в препарате). Зола из 0,5 г препарата не должна превышать 0,1%. Количественное определение. Около 0,2 г препарата (точная навеска) помещают в коническую колбу емкостью 250—300 мл, растворяют в 25 ли 95% спирта, прибавляют 25 мл 0,1 н. раствора нитрата серебра, 10 мл азотной кислоты и нагревают с обратным холодильником на водяной бане в течение 30 минут, защищая реакционную колбу от света. Холодильник промывают водой, в колбу прибавляют 100 мл воды и избыток нитрата серебра оттитровывают 0,1 н. раствором роданида аммония (индикатор — железоаммониевые квасцы). Параллельно проводят контрольный опыт. 1 мл 0,1 н. раствора нитрата серебра соответствует 0,01312 г СНI3, ко торого в препарате должно быть не менее 99,0%. Хранение. В хорошо укупоренной таре, предохраняющей от действия света, в прохладном месте. Антисептическое средство. | ||||||||||||

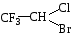
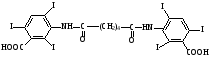
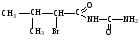 Белый кристаллический порошок или бесцветные кристаллы со слабым специфическим запахом, мало растворим в воде, растворим в спирте.
Белый кристаллический порошок или бесцветные кристаллы со слабым специфическим запахом, мало растворим в воде, растворим в спирте.