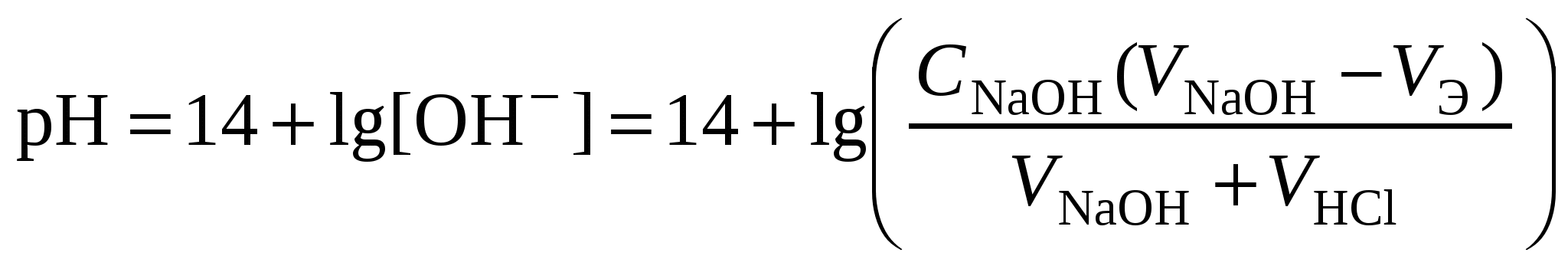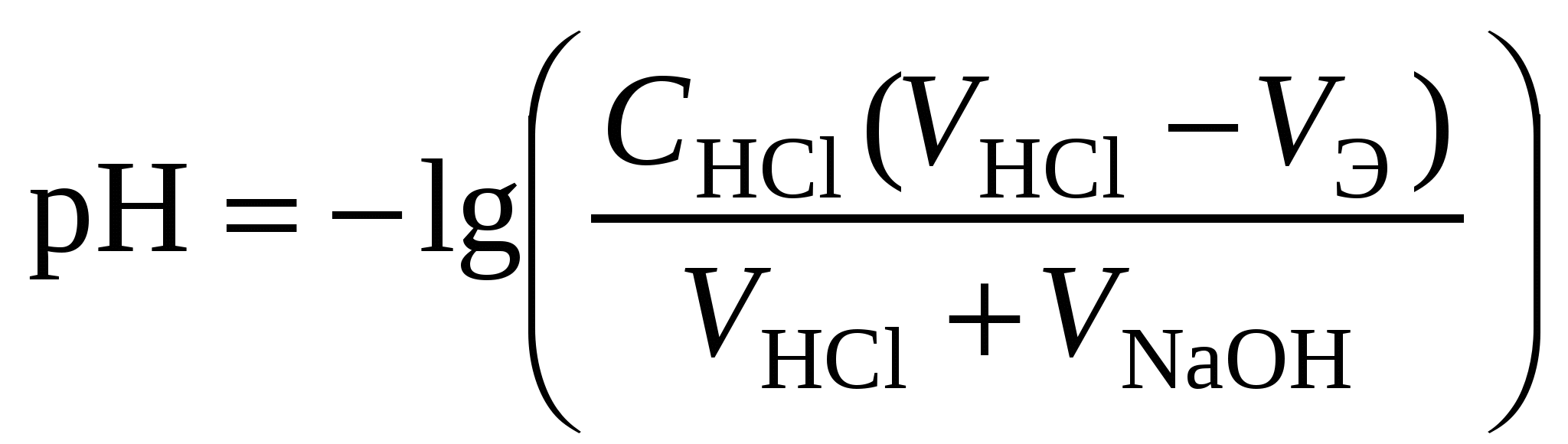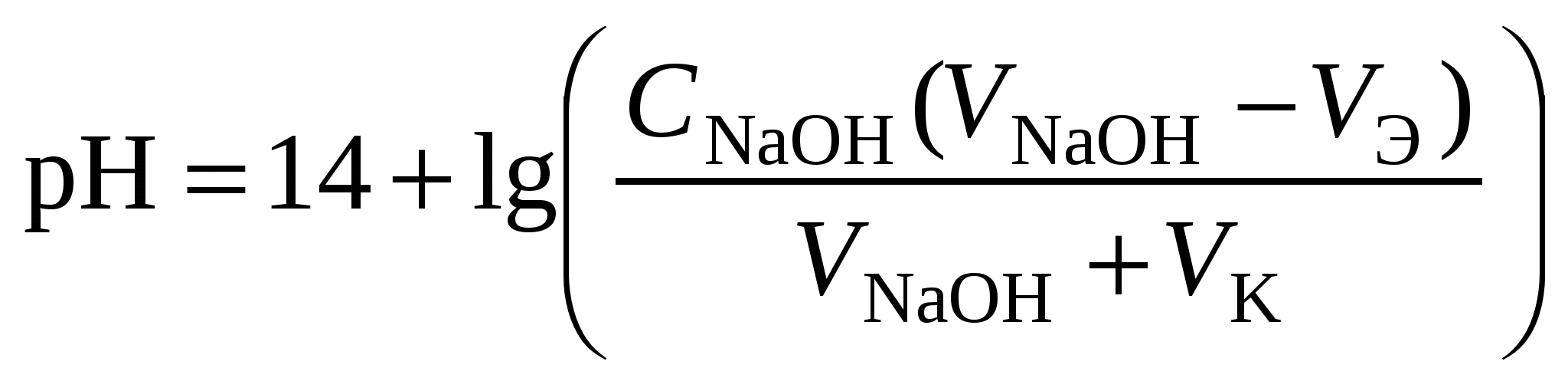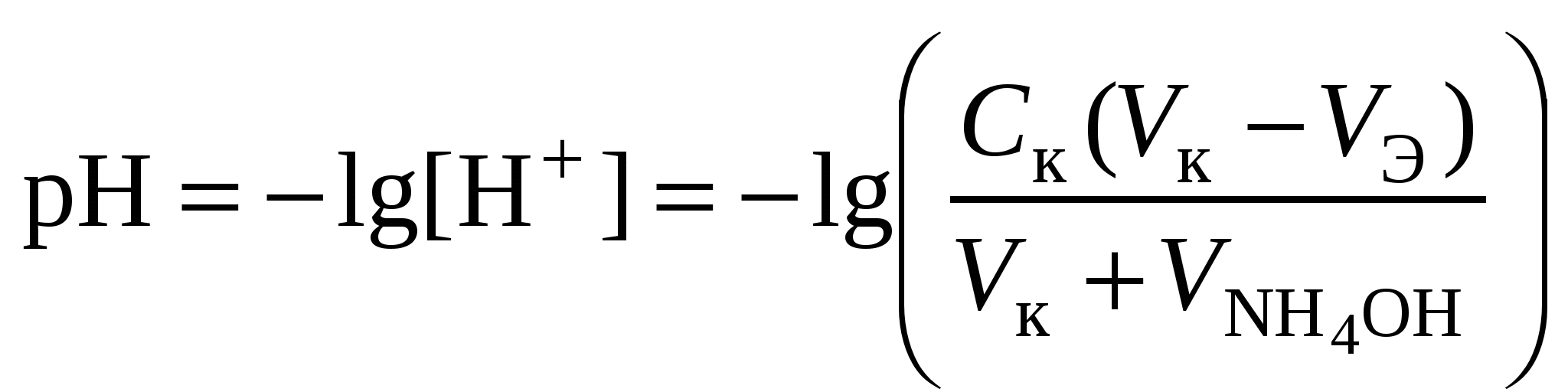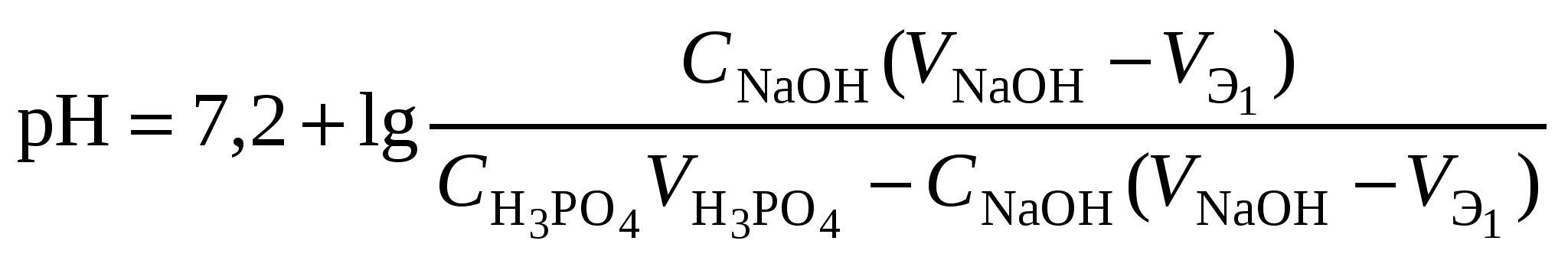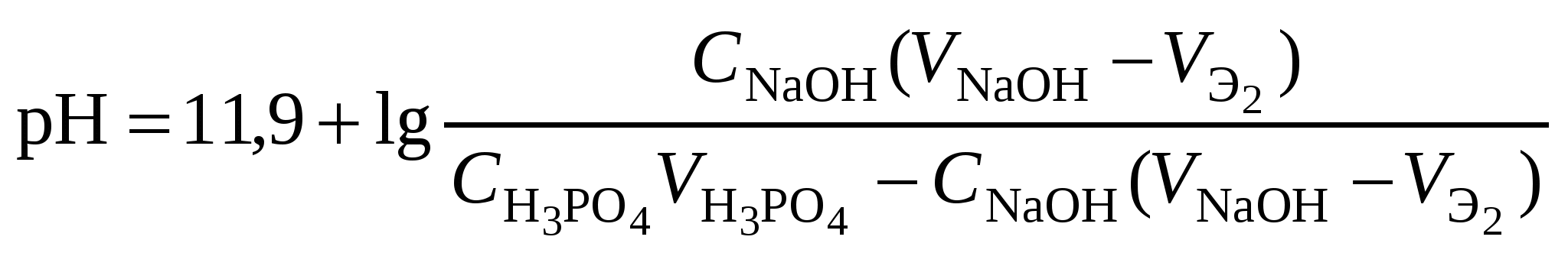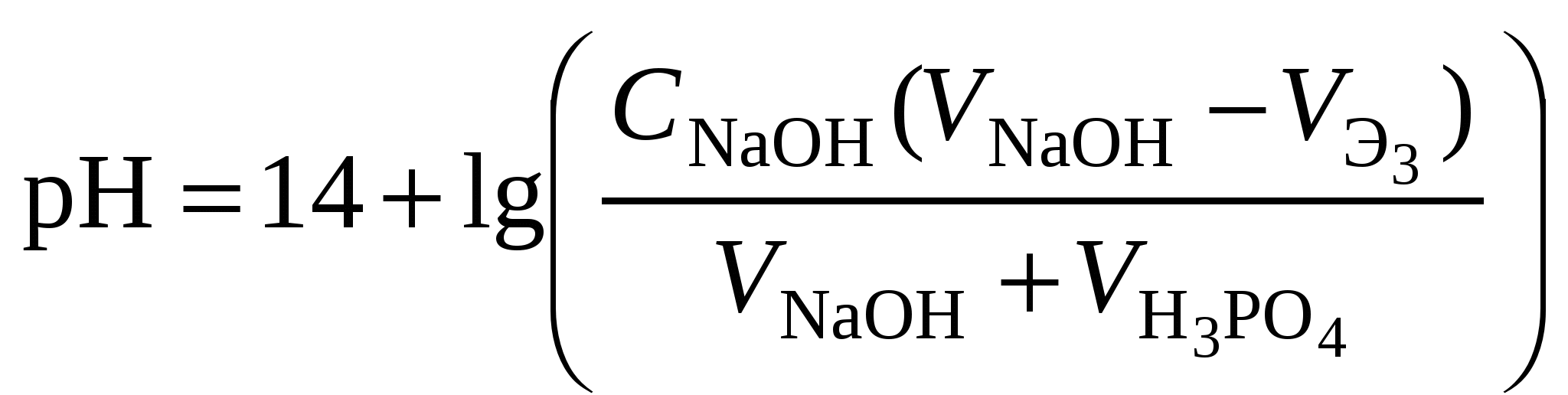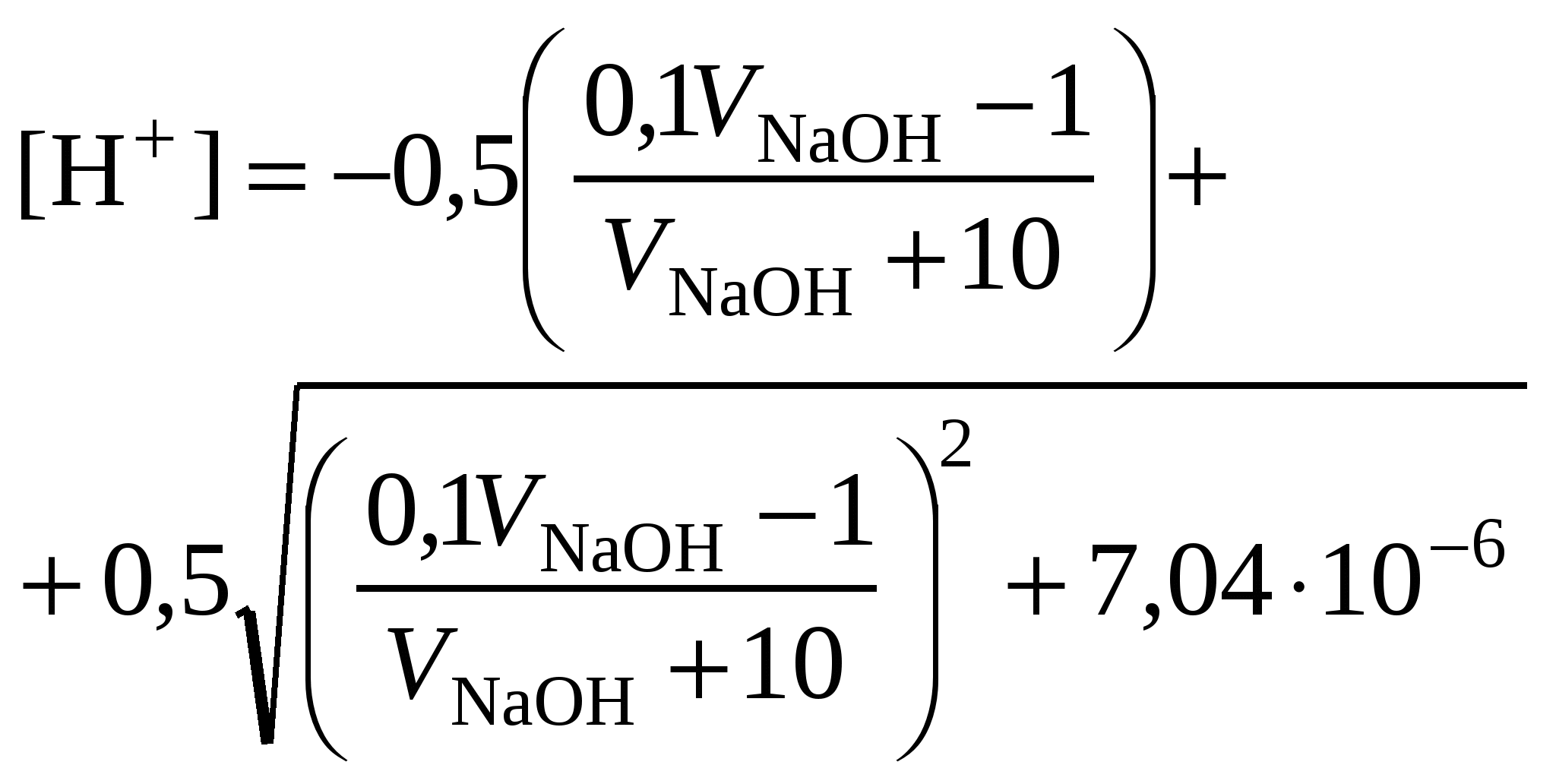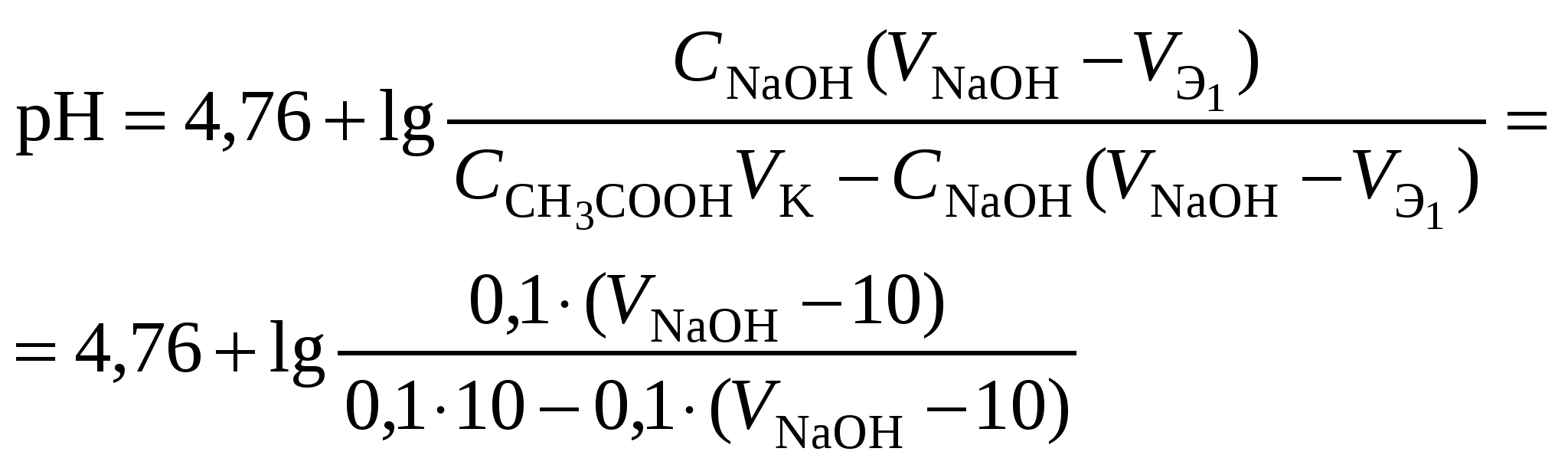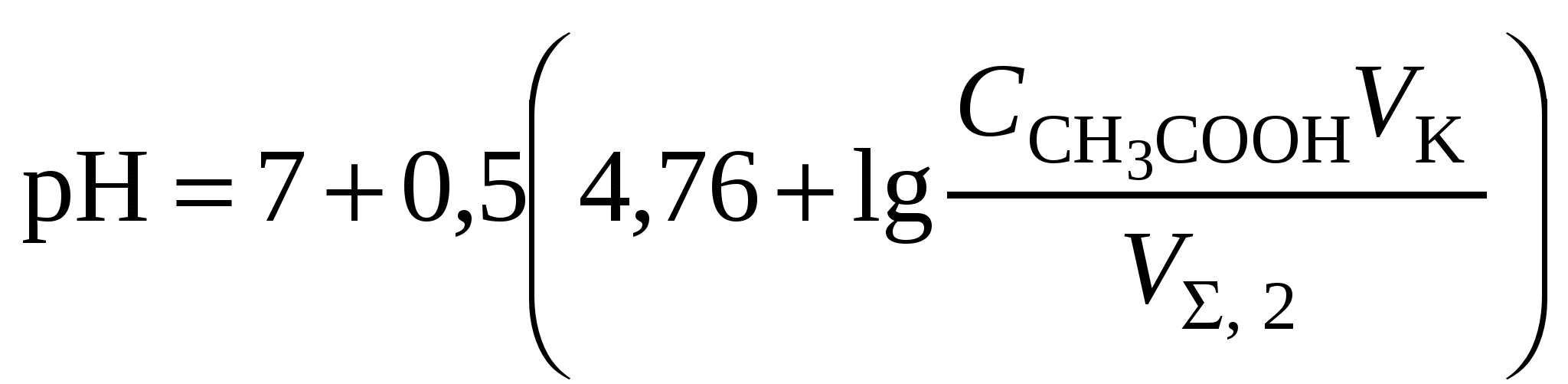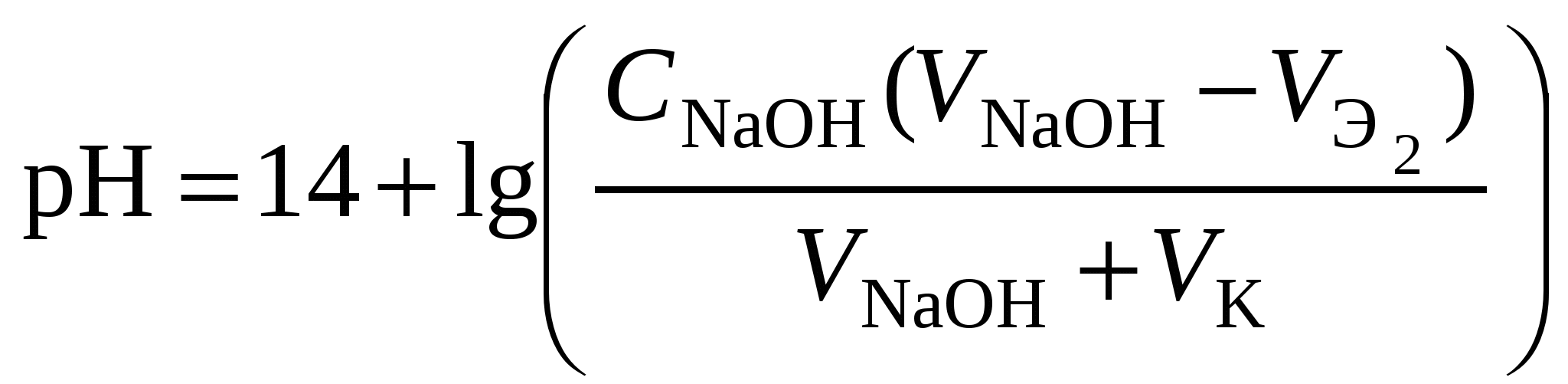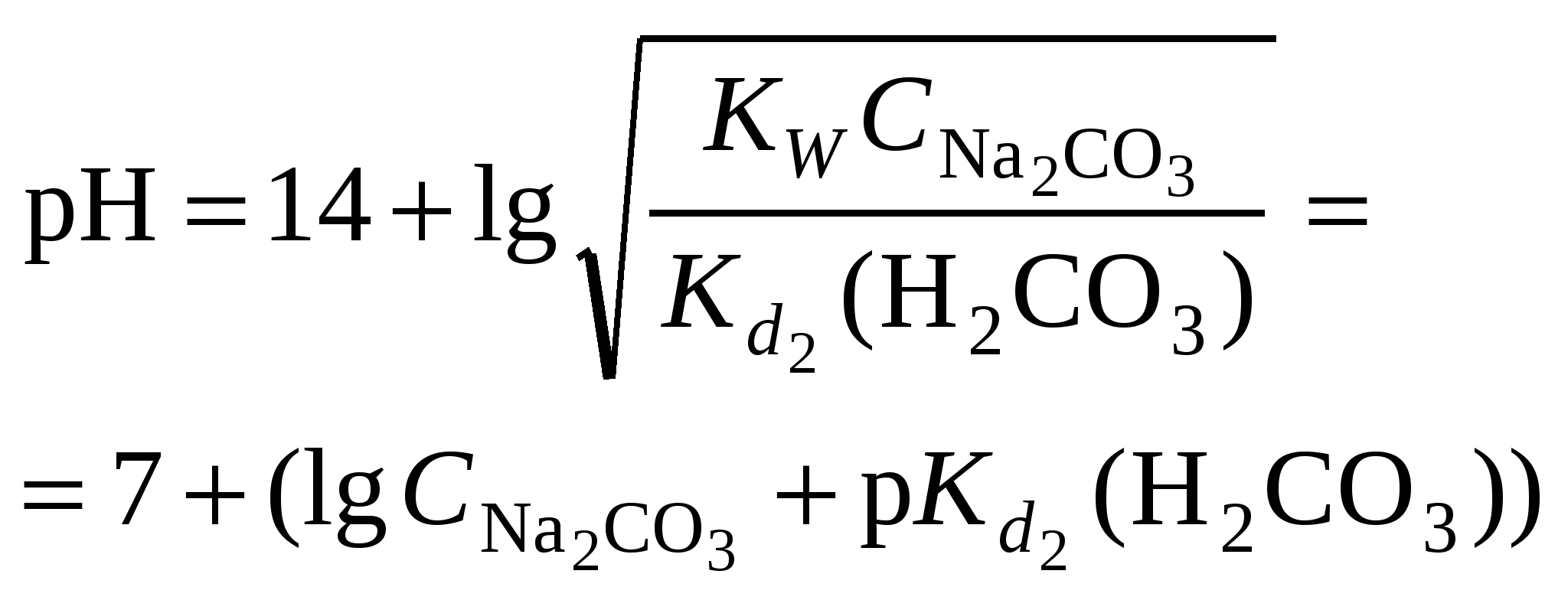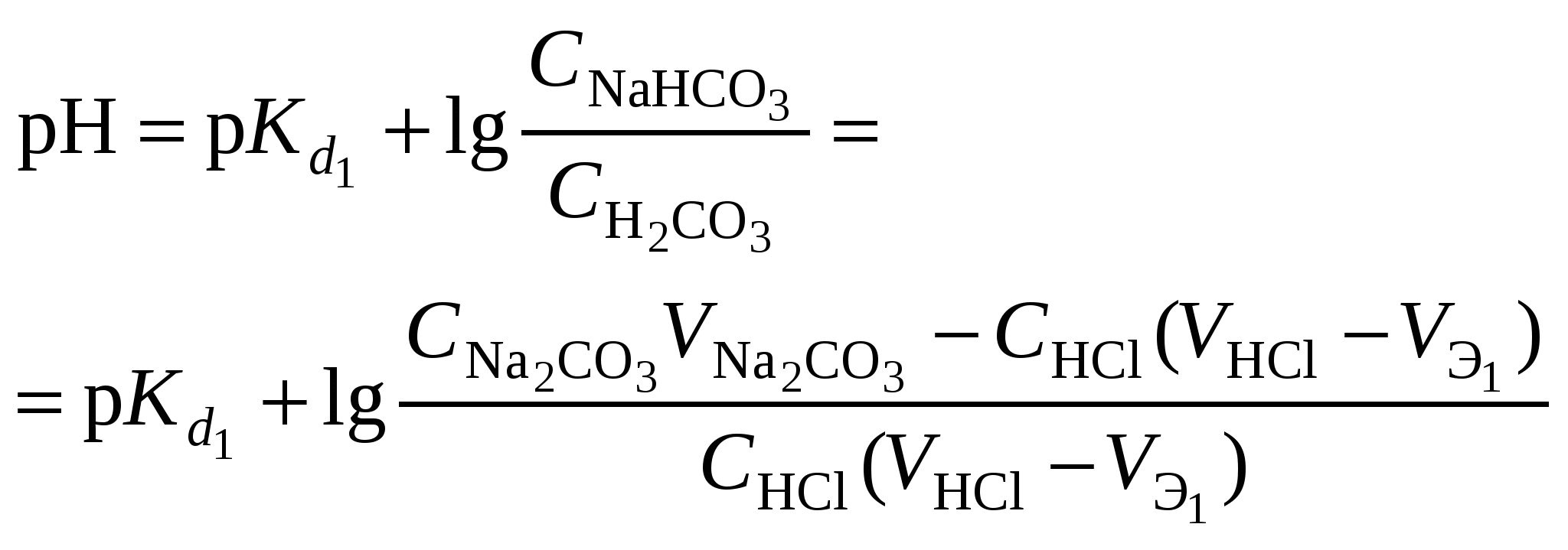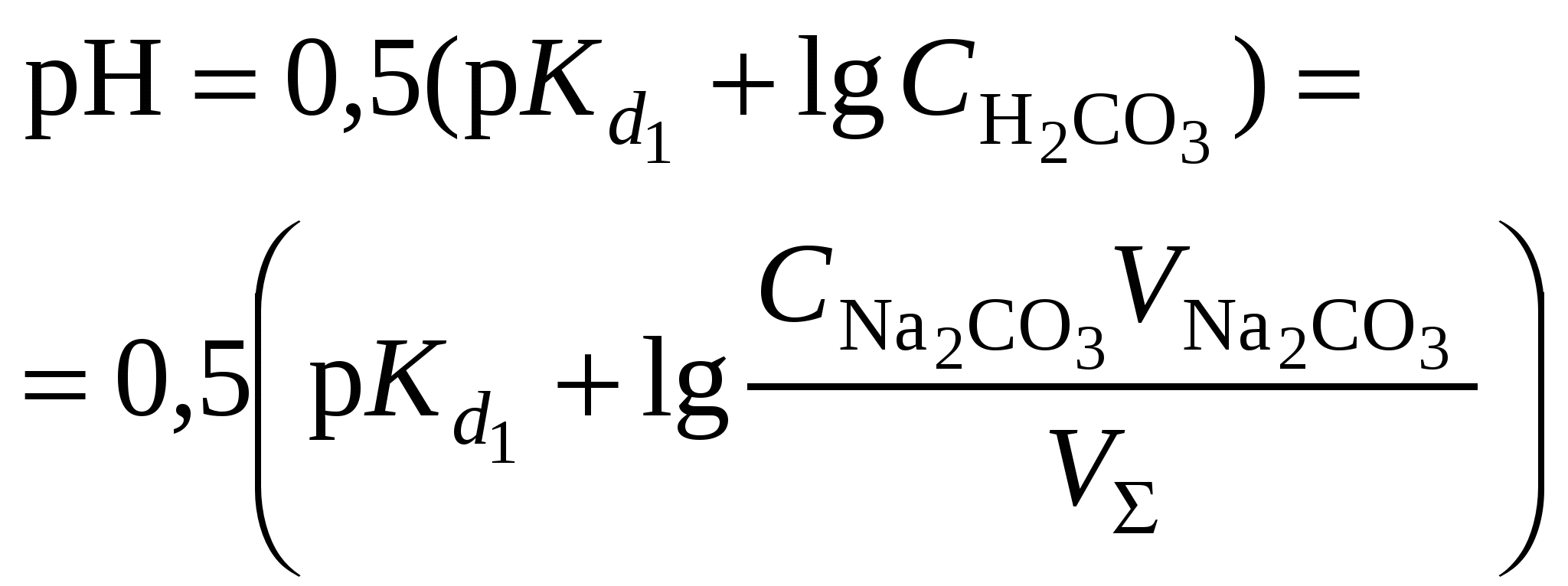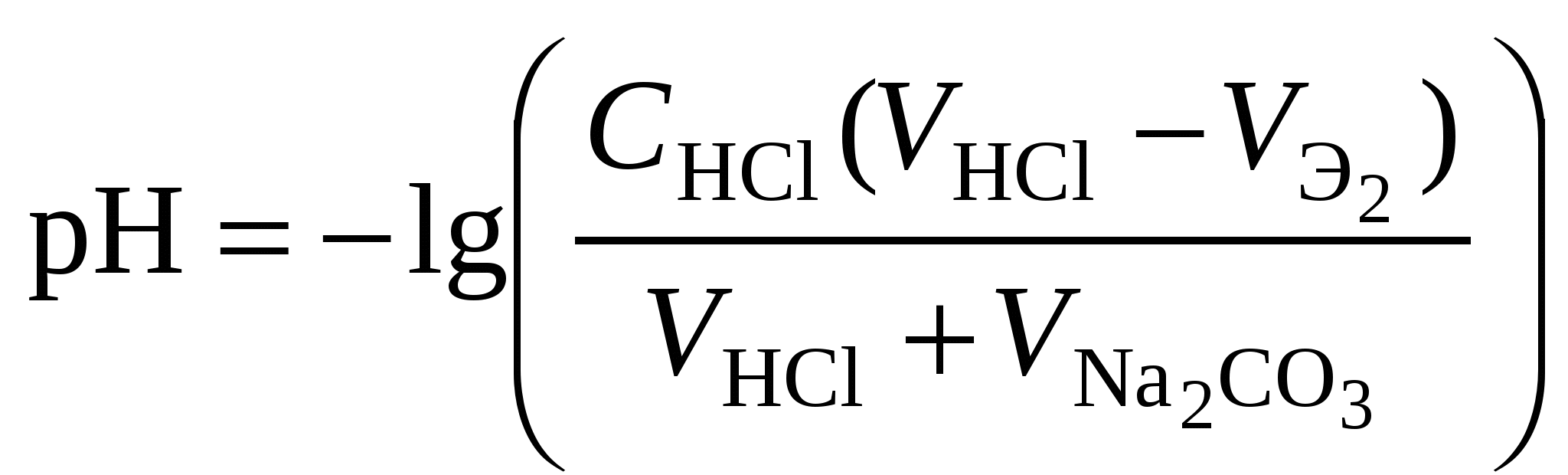Химия методичка (колличественный анализ). Методические указания к лабораторным работам санктпетербург 2010 удк 681 011 622 (075. 84) Количественный анализ
 Скачать 0.67 Mb. Скачать 0.67 Mb.
|
Кислотно-основное титрованиеАналитическая реакция – нейтрализация кислоты щёлочью или, наоборот, щёлочи кислотой. Эквивалентную точку определяют обычно с помощью цветных индикаторов. Действие индикаторовИндикаторами являются слабые органические кислоты или основания, у которых ионная и молекулярная формы имеют различную окраску. Например, фенолфталеин содержит фенольную функциональную группу, метилоранж – ароматическая сульфокислота с функциональной группой SO3H. Процесс их диссоциации в общем виде можно представить уравнением: Константа диссоциации индикатора определяется уравнением: Концентрации ионной и молекулярной форм в середине области перехода окраски индикатора равны между собой и рН перехода окраски индикатора равен логарифму константы диссоциации: При Фенолфталеин является очень слабой кислотой, поэтому он изменяет окраску от бесцветной к малиновой в слабощелочной области, при рН = 8,3 – 10. Метиловый оранжевый – кислота средней силы, изменяет окраску от красной к жёлтой в слабокислой области при рН = 3,7 – 5,1. Лакмус изменяет окраску от красной к синей в нейтральной области при рН около 7. Кривые титрованияКривые титрования – графические зависимости концентрации участника реакции, протекающей при титровании от объёма добавленного титранта. Для реакций кислотно-основного взаимодействия показателем концентрации участника реакции является рН раствора. Различают теоретические и экспериментальные кривые титрования. Теоретический расчёт кривых титрования проводится по уравнению реакции и исходным концентрациям реагирующих веществ. Теоретические кривые титрования нужны для обоснованного выбора индикатора в данном титровании. Экспериментальные кривые титрования получают при измерении какого-либо свойства системы в ходе титрования (ЭДС, электропроводность и т.п.) в зависимости от объёма титранта. Экспериментальные кривые титрования нужны для определения точки эквивалентности. Кривые кислотно-основного титрования позволяют проследить за качественными и количественными изменениями титруемого раствора и выбрать наиболее подходящий индикатор для определения точки эквивалентности (конца титрования). При построении теоретических кривых титрования рассчитывают рН четырёх основных этапов: 1) до начала титрования; 2) титрование до точки эквивалентности; 3) точка эквивалентности; 4) после точки эквивалентности. Кривая титрования сильной кислоты щёлочьюАналитическая реакция – реакция нейтрализации 1 этап. В растворе присутствует только сильная кислота, рН раствора определяется её концентрацией: где СK – нормальная концентрация кислоты. 2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью: рН вычисляется по уравнению: где VK – объём пробы кислоты, взятый для титрования (аликвота), СЩ – нормальная концентрация раствора щёлочи, VЩ – объём раствора щёлочи, добавленного в процессе титрования. 3 этап. Точка эквивалентности. В системе находится только негидролизующаяся соль. рН = 7. На нейтрализацию кислоты затрачен эквивалентный объём щелочи VЭ. 4 этап. Добавление избытка титранта после точки эквивалентности. рН определяется только количеством добавленной щёлочи и вычисляется по уравнению: 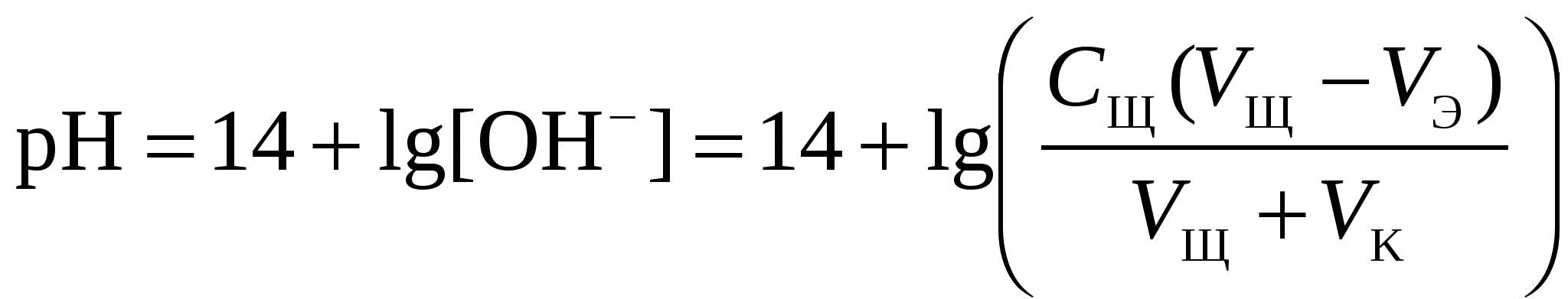 . .Пример. Рассчитать кривую титрования 10 мл 0,1 н. соляной кислоты 0,1 н. раствором гидроксида натрия.
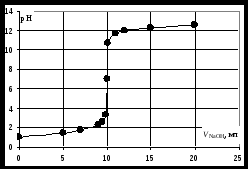 Кривая титрования сильной кислоты щелочью Точка эквивалентности соответствует объёму титранта 10 мл. Обращает внимание резкий скачок величины рН в этой области. Объём одной капли раствора обычно составляет 0,01-0,02 мл. В области эквивалентной точки при добавлении капли щёлочи рН возрастает на 3-6 единиц. Поэтому эквивалентную точку можно определить с помощью любого цветного индикатора, изменяющего окраску в области значений рН от 4 до 10. Кривая титрования сильного основания кислотойАналитическая реакция – реакция нейтрализации 1 этап. В растворе присутствует только щёлочь и рН раствора определяется её концентрацией: 2 этап. Процесс титрования. Происходит постепенная нейтрализация щелочи кислотой: рН вычисляется по уравнению: 3 этап. Точка эквивалентности. В системе находится только негидролизующаяся соль. рН = 7. На нейтрализацию кислоты затрачен эквивалентный объём кислоты VЭ. 4 этап. После точки эквивалентности рН определяется только количеством добавленной кислоты и вычисляется по уравнению: 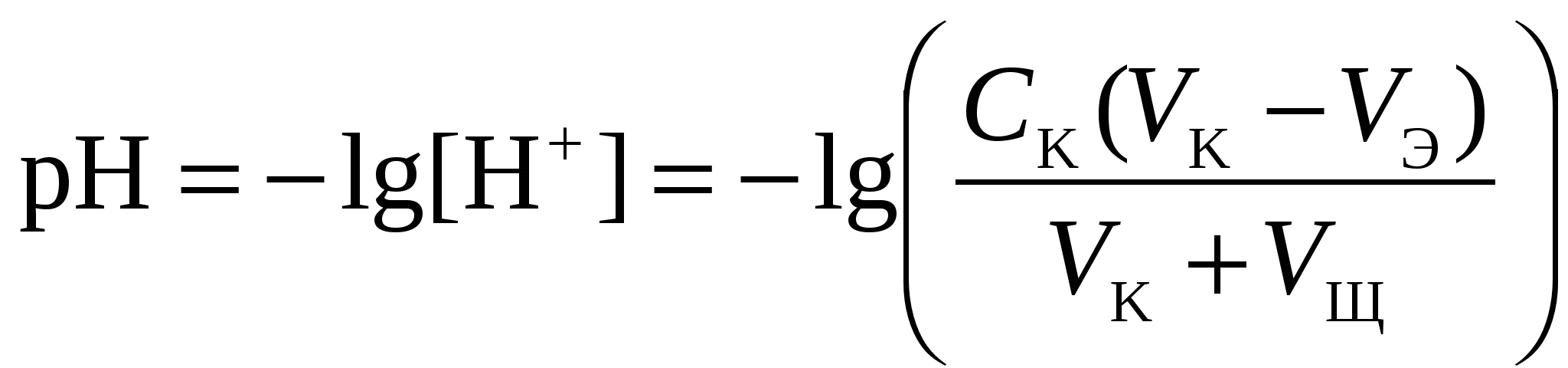 . .Пример. Рассчитать кривую титрования 10 мл 0,1 н. гидроксида натрия 0,1 н. раствором соляной кислоты.
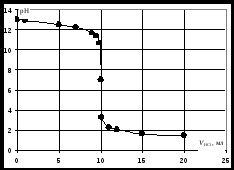 Кривая титрования сильного основания кислотой Кривая титрования щёлочи кислотой является зеркальным отражением кривой титрования сильной кислоты щёлочью. Эквивалентную точку можно определить с помощью любого цветного индикатора, изменяющего окраску в области значений рН от 4 до 10. Кривая титрования слабой одноосновной кислоты щёлочью1 этап. В растворе присутствует только слабая кислота и рН раствора определяется её концентрацией и константой диссоциации: где СK – концентрация раствора кислоты, моль/л. 2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью: В результате образуется буферная смесь, состоящая из слабой кислоты, избыток которой присутствует в системе до точки эквивалентности и соли этой кислоты. рН вычисляется по уравнению для кислого буферного раствора: где 3 этап. Точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи VЭ. В системе находится только соль, гидролизующаяся по аниону. рН в точке эквивалентности будет больше 7 и вычисляется по уравнению: Концентрация соли в точке эквивалентности: где 4 этап. После точки эквивалентности рН определяется только количеством добавленной щёлочи: 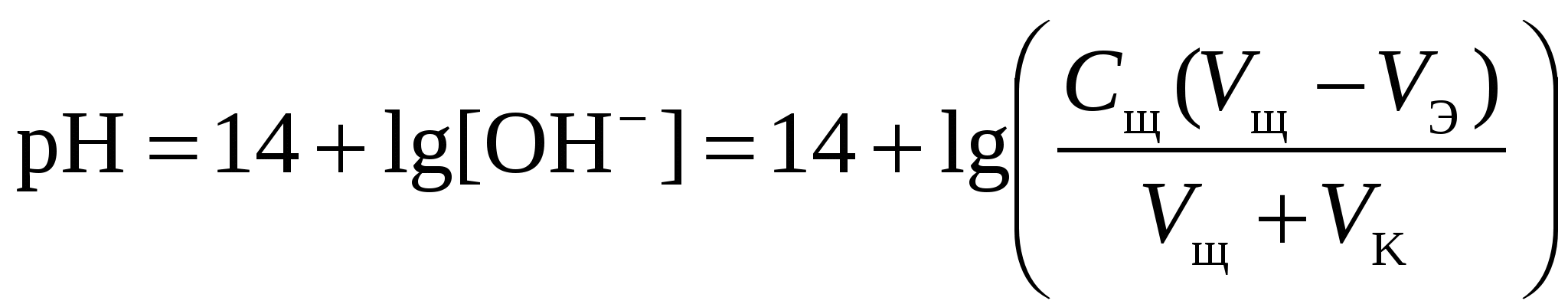 . .Пример. Рассчитать кривую титрования 10 мл 0,1 н. уксусной кислоты 0,1 н. раствором гидроксида натрия.
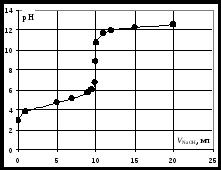 Кривая титрования слабой одноосновной кислоты щелочью При рассмотрении кривой титрования обращает внимание то, что точка эквивалентности лежит в щелочной области. Скачок значений рН вблизи эквивалентной точки меньше, чем в случае сильного электролита и не превышает двух единиц рН при добавлении одной капли титранта. Для титрования следует выбирать индикатор, изменяющий окраску в щелочной среде, в примере – при рН = 8-9. Таковым является фенолфталеин. Кривая титрования слабого однокислотного основания сильной кислотой1 этап. В растворе присутствует только слабое основание и рН раствора определяется его концентрацией и константой диссоциации: где Со – концентрация раствора слабого основания, моль/л. 2 этап. Процесс титрования. Происходит постепенная нейтрализация слабого основания кислотой: В результате образуется буферная смесь, состоящая из слабого основания, избыток которого присутствует в системе до точки эквивалентности и соли этого основания. рН вычисляется по уравнению для основного буферного раствора: где 3 этап. Точка эквивалентности. На нейтрализацию основания затрачен эквивалентный объём кислоты VЭ. В системе находится только соль, гидролизующаяся по катиону. рН в точке эквивалентности будет меньше 7 и вычисляется по уравнению: Концентрация соли в точке эквивалентности: где 4 этап. После точки эквивалентности рН определяется только количеством добавленной кислоты: 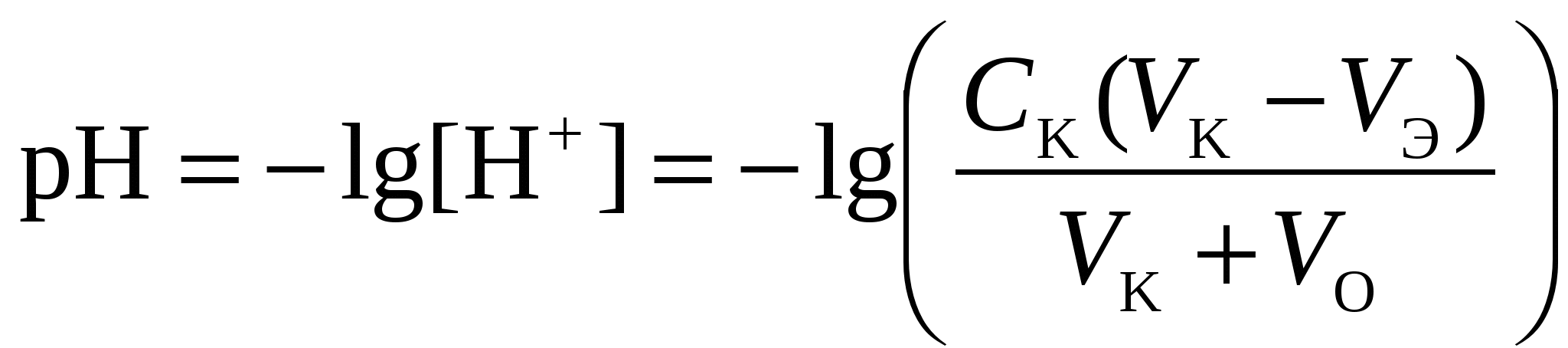 . .Пример. Рассчитать кривую титрования 10 мл 0,1 н. гидроксида аммония 0,1 н. раствором соляной кислоты.
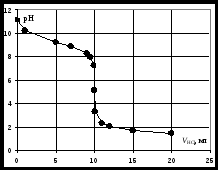 Кривая титрования слабого основания сильной кислотой Кривая титрования слабого основания кислотой, например, раствора аммиака или его органического производного – амина, будет зеркальным отображением кривой титрования слабой одноосновной кислоты. Точка эквивалентности при этом окажется в кислой области. Для её определения необходим индикатор, изменяющий окраску в выбранном примере в области значений рН = 4-6, например, метиловый оранжевый. Кривая титрования слабой многоосновной кислотыОсновное различие в расчетах кривой титрования одно- и многоосновных кислот связано со ступенчатой диссоциацией многоосновных кислот и, как следствие, с возможным существованием двух и более скачков титрования соответственно числу ступеней диссоциации. Возможность титрования кислоты с заданной точностью по первой точке эквивалентности зависит от соотношения ступенчатых констант диссоциации кислоты. Титрование кислоты состава H2An по первой ступени с погрешностью не более 1 % означает, что взаимодействие кислоты со щёлочью по первой ступени должно пройти не менее чем на 99 %, а по второй не более чем на 1 %. Такая ситуация возможна, если вторая константа диссоциации будет на 4 порядка меньше, чем первая. Если различие в константах диссоциации будет составлять 6 или более порядков, то погрешность определения может быть снижена до 0,1 % Участки кривой титрования многоосновной кислоты рассчитываются по тем же формулам, что и для одноосновной кислоты. Ниже рассмотрены этапы титрования слабой трёхосновной кислоты. 1 этап. В растворе присутствует только слабая кислота, рН раствора определяется её концентрацией и первой константой диссоциации: где СK – концентрация раствора кислоты, моль/л. 2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью по первой ступени: В результате образуется буферная смесь, состоящая из слабой кислоты, избыток которой присутствует в системе до точки эквивалентности и кислой соли этой кислоты. рН вычисляется по уравнению для кислого буферного раствора: 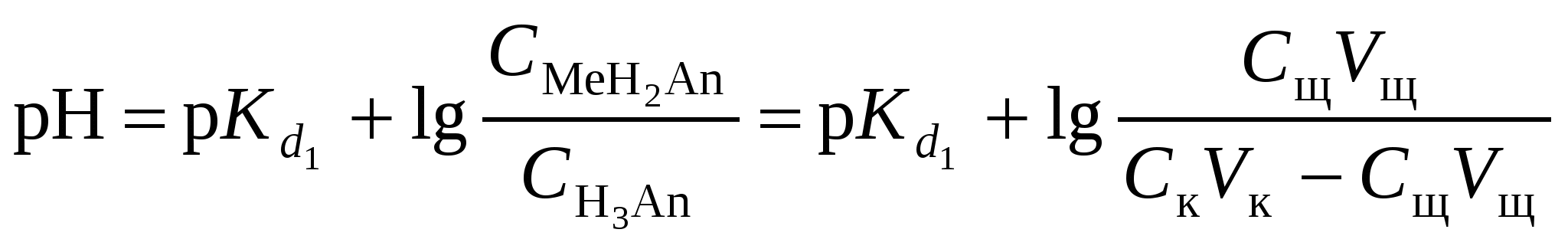 , ,где 3 этап. Первая точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи 4 этап. Аналогичен второму этапу. Происходит нейтрализация кислоты щёлочью по второй ступени: В результате образуется буферная смесь, состоящая из двух кислых солей. Более кислая соль будет играть роль кислоты, менее кислая – роль соли. рН вычисляется по уравнению для кислого буферного раствора: 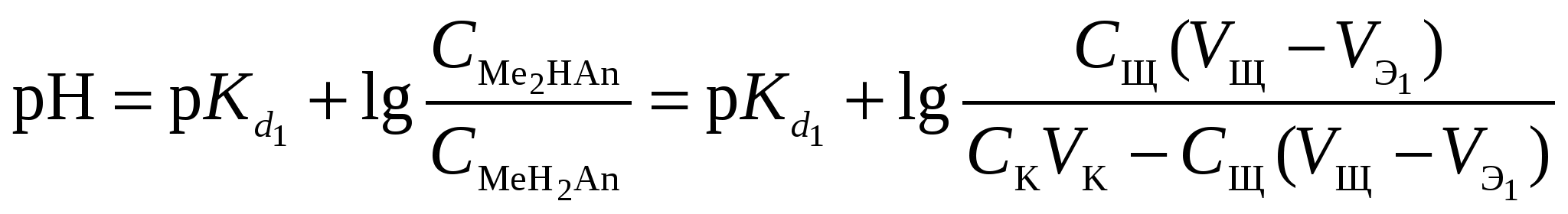 , ,5 этап. Вторая точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объем щёлочи 6 этап. Нейтрализация кислоты по третьей ступени: В результате образуется буферная смесь, состоящая из кислой и основной солей. Кислая соль будет играть роль кислоты, средняя – роль соли. рН вычисляется по уравнению для кислого буферного раствора: 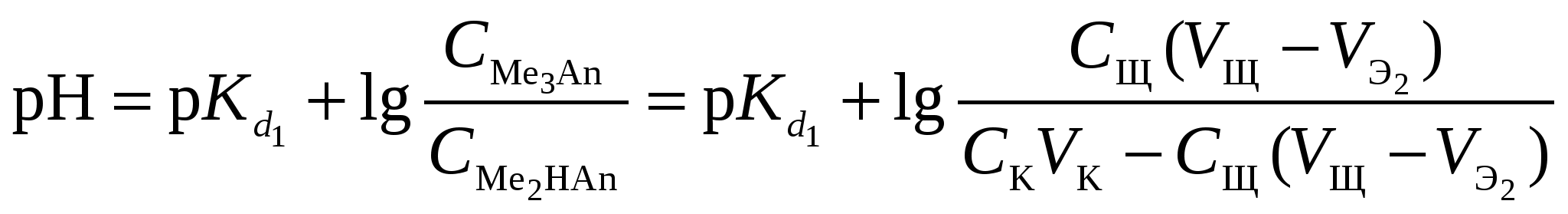 . .7 этап. Третья точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи 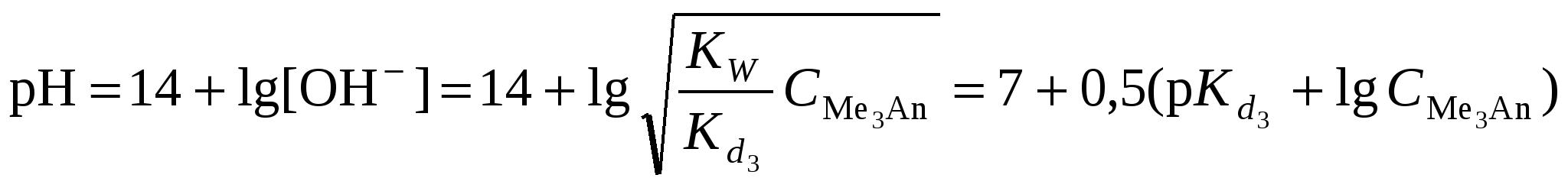 , ,где 8 этап. После точки эквивалентности рН определяется только количеством добавленной щёлочи: 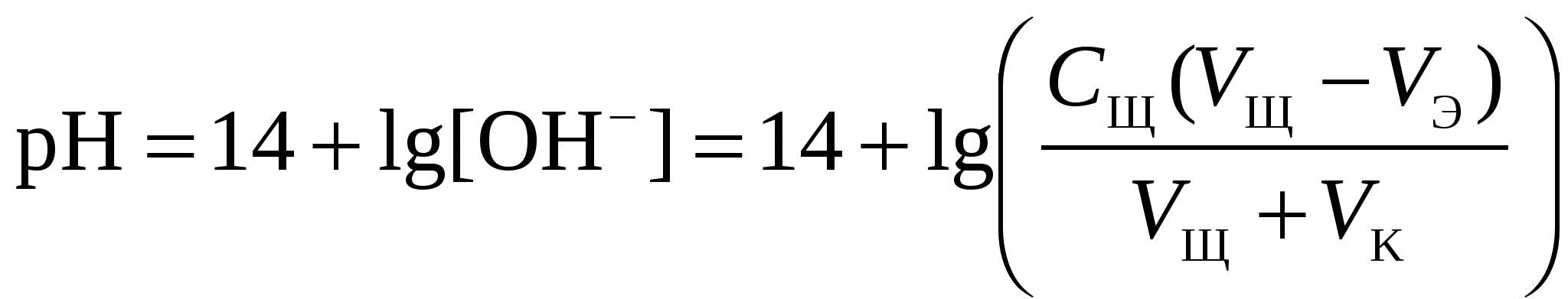 . .Расчёт кривой титрования 10 мл 0,1 н. раствора ортофосфорной кислоты 0,1 н. раствором гидроксида натрия.
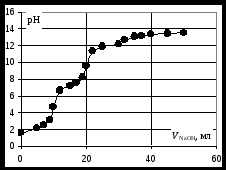 Кривая титрования ортофосфорной кислоты щёлочью Следует отметить, что вследствие малой константы диссоциации кислоты по третьей ступени, на кривой титрования ортофосфорной кислоты можно выделить только 2 скачка значений рН, соответствующих двум эквивалентным точкам. Первую из них при рН около 4,7 удобно определять с помощью индикатора бромкрезолового зелёного по переходу окраски из жёлтой в голубую, вторую эквивалентную точку при рН в районе 9,6 можно определить с тимоловым голубым. Кривая титрования смеси сильной и слабой кислотРаздельное титрование смеси кислот (оснований) в воде возможно, если = отношение их констант диссоциации не менее 104; = константы диссоциации титруемых кислот (оснований) не менее 10‒7; = соблюдается условие: При этом сначала титруется более сильная кислота, а затем – более слабая. На кривой титрования будет наблюдаться соответствующее число скачков титрования. При соотношении констант диссоциации меньше 104 на кривой титрования получится один скачок, соответствующий суммарному титрованию кислот (оснований). Кривая титрования получается совмещением соответствующих участков кривых титрования сильной и слабой кислот. Первый участок соответствует титрованию сильной кислоты. Поэтому в первой эквивалентной точке рН раствора определяется присутствием слабой кислоты. Далее кривая титрования аналогична таковой для слабой кислоты. Вторая эквивалентная точка соответствует содержанию в системе соли, гидролизующейся по аниону. В качестве примера рассмотрим титрование аликвоты объёмом 10 мл, содержащей 0,1 М соляную и 0,1 М уксусную кислоты, 0,1 н. раствором гидроксида натрия. 1. До начала титрования рН раствора в основном определяется концентрацией в растворе соляной кислоты. 2. При расчёте первого участка кривой титрования следует учесть вклад слабой кислоты в концентрацию ионов Н+, который значителен вблизи первой эквивалентной точки и приводит к её сдвигу от значения рН=7 в кислую область. Формулу для расчёта концентрации ионов Н+ получим из условия баланса зарядов, пренебрегая вкладом в него ионов гидроксила, который мал в кислой среде: В этом уравнении произведём следующие подстановки: В итоге получим уравнение для расчёта концентрации катионов водорода в зависимости от объёма добавленной щёлочи: 3. В первой точке эквивалентности рН раствора определяется концентрацией уксусной кислоты и её константой диссоциации: 4. При расчёте второго участка кривой титрования следует учесть образование ацетатного буферного раствора: для которого 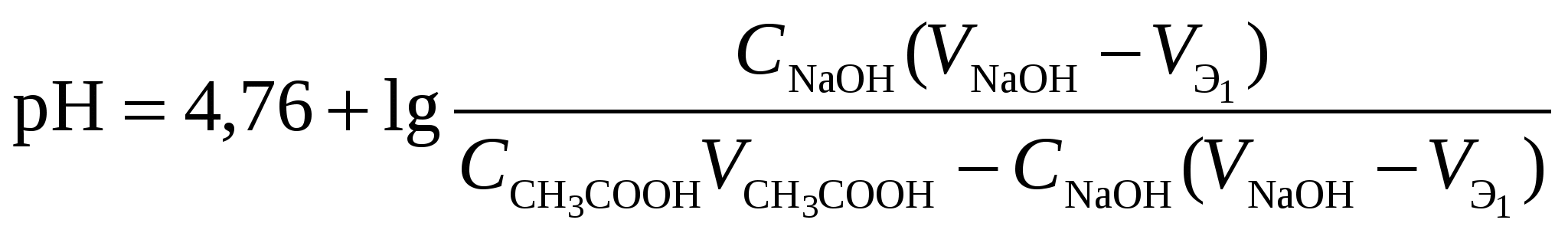 . .5. рН второй точки эквивалентности определяется концентрацией ацетата натрия: 6. рН третьего участка кривой титрования определяется количеством щёлочи: 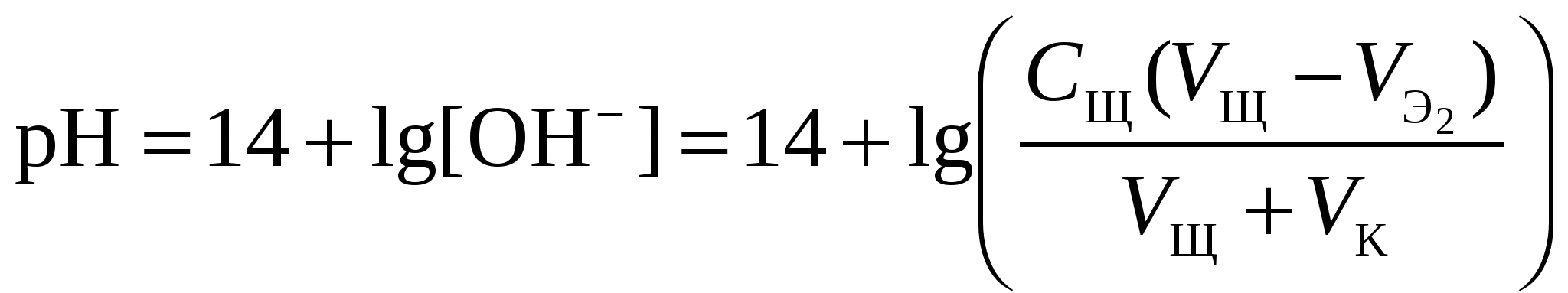 . .Расчёт кривой титрования 10 мл раствора 0,1 н. соляной и 0,1 н. уксусной кислот щёлочью:
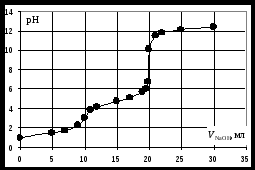 Кривая титрования смеси соляной и уксусной кислот гидроксидом натрия Первой точке эквивалентности, соответствующей содержанию в пробе сильной кислоты, в рассматриваемом примере отвечает слабый скачок значений рН, который можно зафиксировать с помощью рН-метра или, менее точно, по жёлтому окрашиванию динитрофенола. Если вторая кислота слабее уксусной, например, фенол с Kd = 1010, то первая точка эквивалентности будет выражена резче, но слабее проявится вторая эквивалентная точка. Кривая титрования раствора соли слабого электролитаРассмотрим в качестве примера кривую титрования раствора соды. Так как ионы слабой угольной кислоты связывают катионы Н+, карбонатные растворы можно титровать кислотами. Нейтрализация протекает в две ступени, соответственно, на кривой титрования выделяют две эквивалентные точки. Результаты расчёта титрования аликвоты объёмом 10 мл 0,1 M раствора соды 0,1 M соляной кислотой приведены ниже. Расчёт кривой титрования 10 мл 0,1 М раствора карбоната натрия 0,1 н. соляной кислотой:
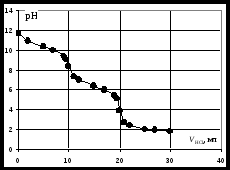 Кривая титрования соды кислотой На кривой титрования выделяются две эквивалентные точки. Скачки рН в них невелики, менее 2 единиц. Первую точку эквивалентности можно определить по обесцвечиванию фенолфталеина при рН=8,3, вторую – по переходу окраски метилового оранжевого из жёлтой в красную в области рН около 3,7. Окислительно-восстановительное титрованиеАналитическая реакция – окислительно-восстановительная. В зависимости от титранта можно выделить следующие виды редоксиметрии: Перманганатометрия – титрование раствором KMnO4 в кислой среде. Восстановление титранта протекает по реакции: в ходе которой малиновый раствор перманганата обесцвечивается. От первой избыточной капли титранта появляется розовая окраска, по которой отмечают эквивалентную точку. Дихроматометрия – титрование раствором K2Cr2O7 в кислой среде. Дихромат калия восстанавливается по реакции: Ванадатометрия – титрование кислым раствором ванадата аммония по реакции: Йодометрия – титрование раствором йода. Часто применяют метод обратного титрования – к аликвоте пробы добавляют избыток титрованного раствора йода, а затем оттитровывают избыточный йод раствором тиосульфата натрия. Восстановительное титрование растворами соли Мора, как часто называют сульфат железа (2+), тиосульфата натрия и др. При расчёте результатов окислительно-восстановительного титрования нормальные концентрации титранта и определяемого элемента выражают в электрохимических эквивалентах на литр. Электрохимический эквивалент равен молярной массе соединения, делённой на число электронов в полуреакции его восстановления или окисления. Например, электрохимический эквивалент перманганата калия равен молярной массе, делённой на 5, тогда как химический эквивалент этого соединения в обменной реакции равен его молярной массе. КомплексонометрияАналитическая реакция – связывание определяемого элемента в растворимый комплекс. В качестве титрантов используют органические комплексоны с несколькими функциональными группами в молекуле, которые образуют с катионами металлов пяти- или шестичленные гетероциклы, называемые хелатами. Наиболее распространённый комплексон – дигидроэтилендиаминтетраацетат натрия, имеющий техническое название трилон Б. Формула трилона Б следующая: 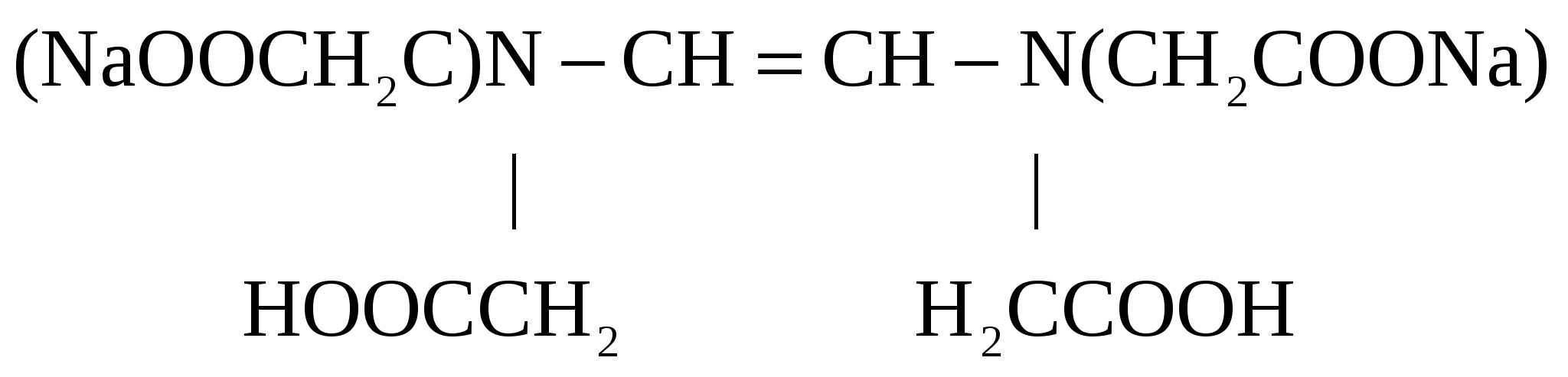 Образующийся в результате диссоциации в растворе анион дигидроэтилендиаминтетраацетата H2Tr2 реагирует с катионами металлов по уравнению: Как следует из уравнения реакции, она протекает не в эквивалентных, а в молярных соотношениях: 1 моль определяемого элемента на один моль трилона Б. Поэтому для расчёта результатов используют не нормальные, а молярные концентрации. Индикаторы трилонометрического титрования – это слабые окрашенные органические кислоты, образующие с катионами металлов комплексы, менее устойчивые, чем комплексы с трилоном Б. При добавлении индикатора раствор окрашивается за счёт образования металл-индикаторного комплекса: С индикатором связана малая часть катионов металла. Остальные катионы определяемого элемента в ходе титрования постепенно связываются в комплекс с трилоном. Когда все свободные катионы металла будут связаны с трилоном, он вытеснит индикатор из неустойчивого металл-индикаторного комплекса: В результате окраска раствора изменяется, что позволяет установить эквивалентную точку. |