ДЗФКХ07. Методические указания к решению задач домашнего задания по курсу Физическая и коллоидная химия Москва 2005
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
167. Для реакции изомеризации А В при 25 0 С концентрации исходного вещества А в разные моменты времени даны в таблице. Равновесная концентрация вещества А составила С A = 0,078 моль / л. Найти константы скоростей прямой k 1 и обратной реакций k2 . Начальная концентрация С В0 = 0.
168. Константа равновесия обратимой реакции А В равна 10, а константа скорости прямой реакции равна 0,2 с – 1. Начальные концентрации веществ А и В равны 0,3 моль/л и 0 моль/л соответственно. Определить время, за которое прореагирует 10 % вещества А. 169. Для обратимого процесса А В известно, что k 1 + k - 1 = 5,13 . 10 - 5 c – 1, а k 1/ k - 1 = 0,575. Начальная концентрация вещества А равна 0,32 моль/л, а вещества В в начальный момент времени нет. Определить концентрации веществ через 100 мин после начала реакции. 170. Для обратимой реакции А В начальные концентрации составляют С А0 = 18,23 моль/л и С В 0 = 0 моль/л, k 1 = 0,027 с – 1 . Равновесная концентрация вещества А равна 4,95 моль/л. Определить значение k - 1 . 171. Константа скорости прямой реакции А В при некоторой температуре равна 10, а константа скорости прямой реакции равна 5 . 10 - 4 с – 1. Константа равновесия равна 1,6. В начальный момент присутствует только вещество А. Определить время, за которое прореагирует 30 % вещества А. 172. Константа равновесия обратимой реакции А В равна 1,4, а константа скорости прямой реакции равна 6 . 10 – 5 с – 1. Определите, какая доля начального количества вещества прореагирует за 40 мин, если в начальный момент в системе содержалось только вещество А. 173. В параллельных реакциях первого порядка: 1. А В; (k 1) , 2. А D. (k 2) выход вещества В равен 53 %, а время превращения вещества А на 1 / 3 равно 40 с. Найти k 1 и k 2. 174. Параллельные элементарные реакции: 1. А В , 2. 2 А С характеризуются следующими данными: скорости обеих реакций равны при концентрации вещества А, равной 0,2 моль / л, а при концентрации вещества А равной 0,4 моль / л скорость превращения А составляет 0,24 моль / (л . с). Определить значения констант скоростей k1 и k 2. 175. Параллельные элементарные реакции: 1. А В, 2. А С характеризуются следующими данными: выход вещества В равен 63 %, а время полупревращения вещества А по приведенной схеме составляет 19 мин. Рассчитать значения констант скоростей k 1 и k 2. 176. Определить, сколько азота и оксида азота (I) образуется через 0,1 с при нагревании 4 моль/ л окиси азота при 1300 К, если константы скорости параллельных бимолекулярных реакций равны k 1 = 25,7 и k2 = 18,2 л/(моль . с). N2 + O2 (k 1 ) 2 NO N2O + 0,5 O2 . (k 2) 177. Реакция разложения вещества А может протекать параллельно по трем направлениям: 1. А В, 2. А D, 3. А F. Концентрации продуктов в смеси через 5 мин после начала реакции были равны: С B = 2 моль / л, C D = 1,5 моль / л, C F = 3 моль / л. Определить константы скорости k1, k2, k3, если период полураспада вещества А равен t ½ = 8 мин. 178. Для некоторой системы, в которой протекают конкурирующие необратимые реакции: 1. А + В ® D ; 2. А + С ® F ; при 25 0 С соотношение продуктов составило C D : C F = 1 : 5. При 60 0 С соотношение продуктов составило C D : C F = 1 : 3. Определить энергию активации реакции 2, если для первой реакции она составляет 30 кДж / моль. 179. Последовательная реакция А В С характеризуется следующими данными: при достижении максимума концентрации вещества В отношение концентраций С А / С В = 4 : 5, а время превращения вещества А на 25 % составляет 85 с. Определить значения констант скоростей k 1 и k 2. 180 . В системе осуществляется последовательная реакция Максимальная концентрация вещества В равно 0,77 [A] 0 и достигается через 170 мин после начала реакции. Рассчитать k 1 и k 2 . 181. Распад радиоактивного изотопа Zn 30 по схеме: Zn 30 Ga 31 Ge 32 характеризуется тем, что максимальное содержание радиоактивного изотопа галлия в образце достигается через 30,3 суток. Причем отношение числа атомов изотопа цинка к числу атомов изотопа галлия в это время оказывается равным 3,48. Определить периоды полураспада изотопов цинка и галлия. 182. Последовательная реакция первого порядка протекает по схеме: При 298 К k1 = 0,1 мин - 1; k2 = 0,05 мин - 1; начальная концентрация исходного вещества СA0 = 0,5 моль / л. Вычислить: 1. координаты максимума кривой С B = f (t); 2. Время достижения концентрации С A = 0,001 моль / л (продолжительность реакции А B); 3. концентрации С B и С D в момент окончания реакции А B. 183. Образец радиоактивного урана массой 200 г распадается по схеме: (над стрелками указаны периоды полураспада). Рассчитать массы нептуния и плутония через 10 мин. После начала распада. Определить максимальную массу нептуния, которая может быть получена из данного образца урана. 184. Образец радиоактивного урана массой 200 г распадается по схеме: где значения констант составляют k1 = 4,7 . 10 – 18 с – 1 и k2 = 1,381 . 10 – 11 с – 1 . Определить периоды полураспада урана и радия и максимальную массу, которая может быть получена из данного образца урана. 185. Был предложен следующий механизм термического разложения озона: О3 ® O 2 + O (k 1) O + O2 ® O3 (k – 1) O + O3 ® 2O2 (k 2) С помощью метода квазистационарных концентраций получить выражение для скорости распада, включающее константы k1, k - 1, k2 и концентрации О2 и О3. 186. Для реакции NO2Cl NO2 + 0,5 Cl2 предложен следующий двухстадийный механизм: 1. NO2Cl NO2 + Cl . (k 1 ); 2. NO 2 Cl + Cl . NO 2 + Cl 2. (k 2 ) Используя метод квазистационарных концентраций, вывести уравнение для скорости разложения NO2Cl. 187. В одной из теорий мономолекулярных реакций был предложен следующий механизм активации молекул (схема Линдемана): 1. А + А А* + А, (k 1 ) (активация) 2. А + А* А + А, (k - 1) (дезактивация) 3. А* В + D. (k2) (распад) Используя метод квазистационарных концентраций, вывести уравнение для скорости мономолекулярной реакции и определить порядок реакции при больших и малых концентрациях А. 188. Предложен следующий механизм для гомогенного пиролиза метана (М - инертная молекула): 1. CH4 + М ® CH3 . + H . + М; (k 1) 2. CH4 + CH3 . ® C2H6 + H . ; (k 2) 3. CH4 + H . ® CH3 . + H2 ; (k 3) 4. H . + CH3 . + M ® CH4 + M. (k 4) Вывести уравнение для скорости образования C2H6 на основе приведенного механизма, используя метод стационарных концентраций. Концентрации СН3 и Н очень малы, поэтому стационарны и не должны входить в уравнение. 189. Химическая реакция N2O N2 + 0,5 O2 протекает по следующему механизму (М – инертная частица): 1. N2O + М N2О* + М; (k 1) 2. N2O * N2 + O . ; (k 2) 3. N2O * + М N2О + М; (k 3) 4. N2O + О N2 + O2 ; (k 4) Считая концентрации N2O * и О . стационарными, найти выражение для скорости распада N2O.190. Дана схема цепной реакции: АН А . + Н . , (k 1) А . В . + С, (k 2) АН + В . А . + D, (k 3) А . + В . Р . (k 4) Используя метод квазистационарных концентраций, вывести уравнение для скорости образования продукта Р. 191. Вывести уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2 N2O 5 ( г) 4 NO2 ( г) + O2 ( г) при следующем механизме реакции (активные промежуточные частицы NO3 и NO): 1. N2O5 NO2 + NO3 ; (k 1) 2. NO 2 + NO 3 N 2 O 5 ; (k - 1) 3. NO 2 + NO 3 N O2 + O 2 + NO; (k 2) 4. NO + N 2 O 5 3 NO 2 . (k 3) 192. При изучении кинетики реакции SiH 4 (г) Si (т) + 2 H 2 (г) был установлен следующий механизм: 1. SiH4 SiH2 + 2 H2 ; (k 1) 2. SiH2 Si + H2; (k 2) 3. SiH2 + H 2 SiH4 ; (k 3) Используя метод квазистационарных концентраций, вывести уравнение для скорости разложения SiH4. 193. Для реакции нитрит - иона с кислородом предложен следующий механизм: 1. NO2 - + O2 ® NO3 - + O; (k 1) 2. NO2 - + O ® NO3- ; (k 2) 3. O + O ® O2; (k 3) Вывести уравнение для скорости образования иона NO3 -, используя метод квазистационарных концентраций. Упростить полученное выражение, предполагая, что реакция (3) гораздо медленнее реакции (2). 194. Предложен следующий механизм разложения азотной кислоты: 1. HNO3 ® HO + NO2; 2. HO+NO2 ® HNO3; 3. HO+HNO3 ® H2O + NO3. Предположив, что концентрация НО стационарна, вывести выражение для скорости разложения азотной кислоты. Как изменится приведенное выше уравнение, если предположить, что исчезновение NO2 происходит быстро? 195. Предполагают, что реакция разложения бромметана 2 CH3Br C2H6 + Br2 может протекать по следующему механизму: 1. CH3Br CH 3 . + Br . ; (k 1) 2. СН 3 . + CH3Br C2H6 + Br . ; (k 2) 3. Br . + CH3Br СН 3 . + Br2 ; (k 3) 4. 2 СН 3 . C2H6 . (k 4) Используя метод квазистационарных концентраций, вывести уравнение для скорости образования этана. 196. Термическое разложение углеводорода R 2 протекает последующему механизму: 1. R 2 2 R . ; (k 1) 2. R . + R 2 P B + R . ; (k 2) 3. R . P A + R . ; (k 3) 4. 2 R . P A + P B . (k 4) Здесь R 2, PA , PB - устойчивые углеводороды, R . и R . – радикалы. Найти зависимость скорости разложения R 2 от концентрации R 2. 197. Дана следующая схема разложения ацетальдегида: 1. СН3СНО СН 3 . + СНО . ; (k 1) 2. СН3 . + СН 3 СНО СН 4 + СН 2 СНО . ; (k 2) 3. СН2СНО . СН 3 . + СО; (k 3) 4. СН3 . + СН3 . С2Н6 ; (k 4) Используя приближение квазистационарных концентраций, вывести выражение для скорости образования метана и скорости расходования ацетальдегида. 198. Предполагают, что реакция образования фосгена СО + Cl2 СОCl2 может протекать по следующему механизму: 1. Cl2 2 Cl . ; (k 1) 2. 2 Cl . Cl 2 ; (k 2) 3. СО + Cl . СОCl . ; (k 3) 4. СОCl . СО + Cl . ; (k 4) 5. СОCl . + Cl 2 СОCl2 + Cl . . (k 5) Используя приближение стационарных концентраций, вывести выражение для скорости образования фосгена. 199. Предполагают, что распад вещества А 2 в растворителе RH протекает по следующему механизму: 1. А 2 2 А . ; 2. А . Р + В . ; 3. В . + RH BH + R . ; 4. R . + R . R – R. Используя приближение квазистационарных концентраций, вывести выражение для скорости образования продукта Р. 200. Для реакции синтеза иодоводорода из простых веществ H2 (г)+ I2 (г) ®2HI (г) предложен следующий механизм: 1. I2 ® 2 I ; (k 1) 2. 2I ® I2 ; (k 2) 3. 2I + H2 ® 2HI. (k 3) Используя квазиравновесное приближение, вывести уравнение для скорости образования HI. 201. Для реакции 2 NO + O 2 2 NO2 предложен следующий механизм: 1. 2 NO (NO) 2 ; ( k 1, k – 1) 2. (NO)2 + O 2 2 NO2. (k 2) Вывести уравнение для скорости образования NO2 , предполагая, что первая стадия – быстрая, а вторая – медленная. 7. Поверхностные явления. Адсорбция Адсорбцией называют самопроизвольное концентрирование веществ на поверхности раздела фаз. Вещество, которое адсорбирует другое вещество, называют адсорбентом. Для обозначения адсорбируемого вещества используют термин адсорбат. Адсорбция описывается уравнением Гиббса где C – равновесная концентрация адсорбата в объеме, - поверхностное натяжение. Это уравнение справедливо для всех видов адсорбции. В случае адсорбции газов уравнение Гиббса (23) приобретает следующий вид: где p – равновесное парциальное давление адсорбата в газовой среде. Для описания процесса адсорбции применяют также ряд других уравнений. Мономолекулярная адсорбция на однородной поверхности описывается уравнением Ленгмюра где K – константа адсорбционного равновесия 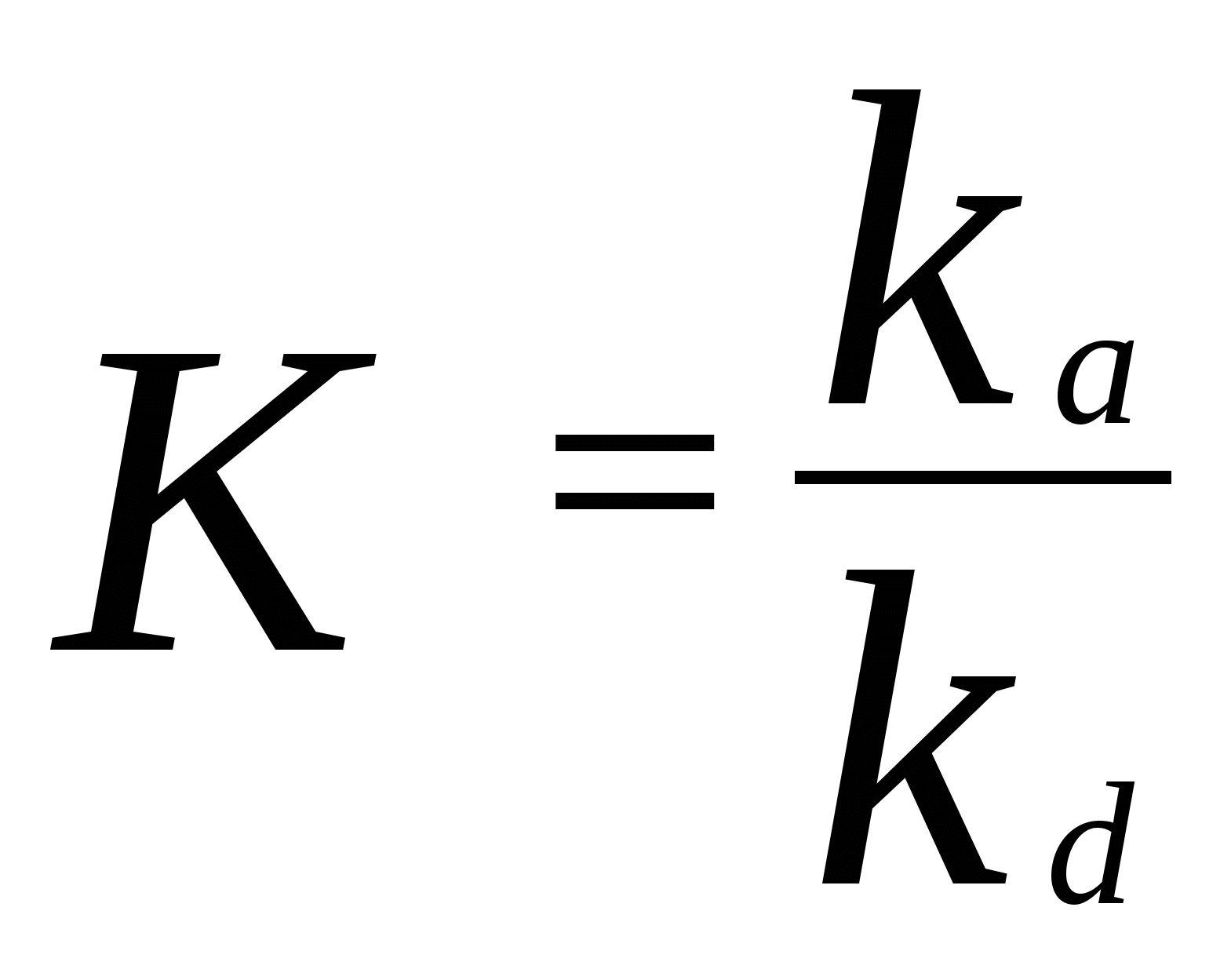 k a и k d – константы скоростей адсорбции и десорбции. Для мономолекулярной адсорбции газов уравнение Ленгмюра (24) имеет вид: Предполагая возможность идеального покрытия поверхности адсорбента мономолекулярным слоем адсорбата, по значениям площади сечения молекул адсорбата S 0 можно рассчитать предельную адсорбцию a : 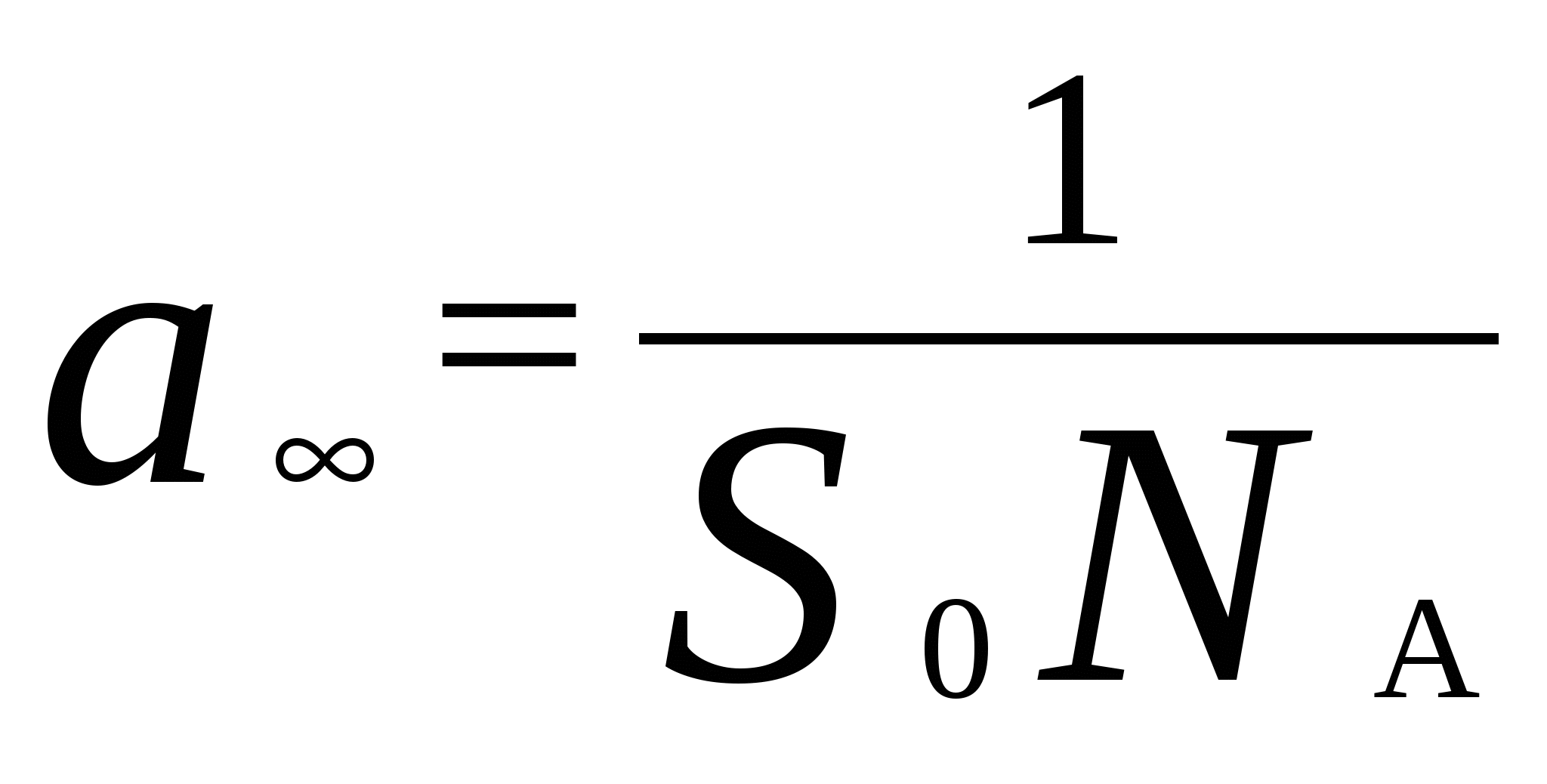 , ,где N A – число Авогадро. Предельную адсорбцию a можно определить по графику зависимости (С / Г) = f(C), полученной преобразованием уравнения изотермы адсорбции Ленгмюра: 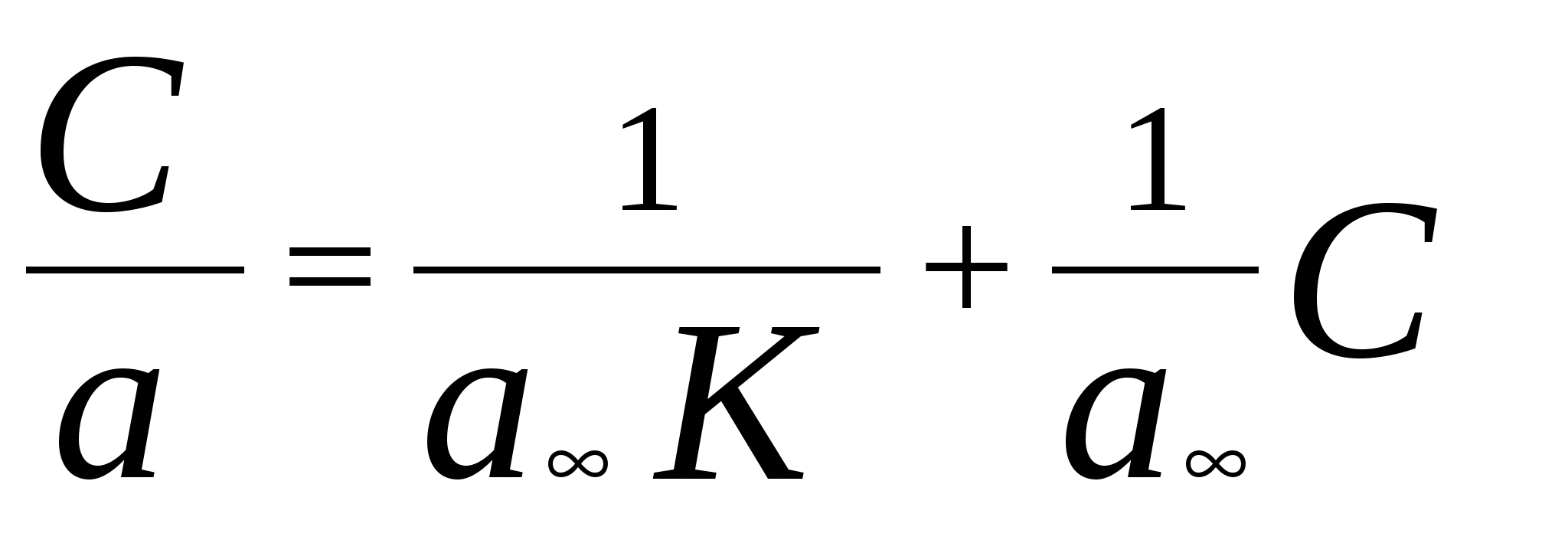 . .Зависимость адсорбции от концентрации адсорбата можно определить с помощью эмпирического уравнения Фрейндлиха где k, n – коэффициенты, определяемые экспериментально. Для этого прологарифмируем уравнение (25): Зависимость lg a - lg C характеризуется прямой линией, тангенс угла которой равен (1 / n), а отрезок, отсекаемый на оси ординат, равен lg k. Для адсорбции газов также справедливо уравнение Фрейндлиха, имеющее вид: Адсорбция на границе жидкость – газ Адсорбция приводит к изменению поверхностного натяжения жидкости . Вещества, снижающие в результате адсорбции поверхностное натяжение жидкости, называются поверхностно – активными (ПАВ). Вещества, поверхностное натяжение растворов которых по отношению к растворителю увеличивается, называются поверхностно – инактивными (ПИВ). Способность вещества при адсорбции на границе раздела фаз снижать поверхностное межфазовое натяжение в зависимости от его концентрации в объеме называют поверхностной активностью. Поверхностная активность равна: 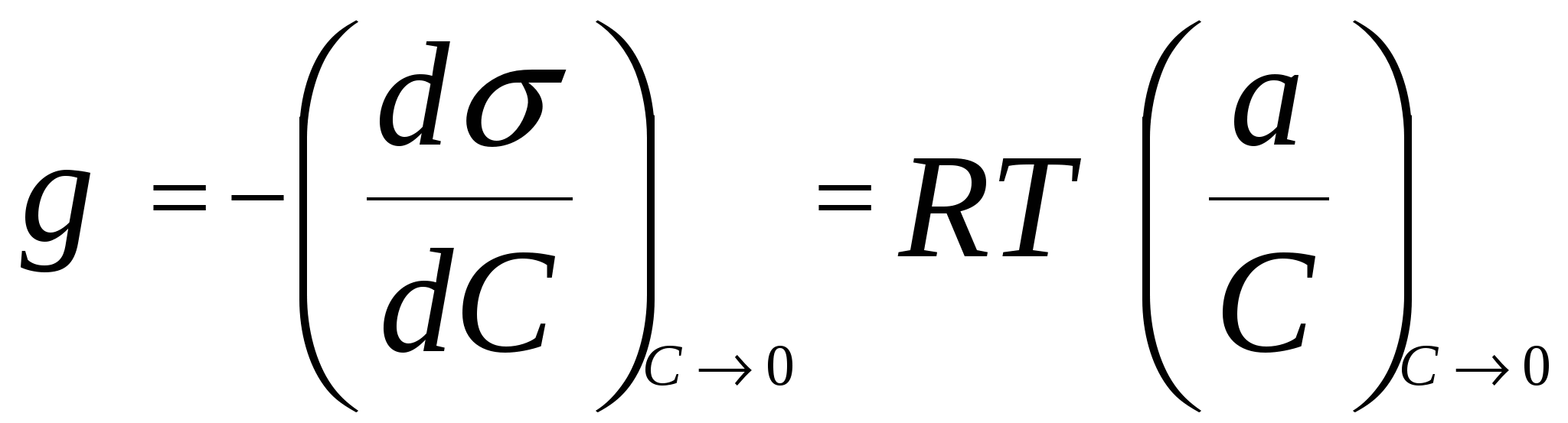 . .В случае адсорбции ПАВ g 0 и (d / dC) 0. Снижение поверхностного натяжения в результате адсорбции ПАВ на границе раздела жидкость – газ можно определить при помощи уравнения Шишковского: где A, B – эмпирические коэффициенты. Пример 20. При Т =298 К поверхностное натяжение (σ) воды равно 72,75 мДж / м2 Для 0,05 М раствора уксусной кислоты поверхностное натяжение равно 71, 2 мДж / м2. Рассчитать адсорбцию уксусной кислоты на поверхности раствора. Решение. Воспользуемся уравнением Гиббса: Заменим производную dσ / dC отношением Δσ / ΔC , так как по условию дано только два значения поверхностного натяжения. Тогда: g = (Δ σ / Δ С ) = (71,2 – 72,75) . 10 – 3 / 0,05 . 10 3 = 31. 10 – 6 (Дж . м) / моль После подстановки в уравнение Гиббса получим: a = 0,05 . 10 3 · 31· 10 - 6 / 8,314· 298 = 0,626· 10 - 6 моль / м 2 Пример 21. По приведенным результатам исследования адсорбции пропана на активном угле, проведенного при 20 0С, составьте уравнение изотермы адсорбции Ленгмюра и определите удельную поверхность угля. Площадь сечения молекул пропана принять равной 1,86 . 10 – 19 м 2.
Решение. Воспользуемся линейной формой уравнения Ленгмюра в виде: 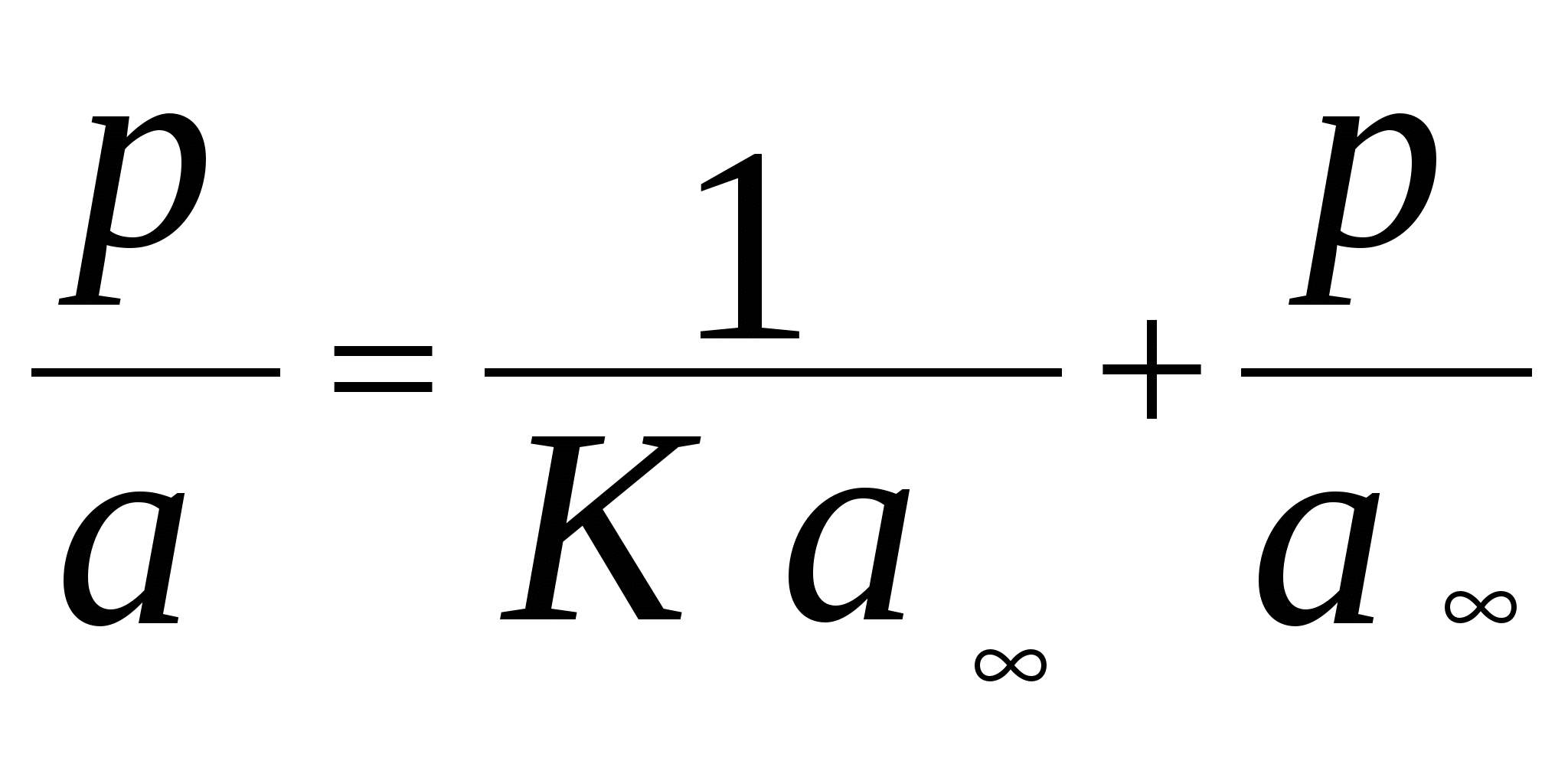 . .Составляем вспомогательную таблицу
Данные таблицы представим в виде графика p / a = f(p). Угловой коэффициент равен 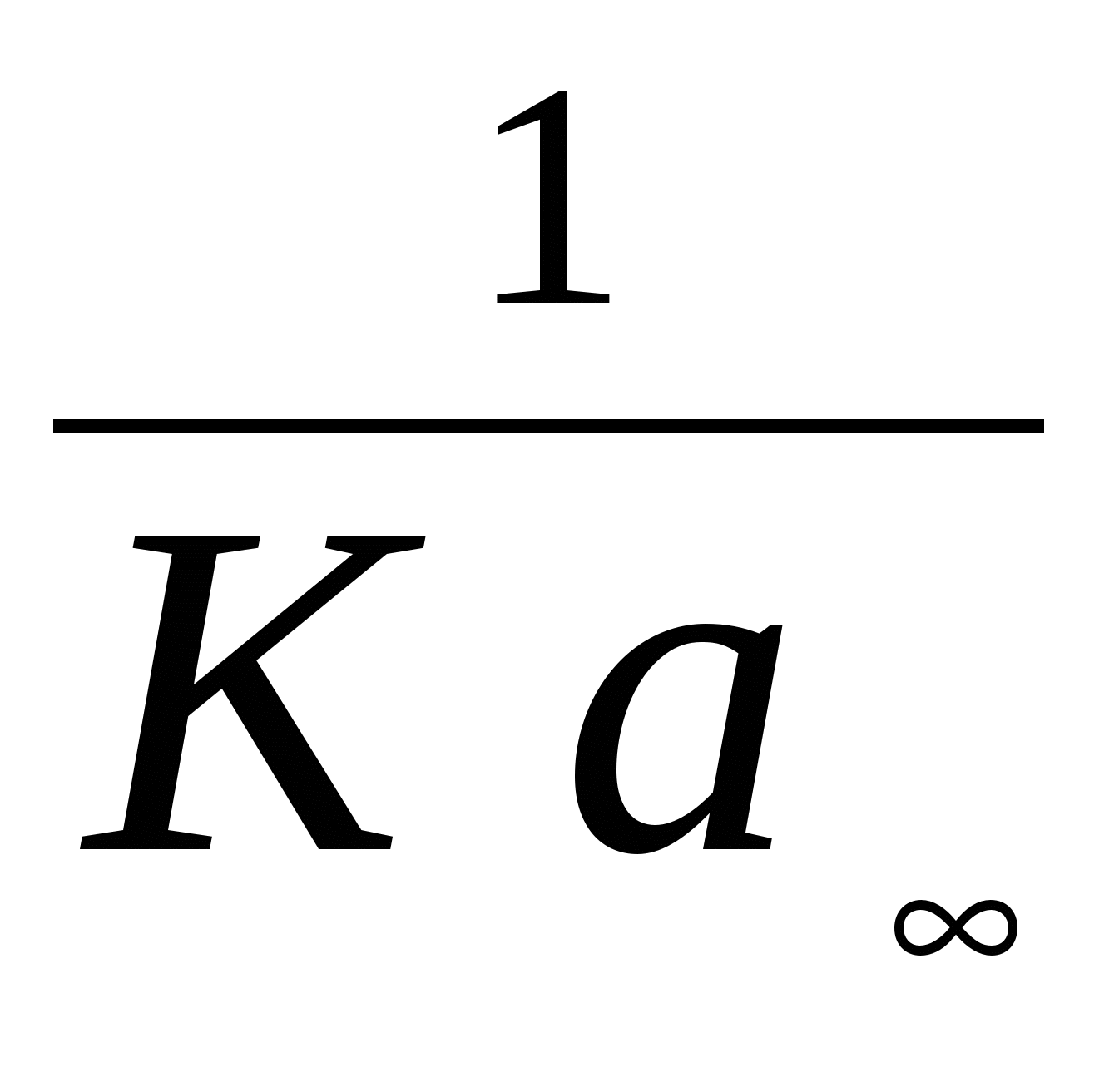 . Получаем следующие результаты: . Получаем следующие результаты: Более точные значения параметров S уд = a S 0 N A = 2,74 моль/кг . 1,86 . 10 – 19 м 2 . 6,022 . 10 23 моль – 1 = 30,7 . 10 4 м 2 /кг. Задачи 202. При изучении адсорбции уксусной кислоты на угле при 25 0С были получены следующие данные:
Определить графически константы в уравнении изотермы адсорбции Фрейндлиха. 203. При изучении адсорбции уксусной кислоты на угле при 25 0С были получены следующие данные:
Определить графически константы в уравнении изотермы адсорбции Фрейндлиха. 204. По уравнению Фрейндлиха вычислить равновесную концентрацию уксусной кислоты, если 1 г угля адсорбирует 3,76 ммоль СН3СООН. Константа k = 2,82; n =2,44. 205. При изучении адсорбции ацетона древесным активированным углем при 20 0С были получены следующие данные:
Определить графически постоянные уравнения изотермы Фрейндлиха и рассчитать количество ацетона, адсорбируемое 1 г угля при равновесной концентрации ацетона 125 ммоль/л. 206. Определить постоянные уравнения Фрейндлиха, используя следующие данные для адсорбции при 231 К углекислого газа на угле:
207. По приведенным данным об адсорбции СО2 на угле марки С при (- 42 0 С) определить константы в уравнении Фрейндлиха.
208. По приведенным результатам адсорбции амилового спирта на активном угле марки СКТ при 20 0С составить уравнение изотермы адсорбции Ленгмюра и определить удельную поверхность угля. Площадь поперечного сечения молекул амилового спирта принять равной 1,6 . 10 – 19 м 2.
209. По приведенным данным для адсорбции уксусной кислоты на древесном угле при 25 0С составить уравнение изотермы адсорбции Фрейндлиха.
210. По приведенным результатам адсорбции СО2 на угле марки С при (- 42 0 С) составить уравнение изотермы адсорбции Фрейндлиха.
Задачи № 211 - 214. По приведенным данным: а) построить изотерму адсорбции; б) проверить применимость уравнения Ленгмюра; в) если изотерма не соответствует уравнению Ленгмюра, составить уравнение адсорбции Фрейндлиха. 211. Адсорбция H2S на цеолите CaX при 25 0С:
212. Адсорбция H2S на цеолите NaA при 25 0С:
213. Адсорбция H2S на цеолите CaА при 25 0С:
214. Адсорбция H2S на цеолите NaХ при 25 0С:
Задачи №№ 215 - 221. Вычислить адсорбцию (a) моль/м2 данного вещества по приведенным данным поверхностного натяжения водного раствора и воды ():
Задачи № 222 - 226. При адсорбции указанных газов на активированном угле получены следующие результаты (см. табл.). Вычислить постоянные в уравнении Лэнгмюра для газовой адсорбции.
Задачи № 227 - 229. Построить изотерму поверхностного натяжения, используя значения поверхностных натяжений водных растворов данных веществ при указанной температуре (см.табл.), если поверхностное натяжение воды при 293 К равно 72,75 м Дж / м2, а при 298 К – 71,96 м Дж/м 2. Определить графически адсорбцию вещества при указанной концентрации.
№ 230. По приведенным результатам массовой адсорбции пентанола на активированном угле при температуре 20°С построить изотерму адсорбции и составить уравнение адсорбции.
№ 231 - 236. Определить поверхностную активность вещества по указанным данным.
237 - 240. Определить площадь занимаемую молекулой вещества (указанного в табл.) в насыщенном адсорбционном слое активированного угля.
ЛИТЕРАТУРА 1. Краткий справочник физико-химических величин / Под. ред. А. А. Равделя и А.М. Пономаревой. Л.: Химия, 1983. 2. Д. Сталл, Э. Вестрам, Г. Зинке. Химическая термодинамика органических соединений. М.: Мир, 1971. 3. Физическая химия т.1, т. 2 / К.С. Краснов, Н.К. Воробьев, И. Н. Годнев и др. М.: Высшая школа, 1995. 4. И.В. Кудряшов, Г.С. Каретников «Сборник примеров и задач по физической химии»,1991, Москва, «Высшая школа». 5. Задачи по физической химии / В. В. Еремин, С. И. Каргов, И. А. Успенская и др. – М.: Изд-во «Экзамен», 2003. – 320 с. 6. Бадаев Ф. З., Батюк В. А. Цепные реакции. Москва, Изд-во МТГУ, 1995. 7. Химическая термодинамика. Методические указания. / Е. Е. Гончаренко, В. А. Батюк, Н. М. Елисеева и др. М.: Изд-во МГТУ, 1994. Содержание1. Зависимость термодинамических функций от температуры 2. Фазовое равновесие в однокомпонентных системах3. Закон распределения. Экстракция 4. Термодинамика растворов неэлектролитов5. Растворы сильных электролитов 6. Химическая кинетика сложных реакций 7. Поверхностные явления. Адсорбция ЛИТЕРАТУРА |
