ДЗФКХ07. Методические указания к решению задач домашнего задания по курсу Физическая и коллоидная химия Москва 2005
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
Московский государственный технический университет им. Н. Э. Баумана Методические указания к решению задач домашнего задания по курсу «Физическая и коллоидная химия» Москва 2005 1. Зависимость термодинамических функций от температуры Расчет стандартной энтальпии r H 298 реакции: 1А1 + 2А2 = 3 A3 + 4 А4, производится следующим образом: где f H 298 (А i ) – стандартная энтальпия образования вещества. Если химический процесс протекает при стандартных условиях и данной температуре Т, изменение энтальпии r H 0T в результате реакции рассчитывается по уравнению Кирхгофа в интегральной форме Температурная зависимость теплоемкостей веществ при Т 200 К представляется в виде ряда: Тогда уравнение (3) примет вид где 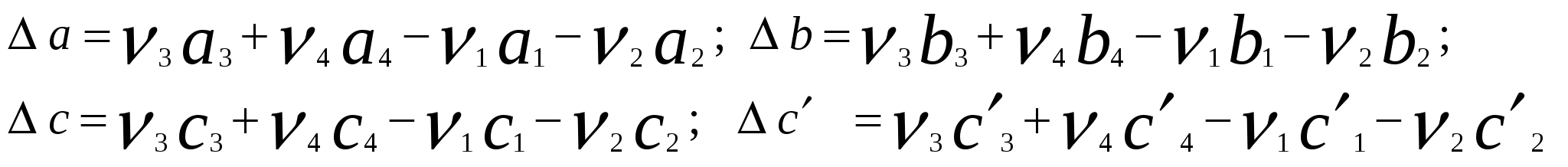 С учетом температурных рядов для теплоемкостей веществ расчет r H 0T производится по формуле: Для упрощения расчета теплового эффекта объединим величину r Н º298 и все слагаемые в уравнении (5), содержащие множитель 298, в одно: r Н º298 - a 298 - Подставив в уравнение (5) величину rН из (6), получим: r Н ºТ = rН + a Т + где r Н – эмпирическая постоянная для данной реакции, размерность которой совпадает с размерностью теплового эффекта. Пример 1. Получить выражение r Н ºТ = T) и вычислить r Н º1000 для реакции СН4 (г) + 2Н2О (г) = СО2 (г) + 4Н2 (г). Решение. В соответствии с уравнением (6) сначала вычисляем тепловой эффект реакции r Н º298 и алгебраические суммы a, b, cПользуясь справочником [1], находим: r Н º298 = 4 fН º298(Н2) + fН º298(СО2) - fН º298(СН4) – 2 fН º298(Н2О) = = 4 . 0 + (- 393,51) – 74,85 – 2 . (- 241,84) = 165,02 кДж/моль, С рº (СО2) = 44,14 + 9,04·10 – 3 Т + 8,53 ·10 5 · Т - 2 , С рº (Н2) = 27,28 + 3,26·10 – 3 Т + 0,502·10 5 Т – 2, С рº (Н2О) = 30 + 10,71·10 - 3 Т + 0,33·10 5 Т – 2, С рº (СН4) = 17,45 + 60,46·10 – 3 Т + 1,117 ·10 - 6 · Т 2 . Отсюда получаем a = 44,14 + 4 . 27,28 – 2 · 30 – 17,45 = 75,81 Дж/(моль . K). Аналогично вычисляем: b = - 59,8 · 10 - 3 Дж/(моль·K 2 ), c = 9,87 · 105 Дж ·K/моль, c·10 – 6 Дж / (моль . К 3). Подставив вычисленные величины r Н º298, a, b, c,cв уравнение (6), получим r Н = 148406,24 Дж/моль. В соответствии с (7) будем иметь выражение, удобное для расчетов в широком интервале температур: r Н 0 Т = 148406,24 + 75,81Т - 29,905· 10 – 3 Т 2 - 9,87 · 10 5 Т – 1 – 0,37 . 10 - 6 . Затем из полученного уравнения r Н ºТ = T) вычисляем: r Н º1000 = 192959,24 Дж/моль = 192,96 кДж /моль. Расчет теплового эффекта по уравнению Кирхгофа (7) с использованием температурных рядов для теплоемкостей является относительно трудоемким. Вычисление теплового эффекта реакции по уравнению Кирхгофа (2) значительно упрощается, если для приближенных расчетов воспользоваться вместо температурных рядов стандартными теплоемкостями веществ (C 0p 298). Подставляя в уравнение (2) вместо С р величину: после интегрирования от 298 до Т получим: r Н ºТ = r Н º 298 + C 0p 298 (Т - 298) , (9) где С 0р (А i) – стандартная теплоемкость i -го вещества. Пример 2. Рассчитать тепловой эффект rН º Т реакции СН4 (г) + 2Н2О (г) = СО2 (г) + 4Н2 (г) при 1000 К, используя стандартные теплоемкости веществ. Решение. Пользуясь справочником [1], находим стандартные теплоемкости веществ: С 0р 298(СО2) = 45,52 Дж/(моль·К), С 0р 298(Н2) = 29,28 Дж/(моль·К), С 0р 298 (Н2О) = 36,02 Дж/(моль·К), С 0р 298 (СН4) = 49,52 Дж/(моль·К). По уравнению (8) вычисляем: C 0p 298 = 45,52 + 4 . 29,28 – 2 · 36,02 - 49,52 = 41,08 Дж/(моль·К) . Для исследуемой реакции r Н º 298 = 165020 Дж/моль. В соответствии с (9): r Н º1000 = 165020 + 41,08 . (1000 - 298) = - 56236 Дж/моль = 193858,16 Дж /моль. Расхождение между величинами теплового эффекта, вычисленными по уравнениям (7) и (9), менее 1%. Третий метод вычисления теплового эффекта реакции при Т > 298 К основан на использовании табличных данных для теплот образования f Н º (298) и высокотемпературных составляющих [Н º T – Н º 298] участников реакции. Выражение для расчета rН º Т = T) выглядит так: r Н º T = r Н º 298+ r [Н º T – Н º 298]. (10) Стандартный тепловой эффект реакции вычисляют по 1-ому или 2-ому следствиям закона Гесса. Второе слагаемое в уравнении (10) определяется из соотношения: r[Н ºT – Н º298] = 3 [Н ºT – Н º298] А3 + 4 [Н ºT – Н º298] А4 – 1[Н ºT – Н º298] А1 - 2 [Н ºT – Н º298] А2 . (11) Пример 3. Вычислить тепловой эффект реакции: СН4 (г) + 2Н2О (г) = СО2 (г) + 4Н2 (г) при 1000 К. Решение. По уравнению (11) определяем: r[Н ºT – Н º298] = [Н ºT – Н º298] СО2 + 4 [Н ºT – Н º298] H2 –[Н ºT – Н º298] СН4 – 2 [Н ºT – Н º298] H2О . По табличным данным для [Н ºT – Н º298] для веществ (см. [2]), находим: r [Н ºT – Н º298] = 33388,3 + 4 . 20677,3 – 38492,8 – 2·26024,5 = 25555,7 Дж/моль. Для исследуемой реакции r H º298 = 165020 Дж/моль (см. пример 1). По уравнению (10) вычисляем: r H º 1000 = 165020 + 25555,7 = 190575,7 Дж/моль = 190,6 кДж/моль. Изменение энтропии при обратимом процессе определяется уравнением: Если система нагревается от температуры Т1 до Т2 при постоянном давлении, то 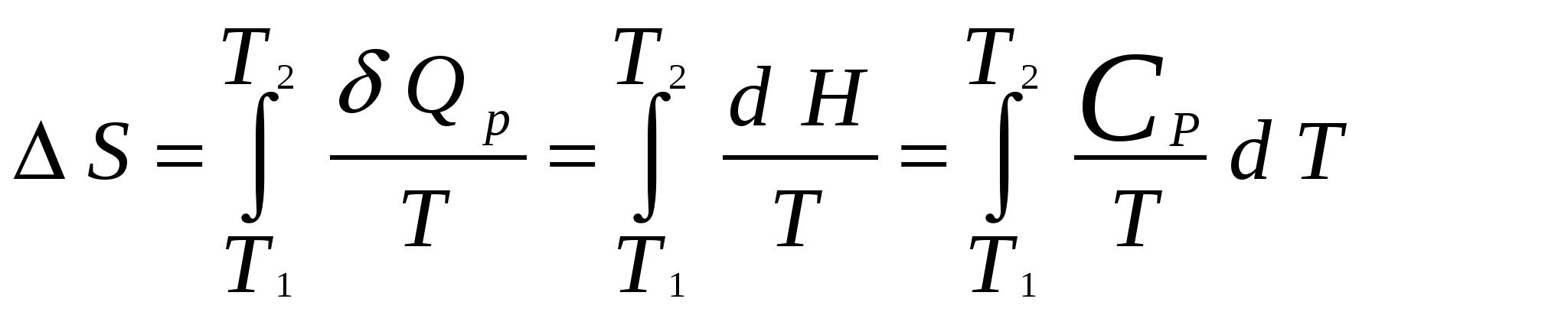 . (12) . (12)Изменение энтропии при изотермических процессах, в частности при фазовых превращениях, определяется уравнением: Уравнения (12) и (13) дают возможность рассчитать изменение энтропии в результате изобарного перехода любого вещества из твердого состояния при исходной температуре Т1 в парообразное при конечной температуре Т2: 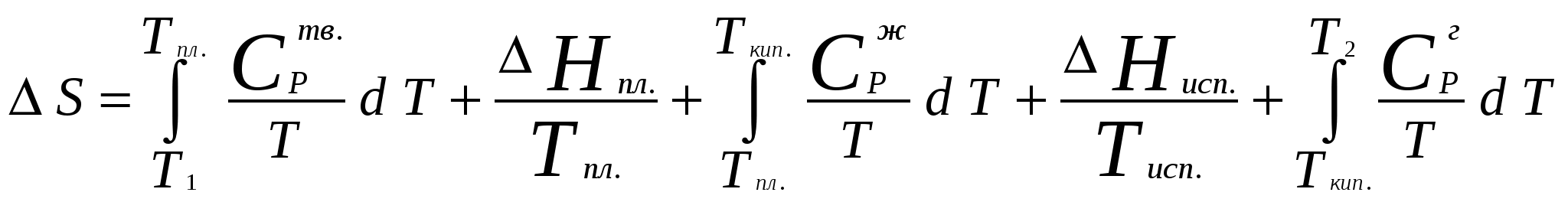 . . Расчет стандартной энтропии реакции r S 298 производится по формуле: где S 298 (A i )– стандартная абсолютная энтропия вещества; i – коэффициенты в уравнении реакции. Изменение энтропии в результате реакции r S T при стандартных условиях и данной температуре Т вычисляется с учетом зависимостей теплоемкостей веществ от температуры: 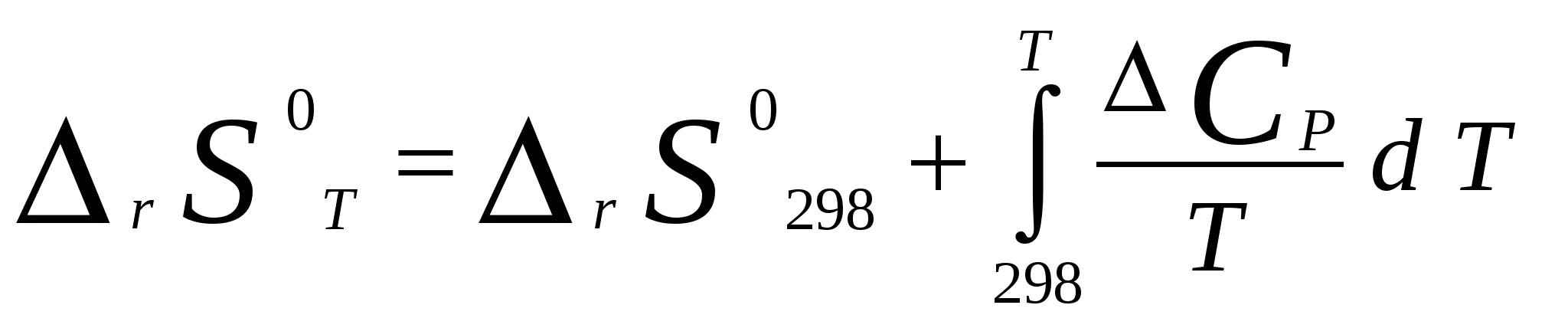 , (14) , (14)где С р определяется уравнением (4). Если теплоемкости веществ задаются температурными рядами, тогда изменение энтропии для химической реакции равно: Расчет стандартной энергии Гиббса и константы равновесия по методу Темкина – Шварцмана Изменение стандартной энергии Гиббса в результате реакции равно 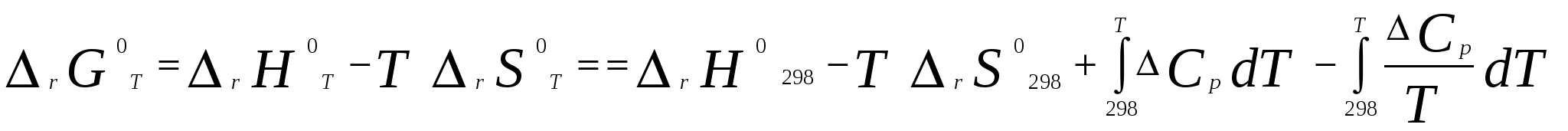 . (15) . (15)С учетом того, что Cp определяется уравнением (4), уравнение (15) можно преобразовать в форму, удобную для расчета: 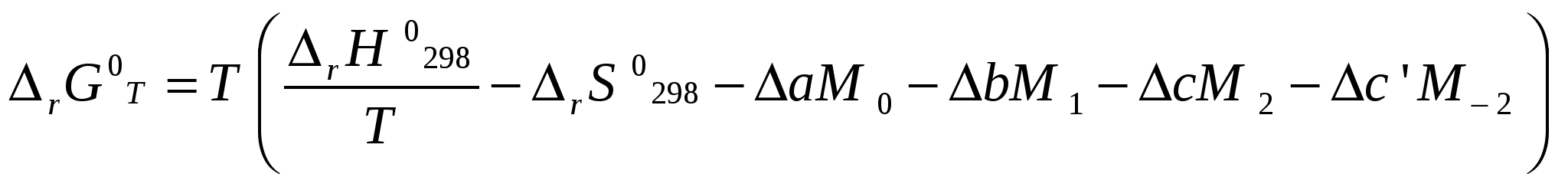 , , где 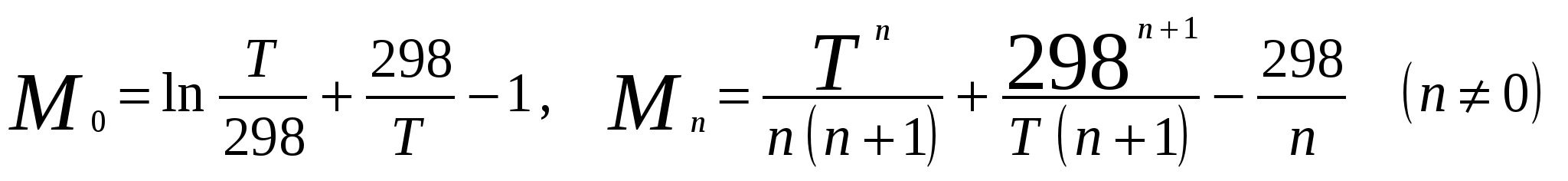 . .Коэффициенты M0, M1,…, Mn приведены в справочнике [1]. Логарифм константы равновесия равен 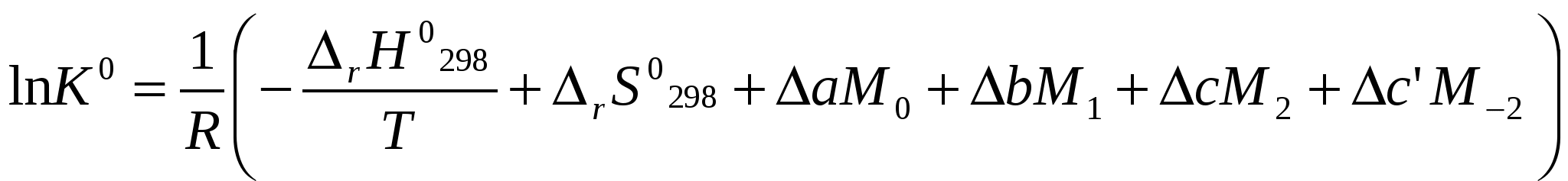 . (16) . (16)Пример 4. Определить К 0при 900 К для реакции СН4 (г) + 2Н2О (г) = СО2 (г) + 4Н2 (г). Решение. Пользуясь справочником [1], находим r H º298 = 165020 Дж/моль; r S 0 298 = S 0 298(CO2)+ 4 S 0 298(Н2) - S 0 298(CН4) – 2 S 0 298(Н2О) = =213,66 + 4130,52 – 186,27 2188,72 = 172,33 Дж / К; При 900 К величины Mn имеют следующее значение: M0 = 0,4361; M1 = 0,2012 10 3; M2 = 0,1004 10 6 ; M – 2 = 0,2521 10 - 5. Подставляя эти значения в уравнение (16) и используя результаты, полученные в примере 1, получаем ln K 0 (900) = + (- 1,117 . 10 – 6 ) . 0,1004 . 10 6 + 9,87 . 10 5 . 0,2521 . 10 – 5 ] = 1,49; K 0 (900) = 4,4. Расчет изменения стандартной энергии Гиббса и константы равновесия с помощью функций приведенных энергий Гиббса веществ Под стандартной приведенной энергией Гиббса, или стандартным приведенным термодинамическим потенциалом, понимают функцию 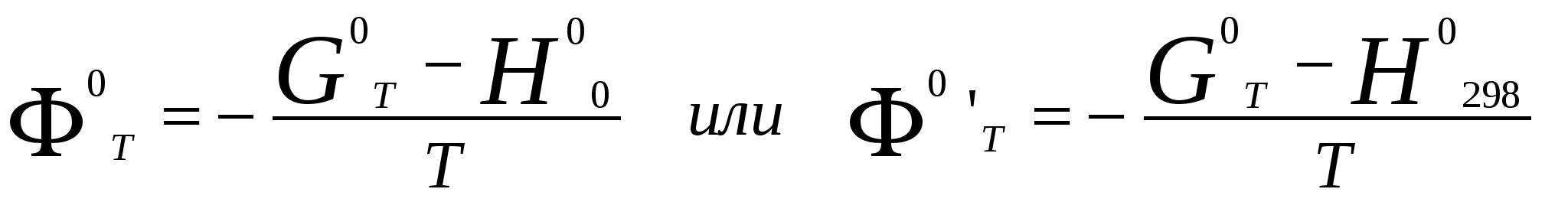 где G T - стандартное значение энергии Гиббса при температуре Т; H 0 и H 298 – стандартные значения энтальпии при 0 и 298 К соответственно. Стандартная энергия Гиббса равна 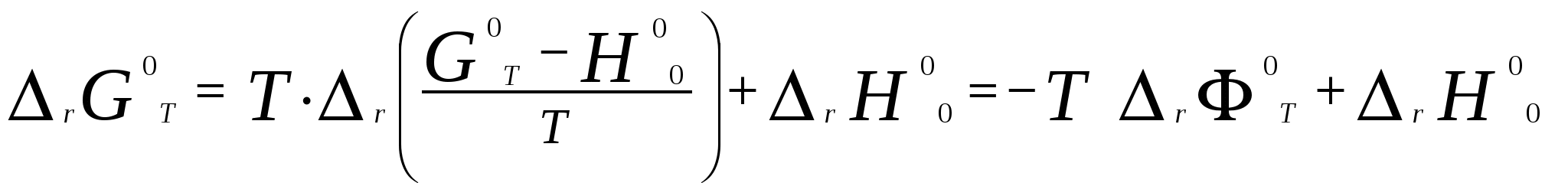 , ,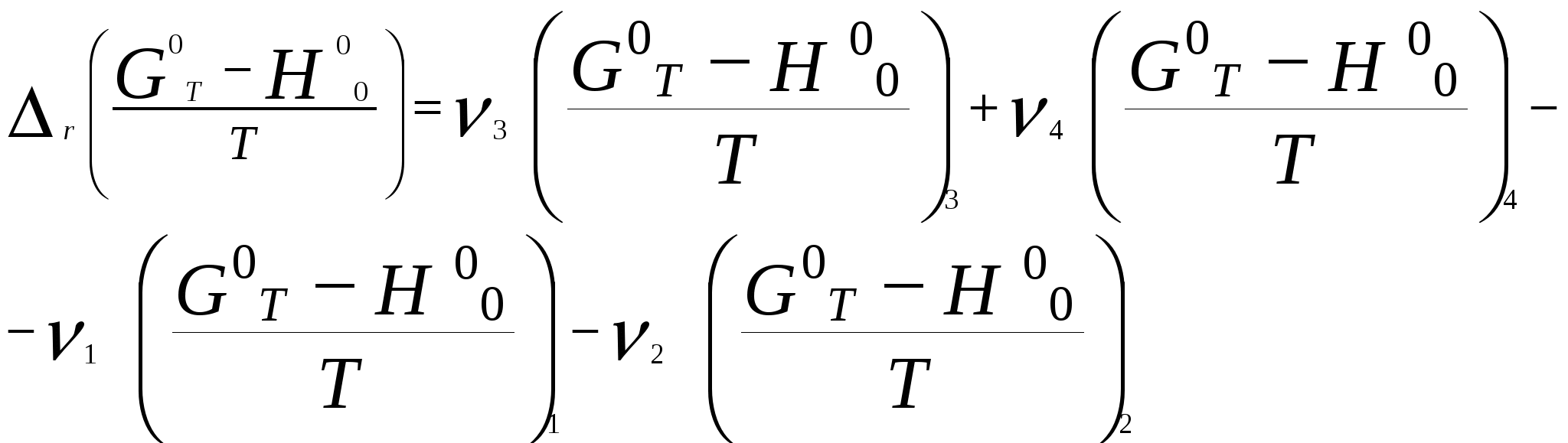 Логарифм стандартной константы равновесия реакции равен 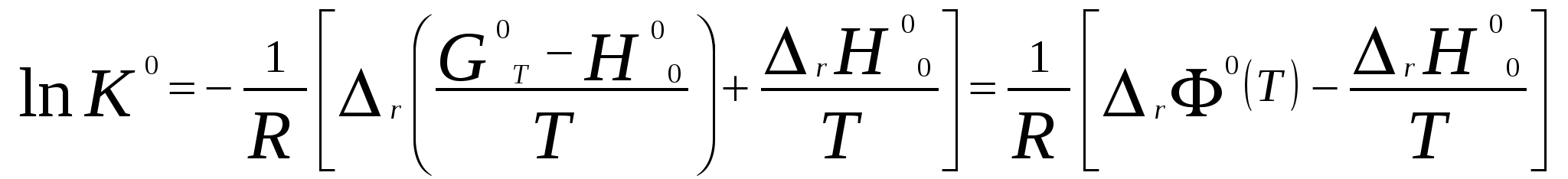 . .Для температуры 298 К эта формула имеет вид: 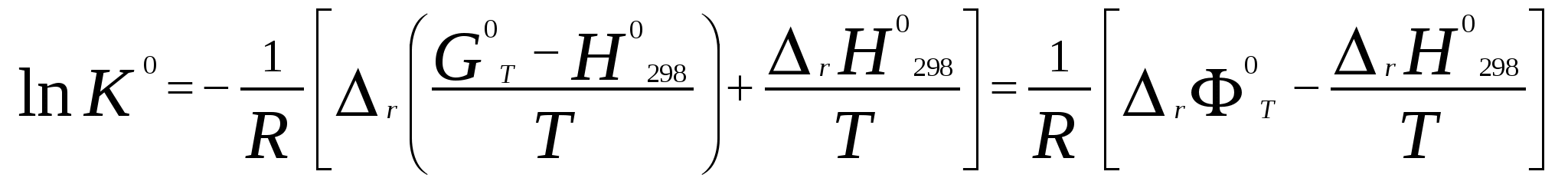 . .Е сли стандартные энтальпии образования веществ при 0 К отсутствуют, то вычисление r H 0 0 можно осуществить на основании табличных данных для стандартных энтальпий образования f H 0298 и высокотемпературных составляющих энтальпий [H 0T – H 0298] при 298 К для каждого реагента: Задачи В задачах №№ 1 – 45 для данных химических реакций выполните следующие задания (необходимые данные возьмите из справочника): 1. Учитывая зависимости теплоемкостей веществ от температуры, вычислите значения r H 0T в интервале температур 300 – 1000 К с шагом 100 K. Выразите уравнением зависимость rH 0T от температуры. Постройте график зависимости rH 0T = f (T). 2. Используя значения стандартных теплоемкостей веществC 0p 298, рассчитайте r H 0T при температуре Т. Сравните значения r H 0T для этой температуры, рассчитанные двумя методами. 3. Учитывая зависимости теплоемкостей веществ от температуры, вычислите значения r S 0T в интервале температур 300 – 1000К с шагом 100 K. Постройте график зависимости r S 0T = f (T). 4. Вычислите значения r G 0 T в интервале температур 300 – 1000 К с шагом 100 K по методу Темкина Шварцмана. Постройте график зависимости r G 0 T = f (T). 5. Рассчитайте значение константы равновесия К 0 (Т) при температуре Т, пользуясь методом Темкина Шварцмана. 6. Используя значения функций приведенной энергии Гиббса 0 T и 0 T определить константу равновесия при температуре Т. Сравните результаты расчетов двумя методами. 7. Проанализируйте результаты термодинамических расчетов и определите, каким образом можно уменьшить выход экологически вредных продуктов реакции. При каких условиях следует проводить процесс?
|
