ДЗФКХ07. Методические указания к решению задач домашнего задания по курсу Физическая и коллоидная химия Москва 2005
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
4. Термодинамика растворов неэлектролитовЗависимость между давлением насыщенного пара данного компонента над раствором piи его мольной долей xi устанавливается законом Рауля где pi - давление насыщенного пара над чистым компонентом. В идеальных растворах закон Рауля выполняется для обоих компонентов во всем интервале составов.Для бинарного раствора парциальные давления компонентов A и B определяются законом РауляОбщее давление пара над раствором так как Соотношение между составом пара и жидкости в системах, подчиняющихся законам идеальных растворов, может быть выражено через давление насыщенных паров чистых компонентов и общее давление. Согласно закону Рауля и следствию из закона Дальтона Отсюда следует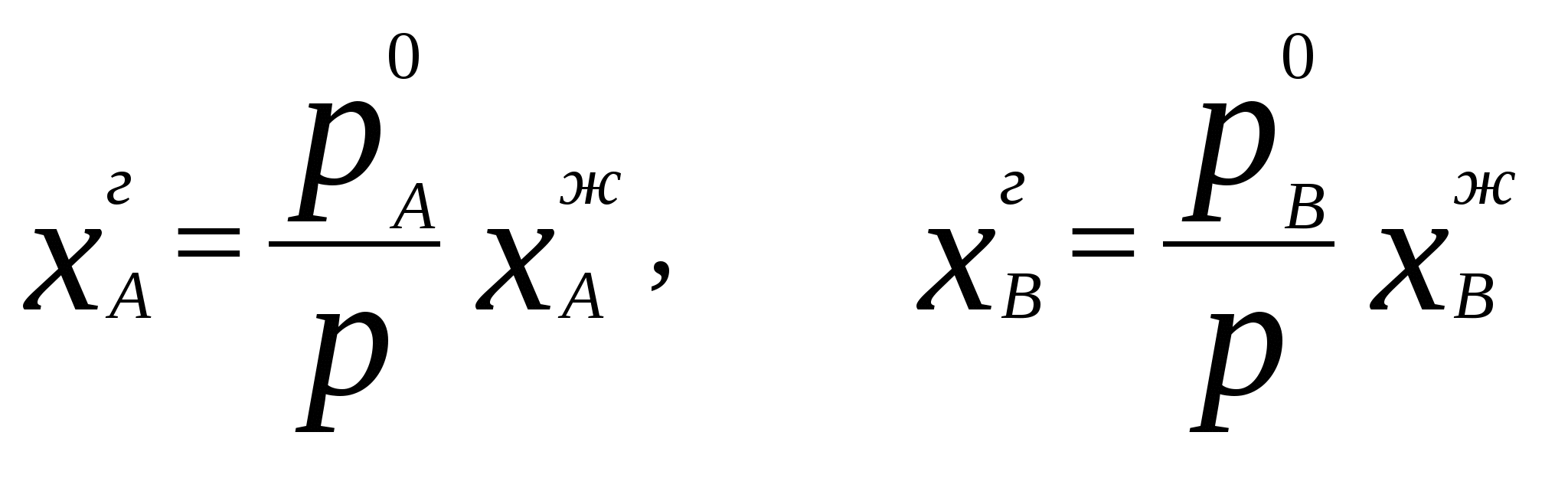 . .В реальных предельно разбавленных растворах для растворителя выполняется закон Рауля, а для растворенного вещества выполняется закон Генри: где K Г - константа Генри. Парциальные молярные величины Парциальной молярной величиной (пмв) данного компонента называют частную производную от экстенсивного свойства раствора (g) по числу моль этого компонента (ni ) при постоянстве температуры, давления и числа моль всех остальных компонентов: 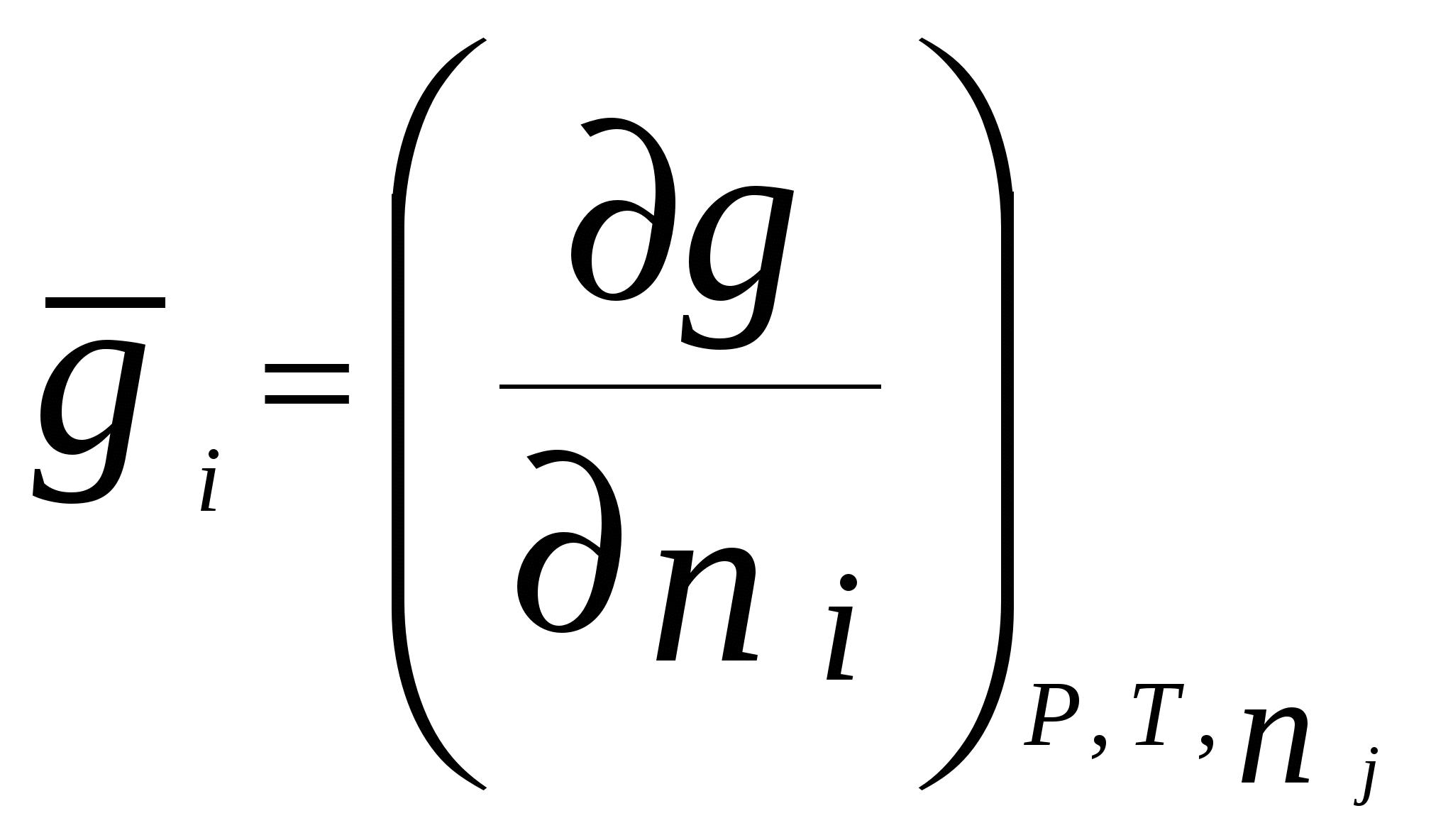 . .Парциальная молярная величина ( Общее значение свойства g выражается суммой вкладов всех компонентов (первое уравнение Гиббса Дюгема): Парциальные молярные величины при постоянных р и Т связаны вторым уравнением Гиббса Дюгема: Химический потенциал. Активность. Коэффициент активности Химический потенциал i - го компонента для идеальных растворов определяется уравнением: где xi – молярная доля i- го компонента; i(T) – химический потенциал чистого компонента при р =1,013.105 Па и xi = 1. В случае реального раствора где ai – активность i- го компонента. Активность данного компонента в реальном растворе определяется уравнением: 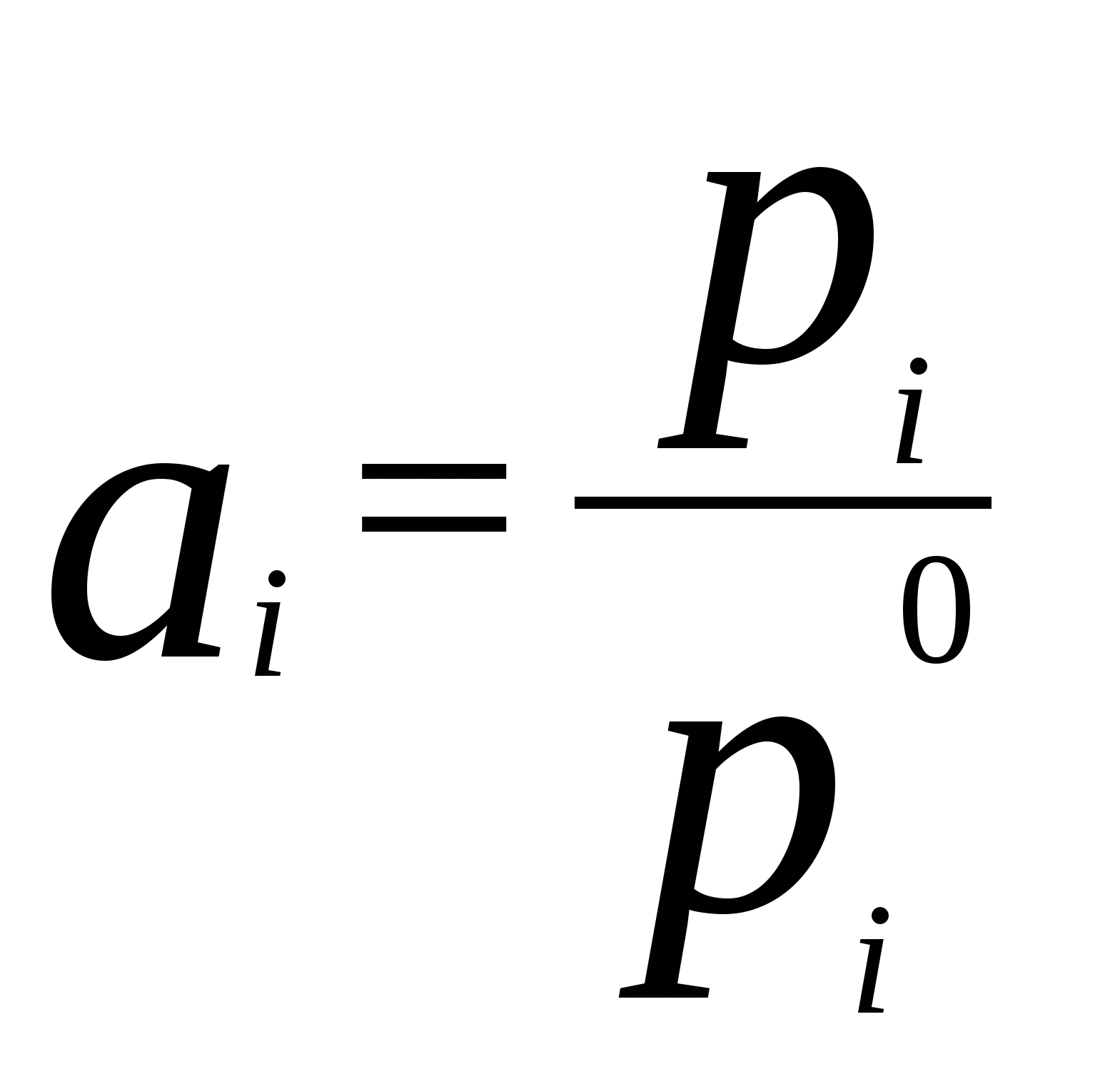 , ,где pi - давление насыщенного пара над чистым компонентом. Коэффициент активности i равен 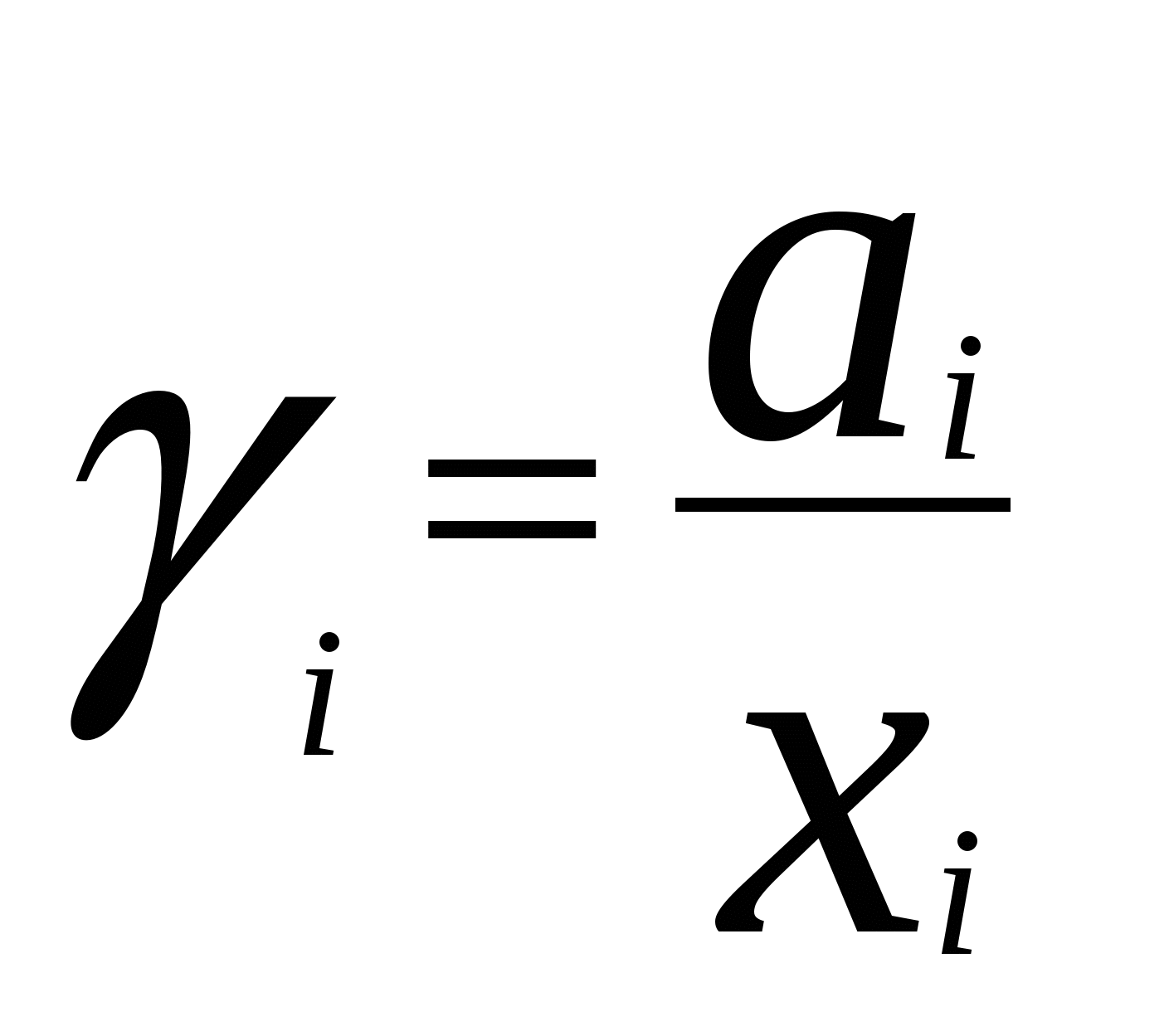 , ,где xi – мольная доля i - го компонента. Коллигативные свойства растворов Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными свойствами. К ним относятся: понижение давления пара над раствором, повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем, осмотическое давление. Повышение температуры кипения разбавленного раствора, содержащего нелетучее растворенное вещество, пропорционально моляльной концентрации этого вещества m: где KЭ- эбулиоскопическая константа растворителя: 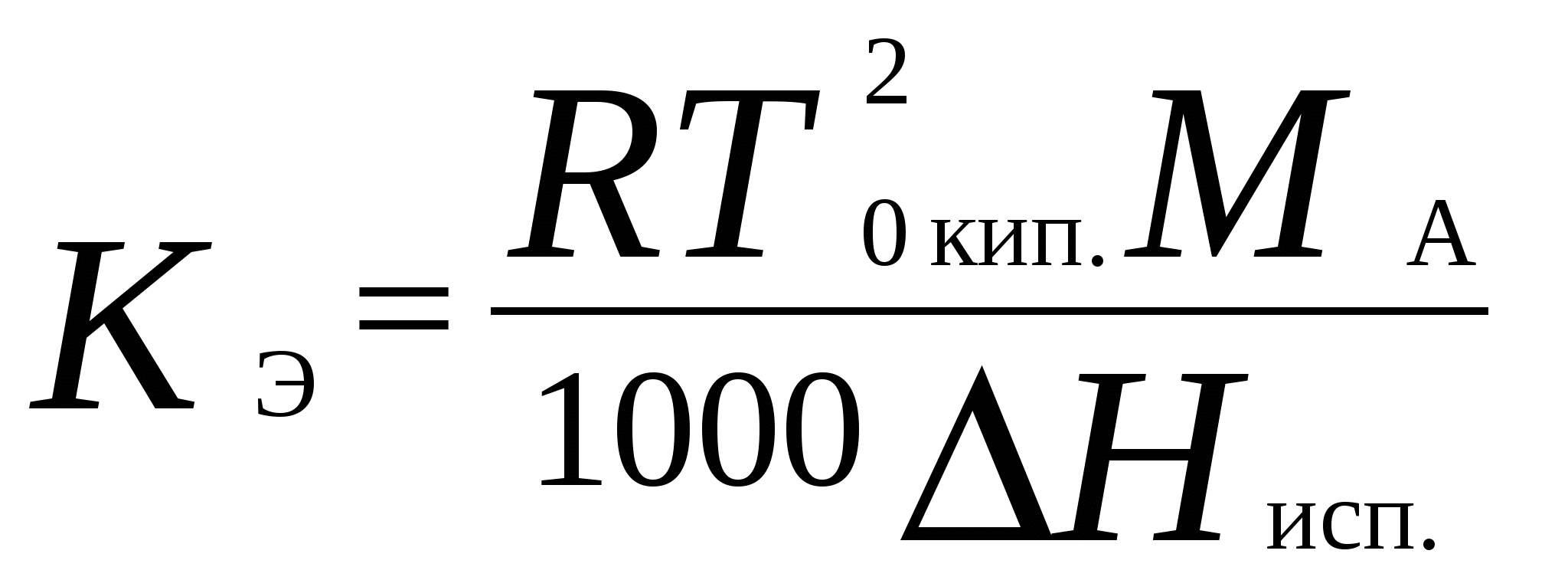 , ,Т0 кип. – температура кипения чистого растворителя, M A – молярная масса растворителя. Для понижения температуры кристаллизации раствора справедливо следующее соотношение: где KК– криоскопическая константа растворителя: 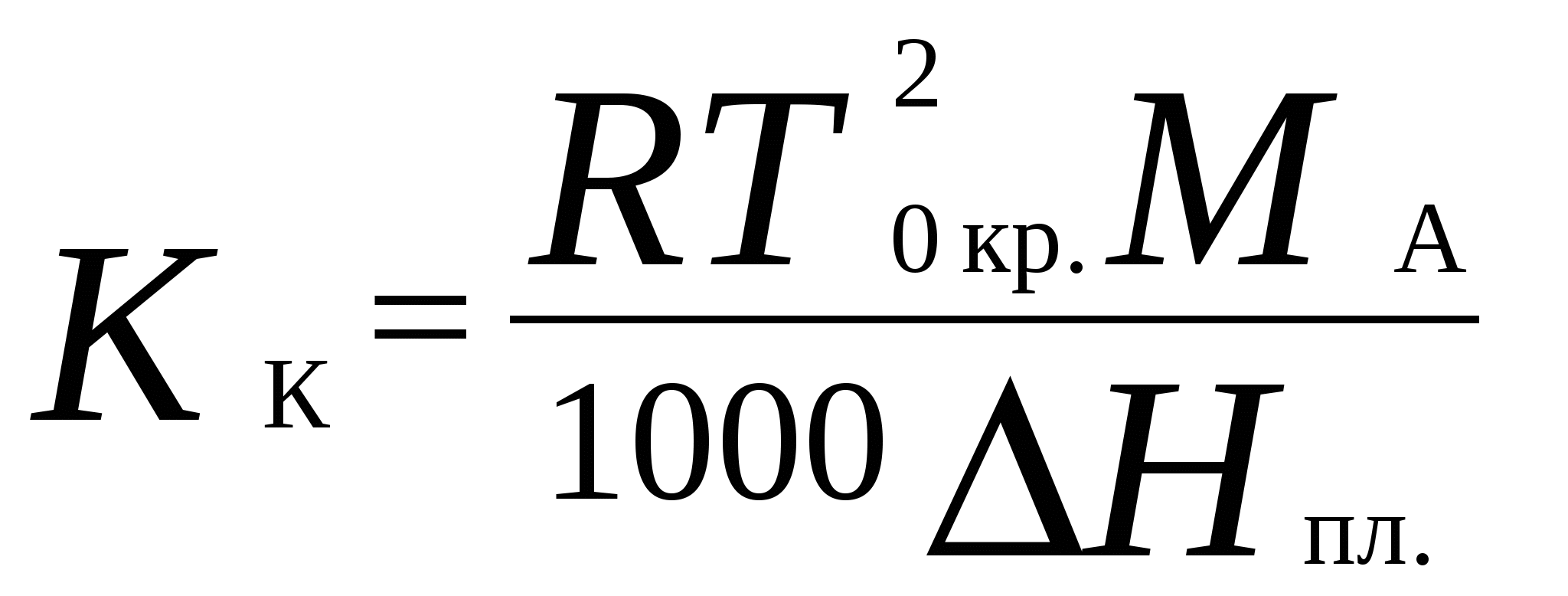 , ,Т 0 кр. – температура кристаллизации чистого растворителя. Осмотическое давление в разбавленных растворах можно рассчитать по уравнению 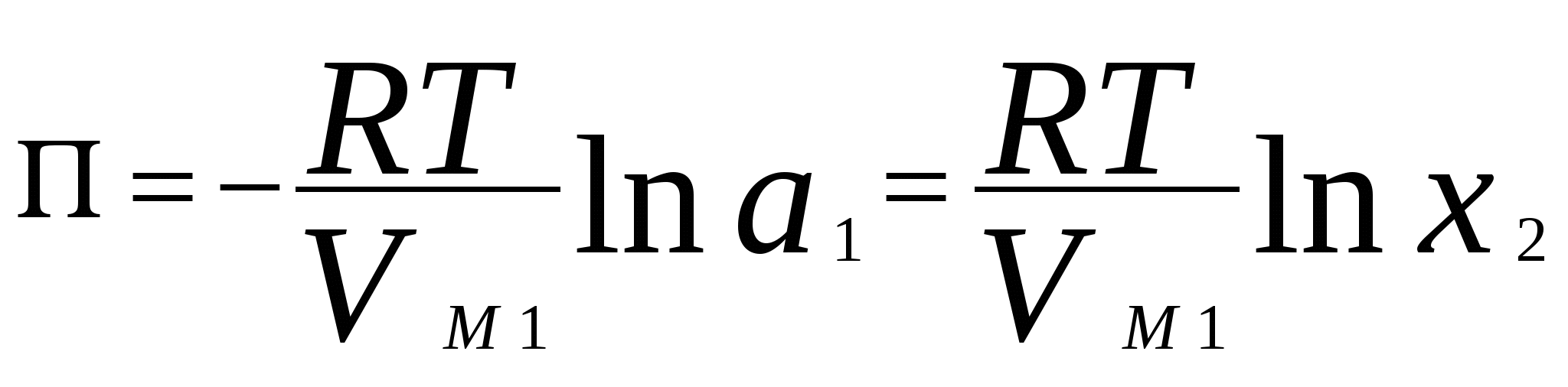 , ,где a 1 - активность растворителя, x 2 - молярная доля растворенного вещества, V M 1 - молярный объем растворителя. Для очень разбавленных растворов это уравнение преобразуется в уравнение Вант-Гоффа: = C R T , где С – молярная концентрация растворенного вещества. Пример 10. Рассчитать состав раствора бензол – толуол в молярных долях, который при нормальном давлении кипит при температуре 1000С, а также состав образующегося пара. Раствор считать идеальным. Давления паров чистых бензола и толуола при 1000 С равны 179,987кПа и 74,126кПа соответственно.Решение. Находим молярную долю бензола в растворе по закону Рауля: p = p 02 + (p 01 – p 02 ) x 1 , где p - общее давление пара над раствором 101,32 = 74,126 + (179,987 – 74,126) x 1 , откуда x 1 = 0,257 . Молярная доля толуола в растворе равна x2 = 1 – x1 = 0,743 . Молярная доля бензола в паре равна: y 1 = p 1/ p = x 1 p 01 / p = 0,257 . 179,987 / 101,32 = 0,456 . Вычислим молярную долю толуола в паре: y 2 =1 – y 1 = 0,544 . Пример 11. Плотность 20% водного раствора этилового спирта равна 0,97 г/см3 при Т = 298 К. Рассчитать парциальный молярный объем этилового спирта, если парциальный молярный объем воды равен 17,4 см3 / моль. Решение. Находим число моль воды и этилового спирта в 100 г раствора: n1= 80 / 18 = 4,44 , n2 = 20 /46 = 0,43 . ρ = m /V =100 / V , где V – объем раствора, откуда V =100 / 0,97 =103,09 см3 . Так как V = n1V1 + n 2 V2 , находим парциальный мольный объем этилового спирта: 103,09 = 4,44 . 17,04 + 0,43 V2 . Откуда, V2 = 60,07 cм3 . Пример 12. 1) Вычислить активность и рациональный коэффициент активности ацетона С3Н6О в водном растворе, если x (С3Н6О) = 0,318; p (С3Н6О) = 152 Торр; p 0 (С3Н6О) = = 229 Торр. 2) Рассчитать химический потенциал μ (С3Н6О) , а также изменение химического потенциала Δ μ (С3Н6О) при растворении ацетона в воде. Решение. a (С3Н6О) = p / p 0 = 152 /229 = 0,664; Так как a (С3Н6О) = x. γ , γ (С3Н6О) = a / x ; γ(с3н6о) = 0,664 / 0,318 = 2,09 . Так как γ больше единицы, отклонения от закона Рауля положительные. 2)Δ μ (С3Н6О) = RTln a (С3Н6О) = 8,31• 298• (ln 0,664) . 10 – 3 = - 1,014 кДж / моль . Так как μ 0 (С3Н6О) = Δ f G 0298 (С3Н6О) = - 155,50 кДж / моль, μ (С3Н6О) = Δ μ (С3Н6О) + μ0 (С3Н6О) = - 1,014 + (- 155,50) = - 156,514 кДж / моль . Задачи 88. Парциальные молярные объемы воды и метанола в растворе с молярной долей метанола 0,4 равны 17,35 и 39,01 см 3 / моль соответственно. Рассчитать объем раствора, содержащего 0,4 моль метанола и 0,6 моль воды, а также объем до смешения. Плотности воды и метанола равны 0,998 и 0,791 г / см 3 . 89. Парциальные молярные объемы воды и этанола в растворе с молярной долей этанола 0,2 равны 17,9 и 55,0 см 3 / моль соответственно. Рассчитать объемы воды и этанола, необходимые для приготовления 1 л такого раствора. Плотности воды и метанола равны 0,998 и 0,789 г / см 3 . 90. Парциальные молярные объемы ацетона и хлороформа в растворе с молярной долей хлороформа 0,47 равны 74,17 и 80,24 см 3 / моль соответственно. Рассчитать объем такого раствора, имеющего массу 1 кг. 91. Плотность 50 % (масс.) раствора этанола в воде при 25 0 С равна 0,914 г / см 3 . Рассчитать парциальный молярный объем этанола в этом растворе, если парциальный молярный объем воды равен 17,4 см 3 / моль. 92. Раствор, содержащий 60 % (масс.) метанола в воде, имеет плотность 0,895 г /см3 при 20 0 С. Парциальный молярный объем воды в растворе этого состава равен 16,8 см 3. Рассчитать парциальный молярный объем метанола. 93. Парциальные молярные объемы воды и метанола в растворе с молярной долей метанола 0,4 равны 17,35 и 39,01 см 3 / моль соответственно. Рассчитать объемы воды и метанола, необходимые для приготовления 300 мл такого раствора. Плотности воды и метанола равны 0,998 и 0,791 г / см 3 . 94. Давления пара чистых СНCl 3 и CCl 4 при 25 0 С равны 26,54 и 15,27 кПа. Предполагая, что они образуют идеальный раствор, рассчитать давление пара и состав (в молярных долях) пара над раствором, состоящим из 1 моль СНCl 3 и 1 моль CCl 4. 95. При 80 0 С давление пара дибромэтилена равно 22,9 кПа, а дибромпропилена 16,9 кПа. Считая, что дибромэтилен и дибромпропилен при смешении образуют идеальные растворы, рассчитайте состав пара, находящегося в равновесии с раствором, молярная доля дибромэтилена в котором равна 0,75. Рассчитать состав раствора, находящегося в равновесии с паром, мольная доля дибромэтилена в котором равна 0,50. 96. При 20 0 С давление пара этанола равно 5,93 кПа, а метанола - 11,83 кПа. Считая, что этанол и метанол при смешении образуют идеальные растворы, рассчитайте давление пара раствора, состоящего из 100 г этанола и 100 г метанола, а также состав (в молярных долях) пара над этим раствором при 20 0 С. 97. Давление пара чистых бензола и толуола при 60 0 С равны 51,3 и 18,5 кПа соответственно. Определите при каком давлении при 60 0 С закипит раствор, состоящий из 1 моль бензола и 2 моль толуола. Определите состав пара (в молярных долях). 98. При 90 0 С давление насыщенного пара толуола равно 53328,93 Па, а о – ксилола – 19998,35 Па. Считая этот раствор идеальным, определите состав жидкой смеси в молярных долях, которая будет кипеть при 90 0 С, если давление насыщенного пара смеси при этом равно 50662,5 Па. Определите состав образующегося пара (в молярных долях). 99. При 60 0 С давление насыщенного пара этанола равно 47022,8 Па, а давление насыщенного пара метанола – 83326,5 Па. Смесь этих спиртов, которую можно считать идеальной, содержит 50 % (масс.) каждого компонента. Определите состав пара над этим раствором при 60 0 С. 100. Давление насыщенного пара над хлористым метилом при 273 К равно 2,64 . 10 5 Па, а над хлористым этилом при той же температуре – 0,638 . 10 5 Па. Считая, что раствор хлористого этила в хлористом метиле подчиняется закону Рауля, определите состав пара (в молярных долях) над 50 % (масс.) раствором. 101. Давление пара чистых хлорбензола и бромбензола при 140 0 С равны 1,237 . 10 5 кПа и 0,658 . 10 5 Па соответственно. Рассчитайте состав раствора хлорбензол – бромбензол, который при давлении 10 5 Па кипит при температуре 140 0 С, а также состав образующегося пара. 102. Бензол и толуол образуют растворы, близкие по свойствам к идеальному. При Т = 293 К давления паров бензола и толуола равны соответственно 1,020 . 10 4 Па и 0,327 . 10 4 Па. Построить график зависимости содержания бензола в паре от содержания бензола в жидкой фазе. Определить содержание бензола в паре, если в жидкой фазе его содержится 40%. 103. Приняв, что SnCl4 и CCl4 образуют идеальный раствор, определить изменения энтропии и энергии Гиббса при образовании 0,5 кг раствора, в котором молярные доли компонентов равны 0,5 при Т = 298 К. 104. Давления паров веществ А и В соответственно равны 0,45 . 10 5 Па и 1,013 . 10 5 Па. Определить состав пара над раствором, полученным смешением 0,5 моль А и 0,7 моль В, если компоненты образуют идеальный раствор. 105. Константа Генри для СО 2 в воде при 25 0 С равна 1666,4 . 10 5 Па. Рассчитайте растворимость (в единицах моляльности) СО 2 в воде при 25 0 С, если парциальное давление СО 2 над водой равно 0,1 атм. 106. Константы Генри для кислорода и азота в воде при 25 0 С равны 4,40 . 10 9 и 8,68 . 10 9 Па соответственно. Рассчитайте концентрации (в моляльностях) растворенных в воде кислорода и азота при 25 0 С, если содержание в воздухе над водой азота 78,2 % и кислорода 20,9 % по объему, а его давление равно 10 5 Па. 107. Бензол и толуол образуют растворы, близкие по свойствам к идеальному. Давление пара чистых бензола и толуола при 60 0 С равны 51,3 и 18,5 кПа соответственно. Построить график зависимости содержания бензола в паре от содержания бензола в жидкой фазе. Определить содержание бензола в паре, если в жидкой фазе его содержится 30%. 108. Хлороформ СНCl 3 и тетрахлорид углерода CCl 4 образуют растворы, близкие по свойствам к идеальному. Давления пара чистых СНCl 3 и CCl 4 при 25 0 С равны 26,54 и 15,27 кПа соответственно. Построить график зависимости содержания хлороформа в паре от содержания хлороформа в жидкой фазе. Определить содержание хлороформа в паре, если в жидкой фазе его содержится 40%. 109. Этанол и метанол образуют растворы, близкие по свойствам к идеальному. При 20 0 С давление пара этанола равно 5,93 кПа, а метанола - 11,83 кПа. Построить график зависимости содержания этанола в паре от содержания этанола в жидкой фазе. Определить содержание этанола в паре, если в жидкой фазе его содержится 60 %. 110. Дибромэтилен и дибромпропилен образуют растворы, близкие по свойствам к идеальному. При 80 0 С давление пара дибпромэтилена равно 22,9 кПа, а дибромпропилена 16,9 кПа. Построить график зависимости содержания дибромэтилена в паре от содержания дибромэтилена в жидкой фазе. Определить содержание дибромэтилена в паре, если в жидкой фазе его молярная доля 0,45. 111. Давления паров веществ А и В соответственно равны 0,45 . 10 5 Па и 1,013 . 10 5 Па. Определить состав пара над раствором, полученным смешением 0,3 моль А и 0,5 моль В, если компоненты образуют идеальный раствор. 112. При Т = 308 К давление пара ацетона 0,459 . 10 5 Па, а давление пара хлороформа 0,391 . 10 5 Па. Над раствором, содержащим 36 % хлороформа, парциальное давление паров ацетона равно 0,2677 . 10 5 Па, а хлороформа 0,0964 . 10 5 Па. Определить активности компонентов, а также коэффициенты активности. 113. Рассчитать активности и рациональные коэффициенты активности компонентов в растворе вода (1) – пропанол-1 (2), в котором мольная доля пропанола равна x 2 = 0,3, парциальные давления компонентов над раствором равны:p (H2O) = 3,84 . 10 3 Па, p(C3H7OH) = = 2,53 .10 3 Па. Давления паров над чистыми компонентами равны:p 0(H2O) = 4,24 . 10 3 Па; p 0(C3H7OH) = 3,8 .10 3 Па. Вычислить изменение химического потенциала и химический потенциал при растворении компонента 2 в компоненте 1 (2 - 20). При расчете принять, что 0 = f G 0 298 (чистого компонента). Недостающие данные взять из справочника. 114. При температуре 57,2 0 С и давлении 1 атм молярная доля ацетона в паре над раствором ацетон – метанол с молярной долей ацетона в растворе x A = 0,400 равна yA = 0,516. Рассчитать активности и рациональные коэффициенты активности обоих компонентов в этом растворе, используя закон Рауля. Давления паров чистых ацетона и метанола при этой температуре равны 756 и 551 Торр соответственно. 115. Для раствора этанол – хлороформ при 35 0 С получены следующие данные:
Рассчитать коэффициенты активности обоих компонентов, используя закон Рауля. 116. Для раствора сероуглерод – ацетон при 35,2 0 С получены следующие данные:
Рассчитать коэффициенты активности обоих компонентов, используя закон Рауля. 117. Экспериментально определены значения парциальных давлений над системой ацетон хлороформ при Т = 308,2 К в зависимости от состава:
На основании этих данных построить график зависимости парциальных и общего давлений над системой от состава. Сравнить с графиком для идеальной системы. Определить, при каком общем давлении закипит смесь, содержащая 50% хлороформа при Т = 308,2 К. Найти состав смеси, которая будет кипеть при p = 3,5 . 10 4 Па. 118. Температура кипения чистого бензола 353,1 К. Удельная теплота испарения при температуре кипения равна 399,69 кДж/кг. Раствор содержащий 0,0128 кг нафталина в 1 кг бензола. Определить: а) температуру кипения этого раствора; б) давление пара бензола над этим раствором, если давление насыщенного пара над чистым бензолом равно 2,433 . 10 4 Па. 119. Водный раствор, содержащий нелетучее растворенное вещество, кристаллизуется при 271,5 К. Определить температуру кипения раствора и давление пара над раствором при 298 К. Криоскопическая константа воды равна 1,86, эбулиоскопическая – 0,513. Давление насыщенного пара над чистой водой при 298 К равно 3167,21 Па. 120. При растворении 0,006 кг некоторого вещества в 0,25 кг воды температура кипения повысилась на 0,204 К . При растворении 0,003 кг этого вещества в 0,2 кг бензола температура кипения повысилась на 0,668 K. Найти эбулиоскопическую константу бензола, если эбулиоскопическая константа воды равна 0,513. 121. В 1 кг воды растворено 0,0684 кг сахара (М = 342 г / моль). Чему равно давление насыщенного пара над этом раствором при Т = 293 К, если давление насыщенного пара над чистой водой при 293 К равна 2338,5 Па? Чему равна температура кипения раствора, если для воды Н исп. = 2256,7 . 10 3 Дж/кг при температуре кипения? 122. Чистый кадмий затвердевает при Т = 594 К, 10%-ый раствор висмута в кадмии – при Т = 583 К. Определить энтальпию плавления кадмия. 123. Температура кристаллизации разбавленного раствора тростникового сахара 272,171 К. Давление насыщенного пара над чистой водой при этой температуре 568,6 Па, а скрытая теплота плавления льда 602,9 . 10 4 Дж/кмоль. Вычислить давление пара над раствором. 124. 68,4 г сахарозы (М = 342 г / моль) растворено в 1000 г воды. Рассчитайте: а) давление пара; б) температуру кристаллизации; в) температуру кипения; г) осмотическое давление раствора. Давление пара чистой воды при 20 0 С равно 2338,5 Па. Криоскопическая и эбулиоскопическая постоянные воды равны 1,86 и 0,52 К . кг / моль соответственно. 125. Некоторое количество вещества, растворенное в 100 г бензола, понижает температуру его кристаллизации на 1,28 0. То же количество вещества, растворенное в 100 г воды, понижает температуру его кристаллизации на 1,395 0 . Вещество находится в бензоле в молекулярной форме, а в воде полностью диссоциировано. Определить, на сколько ионов вещество диссоциирует в водном растворе. Криоскопические постоянные для бензола и воды равны 5,12 и 1,86 К . кг / моль соответственно. 126. Используя справочные данные по давлению насыщенного пара воды при 25 0 С и значению давления паров водного раствора глицерина, равному при этой температуре 3157,06 Па, вычислить осмотическое давление этого раствора при 37 0 С. Плотность раствора равна 1,0017 г / см 3 . Молярная масса глицерина равна 92,09 г / моль. 127. Компоненты А и В образуют идеальный раствор. Давление пара чистого А при 25 0 С равно 100 Торр. Давление пара чистого В при данной температуре практически равно нулю. Давление пара раствора, содержащего 10г А и 1г В при 25 0 С равно 95 Торр. Найти отношение молярных масс А и В. 5. Растворы сильных электролитов Для реальных растворов вместо концентрации в термодинамические уравнения вводится активность: a = . m , где - коэффициент активности растворенного электролита, m - моляльная концентрация электролита. Если электролит распадается на два иона, то стандартное состояние выбирается таким образом, чтобы выполнялось равенство: где a + и a - - активности катиона и аниона соответственно. В бесконечно разбавленном растворе: a + = m ; a - = m ; a = m 2 . Коэффициент активности электролита g определяется уравнением: g= g+ . g-, где g+ и g- - коэффициенты активности катиона и аниона соответственно. Так как экспериментально определить активности катиона и аниона невозможно, вводят понятие средней ионной активности a. Для электролита, распадающегося на два иона, a равна: a ± = (a + . a - ) 1/2 , а средний ионный коэффициент активности равен: g= (g+ . g-) 1/2. Если молекула электролита в растворе диссоциирует на + катионов и - анионов, то средняя ионная активность электролита равна
|
| № задачи | Электролит А | m, моль/кг Н2О | Электролит В | m1, моль/кг Н2О |
| 128 | NaCl | 0,01 | Ca(NO3)2 | 0,025 |
| 129 | CdSO4 | 0,003 | CuCl2 | 0,01 |
| 130 | MgCl2 | 0,02 | ZnSO4 | 0,015 |
| 131 | Na2SO4 | 0,01 | FeCl2 | 0,05 |
| 132 | HNO3 | 0,05 | H2SO4 | 0,02 |
| 133 | KOH | 0,02 | Ba(NO3)2 | 0,04 |
| 134 | HCl | 0,01 | CdCl2 | 0,02 |
| 135 | CuCl2 | 0,005 | LaBr3 | 0,005 |
| 136 | H2SO4 | 0,015 | KCl | 0,01 |
| 137 | KBr | 0,02 | GaCl3 | 0,003 |
| 138 | ZnSO4 | 0,01 | NaNO3 | 0,02 |
| 139 | KNO3 | 0,05 | LaCl3 | 0,025 |
| 140 | CdCl2 | 0,01 | HCl | 0,025 |
| 141 | AgNO3 | 0,003 | Co(NO3)2 | 0,01 |
| 142 | CsCl | 0,02 | H2SO4 | 0,015 |
| 143 | HBr | 0,01 | Mg(ClO4)2 | 0,05 |
| 144 | ZnBr2 | 0,05 | HClO4 | 0,02 |
| 145 | Co(NO3)2 | 0,02 | ZnSO4 | 0,04 |
| 146 | KCl | 0,01 | LaCl3 | 0,02 |
| 147 | LiCl | 0,005 | Na2SO4 | 0,005 |
| 148 | Na2S2O3 | 0,015 | NaBr | 0,01 |
| 149 | CoCl2 | 0,02 | NaNO3 | 0,003 |
| 150 | NaClO3 | 0,01 | ZnCl2 | 0,02 |
| 151 | Mg(ClO4)2 | 0,05 | NaCl | 0,025 |
| 152 | Ca(NO3)2 | 0,01 | HNO3 | 0,025 |
| 153 | HCl | 0,01 | KCl | 0,05 |
| 154 | H2SO4 | 0,01 | K2SO4 | 0,05 |
| 155 | CaCl2 | 0,1 | KCl | 0,05 |
| 156 | NaH2PO4 | 0,02 | NaCl | 0,04 |
| 157 | CuCl2 | 0,02 | CuSO4 | 0,04 |
| 158 | MgSO4 | 0,005 | Mg(NO3)2 | 0,05 |
| 159 | ZnSO4 | 0,05 | CuSO4 | 0,07 |
| 160 | KClO3 | 0,05 | KCl | 0,03 |
| 161 | (NH4)2SO4 | 0,05 | NH4NO3 | 0,10 |
| 162 | Al2(SO4)3 | 0,02 | AlCl3 | 0,03 |
6. Химическая кинетика сложных реакций
При кинетическом изучении сложных реакций применяют принцип независимости (являющийся одним из постулатов химической кинетики):
если в системе протекают несколько реакций, то каждая из них подчиняется основному закону химической кинетики и протекает независимо от других химических реакций.
Константа скорости элементарной химической стадии не зависит от протекания в реакционной системе других элементарных стадий. Из этого постулата следует, что скорость реакции по одному из веществ ее участников - равна алгебраической сумме скоростей тех элементарных стадий, в которых это вещество принимает участие.
