ДЗФКХ07. Методические указания к решению задач домашнего задания по курсу Физическая и коллоидная химия Москва 2005
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
Для мономолекулярных обратимых реакций типа А В дифференциальная форма кинетического уравнения имеет вид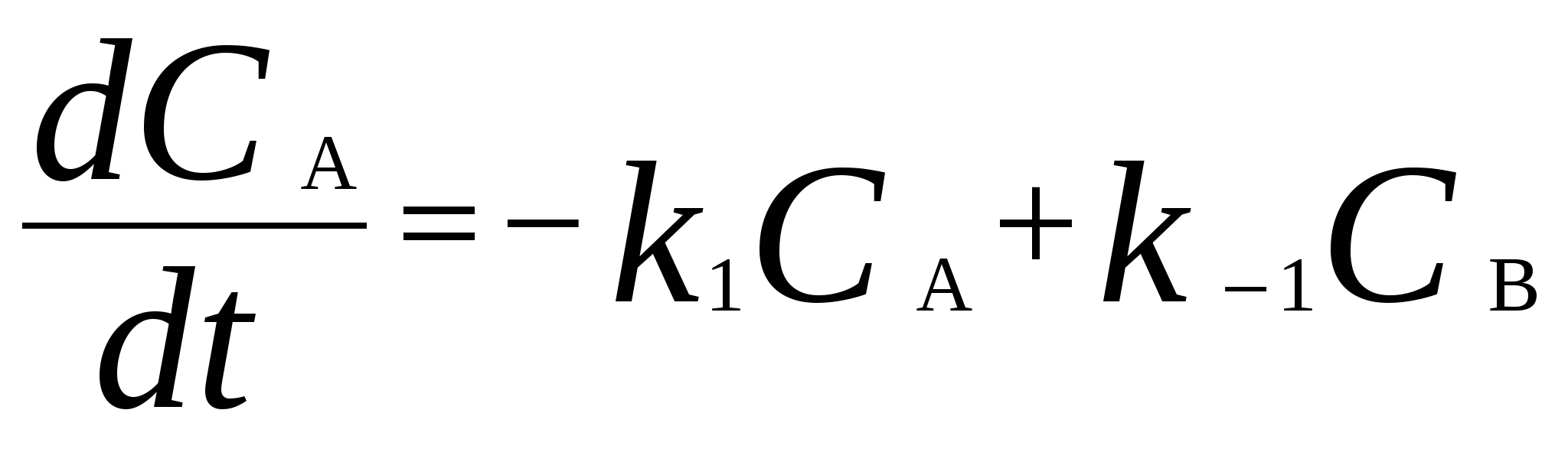 . .Здесь k 1 – константа скорости прямой реакции, k– 1 – константа скорости обратной реакции. При равновесии 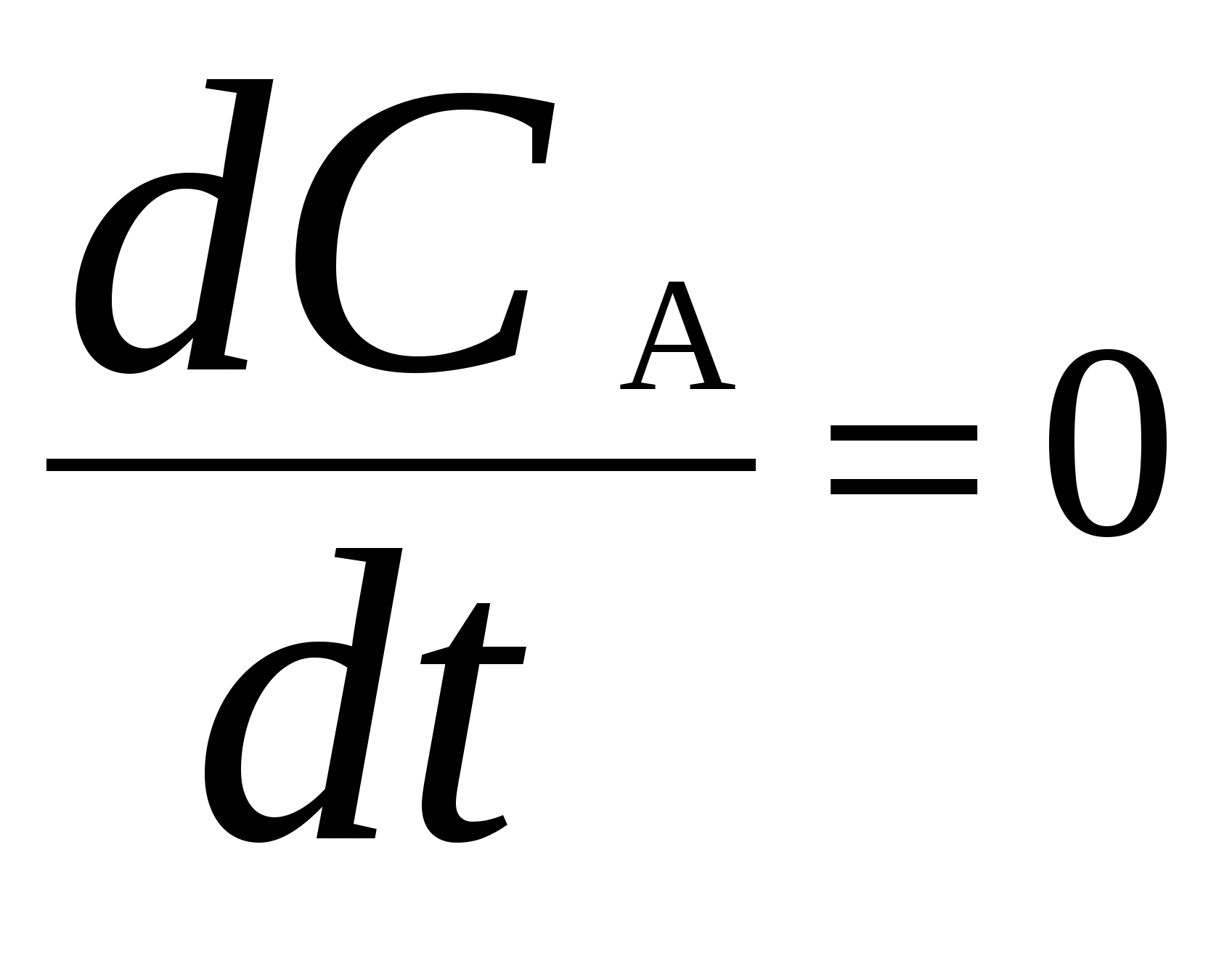 . .Если при t = 0 С B = 0, то справедливы следующие соотношения 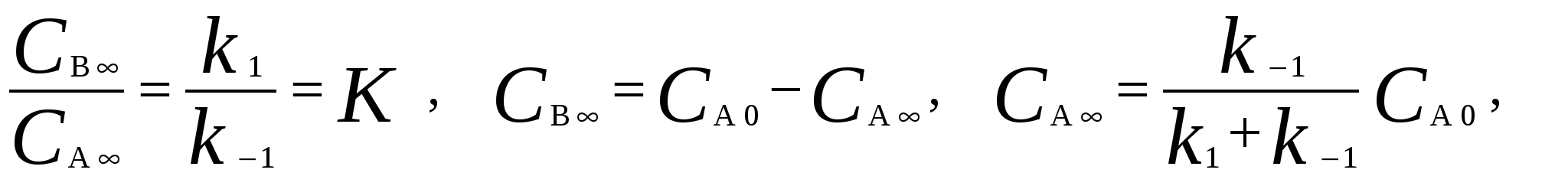 где С А, С B - текущие концентрации веществ A и B; С А 0 - начальная концентрация A при t = 0; k 1 и k – 1 – константы скоростей прямой и обратной реакций; СА и С В - равновесные концентрации A и B; K – константа равновесия. Интегральная форма кинетического уравнения 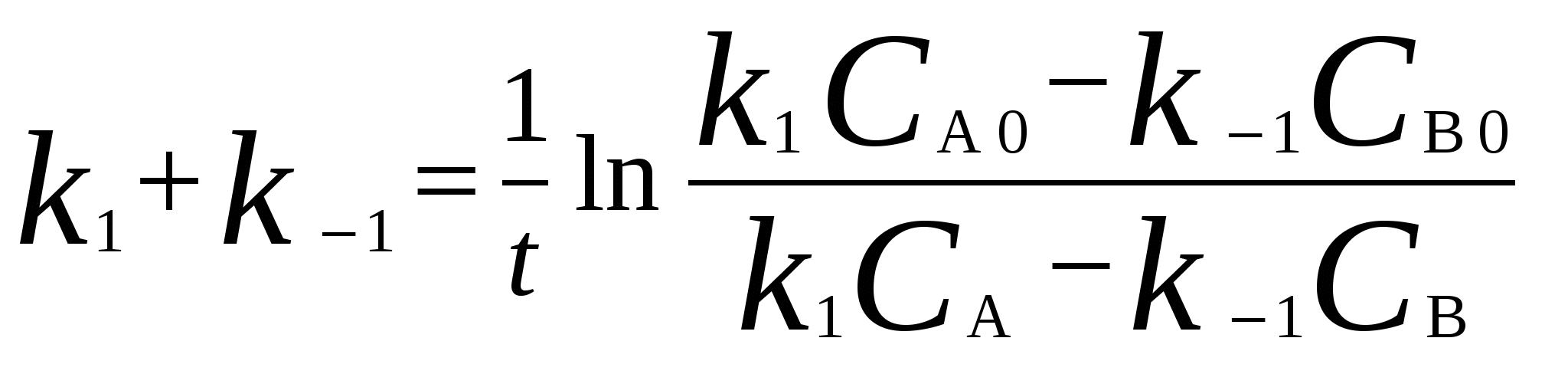 . .При условии, что при t= 0 С B 0 = 0 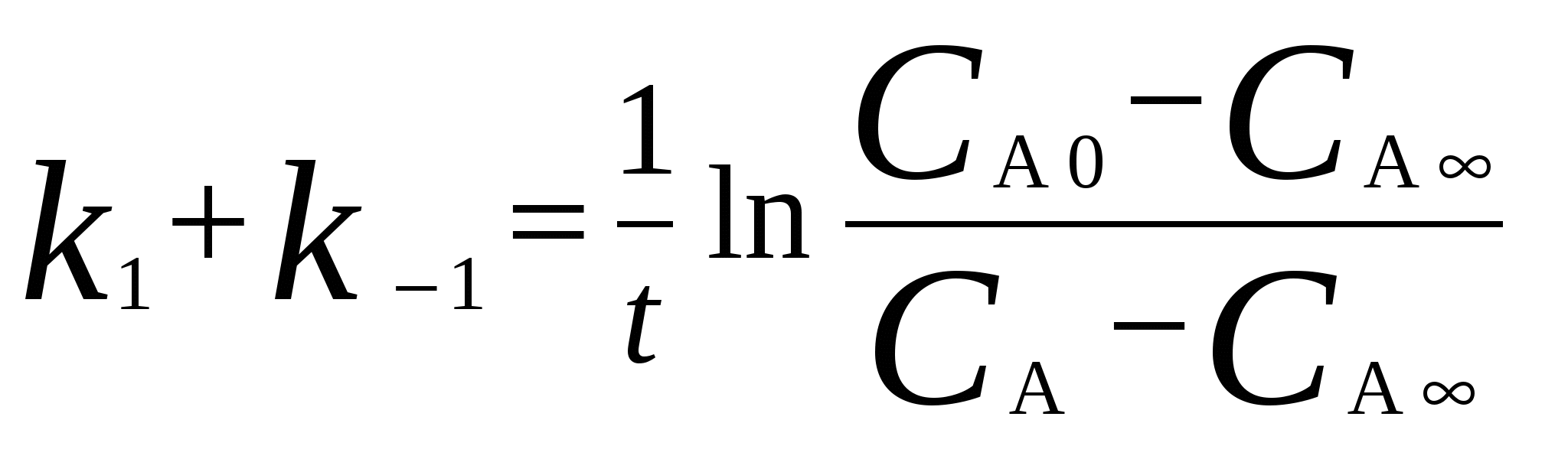 . .Для мономолекулярных параллельных реакций типа B (k1) B (k1) A AC (k 2) дифференциальная форма кинетического уравнения имеет вид 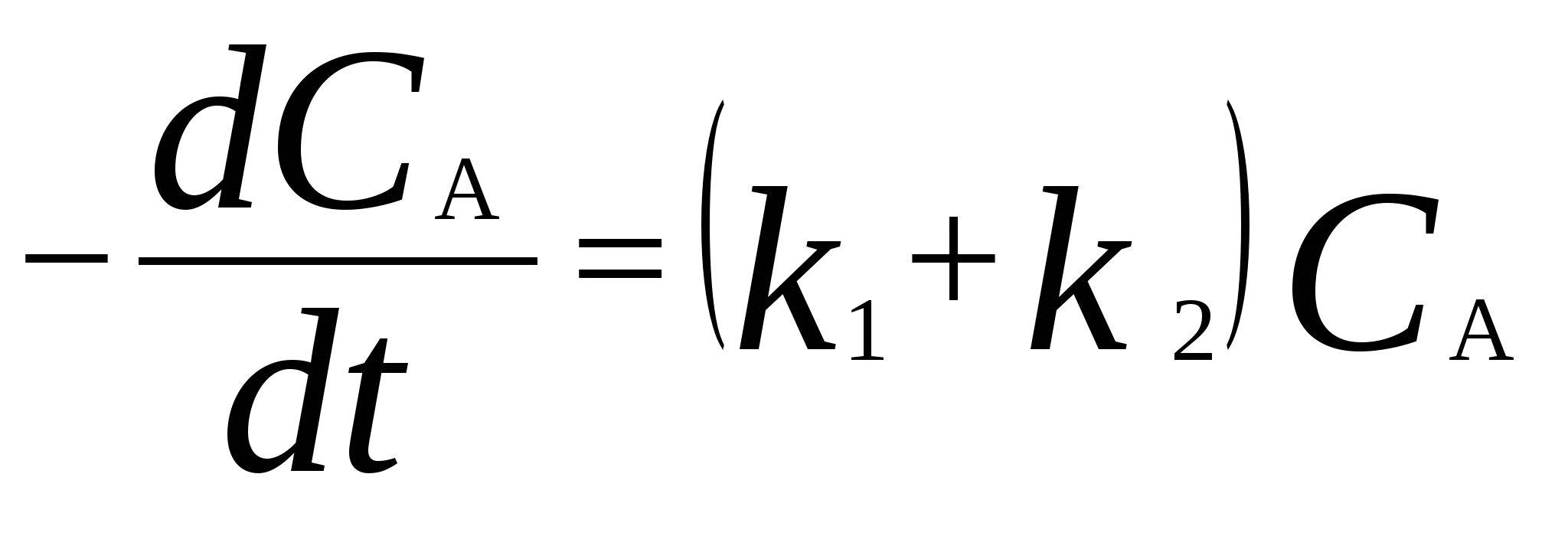 . .Интегрирование приводит к следующему результату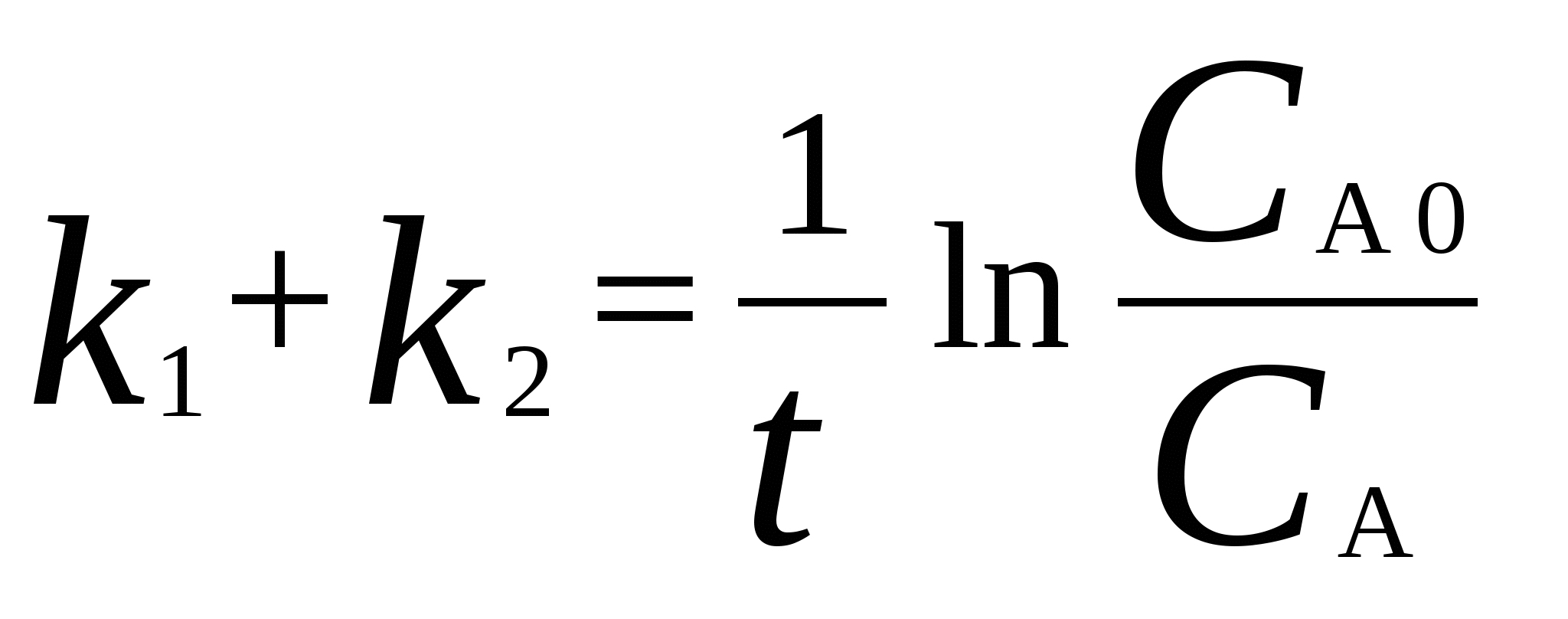 , ,где k 1 и k 2 – константы скоростей первой и второй реакций. Константы скоростей отдельных стадий для реакций данного типа определяют по соотношению 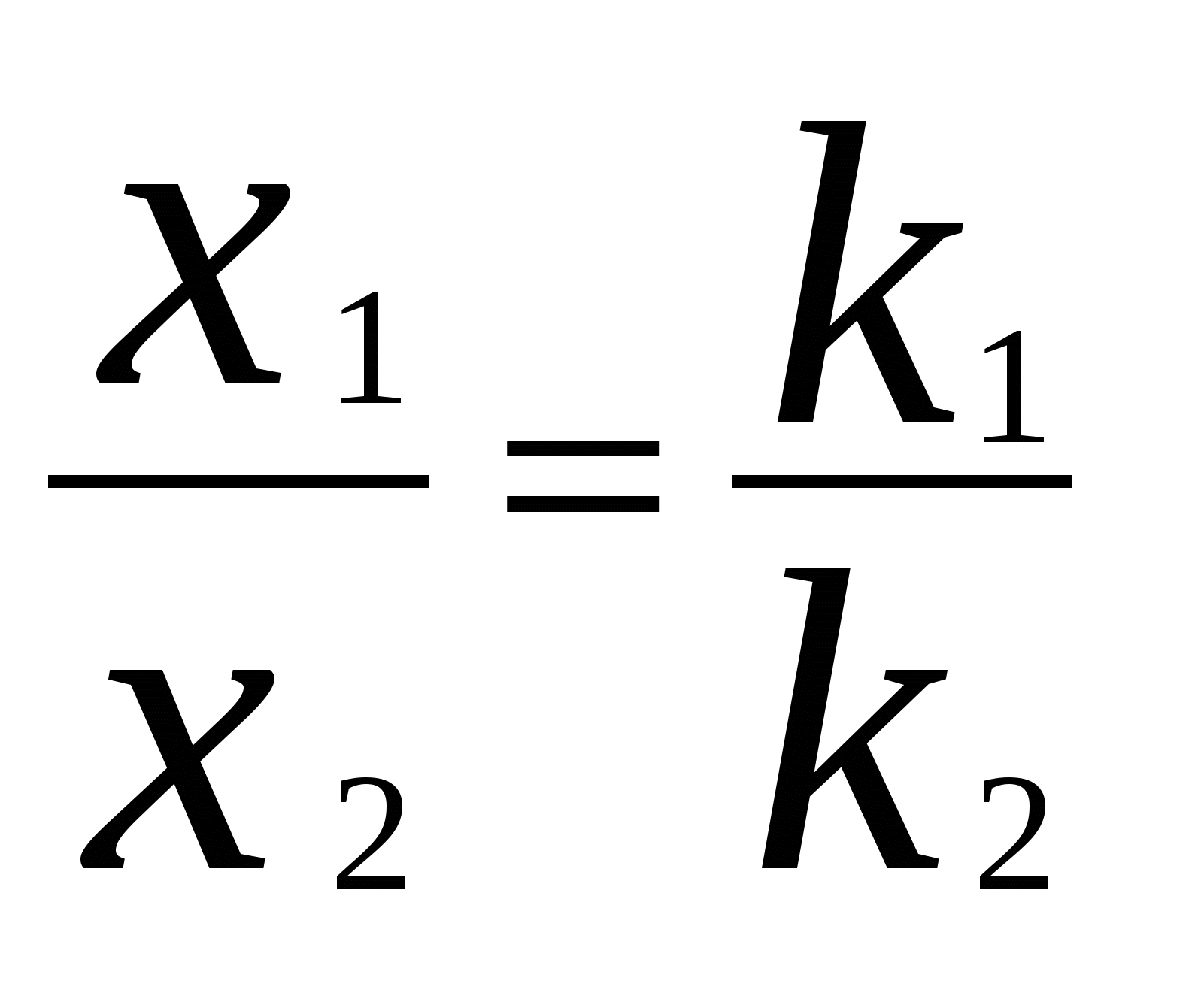 , ,где x 1 и x 2 – количества моль веществ B и C, образовавшихся к моменту времени t. Для последовательных реакций первого порядка типадифференциальные кинетические уравнения имеют вид 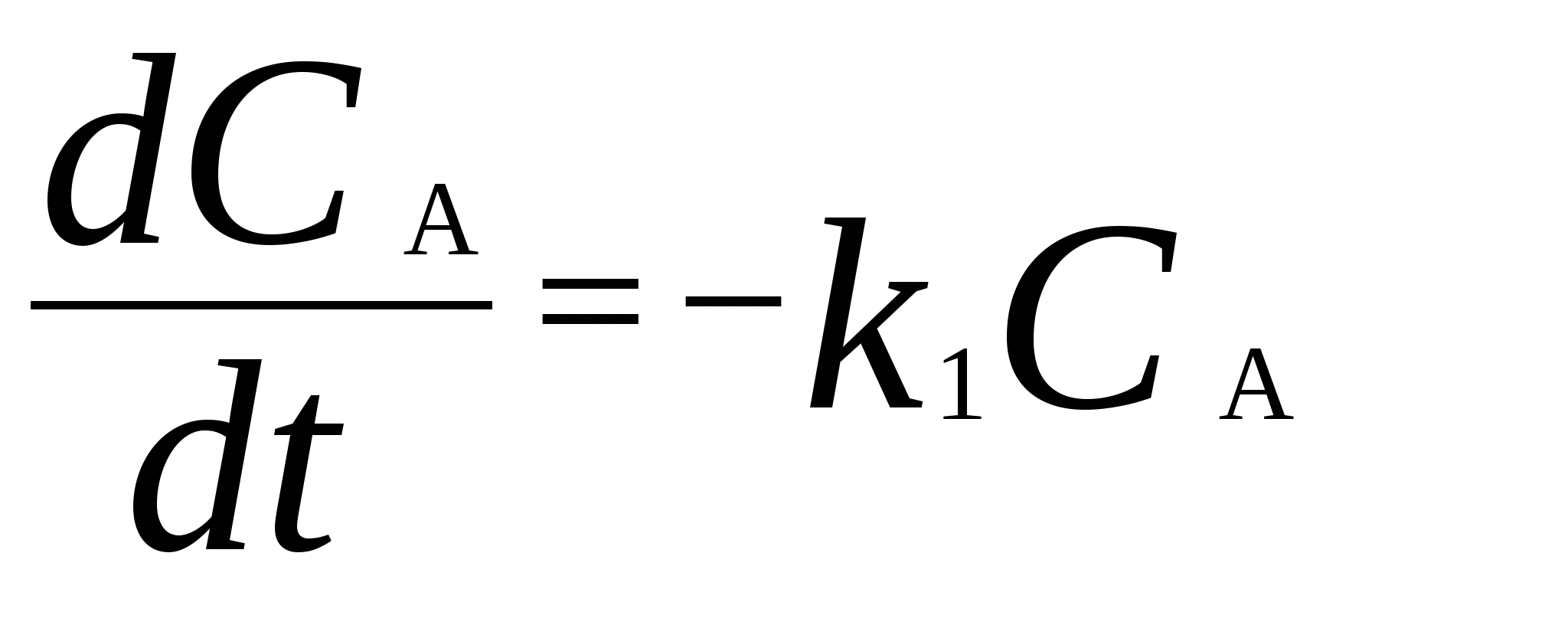 , , 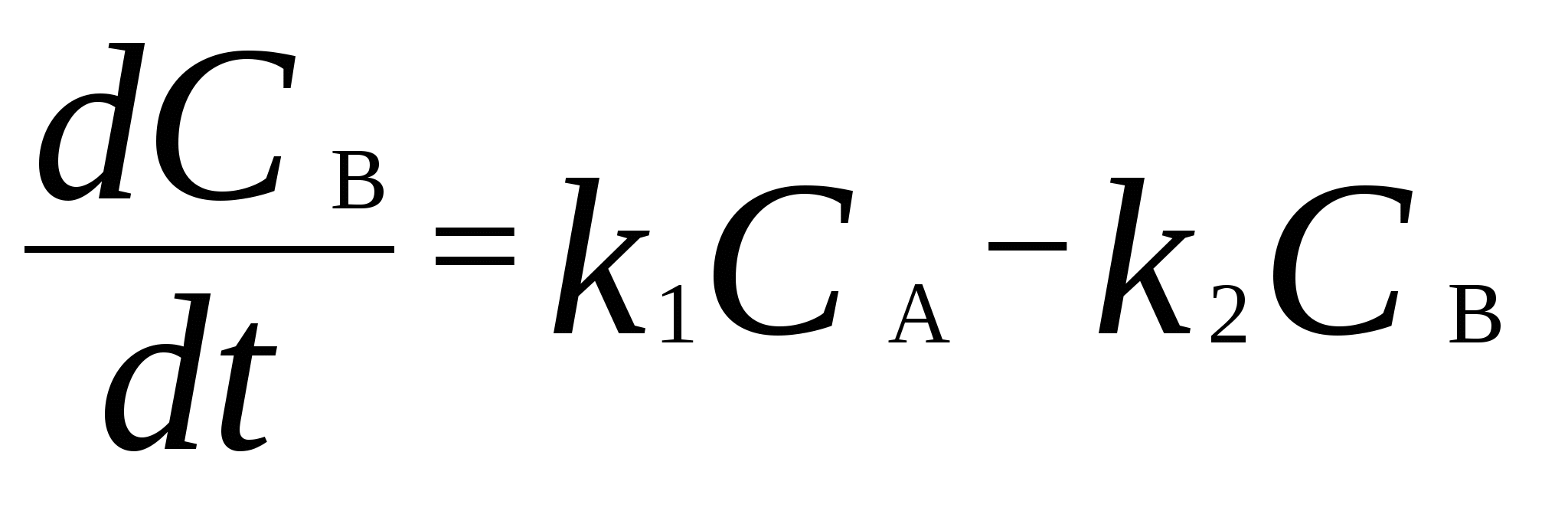 , , 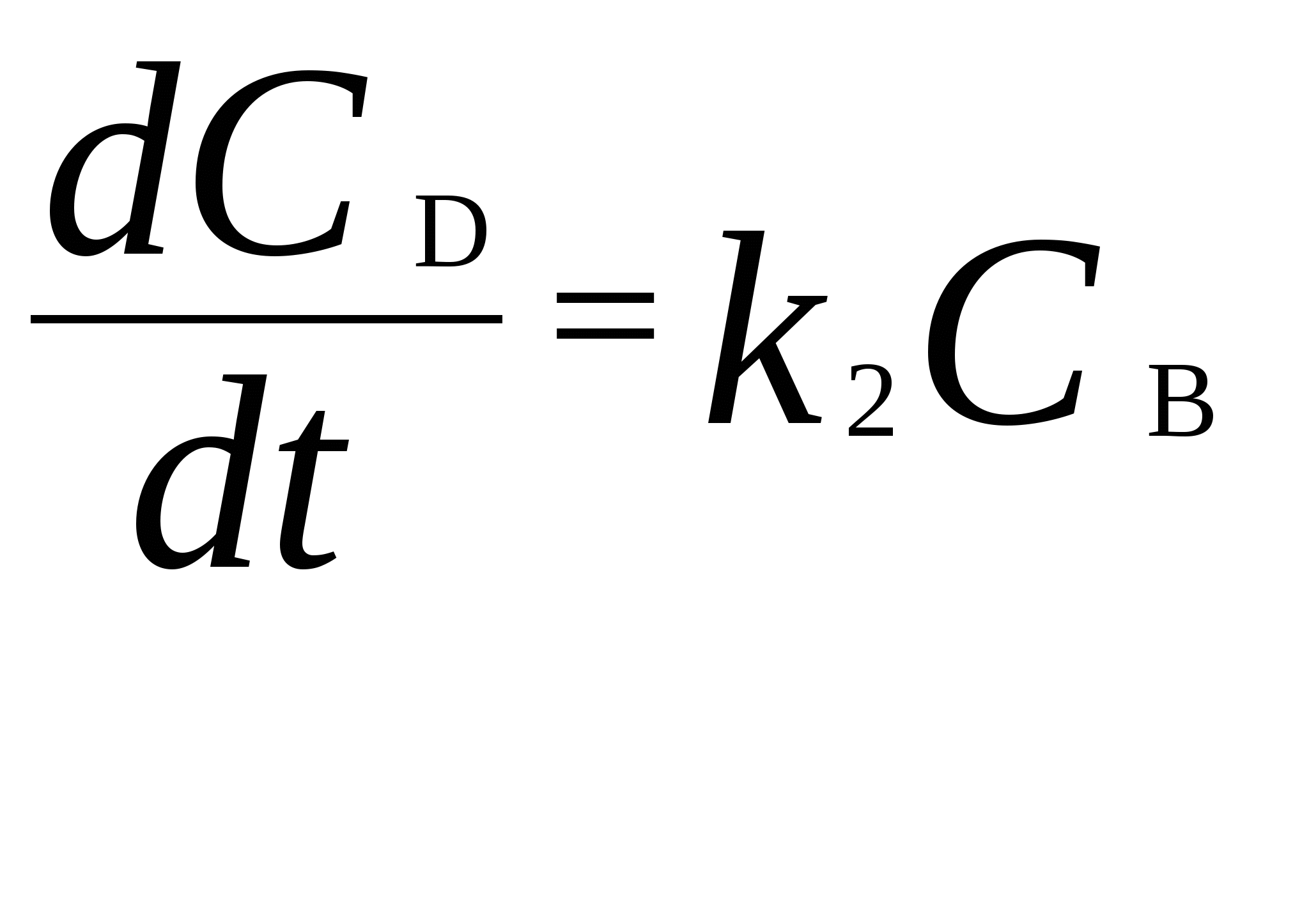 . .Решение этих уравнений приводит к следующим результатам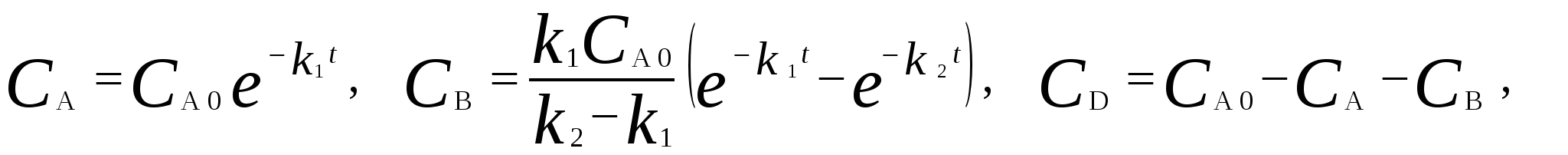 где С А, С B , С D – текущие концентрации веществ А, В и D; С А 0 – начальная концентрация вещества A; k 1 и k 2 – константы скоростей первой и второй стадий. Точка максимума на кинетической кривой С B = f (t) характеризуется уравнениями: 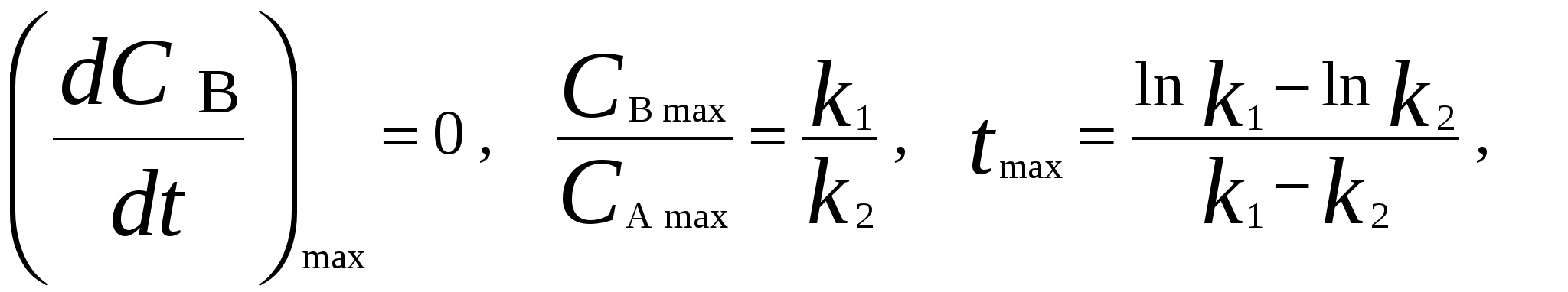 где t max – время, соответствующее максимальной концентрации вещества B. Приближенные методы химической кинетики В сложных реакциях с участием активных промежуточных частиц используется метод квазистационарных (или стационарных) концентраций. В этих реакциях за малый промежуток времени (мало изменение концентрации исходных веществ) в системе устанавливается режим, при котором разность скоростей образования r o и расходования r p промежуточных частиц становится малой по сравнению с этими скоростями. Такой режим процесса называется квазистационарным, а соответствующие ему концентрации промежуточных частиц - квазистационарными концентрациями. В квазистационаром режиме можно полагать: 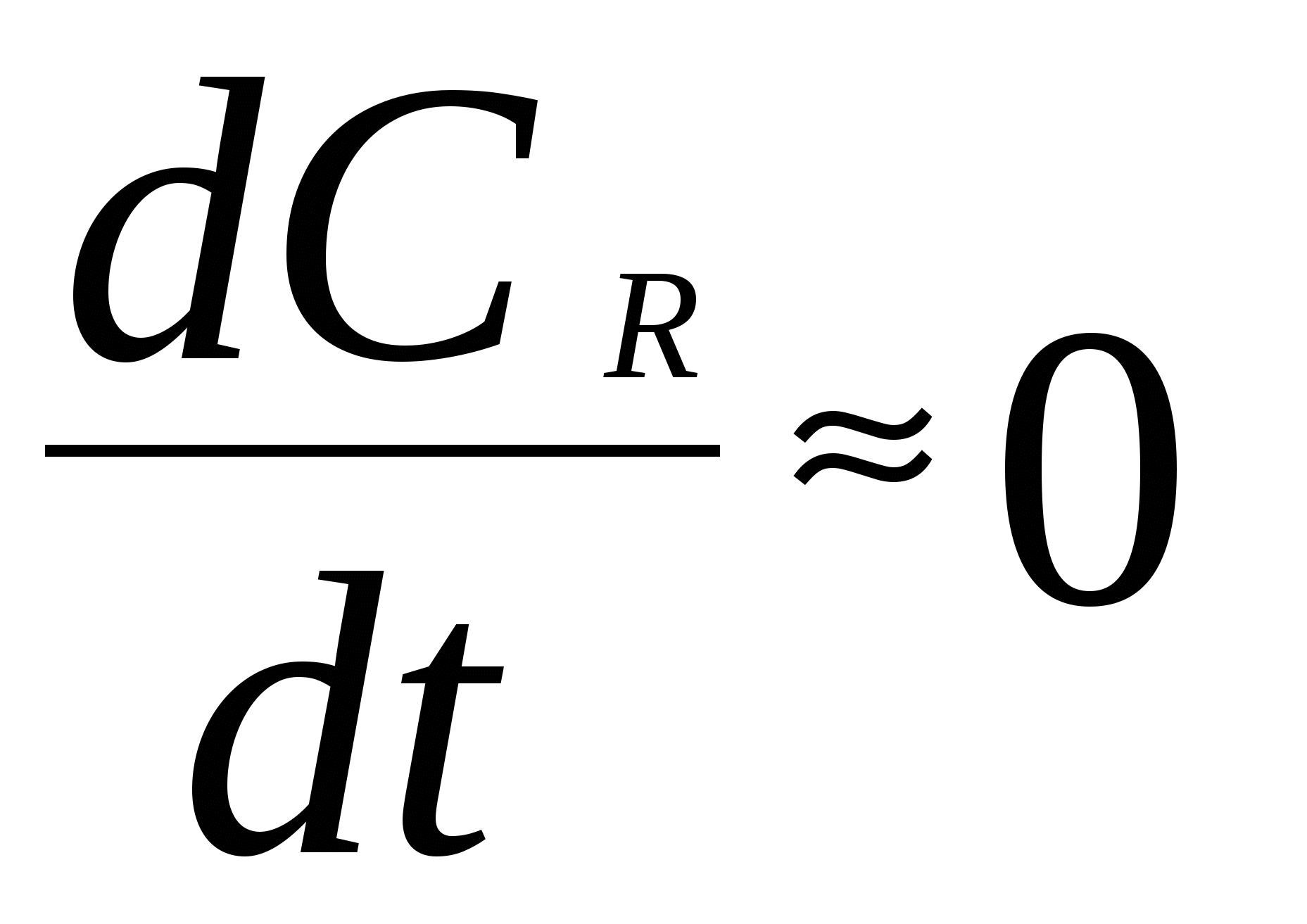 , ,где результате можно выразить концентрации промежуточных частиц через концентрации стабильных веществ, принимающих участие в данном процессе. Если время установления квазистационарного режима мало, концентрации активных промежуточных частиц будут непрерывно подстраиваться к новым квазистационарным значениям, то есть квазистационарный режим не будет нарушаться на протяжении всего процесса. Таким образом, метод квазистационарных концентраций состоит в том, что в системе дифференциальных уравнений, описывающей сложный химический процесс, дифференциальные уравнения для активных промежуточных частиц заменяются алгебраическими уравнениями, выражающими равенство скоростей образования и расходования этих частиц. Метод квазистационарных концентраций применяется обычно к реакциям с участием свободных радикалов, которые представляют собой реакционноспособные неустойчивые частицы. Квазиравновесное приближение применяют тогда, когда одна из реакций является обратимой, причем равновесие быстро устанавливается и медленно разрушается. Рассмотрим кинетическую схему: 1. A B ; (k 1 , k – 1 ) 2. B C . (k 2 ) Поскольку равновесие на первой стадии устанавливается быстро, то k 2 k – 1. Тогда концентрацию промежуточного продукта В можно выразить через константу равновесия: 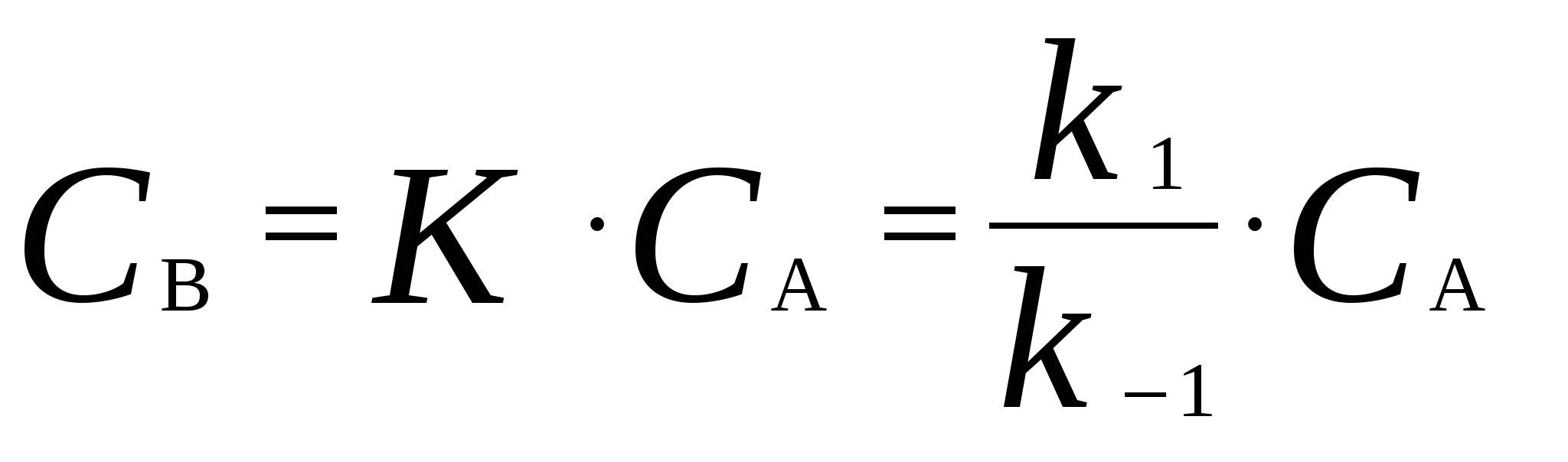 . .Скорость реакции равна: 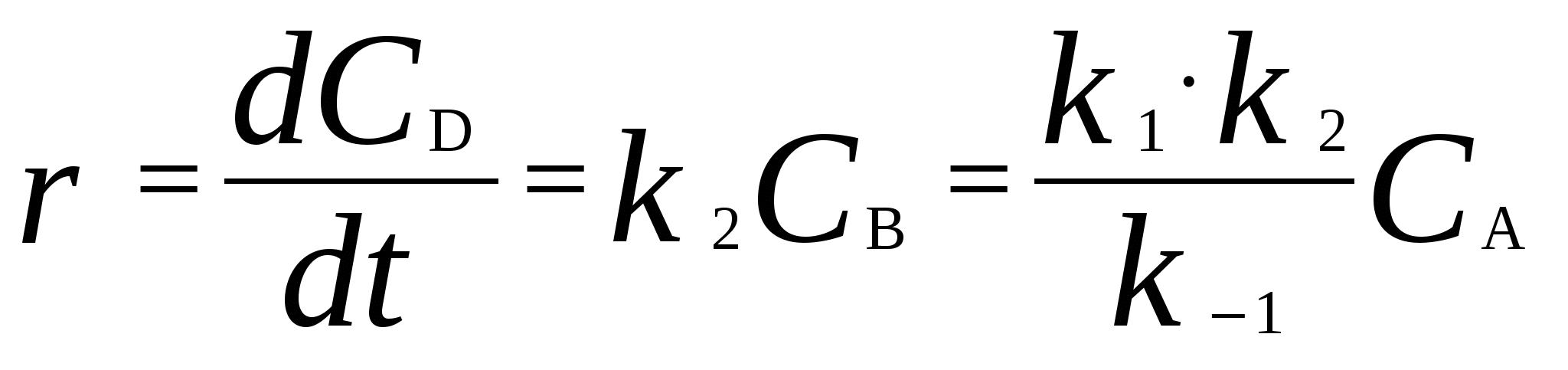 . .Мы получили уравнение реакции первого порядка. Пример 16. Для обратимого процесса А В константы скоростей прямой и обратной реакций равны соответственно k 1 = 0,4 c – 1 , k 2 = 0,05 c – 1. Начальные концентрации веществ А и В равны 0,04 моль/л. Определить какими окажутся концентрации этих веществ через 0,2 с. Решение. 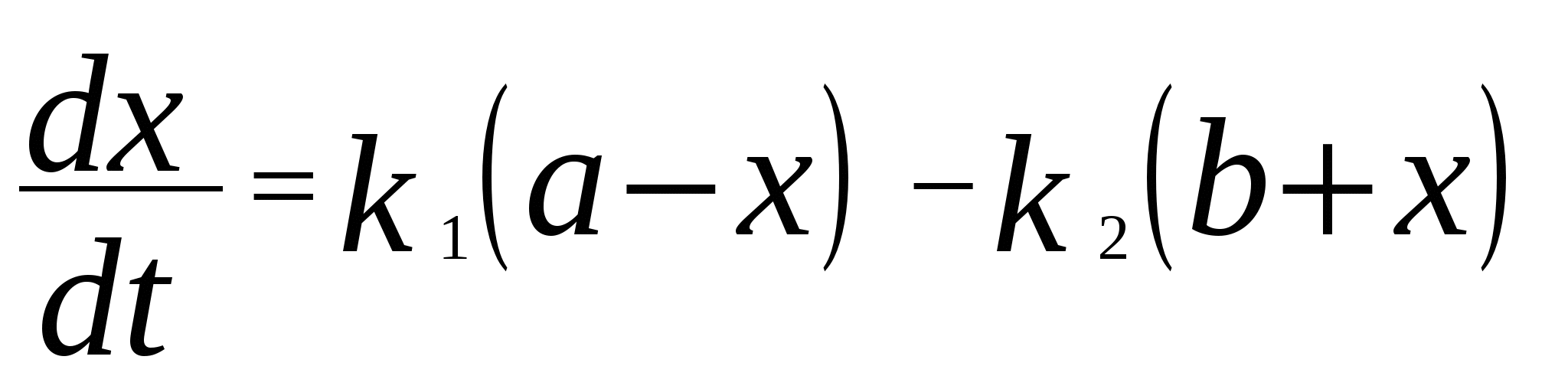 , ,где x – количество прореагировавшего вещества А, a и b – начальные концентрации веществ А и В. Решение этого уравнения: 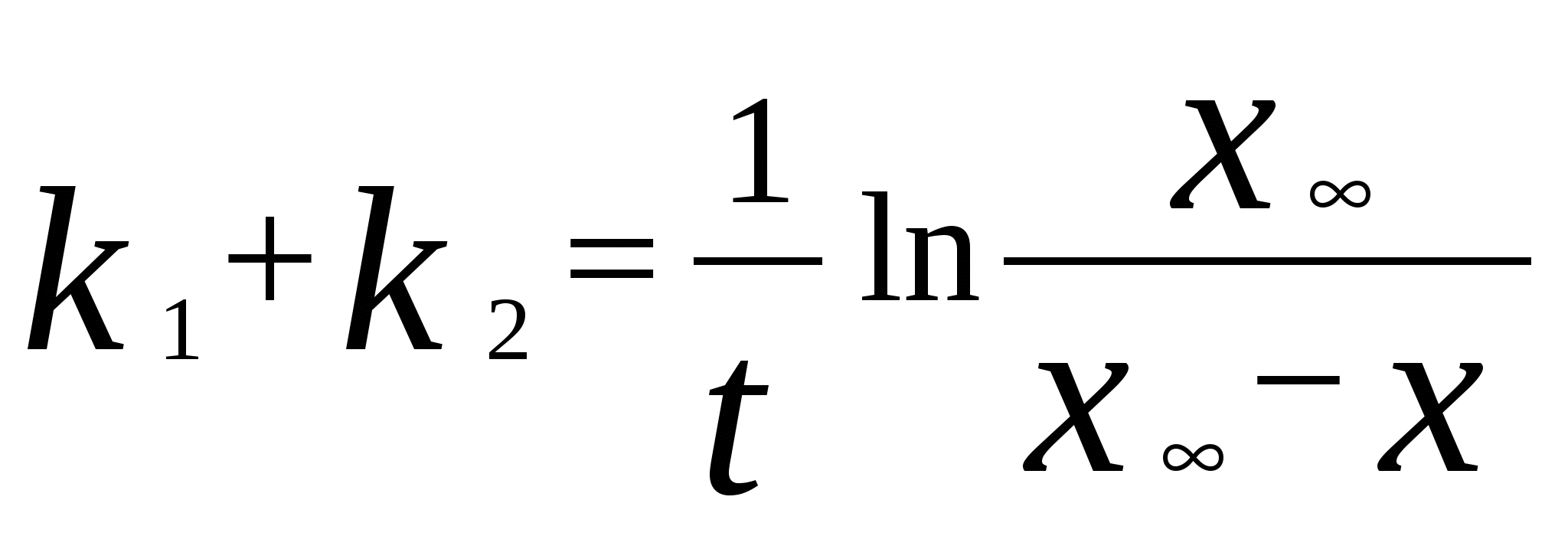 . (*) . (*)Здесь 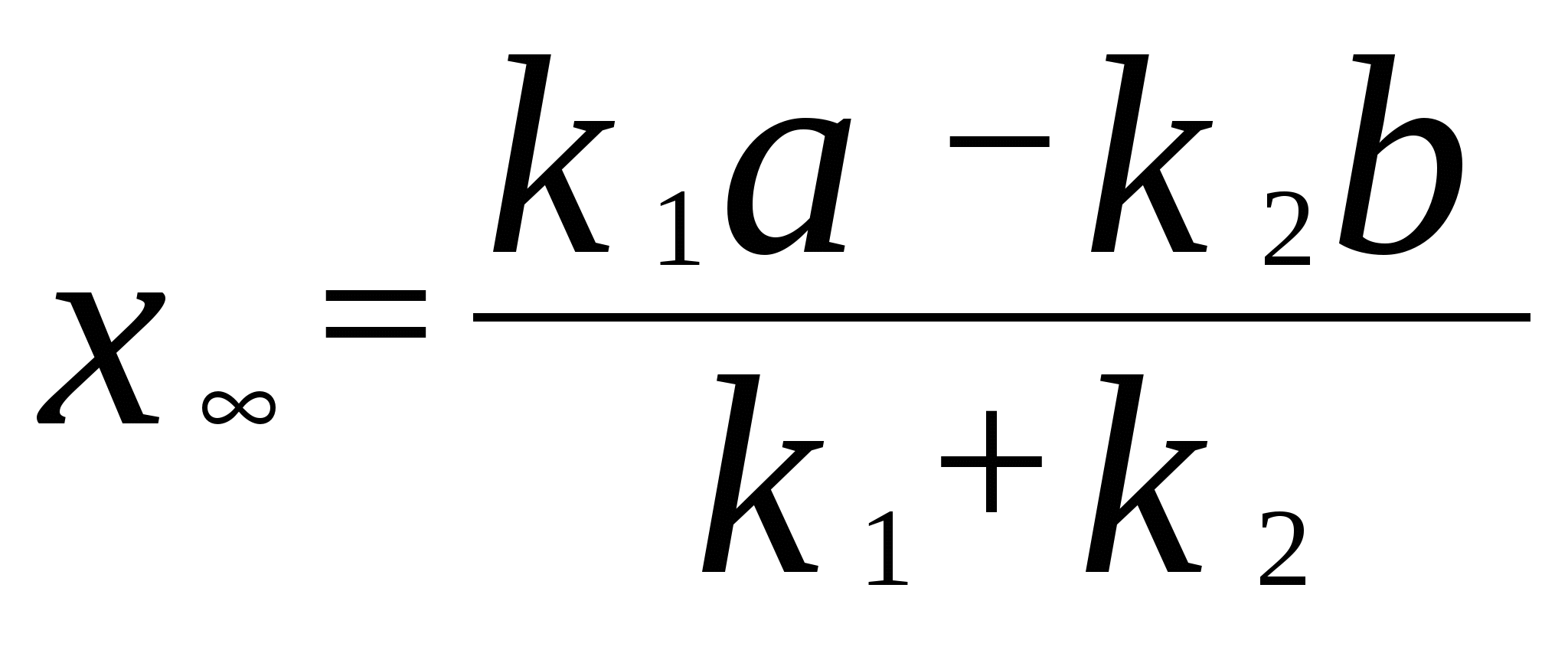 . .При t наступает равновесие, которое характеризуется константой равновесия 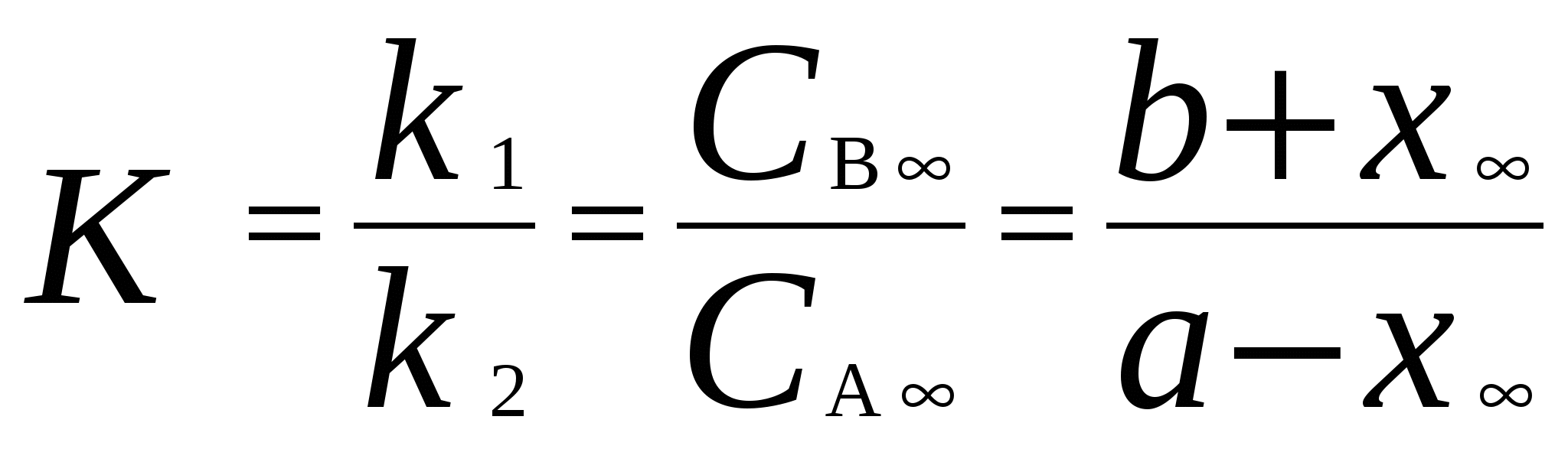 . .Вычисляем 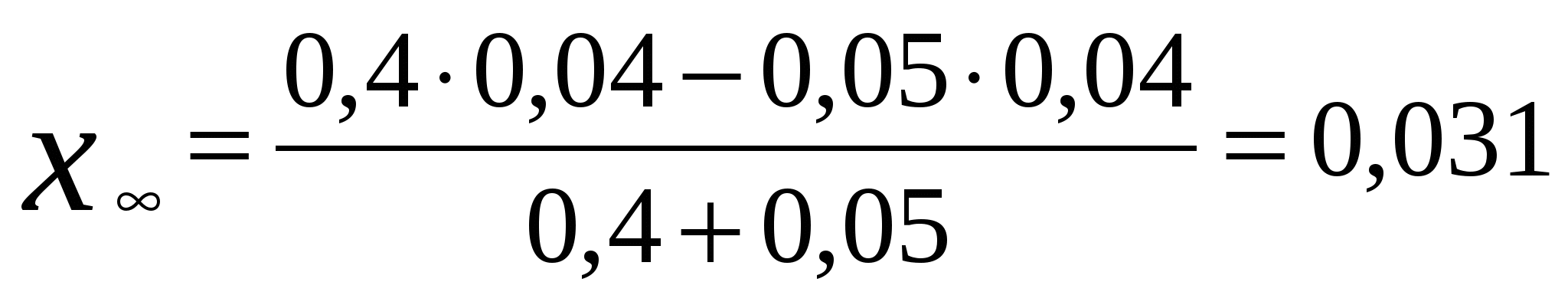 моль/л моль/лИз уравнения (* ) получаем С А = 0,04 – 0,0027 = 0,0373 моль/л; С В = 0,04 + 0,0027 = 0,0427 моль/л. Пример 17. В параллельных реакциях первого порядка: 1. А В ; (k 1 ) 2. A D ; (k 2 ) Выход вещества В равен 40 %, а время превращения А на 30 % равно 5 мин. Найти k1 и k2. Решение. Кинетическое уравнение для превращения вещества в двух параллельных реакциях первого порядка имеет вид 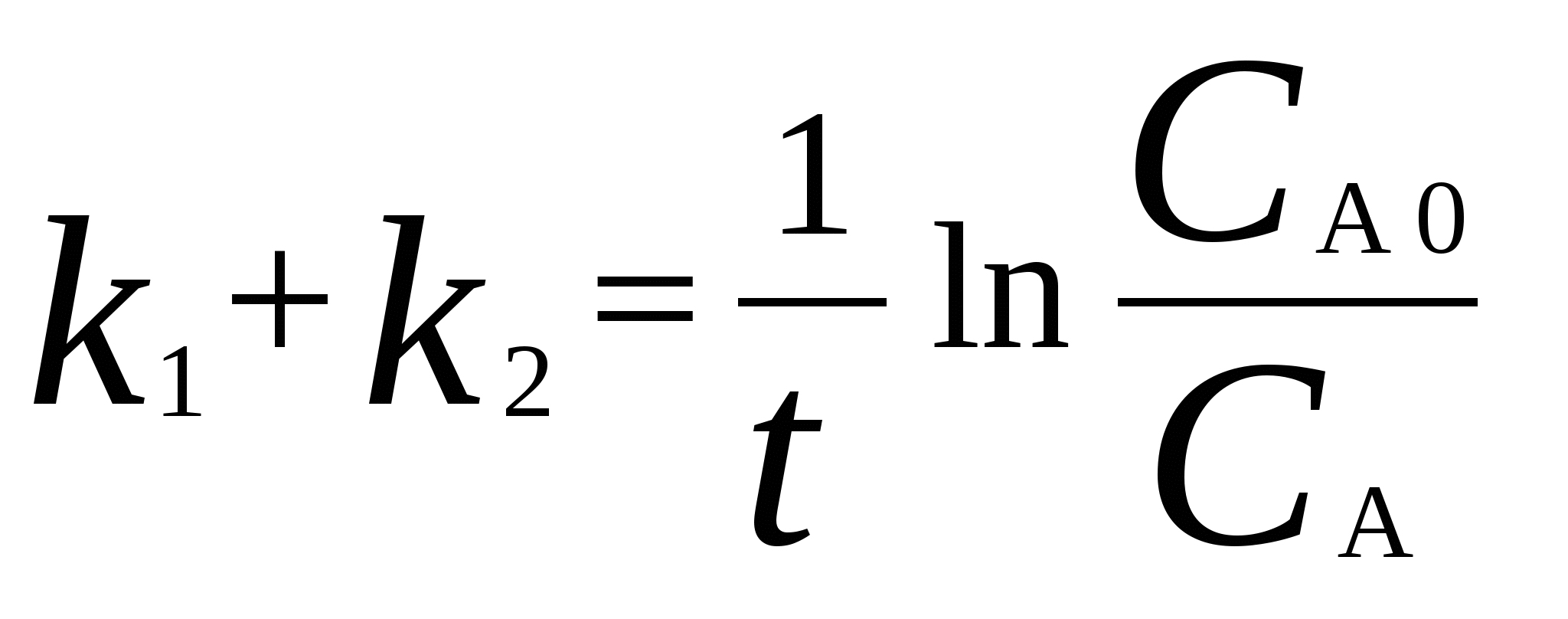 . .С учетом превращения вещества А на 30 % получаем уравнение: где а – начальная концентрация вещества А. Вычисляем Выход вещества В равен 40 %, следовательно выход вещества D – 60 %. Отношение этих выходов равно отношению конечных концентраций веществ В и D. Следовательно, отношение соответствующих констант скоростей равно: 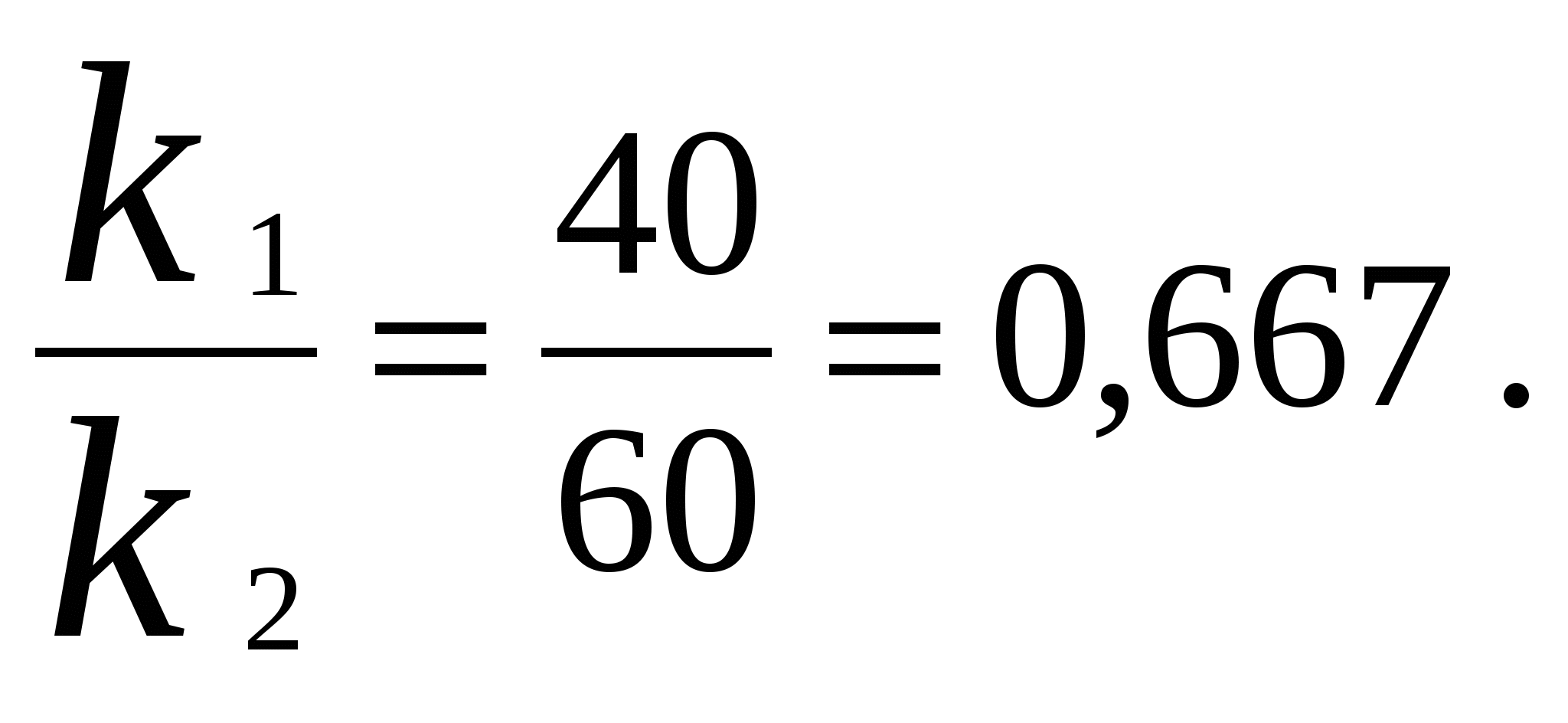 Решаем систему уравнений: k 1 = 0,667 k 2 , k 1 + k 2 = 0,071. 0,667 k 2 + k 2 = 0,071 ; k 2 = 0,043 мин – 1; k 1 = 0,028 мин – 1 . Пример 18. В системе осуществляется последовательная реакция Начальная концентрация вещества А равна 1 моль/л, вещества В и D в начальный момент в системе отсутствуют. Константы скорости равны k 1 = 0, 2 мин – 1 и k 2 = 0, 05 мин – 1 . Вычислите: 1) время достижения максимальной концентрации вещества В; 2) максимальную концентрацию вещества В; 3) время достижения концентрации С А = 0,01 моль/л. Решение. 1. Рассчитаем время, которое будет соответствовать максимальной концентрации промежуточного вещества В: 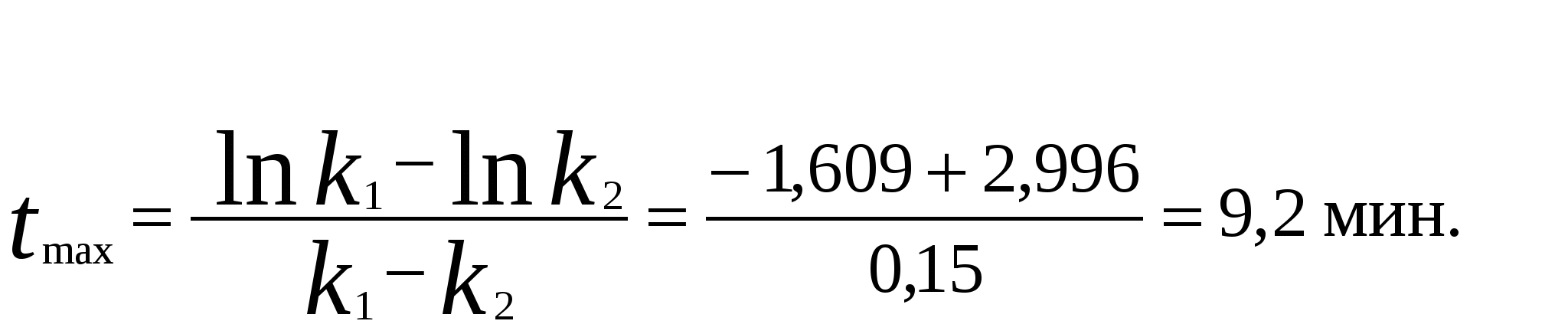 2. Рассчитаем концентрацию вещества А через время t max: 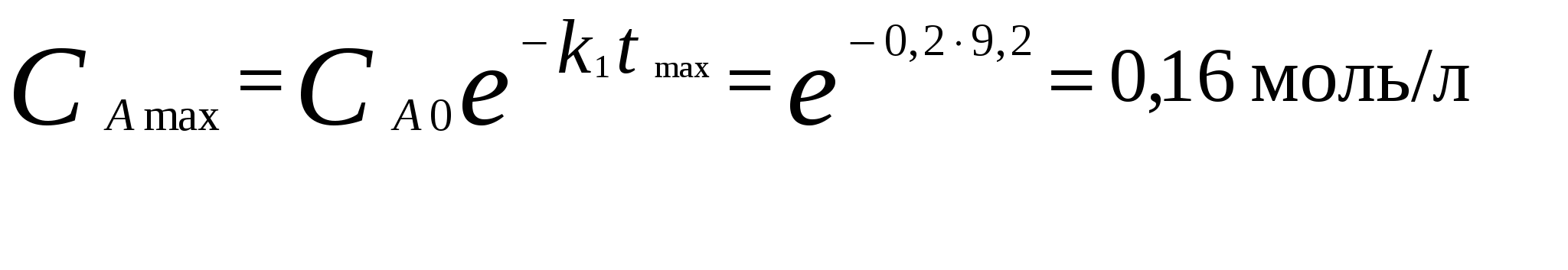 . .Максимальная концентрация промежуточного вещества равна: 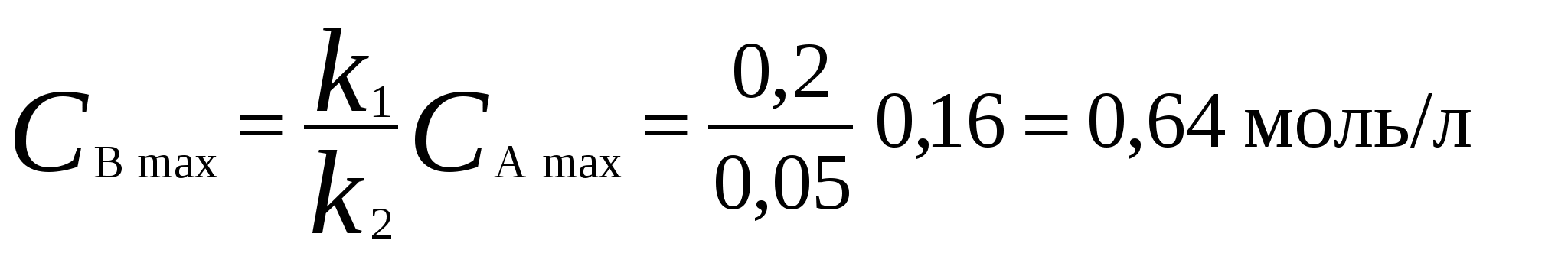 3. Рассчитаем время t x достижения концентрации С А = 0,01 моль/л: Пример 19. Реакция превращения пара-водорода в орто-водород протекает по следующему механизму (М – инертная частица): 1. п-Н 2 + М Н + Н + М ; 2. Н + п-Н 2 Н + о-Н 2 ; 3. Н + Н + М п-Н 2 + М . Пользуясь методом квазистационарных концентраций, получить выражение для скорости конверсии пара-водорода. Решение. Из уравнения (2) следует, что скорость образования орто-водорода равна: Метод квазистационарных концентраций применяем для активных атомов водорода 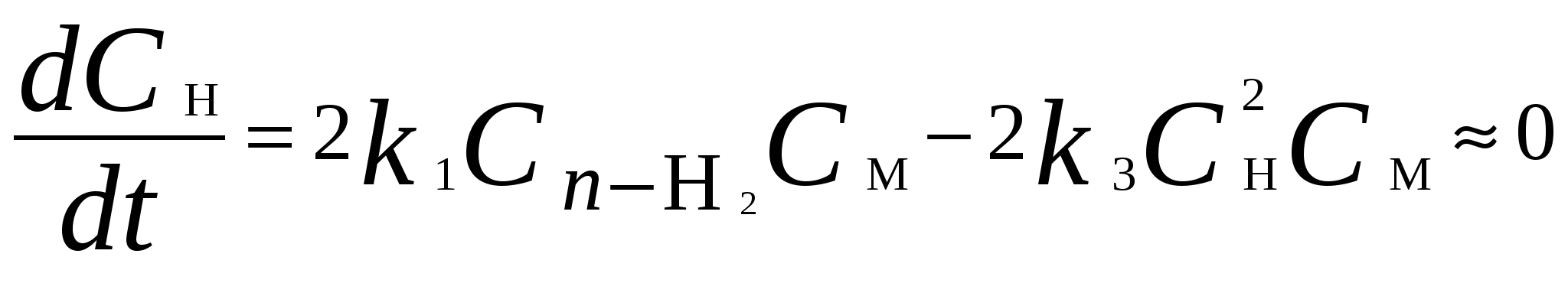 . .Из этого выражения следует, что 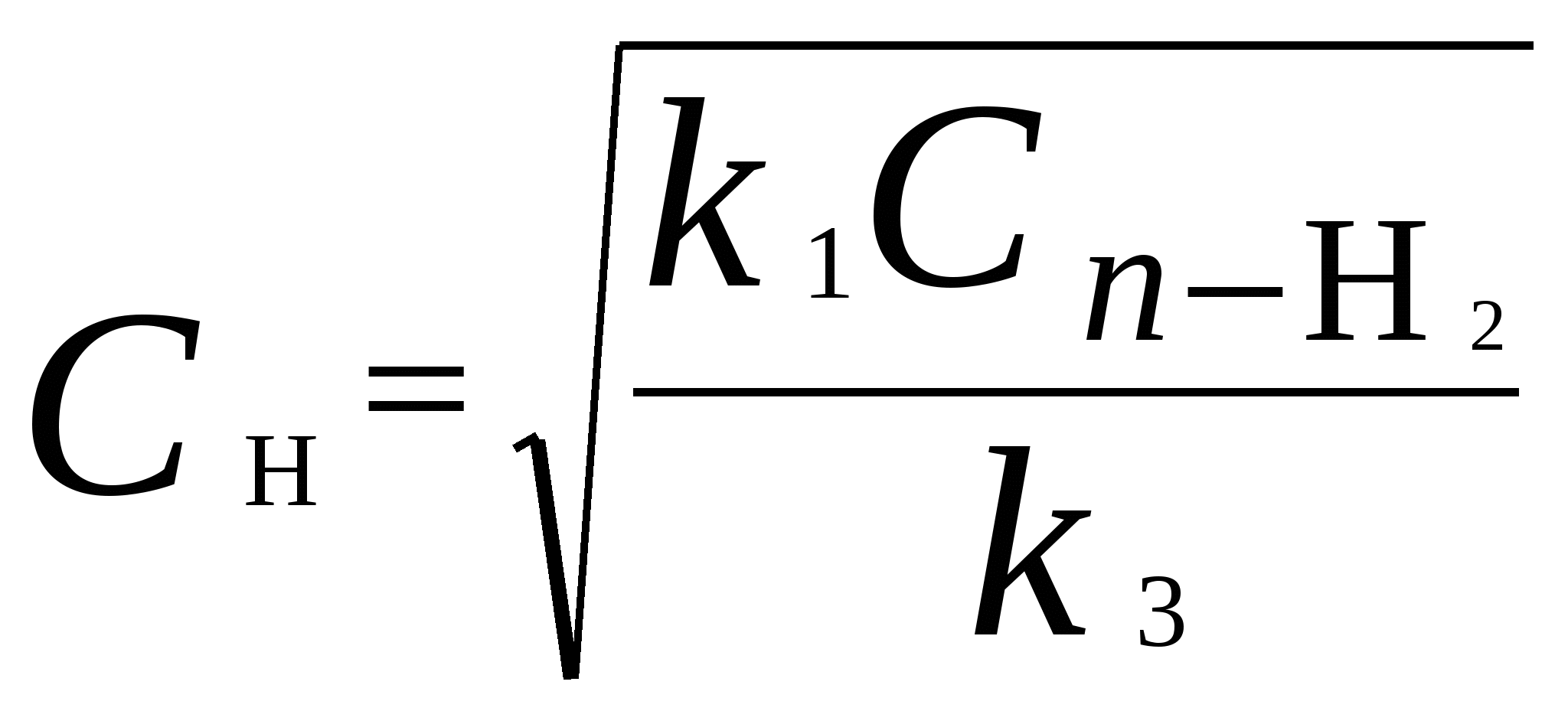 . .Заметим, что в реакции (2) число атомов Н не изменяется, поэтому скорость изменения их концентрации определяется первой и третьей реакциями. Таким образом, получаем 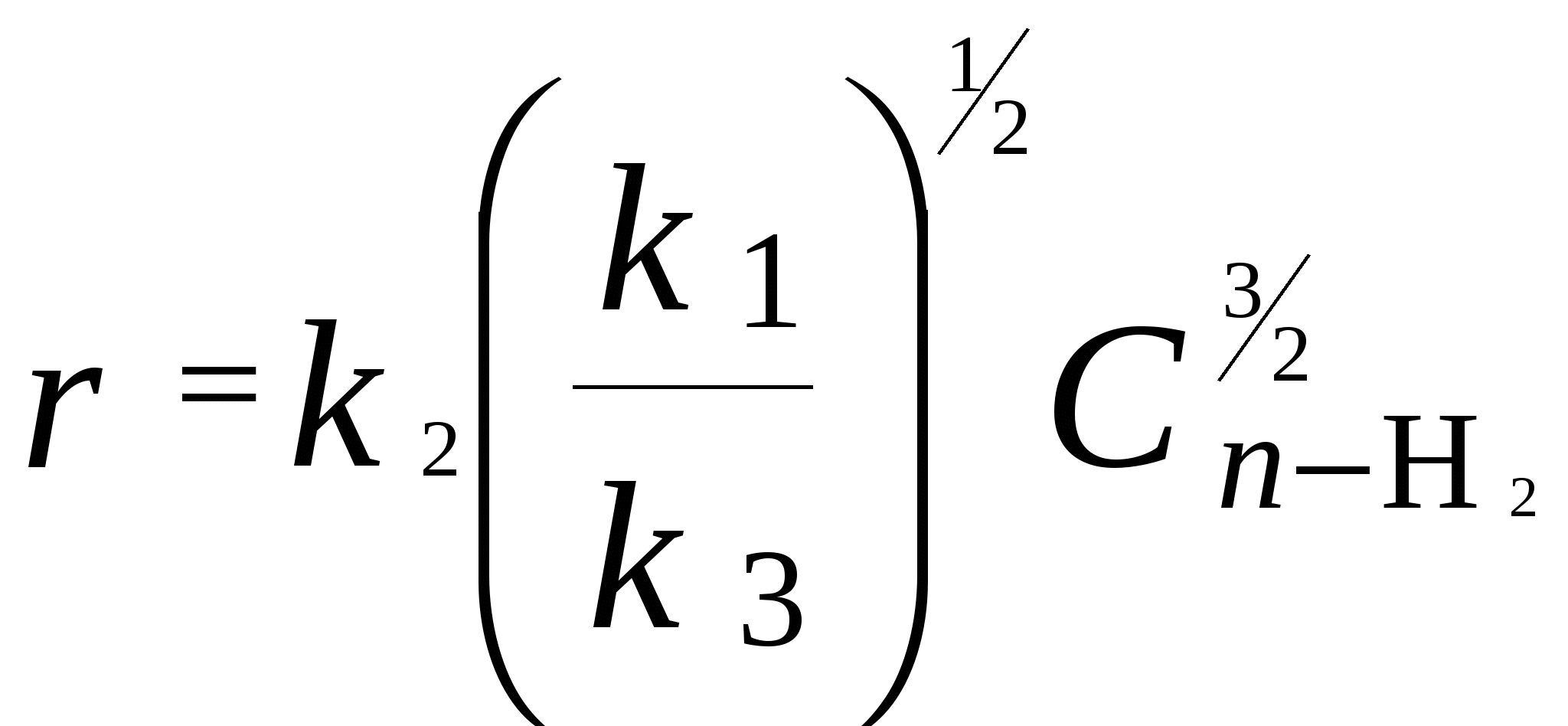 . .Задачи 163. Для обратимого процесса А В константы скоростей прямой и обратной реакций равны соответственно k 1 = 0,01 c – 1 и k 2 = 0,15 c – 1. Начальные концентрации веществ А и В взяты равными 0,2 моль/л. Определить концентрации этих веществ через 8 с. 164. Константа равновесия обратимой реакции А В равна 10, а константа скорости прямой реакции равна 0,2 с – 1. Определить время, за которое концентрации обоих веществ достигнут равенства, если вначале в системе содержалось только вещество А. 165. Для обратимой реакции А В начальные концентрации веществ равны С A0 = = 0,4 моль/л и С В0 = 0. Через 10 мин после начала реакции С A = 0,15 моль/ л и С В = = 0,25 моль/ л. Определить концентрацию вещества А через 20 мин, если константа равновесия реакции равна K = 3. 166. Константа скорости гомогенного мономолекулярного процесса цис-транс-изомеризации бутена при 417 0С равна 1,6 . 10 6 с – 1. Константа равновесия при этой температуре равна 1,14. В начальный момент времени в системе присутствует только цис-изомер. Вычислить время достижения равных концентраций изомеров. |
