Лаб. работы химия. Методические указания к выполнению лабораторных работ Иркутск 2011 оглавление
 Скачать 435.5 Kb. Скачать 435.5 Kb.
|
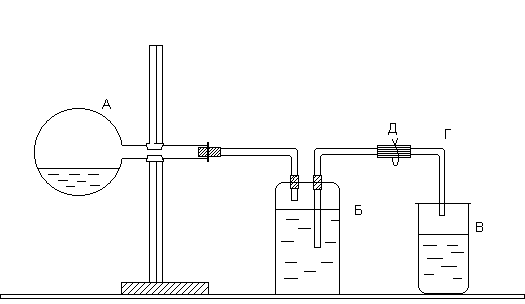
Лабораторная работа 2ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЦИНКАТеоретическое введение Эквивалент (Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях, или одному электрону в окислительно-восстановительных реакциях. Под реальной частицей понимают реально существующие соединения (NaOH, H2SO4, H2O), под условной – доли этих реальных частиц (1/2 H2SO4, ½ H2O). Эквивалент – безразмерная величина, состав которой выражают с помощью знаков и формул. Например, Э(NaOH) = NaOH; Э(H2SO4) = 1/2H2SO4; Э(MgCl2) = 1|2MgCl2; Э(Са) = 1/2Са. Единицей количества вещества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,02×1023 эквивалентов. Масса одного моля эквивалентов называется молярной массойэквивалентов(Мэк)и выражаетсяв г/моль. При определении молярной массы эквивалентов необходимо исходить из конкретной реакции, в которой участвует данное вещество. Молярная масса эквивалентов вещества В, участвующего в окислительно-восстановительной реакции, рассчитывается по формуле: где МВ – молярная масса вещества В; Например, в реакции Mg0 + 2H+Cl = Mg+2Cl2 + H20 степень окисления магния изменяется от 0 до +2. Следовательно, магний теряет 2 электрона, т.е. одному электрону эквивалентна условная частица ½ атома Mg. Э(Mg) = 1/2 Mg; Мэк(Mg) = У водорода степень окисления меняется от +1 до 0, а т.к. молекула водорода состоит из двух атомов, то число принятых электронов будет равно 2. Таким образом, одному электрону эквивалентна условная частица ½ молекулы Н2: Э(Н2) = 1/2 Н2; Мэк(Н2) = Закон эквивалентов: массы реагирующих друг с другом веществ пропорциональны их молярным массам эквивалентов: |