|
|
Лаб. работы химия. Методические указания к выполнению лабораторных работ Иркутск 2011 оглавление
В одну пробирку налейте 1-2 мл раствора уксусной кислоты CH3COOH, в другую – столько же раствора соляной кислоты HCl. Возьмите два приблизительно одинаковых по величине кусочка мрамора и бросьте по одному в каждую пробирку. Какой газ выделяется? В какой пробирке процесс идет более энергично?
Требования к результатам опыта:
1. Напишите молекулярные и ионные уравнения реакций взаимодействия мрамора (СаСО3) с CH3COOH и HCl.
2. Сделайте вывод, от концентрации каких ионов зависит скорость выделения газа. В растворе какой кислоты концентрация этих ионов больше?
3. Сделайте вывод об относительной силе исследованных кислот.
Опыт 2. Реакции, идущие с образованием осадка
Налейте в три пробирки по 1-2 мл хлорида железа (III) FeCl3, сульфата магния MgSO4, сульфата меди CuSO4 и прибавьте в каждую по такому же количеству щелочи. Наблюдайте образование осадков, отметьте цвет. Осадки сохраните до следующего опыта.
Требование к результатам опыта:
Составьте молекулярные и ионные уравнения реакций образования осадков гидроксидов железа (III), магния и меди.
Опыт 3. Реакции, идущие с образованием слабого электролита
К полученным в предыдущем опыте осадкам гидроксидов железа, магния и меди прилейте раствор соляной кислоты до полного их растворения.
Требования к результатам опыта:
1. Составьте молекулярные и ионные уравнения реакций растворения осадков в кислоте гидроксидов железа (III), магния и меди.
2. Объясните растворение осадков.
Опыт 4. Реакции, идущие с образованием газа
Налейте в пробирку 1-2 мл раствора карбоната натрия, прилейте в нее раствор соляной кислоты. Наблюдайте выделение газа.
Требование к результатам опыта:
Составьте молекулярные и ионные уравнения реакции взаимодействии Na2CO3 с HCl.
Опыт 5. Амфотерные электролиты
В одну пробирку налейте 2-3 мл раствора хлорида цинка ZnCl2, другую – столько же сульфата хрома (III) Cr2(SO4)3. Затем в каждую пробирку добавьте разбавленный раствор щелочи NaОН до выпадения осадков гидроксидов. В каждом случае осадки разделите на две пробирки. В одну из пробирок прилейте раствор соляной кислоты, а в другую – раствор щелочи до растворения осадков.
Требования к результатам опыта:
1. Составьте молекулярные и ионные уравнения реакций образования осадков Zn(OH)2 и Cr(OH)3.
2. Составьте молекулярные и ионные уравнения реакций растворения осадков гидроксидов цинка и хрома (III) в кислоте и щелочи.
3. Запишите уравнения диссоциации полученных гидроксидов по типу кислот и по типу оснований.
Лабораторная работа 6
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Теоретическое введение
Окислительно-восстановительными реакциями называются реакции, сопровождающиеся изменением степени окисления элементов. Под степенью окисления понимают заряд атома элемента в соединении, вычисленный исходя из предположения, что вещество состоит из ионов.
Окисление – процесс отдачи электронов атомом, молекулой или ионом, сопровождающийся повышением степени окисления. Восстановление – процесс присоединения электронов, сопровождающийся понижением степени окисления.
П
роцесс окисления
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8
П
роцесс восстановления
Окисление и восстановление – взаимосвязанные процессы, протекающие одновременно.
Окислителями называются вещества (атомы, ионы или молекулы), которые в процессе реакции присоединяют электроны, восстановителями – вещества, отдающие электроны. Окислителями могут быть галогены (F2, CL2, Br2, I2), кислород O2, положительно заряженные ионы металлов (Fe3+, Au3+, Hg2+, Cu2+, Ag+), сложные ионы и молекулы, содержащие атомы металла в высшей степени окисления (KMnO4, K2Cr2O7, NaBiO3 и др.), атомы неметаллов в положительной степени окисления (HNO3, концентрированная H2SO4, HClO, KClO3, NaBrO и др.).
Типичными восстановителями являются почти все металлы и многие неметаллы (углерод, водород) в свободном состоянии, отрицательно заряженные ионы неметаллов (S2-, N3-, I‾, Br‾, Cl‾ и др.), положительно заряженные ионы металлов в низшей степени окисления (Sn2+, Fe2+, Cr2+, Mn2+, Cu+ и др.).
Соединения, содержащие элементы в максимальной и минимальной степенях окисления, могут быть соответственно или только окислителями (KMnO4, K2Cr2O7, HNO3, H2SO4, PbO2), или только восстановителями (KI, Na2S, NH3). Если же вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции оно может быть и окислителем, и восстановителем. Например, нитрит калия KNO2, содержащий азот в степени окисления +3, пероксид водорода H2O2, содержащий кислород в степени окисления -1, в присутствии сильных окислителей проявляют восстановительные свойства, а при взаимодействии с активными восстановителями являются окислителями.
При составлении уравнений окислительно-восстановительных реакций рекомендуется придерживаться следующего порядка:
1. Написать формулы исходных веществ. Определить степень окисления элементов, которые могут ее изменить, найти окислитель и восстановитель. Написать продукты реакции.
2. Составить уравнения процессов окисления и восстановления. Подобрать множители (основные коэффициенты) так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
3. Расставить коэффициенты в уравнении реакции.
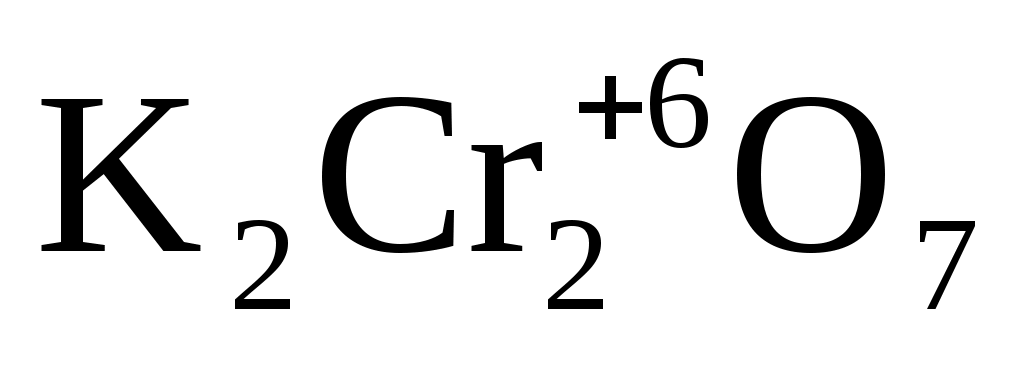 + 3H2S-2 + 4H2SO4 = Cr2 +3(SO4)3 + 3S0 + K2SO4 + 7H2O + 3H2S-2 + 4H2SO4 = Cr2 +3(SO4)3 + 3S0 + K2SO4 + 7H2O
ок-ль восст-ль среда
S-2 - 2e → S0 ½3 - окисление
2Cr+6 + 6e → 2Cr+3 ½1 - восстановление
Характер многих окислительно-восстановительных реакций зависит от среды, в которой они протекают. Для создания кислой среды чаще всего используют разбавленную серную кислоту, для создания щелочной - растворы гидроксидов натрия или калия.
Различают три типа окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные, диспропорционирования. Межмолекулярные окислительно-восстановительные реакции - это реакции, в которых окислитель и восстановитель находятся в разных веществах. Рассмотренная выше реакция относится к этому типу. К внутримолекулярным относятся реакции, в которых окислитель и восстановитель находятся в одном и том же веществе.
2KCl+5O3-2 = 2KCl-1 + 3O20
Сl+5 + 6e → Cl‾ ½2 Cl+5 - окислитель
2O-2 - 4e → O20 ½3 O-2 - восстановитель
В реакциях диспропорционирования (самоокисления - самовосстановления) молекулы одного и того же вещества реагируют друг с другом как окислитель и как восстановитель.
3K2Mn+6O4 + 2H2O = 2KMn+7O4 + Mn+4O2 + 4KOH
Mn+6 - e → Mn+7 ½ 2 Mn+6 - восстановитель
Mn+6 + 2e → Mn+4 ½ 1 Mn+6 – окислитель
Выполнение работы
|
|
|
 Скачать 435.5 Kb.
Скачать 435.5 Kb.

