Лаб. работы химия. Методические указания к выполнению лабораторных работ Иркутск 2011 оглавление
 Скачать 435.5 Kb. Скачать 435.5 Kb.
|
Данные опыта и результаты расчетов
2. Вычислить: а) Массу выделившегося объема водорода, пользуясь уравнением Менделеева-Клапейрона: где P – парциальное давление водорода, кПа; V – объем выделившегося водорода, л; m – масса водорода, г; M – молярная масса водорода, г/моль; Т – температура опыта, К; R – универсальная газовая постоянная, равная 8,314 Дж/моль·К. В нашем опыте водород собирается над водой и потому содержит водяной пар. Общее давление газа в приборе равно атмосферному, а складывается оно из парциальных давлений водорода и водяного пара. Для вычисления парциального давления водорода нужно из величины атмосферного давления вычесть величину давления насыщенного водяного пара при температуре опыта (табл.2). Р = Р1 - Р2. б) Молярную массу эквивалентов цинка Мэк,пр.(Zn) по закону эквивалентов: в) Теоретическое значение молярной массы эквивалентов цинка Мэк,т.(Zn): Мэк,т.(Zn) = г) Относительную ошибку опыта Е: Таблица 2 Давление насыщенного водяного пара при различных температурах
Лабораторная работа 3 ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ Теоретическое введение Химические реакции сопровождаются выделением или поглощением энергии (чаще всего теплоты). Реакции, протекающие с выделением теплоты, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы ΔН. При экзотермической реакции энтальпия системы уменьшается и ΔН<0, а при эндотермической – энтальпия системы увеличивается и ΔН>0. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то в этом случае энтальпию реакции называют стандартной и обозначают ΔН0. Уравнения химических реакций, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими уравнениями. Например, термохимическое уравнение СаО(К) + Н2O(Ж) = Са(ОН)2(К), ΔН0 = -65,3 кДж показывает, что при взаимодействии 1 моль СаО и 1 моль воды образуется 1 моль Са(ОН)2 и выделяется количество теплоты, равное 65,3 кДж. Определение тепловых эффектов может быть осуществлено опытным путем с помощью калориметра или путем вычислений. В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции (т. е. изменение энтальпии ΔН) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса. Часто в термохимических расчетах применяют следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Например, стандартная энтальпия реакции nА + mВ == рС + qD рассчитывается по формуле ΔН0х..р = ( р ΔfН0 С + q ΔfН0 , Р ) − (n ΔfН0 А + mΔfН0B ), где ΔfН0 – стандартная энтальпия образования соединения. Стандартной энтальпией образованиявеществаназываетсястандартная энтальпия реакции получения 1 моль данного вещества из простых веществ. Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н+ + ОН‾ = Н20 (1) Поэтому тепловой эффект реакции нейтрализации должен быть постоянным, независимо от взятых кислоты и щелочи. Выполнение работы Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из двух стаканов – внешнего и внутреннего, между которыми имеется изоляция из фольги. В сухой внутренний стакан калориметра с помощью мерного цилиндра налейте 25 мл раствора серной кислоты. В другой сухой стакан налейте мерным цилиндром 25 мл раствора щелочи. Опустите в раствор кислоты термометр. Запишите температуру и, не вынимая термометр из стакана, быстро влейте в кислоту щелочь. Осторожно помешивая раствор термометром, отметьте и запишите максимальную температуру. Эту температуру считайте конечной. Требования к результатам работы: 1. Полученные данные занесите в таблицу.
2. Вычислить: а) Количество выделившейся при реакции теплоты АН по формуле ΔH = -V где V – общий. объем раствора, мл; Примите плотность раствора после нейтрализации равной 1 г/мл, а тепло емкость его, равной теплоемкости воды, т. е. 4,18 Дж/г ∙ К. б) Тепловой эффект реакции нейтрализации в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л (1000мл) раствора, а для реакции было взято 25 мл, то в) Теоретическое значение теплоты реакции нейтрализации г) Относительную ошибку опыта (Е): 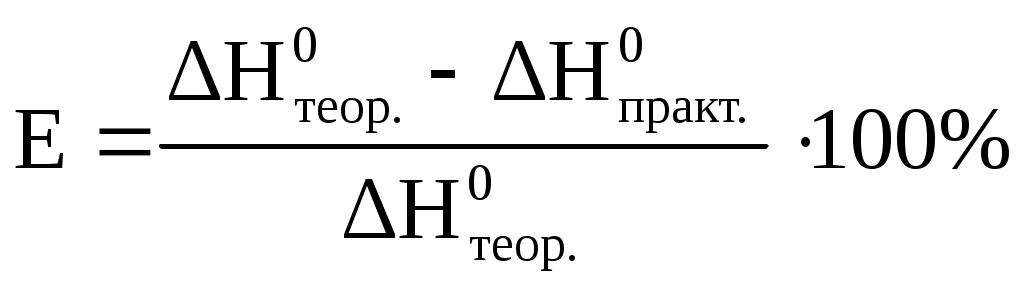 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
