Лаб. работы химия. Методические указания к выполнению лабораторных работ Иркутск 2011 оглавление
 Скачать 435.5 Kb. Скачать 435.5 Kb.
|
Опыт 1. Влияние среды на окислительно-восстановительные реакцииВ три пробирки налейте по 2-3 мл раствора перманганата калия KMnO4. В первую пробирку прилейте 1-2 мл разбавленной серной кислоты H2SO4, во вторую 1-2 мл воды, в третью - 1-2 мл концентрированного раствора щелочи (NaOH или KOH). В каждую пробирку добавьте по 2-3 мл свежеприготовленного раствора сульфита натрия Na2SO3. Отметьте наблюдения. Учтите, что фиолетовая окраска характерна для ионов MnO4-, бесцветная или слабо-розовая для ионов Mn2+, зеленая - для ионов MnO42-, бурый цвет имеет осадок MnO2. Требования к результатам опыта: 1. Составьте уравнения реакций взаимодействия KMnO4 с Na2SO3 в кислой, щелочной и нейтральной среде. В каждой реакции укажите окислитель, восстановитель, среду, процессы окисления и восстановления. Расставьте коэффициенты. 2. Сделайте вывод о характерной степени окисления марганца в кислой, щелочной и нейтральной среде. Опыт 2. Окислительно-восстановительная двойственность нитрита калия В две пробирки налейте по 2-3 мл раствора нитрита калия KNO2. Добавьте в каждую из них по 1-2 мл разбавленной серной кислоты. Затем в одну из них прилейте раствор дихромата калия K2Cr2O7, в другую – раствор иодида калия KI. Что наблюдается? Требования к результатам опыта: 1. Составьте уравнения реакций. Укажите в каждой реакции окислитель, восстановитель, среду, процессы окисления и восстановления. Расставьте коэффициенты. 2. Сделайте вывод об окислительно-восстановительных функциях KNO2 в проведенных реакциях. 3. Сделайте общий вывод, какие вещества могут проявлять окислительно-восстановительную двойственность. Опыт 3. Реакция диспропорционированияПоместите в пробирку 1-2 кристалла йода I2, 3-5 капель концентрированного раствора щелочи NaOH (или KOH). Как меняется цвет раствора? Требования к результатам опыта: 1. Напишите уравнение реакции, учитывая, что продуктом окисления йода в щелочной среде является йодат натрия NaIO3 (или KIO3). 2. Сделайте общий вывод, какие вещества могут участвовать в реакциях диспропорционирования. Опыт 4. Внутримолекулярная реакцияВ сухую пробирку поместите небольшое количество кристаллов перманганата калия KMnO4 и осторожно нагрейте. Во время нагревания поднесите к отверстию пробирки тлеющую лучину. Что наблюдается? Нагревание продолжайте до прекращения выделения газа. Охладите пробирку и прилейте немного воды. Слейте pаствор с осадка диоксида марганца (MnO2) и разбавьте водой. Какова окраска раствора? Требования к результатам опыта: 1. Закончите уравнения реакций: KMnO4 K2MnO4 + Н2О = В каждой реакции укажите окислитель, восстановитель, процессы окисления и восстановления. Расставьте коэффициенты. 2. Сделайте вывод, к какому типу ОВР относится каждая из реакций. Лабораторная работа 7 ЖЁСТКОСТЬ ВОДЫТеоретическое введение Жёсткость воды обусловливается присутствием в ней солей кальция и магния. Различают временную (карбонатную) и постоянную (некарбонатную) жёсткость. Временную жёсткость придают воде гидрокарбонаты, постоянную – сульфаты и хлориды кальция и магния. Сумма временной и постоянной жёсткости составляет общую жёсткость воды. Жёсткая вода непригодна для употребления в промышленности и быту. С этим связана проблема устранения жёсткости воды. Временную жёсткость можно устранить кипячением воды. При этом гидрокарбонаты разлагаются, переходя в малорастворимые соединения. Постоянную жёсткость устраняют обработкой воды карбонатом или фосфатом натрия, образующими осадки с ионами Са2+ и Мg2+. В настоящее время для устранения жёсткости воды широко используется ионный обмен, осуществляемый с помощью природных или синтетических ионитов. Жёсткость воды выражается числом миллимолей эквивалентов ионов Са2+ и Мg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль эквивалентов жёсткости отвечает содержанию 20,04 мг/л ионов Са2+ или 12,16 мг/л ионов Мg2+. Для определения общей жёсткости воды используется метод комплексонометрии. В основе этого метода лежит титрование воды в присутствии аммиачного буферного раствора и индикатора раствором комплексона III (трилона Б) до перехода винно-красной окраски в синюю. При анализе применяют индикатор хромоген чёрный ЕТ-00. В присутствии ионов Са2+ и Мg2+ этот индикатор окрашивается в красный цвет, при отсутствии - в синий. Трилон Б - двузамещённая натриевая соль этилендиаминтетрауксусной кислоты: N 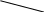 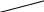 aOOCCH2 CH2COONa aOOCCH2 CH2COONa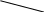 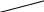 N - CH2 - CH2 - N N - CH2 - CH2 - NHOOCCH2 CH2COOH При титровании жёсткой воды раствором трилона Б образуется внутрикомплексное соединение: N   aOOCCH2 CH2COONa aOOCCH2 CH2COONa    N - CH2 - CH2 - N N - CH2 - CH2 - N  OOCCH2 CH2COO OOCCH2 CH2COO |


 М
М
 СО3‾ + Н2О Н2СО3 + ОН‾
СО3‾ + Н2О Н2СО3 + ОН‾