неорганика. Методические указания содержат теоретические сведения по основным разделам курсов Общая и неорганическая химия
 Скачать 0.73 Mb. Скачать 0.73 Mb.
|
Основные понятия и законы химии. Основные газовые законы. Закон парциальных давлений. Теоретические сведения Единицей количества вещества является моль. Моль – это количество вещества, которое содержит столько структурных единиц (молекул, атомов, ионов, катионов, электронов, эквивалентов и т.д.), сколько атомов содержится в 12 г изотопа углерода – 12, а именно, 6,02 . 1023 (число Авогадро). Эквивалентом элемента или вещества называется такое его количество, которое соединяется с одним молем атомов водорода или замещает один моль водорода в химических реакциях. Массу одного моля эквивалентов называют молярной массой эквивалентов вещества (Мэ), г/моль. Молярная масса эквивалента элемента в соединении не является величиной постоянной, зависит от валентности элемента в данном соединении и выражается уравнением где М – молярная масса элемента, г/моль; Z – валентность элемента в данном соединении; 1/z – фактор эквив алентности. Молярные массы эквивалентов сложных соединений рассчитываются по формулам: где n – число атомов кислорода; Z – валентность кислорода где основность кислоты – это общее число атомов водорода или число атомов водорода, замещенных в реакции атомами металла. Например, основность фосфорной кислоты в реакции H3PO4 + 2 NaOH = Na2HPO4 + 2 H2O равна 2, т.к. 2 атома водорода заместилось атомами натрия. где кислотность основания – это общее число OH- - групп или число OH- - групп, замещенных в процессе реакции кислотными остатками. Например, кислотность гидроксида алюминия в реакции Аl(ОН)3 + 2 НС1 = А1(OH)С12 + 2 H2O равна 2, т.к. 2 группы OH- заместились двумя хлорид-ионами (Cl-). где n – число атомов металла; Z – валентность металла. Согласно закону эквивалентов вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. 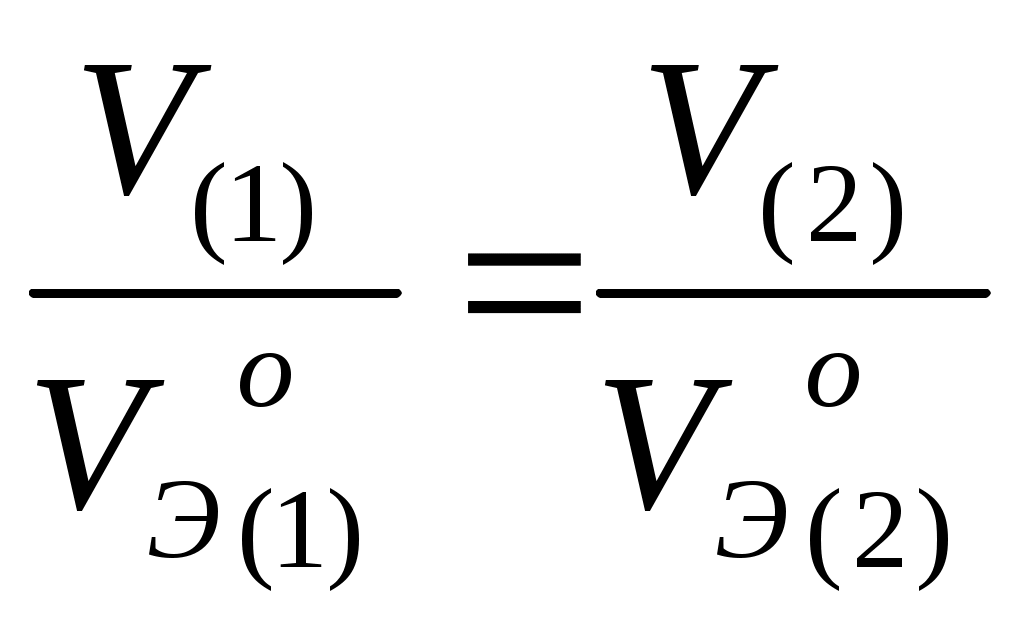 При решении некоторых задач удобнее пользоваться другой формулировкой этого закона: массы (объемы) всех веществ, реагирующих между собой в химических реакциях, прямо пропорциональны их молярным массам эквивалентов (молярным объемам эквивалентов). 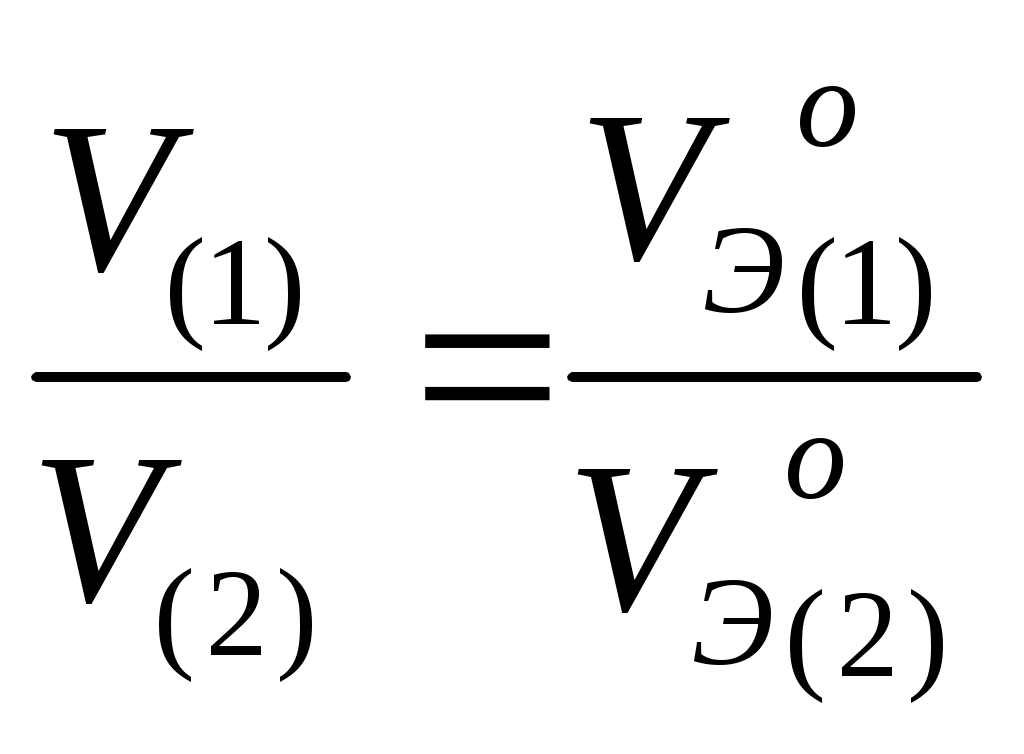 где m1 и m2 – масса веществ, вступивших или получившихся в результате реакции, г; Mэ1, Мэ2 – молярные массы эквивалентов этих веществ, г/моль; V1, V2 – объемы газообразных веществ при н.у.; V10 и V20 – объем, который занимает эквивалент вещества при н.у. Молярный объем эквивалента вещества Vэо – это объем, занимаемый одним моль эквивалентом газообразного вещества, при нормальных условиях. Газовые законы и расчет молярных масс газообразных веществ 1. Уравнение Бойля-Мариотта и Гей-Люссака где V – объем газа, измеренный при реальных условиях, т.е. при атмосферном давлении Р и температуре Т; V0 – объем газа при нормальном давлении Р0 и температуре Т0. Используют для приведения объема к нормальным условиям. 2. Закон Авогадро: в равных объемах разных газов при одинаковом давлении и температуре содержится одинаковое число молекул. В одном моле содержится 6,022·1023 молекул (число Авогадро). При нормальных условиях (T= 273К, p = 101,325 кПа или 760 мм рт.ст.) моль любого газа занимает объем 22,4 л. Теперь несложно рассчитать молярные объемы эквивалентов наиболее распространенных в реакциях газов Н2 и О2. Один моль Н2 (2г) занимает объем 22,4 л, а один эквивалент Н2(1г) – V л, следовательно, Vэ(Н2) = 11,2 л/моль. Аналогичным образом рассчитывается Vэ(О2) = 5,6 л/моль. 3. Молярную массу газа можно вычислить, пользуясь уравнением Клапейрона – Менделеева где Р – давление, кПа; V – объем, л; m- масса, г; М – молярная масса, г/моль; R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К); Т – абсолютная температура, К. 4. Из закона Авогадро следует, что при одном и том же давлении и температуре массы равных объемов газов относятся как их молярные массы где D = m1/m2 -относительная плотность D первого газа по второму, m1 – масса первого газа, m2 – масса второго газа. 5. Закон Дальтона (закон парциальных давлений). Парциальным давлением (po) газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Согласно закону: общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь. |
