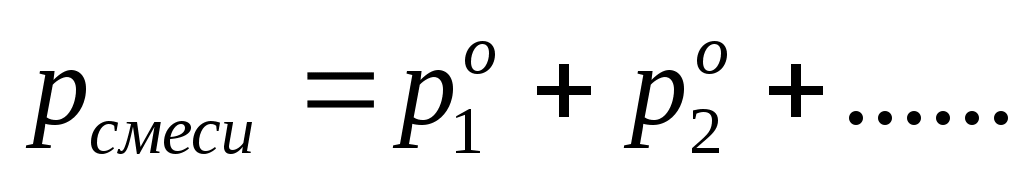
Задачи
1. (Р.77) При н.у. масса 0,5×10-3 м3 газа равна 1,806*10×-3 кг. Определите плотность газа по диоксиду углерода СО2 и метану СН4, а также молекулярную массу газа.
Ответ: 1,84, 5,05, 80,9 × 10-9 кг.
2. (Р.83) Объем резиновой камеры автомобильной шины равен 0,025 м3, давление в ней 5,0665 × 105 Па. Определите массу воздуха, находящегося в камере, при 20°С.
Ответ: 0,15 кг.
3. (Р.86) Определите массу паров толуола в помещении объемом 30 м3 при 25°С. Давление паров толуола при этой температуре равно 2972 Па.
Ответ: 3,31 кг.
4. (Р.88) Определите массу 10-3 м3 газовой смеси, содержащей (по объему) 50 % водорода и 50 % диоксида углерода (н.у.).
Ответ: 1,02 × 10-3 кг.
5. (Р.89) Газ (н.у.) занимает объем 1 м3. При какой температуре объем газа утроится, если давление газа не меняется?
Ответ: 819 К.
6. (Р.92) Какую массу СаСО3 надо взять, чтобы получить при его прокаливании диоксид углерода, занимающий объем 25 × 10-6 м3 при 15°С и давлении 104000 Па?
Ответ: 0,109 × 10-3 кг.
7. (Р.94) Из 5 × 10-3 кг хлората калия КСlО3 было получено 0,7 × 10-3 м3 кислорода, измеренного при 20°С и давлении 111900 Па. Определите массовую долю примесей в хлорате калия.
Ответ: 48 %.
8. (С.1) Будет ли одинаковым количество молекул в равных объемах водорода и кислорода: а) при нормальных условиях; б) при температуре 25°С и давлении 1 атм; в) если условия, при которых измерены объемы водорода и кислорода, различны?
9. (С.9) При какой температуре 1 л хлора будет весить 1 г, если давление равно 1 атм?
Ответ: 863 К.
10. (С.15) Сосуд емкостью 112 л, заполненный воздухом под давлением 1 атм, весит
2,5 кг. Каков будет вес этого сосуда, если его наполнить хлором под давлением 5 атм?
Ответ: 4,13 кг.
11. (С.32) Литр одного газа, взятого при нормальных условиях, весит 1,43 г, второго – 0,09 г. Найдите число молекул во взятых объемах газа. Исключите лишние данные из задачи. Проведите расчет.
Ответ: 2,69 × 1022.
12. (С.35) Сколько молекул азота и кислорода будет находиться при нормальных условиях в 896 мл газовой смеси, состоящей по объему 50 % азота и 50 % кислорода? Исключите лишние данные из задачи. Проведите расчет.
Ответ: 2,41 × 1022.
13. (С.60) Определите плотность смеси окиси и двуокиси углерода по водороду, если известно, что окись углерода составляет 20 % по объему. Найдите массу 1 л такой смеси при температуре 27°С и давлении 1 атм.
Ответ: 20,4, 1,66 г.
14. (С.68) Объем смеси окиси углерода с кислородом равен 200 мл. После сгорания всей окиси углерода за счет находившегося в смеси кислорода и приведения объемов газов к первоначальным условиям было получено 150 мл новой смеси газов. Определите в процентах объемный состав исходной смеси.
Ответ: 50 %.
15. (С.76) Смесь водорода с азотом, объем которой измерен при определенных условиях, сожгли в избытке кислорода. После окончания реакции и приведения газов к первоначальным условиям (вода сконденсировалась) уменьшение объема газов оказалось равным объему исходной смеси водорода с азотом. Определите объемной соотношение газов в смеси.
Ответ: 2 : 1.
16. (С.92) В замкнутом сосуде имеется 100 молей азота и водорода в отношении 1:3. Давление смеси 300 атм. Определите состав и давление смеси после того, как 10 % азота вступили в реакцию и газы приведены к первоначальной температуре.
Ответ: 285 атм.
17. (С.100) В замкнутом сосуде при температуре 0°С находилось 3 л кислорода и 4 л водорода. Как изменится давление в сосуде, если одно из веществ прореагирует полностью, после чего будет восстановлена первоначальная температура?
Ответ: в 7 раз.
18. (П.122) Какой из благородных газов находится в смеси с аммиаком, если известно, что при нормальном давлении и 80°С ее плотность равна 0,5165 г/л?
Ответ: Не.
19. (П.130) В смеси аммиака и азота число атомов в 3,4 раза больше числа молекул. Выясните относительную плотность этой газовой смеси по воздуху.
Ответ: 0,700.
20. (Г.21) Даны 480 л газа при 17°С и 104 кПа. Приведите объем газа к нормальным условиям: 0°С и 101,3 кПа.
Ответ: 464 л.
21. (Г.25) Даны 8 л газа при –23°С. При какой температуре объем газа станет равным 10 л, если давление останется неизменным?
Ответ: 39,5°С.
22. (Г.27) В закрытом баллоне находится газ при температуре –3°С под некоторым давлением. До какой температуры должен быть нагрет газ, чтобы давление внутри баллона выросло на 20 %?
Ответ: 51°С.
23. (Г.41) Баллон вместимостью 10 л содержит при 27°С моль кислорода. Вычислите давление кислорода в баллоне.
Ответ: 249 кПа.
24. (Г.42) В закрытом баллоне вместимостью 40 л находится 77 г СО2. Манометр, присоединенный к баллону, показывает давление 106,6 кПа. Вычислите температуру газа.
Ответ: 20,2°С.
25. (Г.56) Из 3 г смеси СаСО3 и MgCО3 получено 760 мл СО2 (при 20°С и 99,7 кПа). Вычислите количественное соотношение СаСО3 и MgCО3.
Ответ: 4:1.
26. (Г.58) Соединение содержит 46,15 % углерода, остальное – азот. Плотность по воздуху равна 1,79. Найдите истинную формулу соединения.
Ответ: C2N2.
27. (Г.67) При сжигании некоторого соединения азота с водородом полечено из
0,24 г Н2О и 168 мл азота (при 0°С и 101,3 кПа). Плотность пара азотсодержащего вещества по воздуху 1,1. Какова истинная формула вещества?
Ответ: N2H4.
28. (Г.128) Сколько молекул содержится в 1 мл любого газа, измеренного при нормальных условиях (при 0°С и 101,3 кПа)?
Ответ: 2,7 × 1019.
29. (Г.136) Сколько лет потребуется для того, счтобы пересчитать число молекул, которое содержится в 1 г воды, если отсчитывать по одной молекуле в секунду? (Считать год равным
365 дням).
Ответ: 1,06 × 1015.
30. (Р.96) При 0°С в сосуде объемом 14 × 10–3 м3 содержится 0,8 × 10–3 кг водорода и 6,30 × 10–3 кг азота. Определите парциальное давление азота и общее давление смеси.
Ответ: 36479,43; 101331,75 Па.
31. (Р.97) В газометре над водой при 20°С и давлении 98500 Па находится 8 × 10–3 м3 кислорода. Давление водяного пара при 20°С равно 2335 Па. Какой объем (н.у.) займет кислород, находящийся в газометре?
Ответ: 7,07 × 10–3 м3.
32. (Р.98) Газовая смесь состоит из 5 × 10–3 м3 азота, находящегося под давлением
95940 Па, и 3 × 10–3 м3 кислорода. Объем смеси 8 × 10–3 м3. Общее давление газовой смеси 104200 Па. Под каким давлением взят кислород?
Ответ: 117967 Па.
33. (Р.99) 0,2 × 10–3 м3 водорода собраны над водой при 33°С и давлении 96000 Па. Определите объем сухого водорода (н.у.). упругость насыщенного водяного пара при 33°С равна 5210 Па.
Ответ: 1,59 × 10–4 м3.
34. (Р.100) В газонаполненных лампах содержится смесь газов, имеющая объемный состав: 86 % Ar и 14 % N2. Рассчитайте парциальное давление каждого из газов, если общее давление равно 39990 Па.
Ответ: 34391,4; 5598,6 Па.
35. (Р.101) Водород объемом 3 × 10–3 м3 находится под давлением 100500 Па. Какой объем аргона под таким же давлением надо прибавить к водороду, чтобы при неизменном общем давлении парциальное давление аргона в смеси стало равным 83950 Па?
Ответ: 15,2 × 10–3 м3.
36. (Р.102) Газовая смесь составлена из 5 × 10–3 м3 метана под давлением 96000Па,
2 × 10–3 м3 водорода под давлением 84000Па и 3 × 10–3 м3 диоксида углерода под давлением 109000Па. Объем смеси 8 × 10–3 м3. Определите парциальные давления газов в смеси и общее давление смеси.
Ответ: 60000; 21000; 40875; 121875 Па.
37. (Р.104) Равновесная смесь CO + Cl2 « COCl2, содержащая 0,7 кмоль СО, 0,2 кмоль Cl2 и 0,5 кмоль COCl2, находится под давлением 105 Па. Найдите парциальные давления газов
в смеси.
Ответ: 50000; 14300; 35700 Па.
38. (Р.105) В закрытом сосуде объемом 6 × 10–3 м3 находится при 10°С смесь, состоящая из 8,8 × 10–3 кг диоксида углерода, 3,2 × 10–3 кг кислорода и 1,2 × 10–3 кг метана. Вычислите общее давление газовой смеси, парциальные давления газов и их объемные доли (%).
Ответ: 147061,00; 78432,51; 39216,25; 29412,19 Па; 53,33; 26,67; 20 %.
39. (Г.69) Смешаны 4 г СН4 и 24 г О2. Выразите состав газовой смеси в процентах по объему.
Ответ: 25 и 75 %.
40. (Г.70) Смешаны при нормальных условиях 56 л СН4 и 112 л О2. Выразите состав газовой смеси в процентах по массе.
Ответ: 20 и 80 %.
41. (Г.71) Вычислите парциальные давления кислорода азота и кислорода в воздухе, приняв давление воздуха 101,3 кПа (воздух содержит 21 % О2 и 78 % N2 по объему).
Ответ: 21,3; 79 кПа.
42. (Г.72) Вычислите процентное содержание кислорода и азота в воздухе по массе. Масса 1 л воздуха (0°С и 101,3 кПа) составляет 1,293 г.
Ответ: 23,2 и 75,5 %.
43. (Г.75) Вычислите массу 70 мл кислорода, собранного над водой при 7°С и 102,3 кПа. Давление пара воды при той же температуре равно 1 кПа.
Ответ: 97,5 мг.
44. (Г.76) Какой объем займут 0,12 г кислорода, если собрать газ над водой при 14°С и 102,4 кПа. Давление пара воды при той же температуре составляет 1,6 кПа.
Ответ: 88,7 мл.
45. (Г.81) Сколько молей кислорода и азота содержится в аудитории размером 6´8´5 м при 22°С и 100,0 кПа?
Ответ: 2055 и 7635 моль.
46. (Г.83) В камеру вместимостью 1 м3 заключили 15 моль N2, 25 моль СО2 и 10 моль О2. Вычислите: а) общее давление смеси газов при 27°С; б) процентный состав смеси по массе;
в) процентный состав смеси по объему; г) парциальное давление каждого из газов при заданной температуре.
Ответ: 125 кПа; 22,8; 59,8; 17,4 %; 30; 50 и 20 %; 37,4; 62,3; 24,9 кПа.
47. (Г.85) В каком объеме воздуха (0°С и 101,3 кПа) содержится 1 мг аргона? Воздух содержит 0,93 % аргона по объему.
Ответ: 60 мл.
Концентрация
Теоретические сведения
Раствор – гомогенная система состоящая из двух или нескольких компонентов. Чаще раствор состоит из двух компонентов растворителя и растворенного вещества.
Отношение количества или массы вещества, содержащегося в системе (например, в растворе), к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации.
Молярная концентрация (СМ) или молярность – это отношение количества растворенного вещества (n), содержащегося в растворе, к объему (V) этого раствора. Единица измерения – моль/л.
 , , 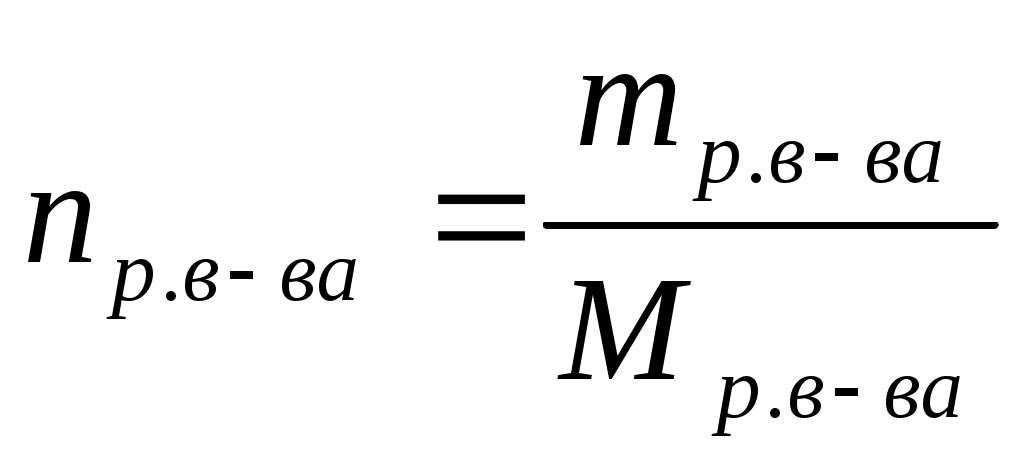 , , 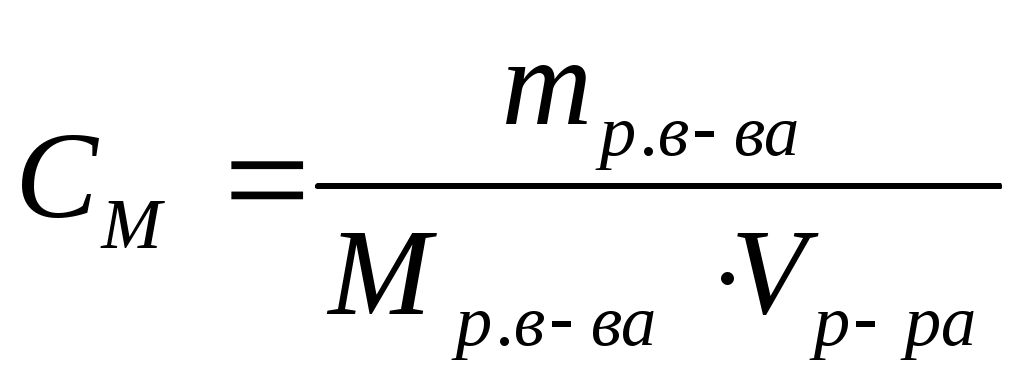 . .
Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают 1М раствор; соответственно, раствор, имеющий концентрацию 0,5 моль/л, обозначают 0,5 М.
Нормальная (эквивалентная) концентрация (СН) или нормальность – это отношение количества эквивалентов растворенного вещества к объему раствора. Единица измерения –
моль-экв./л
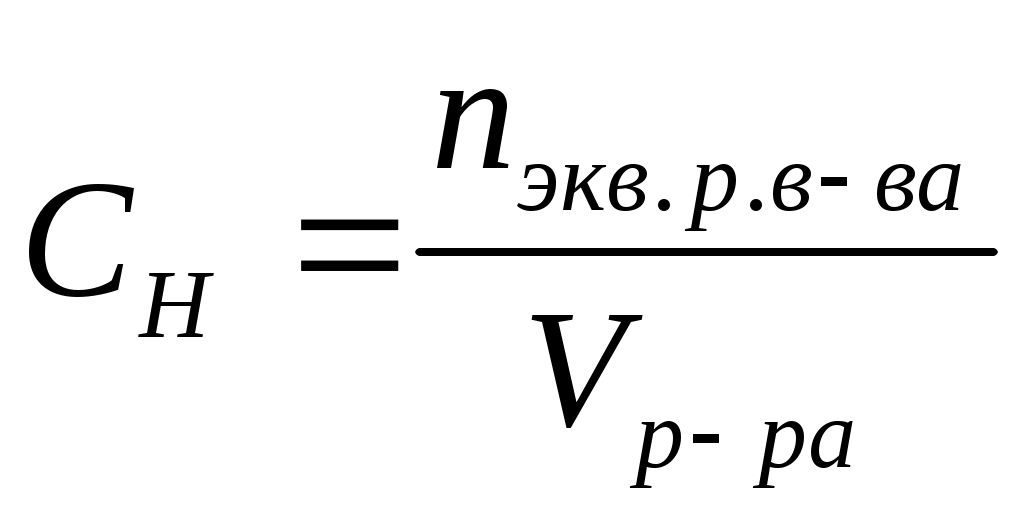 , , 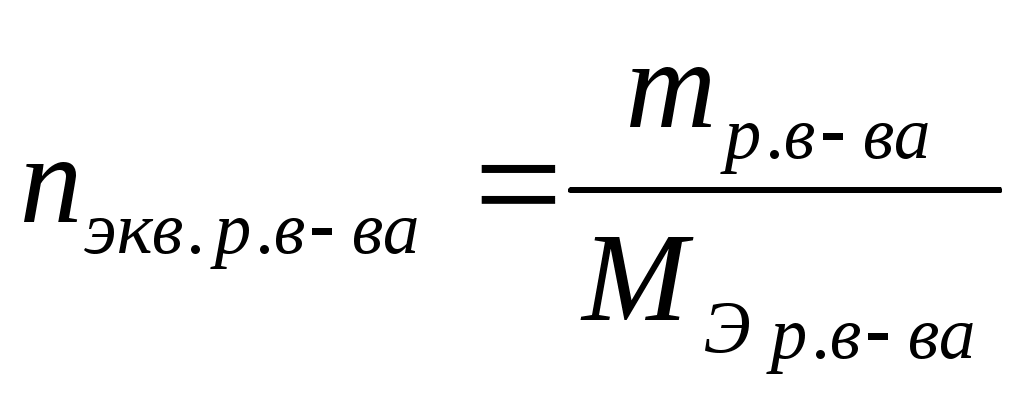 , , 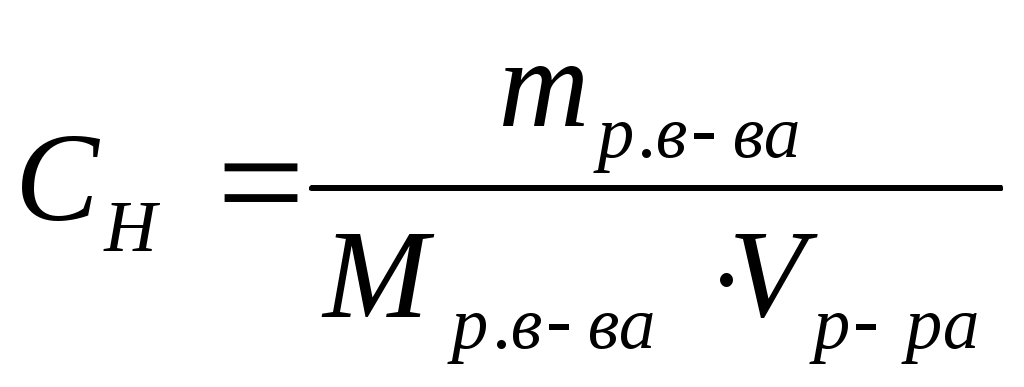 . .
Раствор, в 1 литре которого содержится 1 моль-эквивалент вещества, называют нормальным и обозначают 1 н. Соответственно, могут быть 1 н., 0,01 н. и т.п. растворы.
Моляльная концентрация (Сm) или моляльность – это отношение количества растворенного вещества к массе (m) растворителя. Единица измерения – моль/кг.
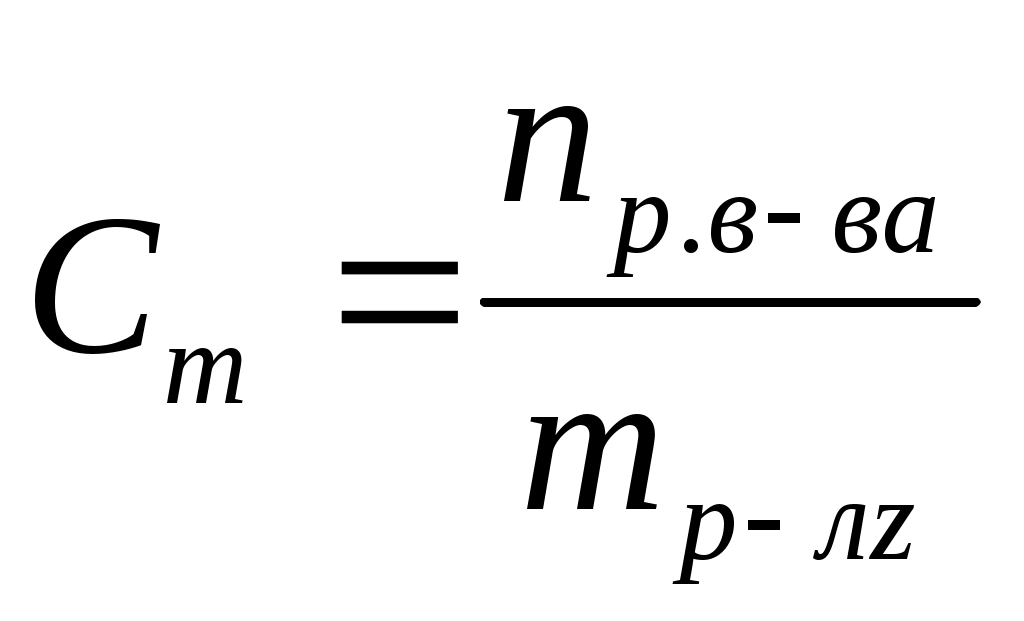 , , 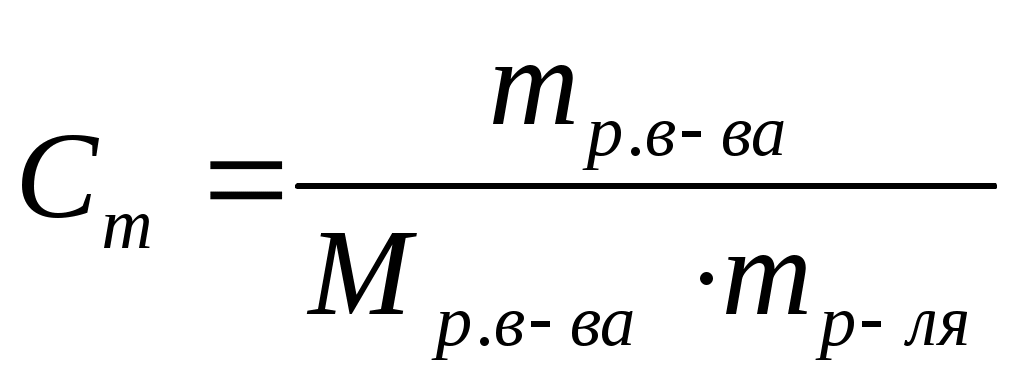
Массовая доля (ω) – отношение массы растворенного вещества к общей массе всего раствора. Массовая доля может быть выражена в долях единицы, процентах (%).
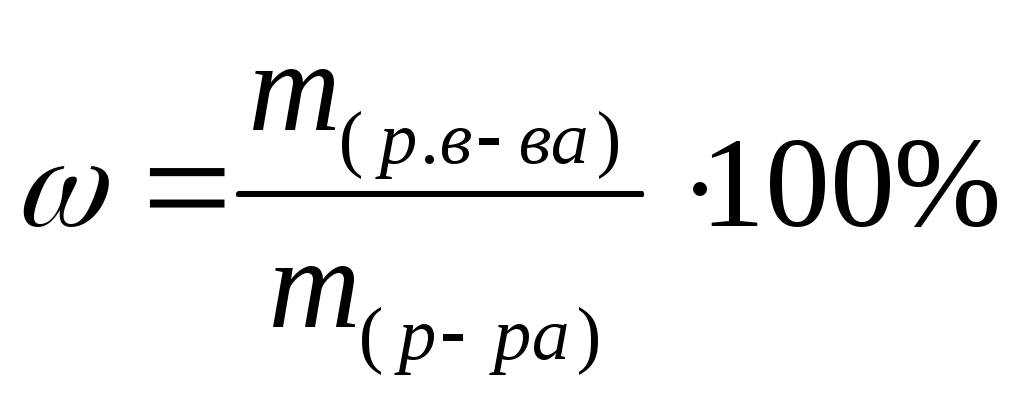 . .
Массовая доля, выраженная в процентах, показывает, сколько граммов растворенного вещества содержится в 100 граммах раствора.
Пример: запись 35% раствор HCl означает, что в 100 г раствора содержится 35 г растворенного вещества (HCl) и 65 г растворителя (воды).
Мольная доля (N) –это отношение количества растворенного вещества к общему сумме количеств растворенного вещества и растворителя.
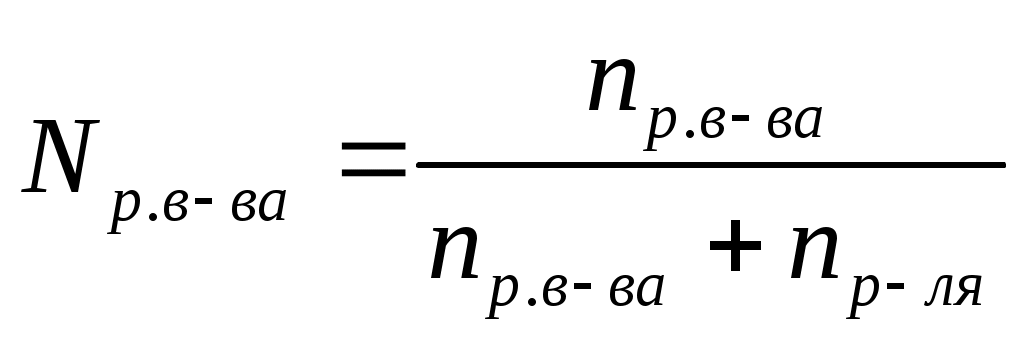 , , 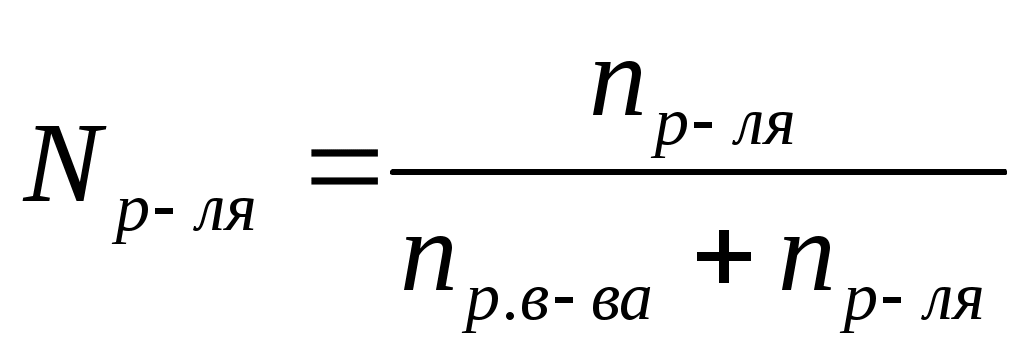 , , 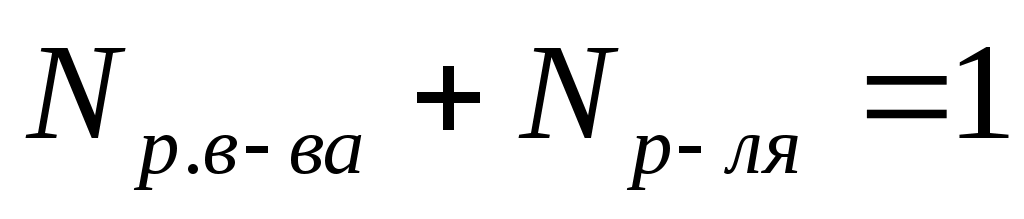
Титр раствора (Т) – это масса вещества, содержащегося в 1 см3 или в 1 мл раствора. Единица измерения титра – г/см3, г/мл.
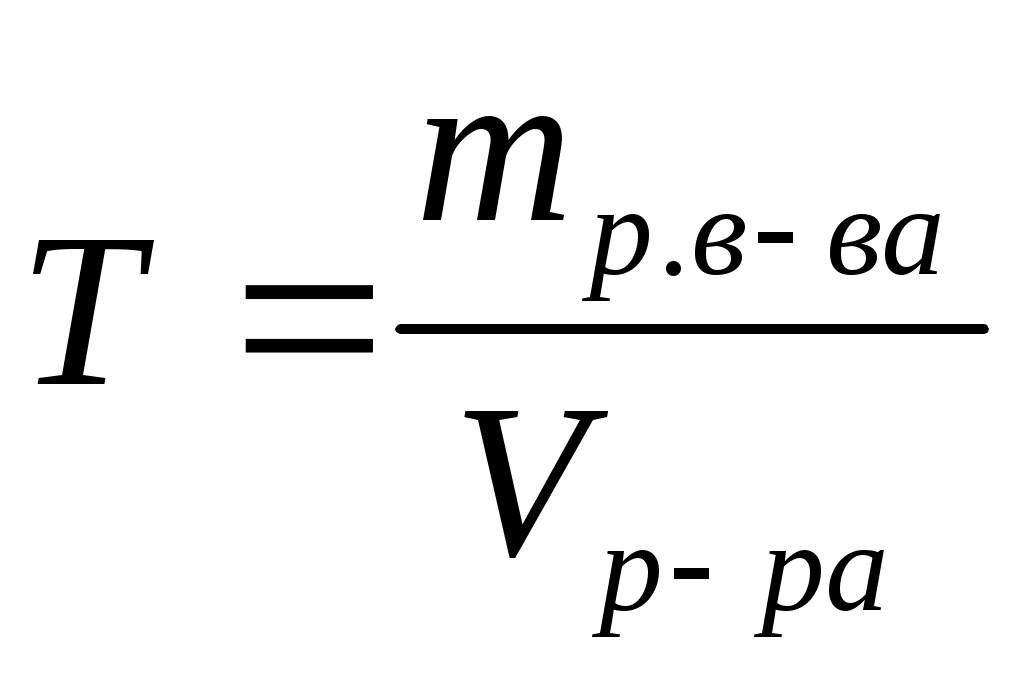 , , 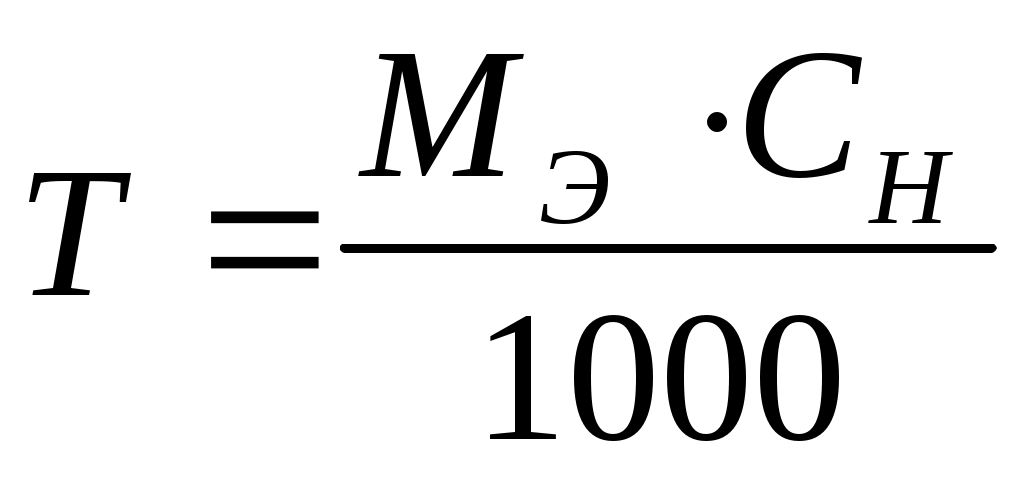 . .
ПРАВИЛО СМЕШИВАНИЯ (ПРАВИЛО «КРЕСТА»)
Применяют для быстрого расчета масс или объемов при приготовлении раствора из двух растворов различной концентрации
Задача: Рассчитать и приготовить 3 кг 30% раствора H2SO4 из 98% раствора H2SO4 (ρ=1,86 г/мл) и воды. Рассчитать объем 98% раствора и объем воды необходимые для приготовления заданного раствора.
Составляем крест
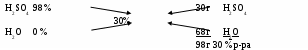
В левый столбик записываем исходные растворы и их процентные концентрации, причем процентная концентрация воды равна 0 %. Далее между ними посередине записываем ту концентрацию, которую необходимо приготовить, и по направлению стрелок вычитаем из большего значения меньшее и по диагонали записываем полученное число. В правой части получили весовые соотношения двух исходных растворов. Общая масса полученного 30 %-го раствора равна сумме 30 г 98% H2SO4 + 68 г H2O = 98 г.
Для приготовления 98 г (30%) р-ра необходимо взять 30 г H2SO4 (98 %) и добавить
68 г воды. Затем находим массу m 98 % р-ра H2SO4, необходимую для приготовления 3 кг
30 % р-ра H2SO4. Составляем пропорцию:
1) Для приготовления 98 г (30 %) нужно взять 30 г (98 %) р-ра H2SO4
3000 г (30 %) X г
X = 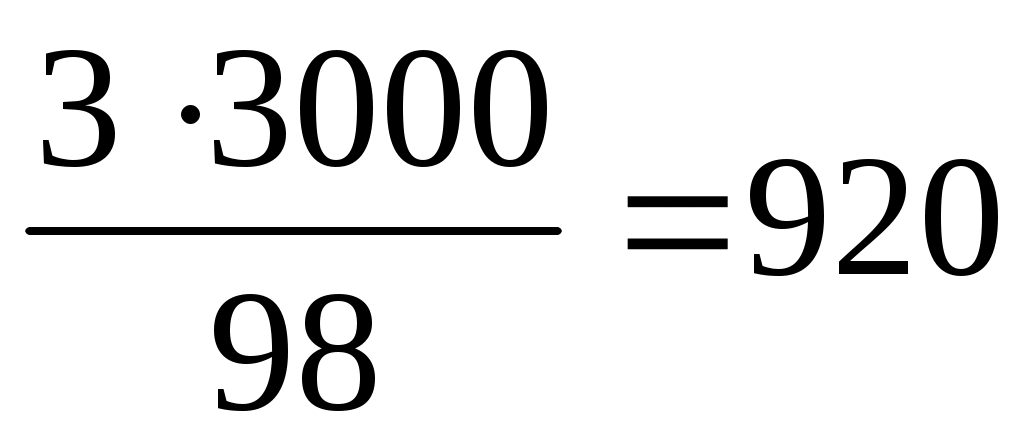 г (98 % р-ра H2SO4). г (98 % р-ра H2SO4).
Рассчитываем объем: 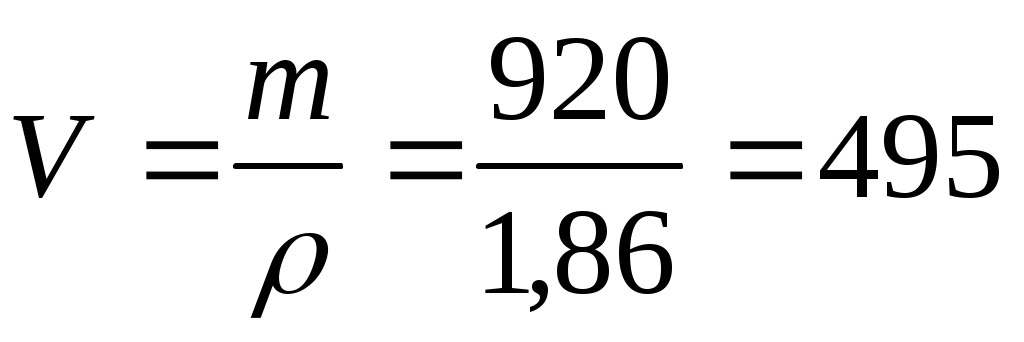 мл (98 % р-ра H2SO4) мл (98 % р-ра H2SO4)
2) 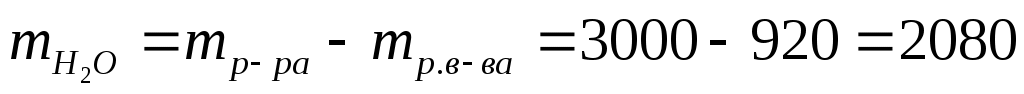 г г
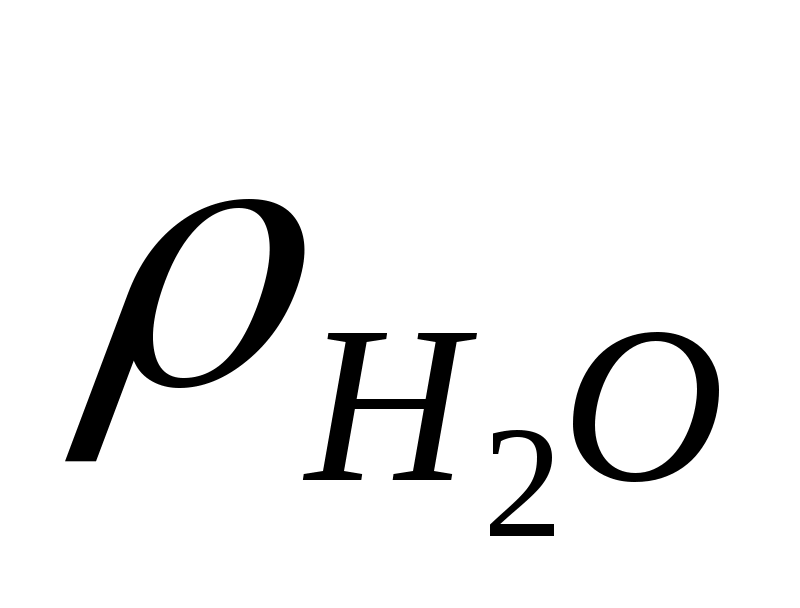 =1 г/мл, следовательно, =1 г/мл, следовательно, 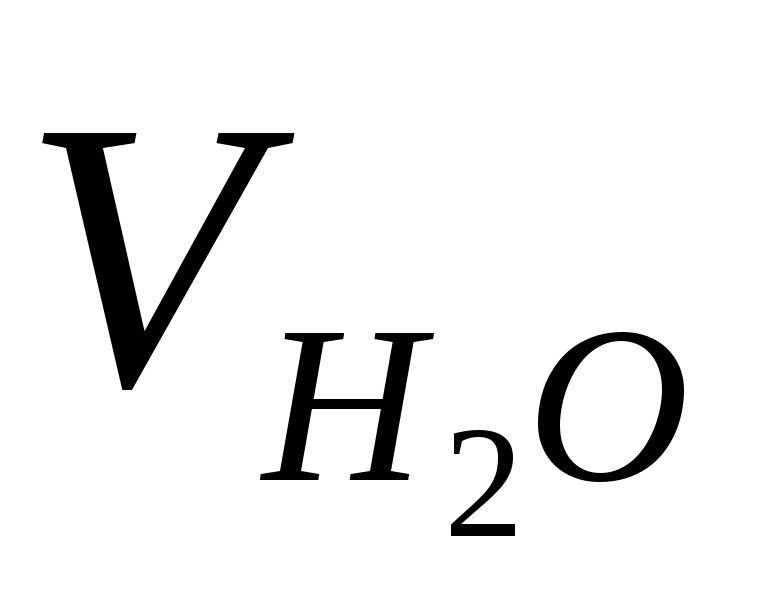 = 2080 мл = 2,08 л. = 2080 мл = 2,08 л.
Итак, для приготовления 3 кг 30% р-ра H2SO4 нужно отмерить 2,08 л дистиллированной воды и добавить 0,495 л 98% H2SO4.
Задачи
48. (Р.383) Какая масса HCl содержится в 0,250 л раствора соляной кислоты с массовой долей 10,52 % (r = 1050 кг/м3)?
Ответ: 27,6 г.
49. (Р.384) 0,6 л раствора гидроксида калия содержит 16,8 г КОН. Чему равна молярная концентрация этого раствора?
Ответ: 0,5 моль/л.
50. (Р.385) Какая масса BaCl2 содержится в 0,025 л 0,25 н. раствора?
Ответ: 0,65 г.
51. (Р.386) Вычислите молярную концентрацию K2SO4, в 0,02 л которого содержится
2,74 г растворенного вещества.
Ответ: 0,73 моль/л.
52. (Р.387) Вычислите молярную концентрацию эквивалента иодида калия, 10-3 л которого содержат 0,0037 г КI.
Ответ: 0,02 моль/л.
53. (Р.388) Рассчитайте титр 0,04 н. NaCl.
Ответ: 0,00234 г/мл.
54. (Р.389) В 45 г воды растворено 6,84 г сахара C12H22O11. Вычислите молярные доли сахара и воды.
Ответ: 0,008; 0,992.
55. (Р.392) Определите молярную концентрацию эквивалента, моляльность и массовую долю (%) Fe2(SO4)3 в растворе и титр 0,8 М Fe2(SO4)3, если плотность раствора равна 1000 кг/м3.
Ответ: 4,8 моль/л; 1,18 моль/кг; 32,0 %; 0,31987 г/мл.
56. (Р.394) Вычислите молярную массу эквивалента двухосновной кислоты, в 12,5 н. растворе которой массовая доля этой кислоты 37 %, а r = 1664 кг/м3. Какая это кислота? Чему равны молярная концентрация, моляльность и титр раствора этой кислоты?
Ответ: 49,2 г/моль; 6,25 моль/л; 5,94 моль/кг; 0,6156 г/мл.
57. (Р.398) Какой объем раствора фосфорной кислоты с массовой долей H3PO4 36 %
(r = 1216 кг/м3) требуется для приготовления 13 л 0,15 н. раствора H3PO4?
Ответ: 0,142 л.
58. (Р.400) Какой объем раствора гидроксида калия с массовой долей КОH 24 %
(r = 1218 кг/м3) можно приготовить из 125 л раствора едкого кали с моссовой долей КОН 48 %
(r = 1510 кг/м3)?
Ответ: 309,9 л.
59. (Р.402) К 0,5 л раствора серной кислоты (w = 98 %, r = 1837 кг/м3) прибавлено 3 л воды. Какова массовая доля H2SO4 в полученном растворе?
Ответ: 23 %.
60. (Р.403) Какой объем воды нужно прибавить к 1 л раствора гидроксида калия
(w = 40 %, r = 1411 кг/м3), чтобы получить раствор, в котором массовая доля КОН 18 %?
Ответ: 0,17 л.
61. (Р.404) Смешаны 0.8 л. 1,5 н. NaOH и 0,4 л 0,6 н. NaOH. Какова молярная концентрация эквивалента полученного раствора?
Ответ: 1,2 моль/л.
62. (Р.405) Какой объем раствора соляной кислоты с массовой долей HCl в растворе 30 % (r = 1149 кг/м3) следует добавить к 5 л 0,5 н. раствора HCl для получения 1 н. раствора?
Ответ: 0,3 л.
63. (Р.406) В каких соотношениях надо смешать растворы серной кислоты с массовой долей H2SO4 соответственно 90 и 8 %, чтобы приготовить раствор с массовой долей H2SO4 48 %.
Ответ: 20 : 21.
64. (Р.412) Какой объем раствора соляной кислоты, в котором массовая доля HCl 4 %
(r = 1018 кг/м3), необходимо прибавить к 0,5 л 0,02 н. раствора AgNO3 для полного осаждения иона Ag+ в виде AgCl?
Ответ: 0,009 л.
65. (Р.415) Какой объем 0,20 н. раствора КОН требуется, чтобы осадить в виде Fe(OH)3 все железо, содержащееся в 0.028 л 1,4 н. раствора FeCl3?
Ответ: 0,196 л.
66. (Р.416) Каким объемом 4 н. раствора H2SO4 можно полностью разложить 0,65 л раствора карбоната калия, плотность которого 1189 кг/м3, а массовая доля К2СО3 в нем 20 %? Какой объем займет выделившийся газ (н. у.)?
Ответ: 0,559; 25,05 л.
67. (Р.419) Какова была масса А1(ОН)3, если для его растворения потребовалось 0,2 л раствора азотной кислоты (w = 30 %, r = 1180 кг/м3)? Какой объем 2,5 н. раствора КОН необходимо затратить для растворения этого количества гидроксида алюминия?
Ответ: 29,2 г; 0,15 л.
68. (Г.149) Вычислите процентное содержание безводных солей для растворов следующих кристаллогидратов: а) 100 г FeSO4 ´ 7H20 в 900 г воды; б) 14,3 г Na2CO3 ´ 10 Н20 в 120 г воды; в) 61 г ВаС12 ´ 2Н20 в 239 г воды.
Ответ: а) 5,46 %; б) 3,94 %; в) 17,33 %.
69. (Г.162) Сколько килограммов воды следует добавить к 1 кг 40%-ного раствора H2S04 для получения 25%-ного раствора?
Ответ: 0,6 кг.
70. (Г.163) Сколько молей воды следует добавить к 1,6 кг 25%-ного раствора NaOH для получения 16%-ного раствора?
Ответ: 50 моль.
71. (Г.165) Сколько граммов 32%-ного раствора HN03 следует добавить к 600 г 80%-ного раствора той же кислоты для получения 64%-ного раствора?
Ответ: 300 г.
72. (Г.212) Вычислите молярную и нормальную концентрации следующих растворов, насыщенных при 20°С: а) 27,1%-ного раствора NH4C1 (r = 1,075); б) 6,91%-ного раствора Ва(ОН)2 ´ 8Н2О (r = 1,04); в) 61,4%-ного раствора MgSO4 ´ 7H20 (r = 1,31);
г) 5,67%-ного раствора KAl(SO4)2 (r = 1,053); д) 2,6%-ного раствора Na2B4O7 (r = 1,02); е) 68,3%-ного раствора AgNO3 (r = 2,18).
Ответ: а) 5,45 М; 5,45 н.; б) 0,228 М; 0,456 н.; в) 3,26 М; 6,53 н.; г) 0,231 М; 0,925 н.;
д) 0,132 М; 0,264 н.;е) 8,76 М; 8,76 н.
73. (Г.213) Вычислите процентное содержание растворенного вещества в следующих растворах: а) 10 н. H2S04 (r = 1,29); б) 7,98 н. НС1 (r = 1,13); в) 4,85 н. HNO3 (r = 1,16); г) 8,55 н. КОН (r = 1,35); д) 0,7 н. NaOH (r= 1,03); е) 3,07 н. Na2CO3 (r = 1,15); ж) 14,8 н. NH3 = 0,90).
Ответ: а) 38 %; б) 25,8 %; в) 26,3 %; г) 35,5 %; д) 2,72 %; е) 14,2 %; ж) 28 %.
74. (Г.223) Сколько граммов 5%-ного раствора AgNO2 требуется для обменной реакции со 120 мл 0,6 н. А1С13?
Ответ: 245 г.
75. (Г.225) Сколько литров 0,03 н. раствора Н3РО4 способно прореагировать с 250 г
4%-ного раствора NaOH с образованием дигидроортофосфата натрия?
Ответ: 25 л.
76. (Г.233) Сколько миллилитров 8,5%-ного раствора NaHSO4 (r = 1,08) можно перевести в сульфат с помощью 400 мл 2,5 н. раствора NaOH?
Ответ: 1308 мл.
77. (Г.235) Сколько миллилитров 0,4 н. H2SO4 .можно нейтрализовать прибавлением
800 мл 0,25 н. NaOH?
Ответ: 500 мл.
78. (Г.237) До какого объема следует разбавить водой 2,4 л 1,6 н. НС1 для получения
0,25 н. раствора?
Ответ: 15,4 л.
79. (Г.238) До какого объема следует упарить 3,5 л 0,04 н. КОН для получения 0,1 н. раствора?
Ответ: 1,4 л.
80. (Г.239) К 250 мл 1,6 н. H2SO4 добавили 400 мл 0,35 н. NaOH. Сколько миллилитров 0,25 н. КОН дополнительно требуется для нейтрализации раствора?
Ответ: 1040 мл.
Энергетика химич6еских процессов. Элементы химической термодинамики.
Теоретические сведения
Химический процесс, фазовые превращения сопровождаются энергетическими изменениями. Законы взаимного превращения различных видов энергии, а также состояние химического равновесия и зависимость его от различных факторов изучает наука – химическая термодинамика.
I закон термодинамики: Теплота, сообщенная системе расходуется на изменение внутренней энергии U и работы расширения или сжатия системы А.
Q = U + A, A = p V, Q = U + p V
Внутренняя энергия U – это функция состояния системы, включающая энергию движения атомов и молекул, электронов и ядер в атомах, внутриядерную энергию, энергию межмолекулярного взаимодействия и другие виды энергий, за исключением кинетической и потенциальной энергии системы, как целого.
Абсолютную величину запаса внутренней энергии химической системы измерить невозможно. Определяют изменение внутренней энергии системы при переходе её из начального в конечное состояние (из исходных веществ в продукты реакции)
U = Uк – Uн
Если процесс идёт с поглощением тепла, внутренняя энергия возрастает, если с выделением, то уменьшается.
В изобарном процессе (p = const), U + pV = H – функция состояния, называемая энтальпия(теплосодержание). Qp = H
В изохорном процессе (V = const) QV = U.
Раздел термодинамики, изучающий тепловые эффекты называется термохимией.
Тепловым эффектом реакции Q называется количество тепла, поглощаемое или выделяемое в процессе химической реакции (кДж).
Если процесс идет с выделением тепла (экзотермический), тепловой эффект условно берется со знаком плюс (+Q), если тепло поглощается (эндотермический процесс) – со знаком минус (–Q).
При записи термохимических уравнений реакции указывается тепловой эффект с соответствующим знаком, агрегатное состояние вещества; допускаются дробные коэффициенты
H2(г) + 1/2 О2(г) = Н2О(ж) + 285,8 кДж/моль.
Стандартной теплотой образования (Но298) называется тепловой эффект образования 1 моль сложного вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при стандартных условиях (tо = 25 оC (298 K); P = 101,3 кПа).
Стандартные энтальпии образования простых веществ принимают равными нулю:
НоСа(к) = 0 ; НоО2(г)= 0.
Для экзотермических процессов H < 0, для эндотермических – H > 0.
Основные законы термохимии:
1. Закон Лавуазье-Лапласа: энтальпия разложения сложного вещества равна по абсолютной величине, но противоположна по закону энтальпии образования этого вещества из продуктов разложения Нразл = – Нобр.
2. Закон Гесса: тепловой эффект реакции, протекающий при постоянных давлении и температуре, не зависит от пути протекания процесса, а зависит только от начального и конечного состояния веществ.
Для расчётов удобно пользоваться следствием из закона Гесса:
тепловой эффект химической реакции равен алгебраической сумме теплот образования продуктов реакции за вычетом алгебраической суммы теплот образования исходных веществ, с учётом стехиометрических коэффициентов.
Нх.р = n Нобр. прод – n Нобр. исх. вещ-в
Пример:
СН4(г) + 2О2(г) = 2Н2О (ж) + СО2 (г)
Нох.р = Нообр СО2 (г) + 2 Нообр Н2О (ж) – Нообр СН4 (г)
Большинство химических процессов протекают самопроизвольно в сторону уменьшения запаса внутренней энергии или энтальпии системы. Но известны и такие процессы, которые протекают самопроизвольно без изменения внутренней энергии системы, движущей силой таких процессов является энтропия S системы. Энтропия характеризует беспорядок в системе, чем выше беспорядок, тем выше энтропия. В изолированных от внешней среды системах процессы протекают самопроизвольно в направлении увеличения энтропии (Sх.р >0). Энтропия реакции рассчитывается по следствию из закона Гесса и имеет единицу измерения Дж/моль.К.
Sох.р = nSoобр. прод. – nSoобр. исх. вещ-в
Таким образом, существуют два основных фактора самопроизвольного протекания процессов:
1) уменьшение внутренней энергии или энтальпии системы (U < 0; Н < 0);
2) увеличение беспорядка или энтропии системы (S > 0).
В термодинамике существует функция, которая отражает влияние на направление процесса двух рассмотренных факторов одновременно. Такой функцией для процессов, протекающих при постоянной температуре и давлении, является изобарно-изотермический потенциал G (или энергия Гиббса, свободная энергия системы, кДж).
Изменение изобарно-изотермического потенциала химической реакции можно рассчитать по формуле Гиббса
Gх.р = Нх.р – Т Sх.р,
где Т – абсолютная температура процесса.
Gх.р характеризует общую движущую силу процесса. Если процесс протекает в стандартных условиях, то Gох.р рассчитывается также по следствию из закона Гесса.
Величина и знак Gх.р характеризуют принципиальную возможность протекания химического процесса. Если Gх.р < 0, процесс протекает самопроизвольно при данных условиях.
Задачи
81. (Р.1) Вычислите стандартную теплоту образования бензола С6Н6(ж), если известны теплоты сгорания водорода, углерода и бензола.
Ответ: 49,12 кДж.
82. (Р.2) Определите стандартную теплоту образования сероуглерода CS2, если известно, что
СS2 (ж) + ЗО2 = СО2 (г) + 2SО2 (г);  = –1075 кДж/моль. = –1075 кДж/моль.
Ответ: 87,69 кДж/моль.
83. (Р.3) Вычислите 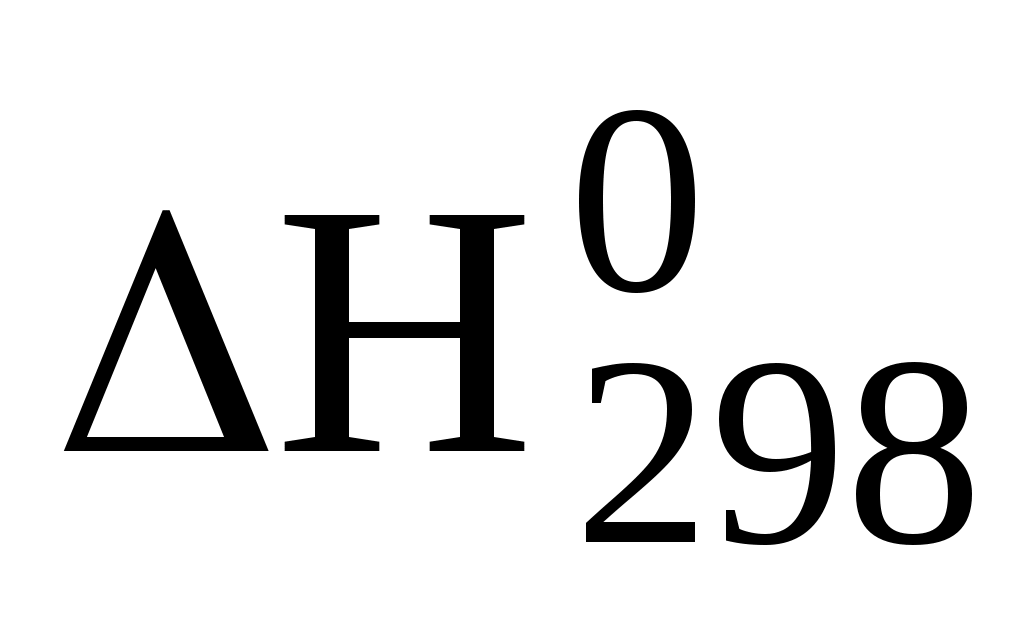 хлорида аммония, если для реакции хлорида аммония, если для реакции
NН3 (г) + НС1 (г) = NH4C1 (к); 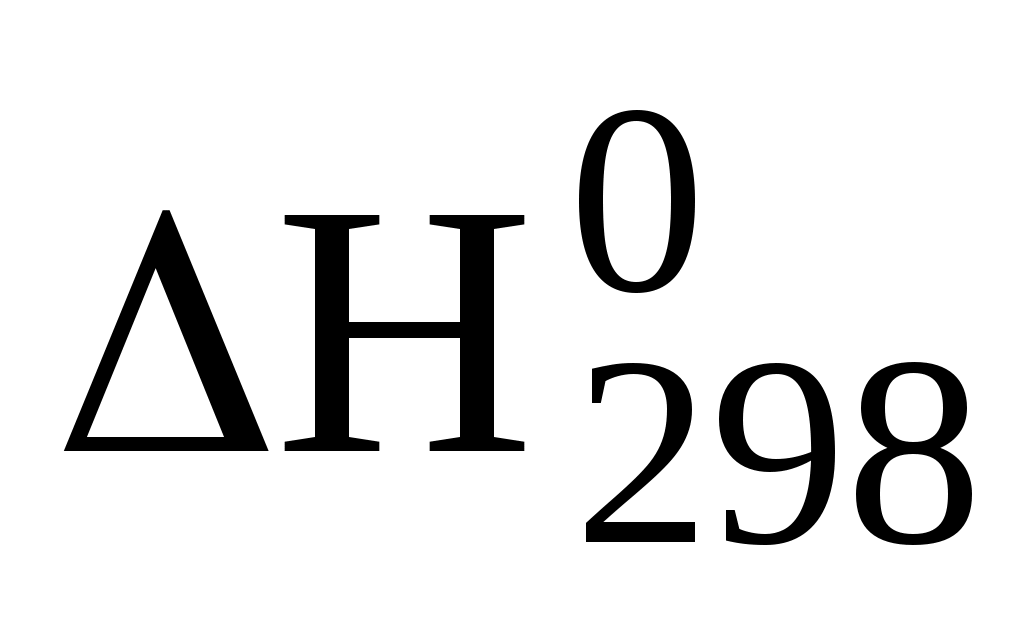 = –176,93 кДж/моль. = –176,93 кДж/моль.
Ответ: –315,42 кДж/моль.
84. (Р.4) Определите 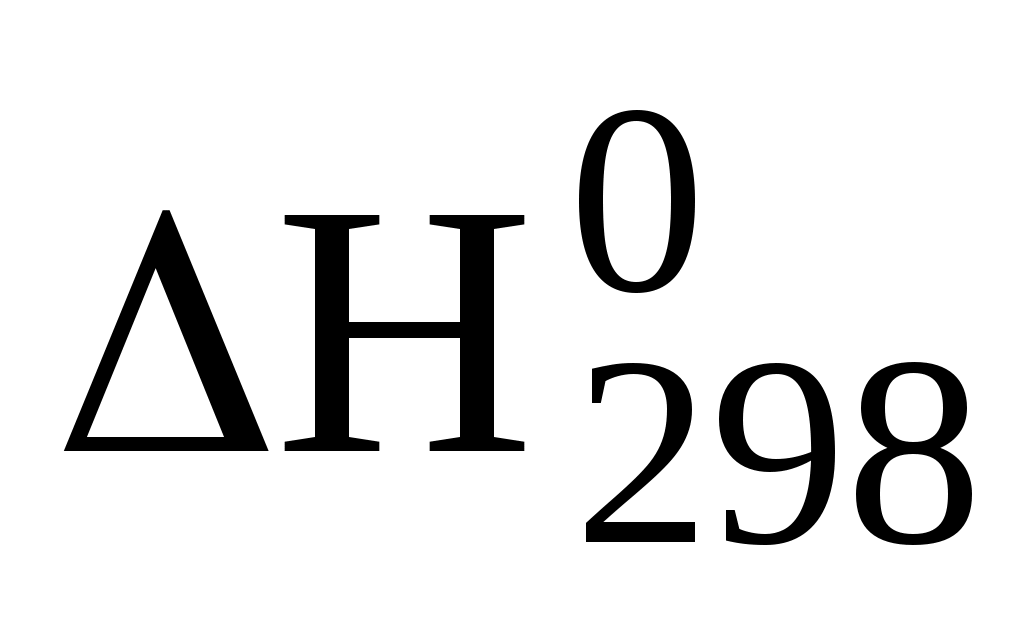 ВiCl3 (к), если ВiCl3 (к), если 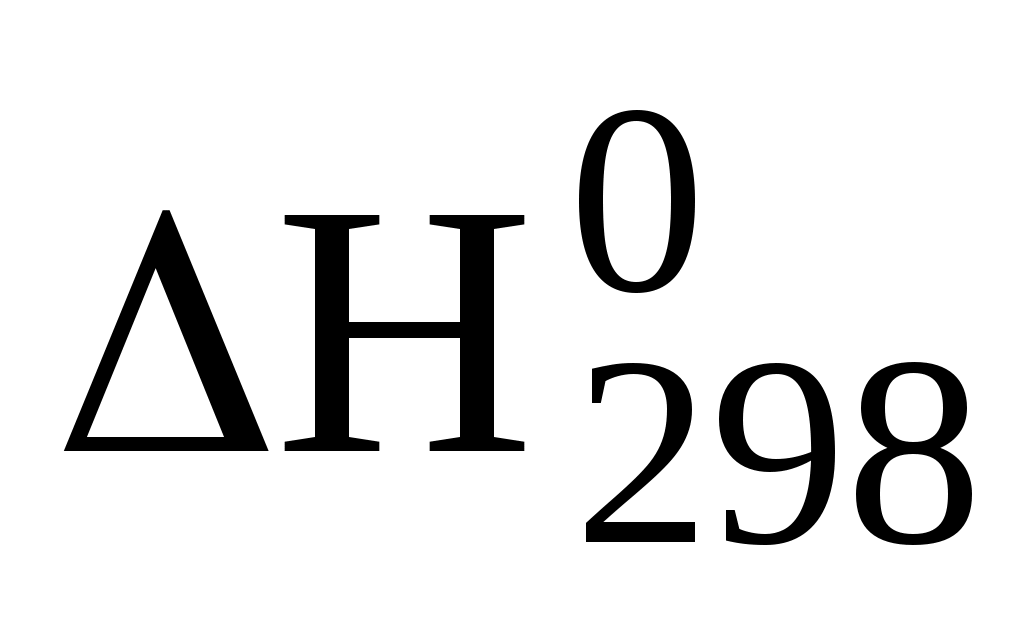 BiCl3 (г) равна –270,70 кДж/моль, а BiCl3 (г) равна –270,70 кДж/моль, а  возгонки BiCl3 (к) составляет 113,39 кДж/моль. возгонки BiCl3 (к) составляет 113,39 кДж/моль.
Ответ: –384,09 кДж/моль.
85. (Р.5) При взаимодействии 5 г металлического натрия с водой выделяется 40,25 кДж теплоты, а при взаимодействии 10 г оксида натрия с водой выделяется 36,46 кДж теплоты. Рассчитайте 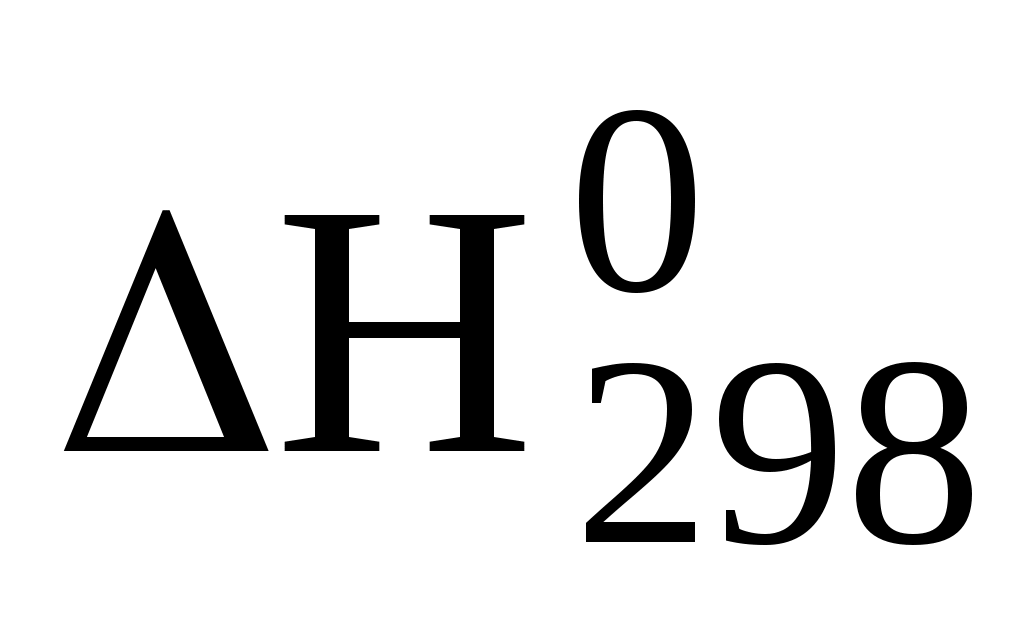 Na2O. Na2O.
Ответ: –430,08 кДж/моль.
86. (Р.6) При растворении 16 г СаС2 в воде выделяется 31,3 кДж теплоты. Определите стандартную теплоту образования Са(ОН)2.
Ответ: –986,33 кДж/моль.
87. (Р.7) Определите 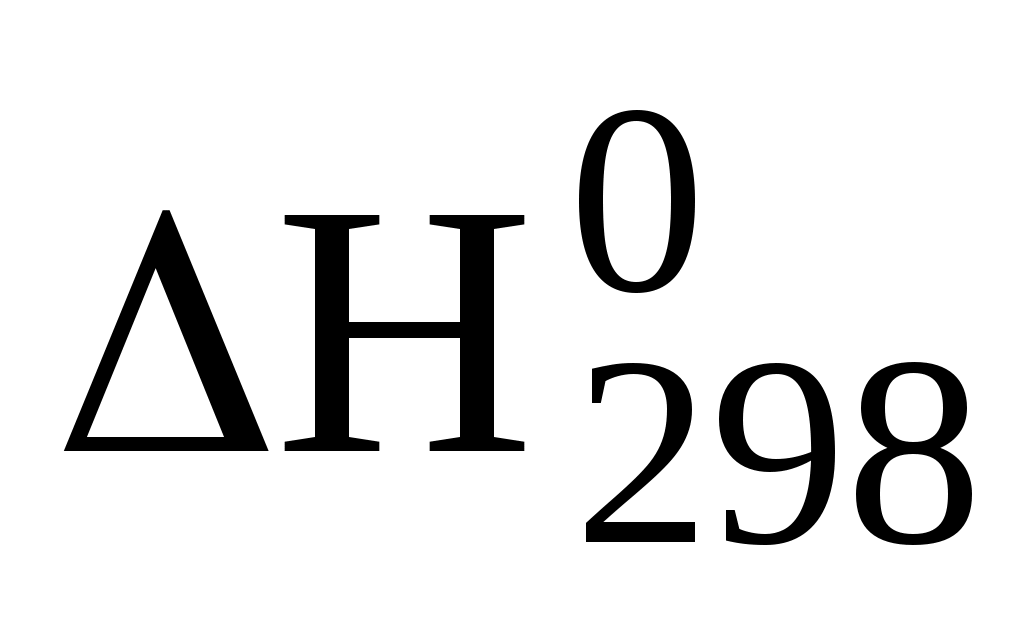 Fe2O3, если при реакции Fe2O3, если при реакции
2Fe + Al2O3 = Fe203 + 2Al
на каждые 80 г Fe2O3 поглощается 426,5 кДж теплоты.
Ответ: –822,00 кДж/моль.
88. (Р.8) Тепловой эффект реакции
SO2 (г) + 2H2S (г) = 3S (ромб) + 2Н2О (ж)
равен –234,50 кДж. Определите стандартную теплоту образования H2S.
Ответ: –20,14 кДж/моль.
89. (Р.9) Окисление аммиака протекает по уравнению
4NH3 (г) + 302 (г) = 2N2+6H20 (ж);  = –1528 кДж. = –1528 кДж.
Определите стандартную теплоту образования NH3(г) и NH3·H2O, если теплота растворения NH3(г) в воде равна –34,65 кДж.
Ответ: –46,76 кДж/моль, –367,25 кДж/моль.
90. (Р.10) Вычислите стандартную теплоту образования сахарозы C12H22O11, если тепловой эффект реакции
C12H22O11 + 12O2= 12СО2+ 11Н2О(ж)
равен –5694 кДж.
Ответ: –2222,36 кДж/моль.
91. (Р.17) По стандартным теплотам сгорания веществ рассчитайте 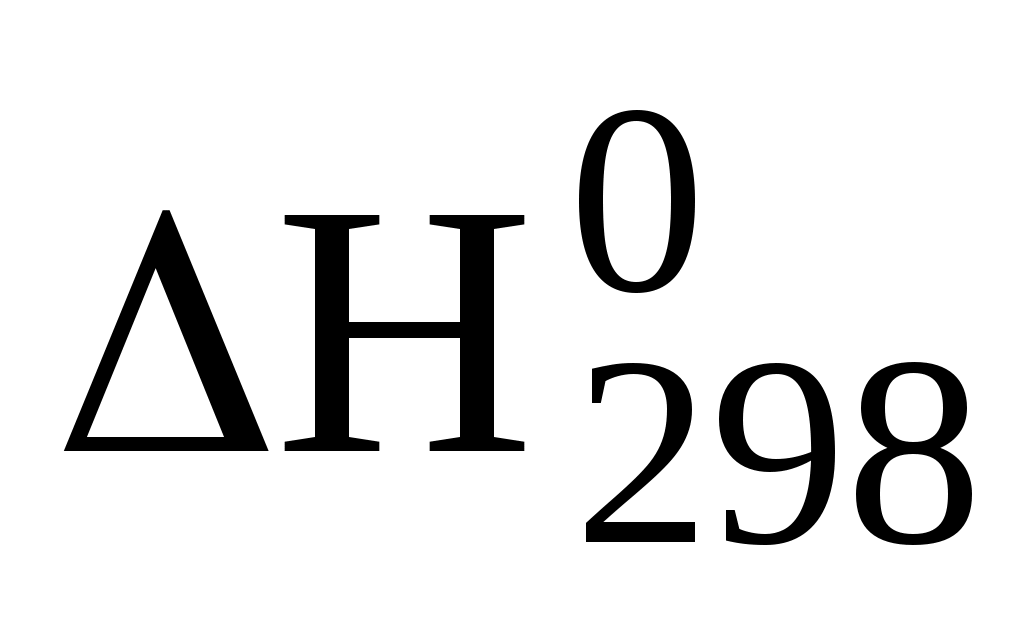 системы системы
С2Н5ОН (ж) + СН3СООН (ж) = СНзСООС2Н5 (ж)+Н2О;
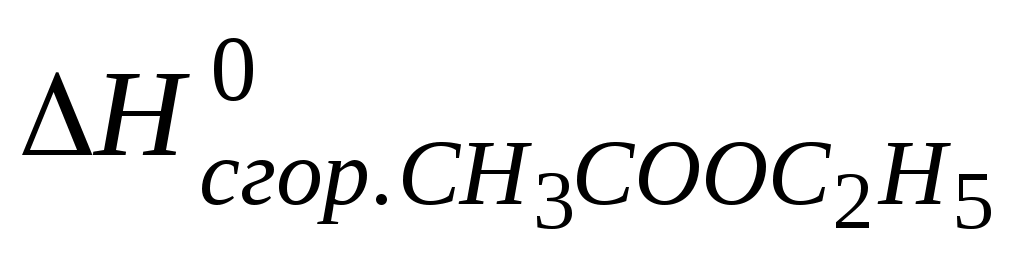 = –2254,21 кДж/моль. = –2254,21 кДж/моль.
Конечные продукты сгорания – газообразный СО2 и жидкая Н2О.
Ответ: 13,51 кДж/моль.
92. (Р.18) Определите тепловой эффект реакции
NaН (к) + Н2О (ж) = NаОН (р) + Н2 (г)
по стандартным теплотам образования веществ, участвующих в реакции, если
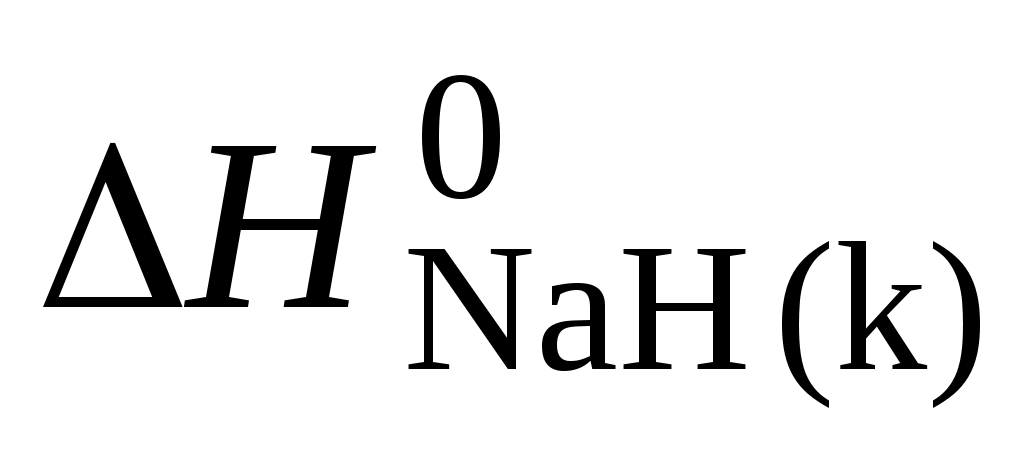 = –56,94 кДж/моль, = –56,94 кДж/моль, 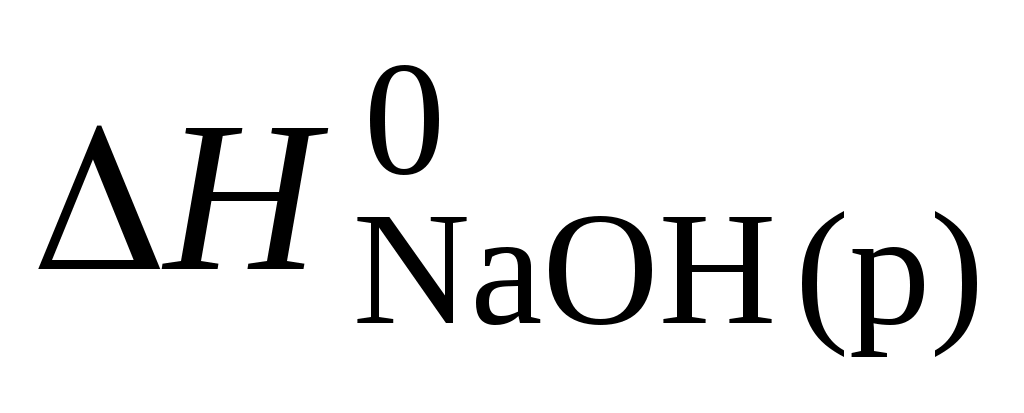 = –469,47 кДж/моль. = –469,47 кДж/моль.
Ответ: –126,69 кДж/моль.
93. (Р.21) Разложение гремучей ртути при взрыве идет по уравнению
Hg(ONC)2 = Hg+2CO + N2, 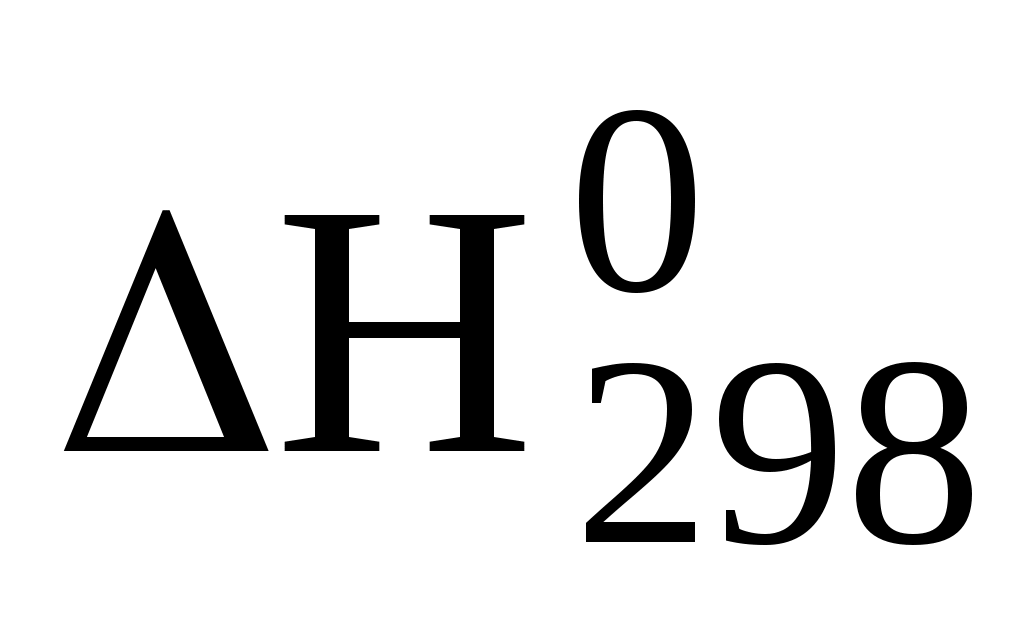 = –364,2 кДж. = –364,2 кДж.
Определите объем выделившихся газов (н. у.) и количество теплоты, выделившейся при взрыве 1,5 кг Hg(ONC)2.
Ответ: 1919,40 кДж/моль, 350,60 л.
94. (Р.24) Найдите теплоту сгорания алмаза, если стандартная теплота сгорания графита равна –393,51 кДж/моль, а теплота фазового перехода С (графит) ® С (алмаз) равна
1,88 кДж/моль.
Ответ: –395,39 кДж/моль.
95. (Р.28) Сколько теплоты выделится при разложении 54 г глюкозы по реакции
С6Н12О6 (к) = 2С2Н5ОН (ж) + 2СО3 (г)
если 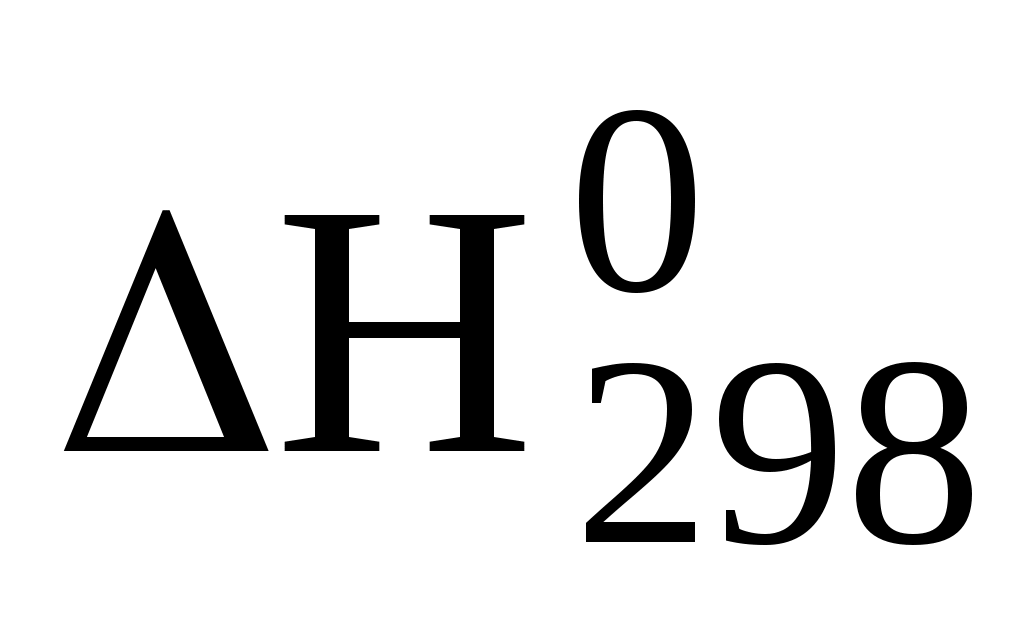 С6Н12О6 (к) = –1273,0 кДж/моль; С6Н12О6 (к) = –1273,0 кДж/моль; 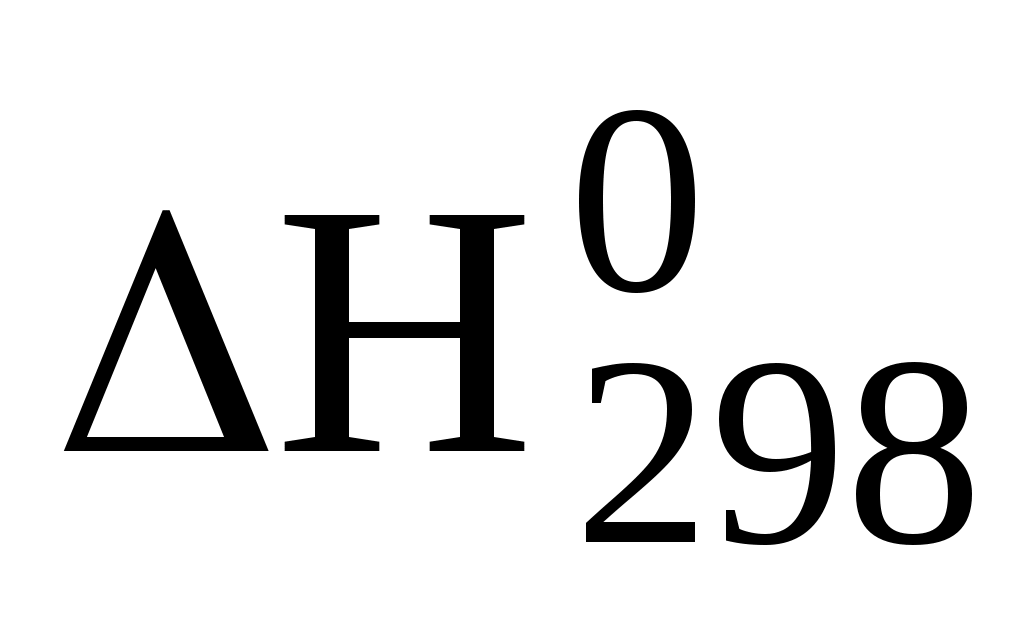 С2Н5ОН (ж) = –277,6 кДж/моль; С2Н5ОН (ж) = –277,6 кДж/моль;
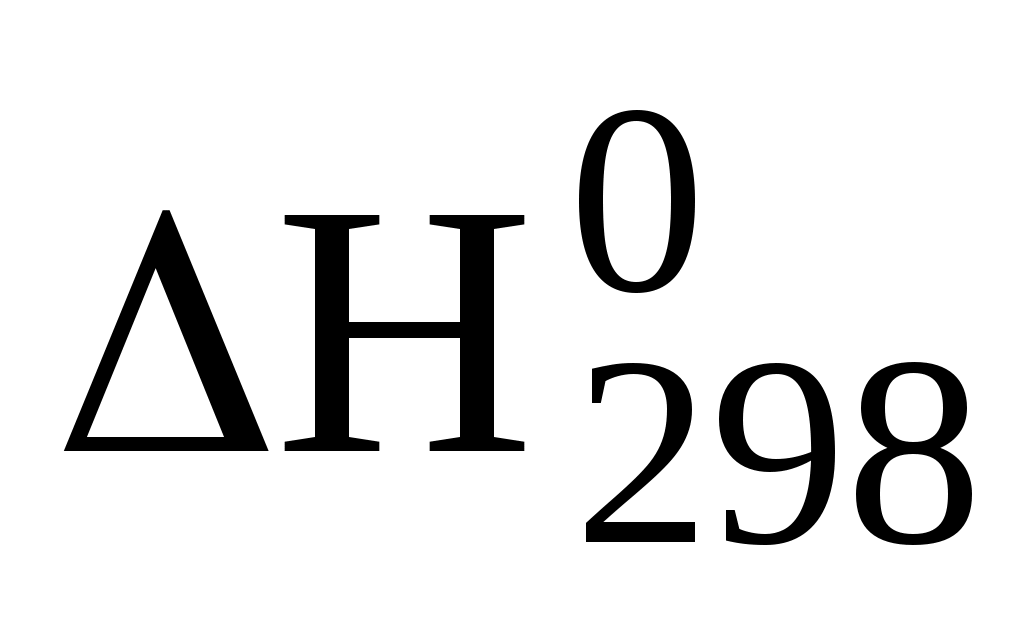 СО2 (г) = –393,5 кДж/моль. СО2 (г) = –393,5 кДж/моль.
Ответ: 20,76 кДж/моль.
96. (Р.29) Определите тепловой эффект реакции восстановления оксида хрома (III) алюминием.
Ответ: 534,00 кДж/моль.
97. (Р.30) При сгорании 9,3 фосфора выделяется 229,5 кДж теплоты. Рассчитайте 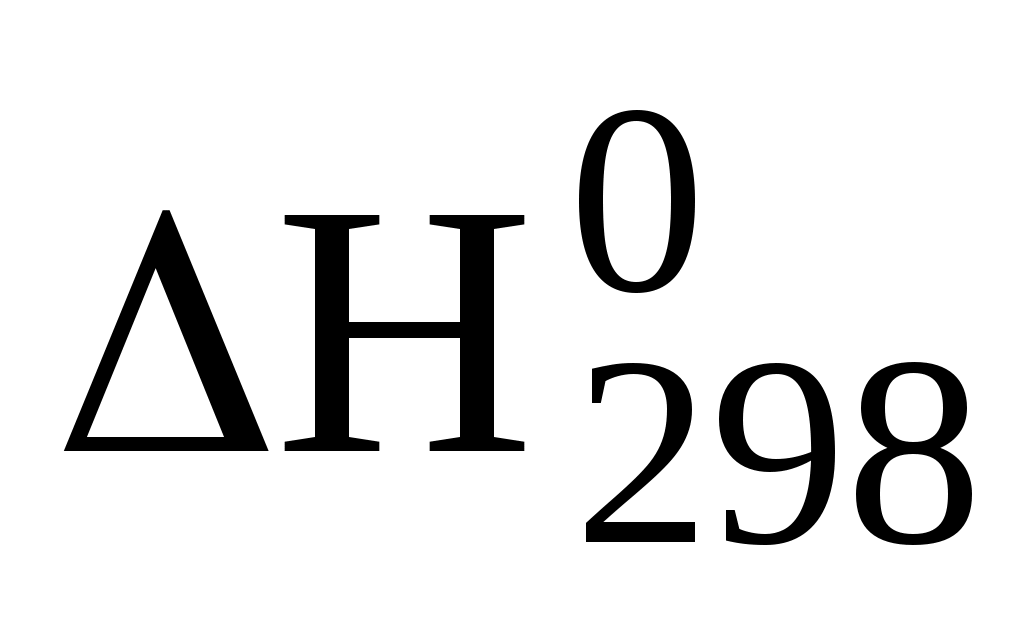 оксида фосфора (V). оксида фосфора (V).
Ответ: –1530,70 кДж/моль.
98. (Р.41) Возможна ли следующая реакция:
2Hg2Cl2 = 2HgCl2 + 2Hg
Ответ подтвердите, рассчитав 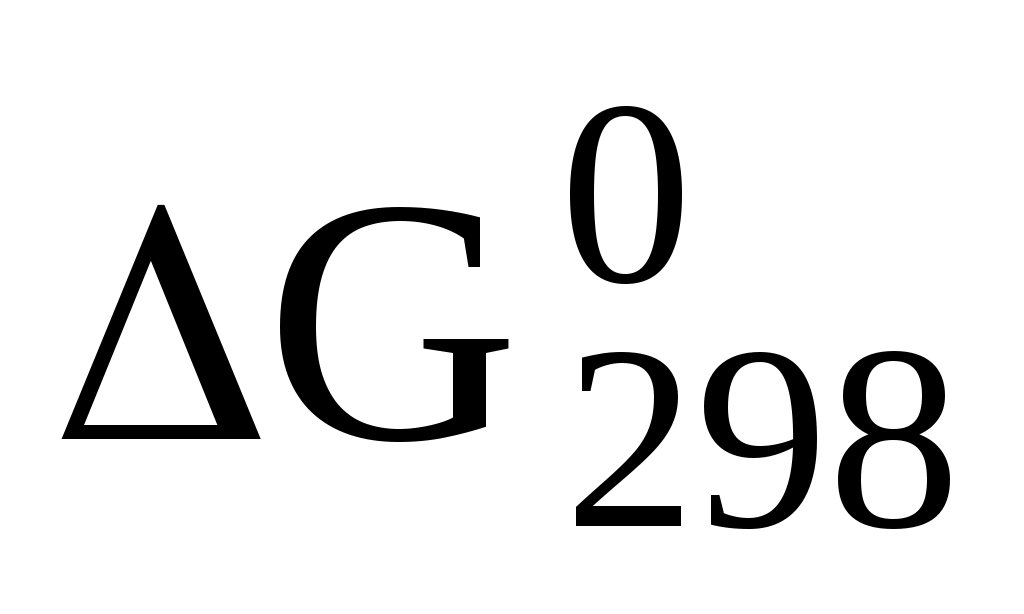 этой системы. этой системы.
99. (Р.43) Исходя из величин 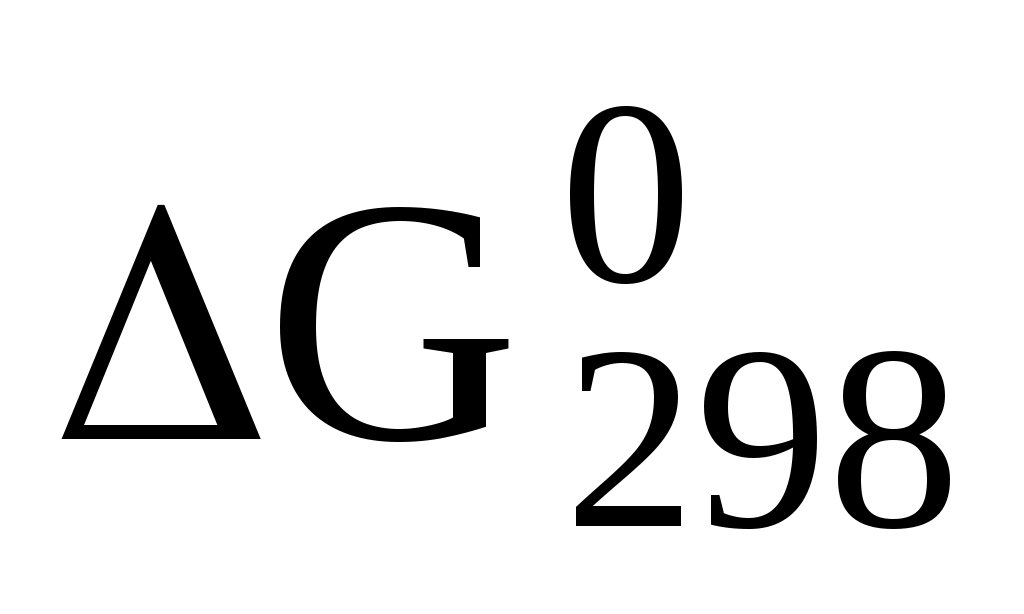 соединений, участвующих в реакции, определите, возможна ли реакция соединений, участвующих в реакции, определите, возможна ли реакция
А12O3 (к) + 2SO3 (к) = А12(SО4)3 (к)
100. (Р.46) Будут при 25 °С протекать реакции:
а) КН+Н2О = КОН + Н2
б) КН = К + 0,5Н2
Как будет влиять повышение температуры на направление указанных процессов?
101. (Р.47) Как изменяются основные свойства оксидов в ряду
Li2O ® Na2O ® K2O ® Rb2O ®Cs2O?
Ответ дайте, рассчитав 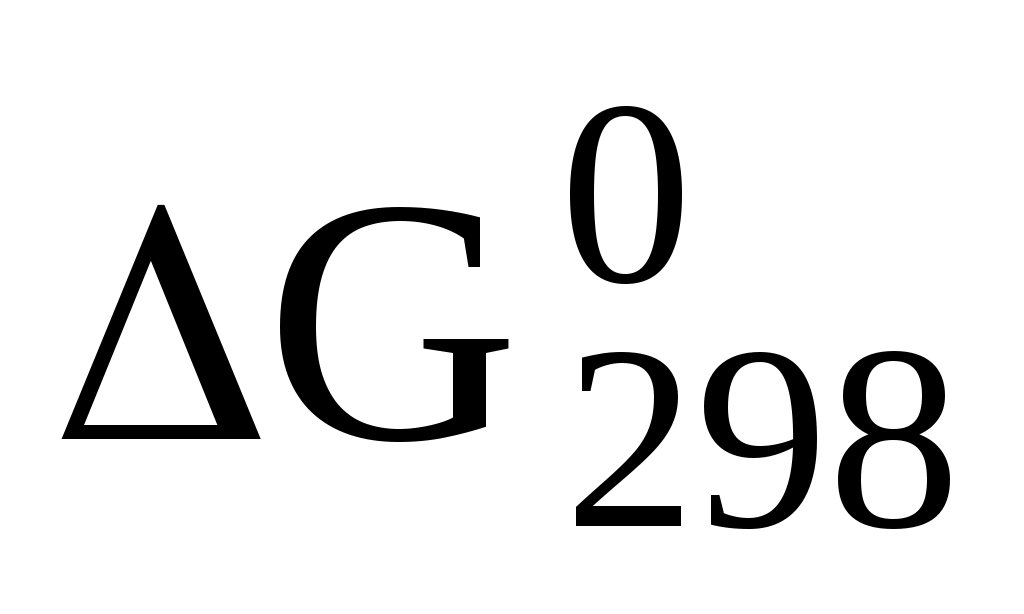 системы системы
Ме20 + Н2О = 2МеОН
102. (Р.49) В каком направлении будет протекать реакция получения аммиака
NН4С1 (к) + NaОН (к) = NaCl (к) + Н2О (г) + NН3 (г)
если реагирующие вещества взяты в стандартных условиях?
103. (Р.50) Используя значения 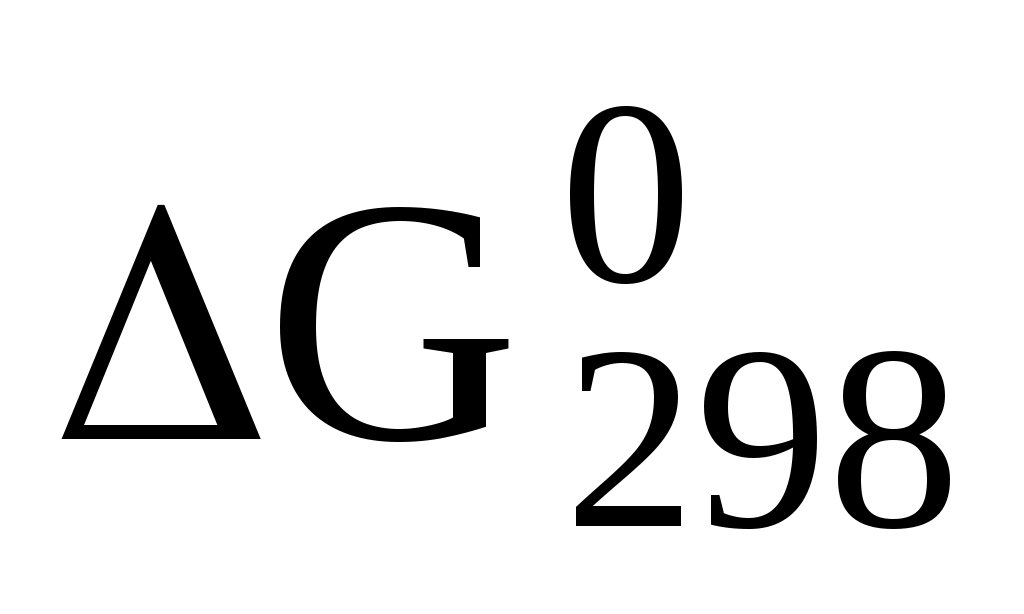 соединений, участвующих в реакции соединений, участвующих в реакции
C6H6 (г) + NH3 (г)=C6H5 – NH3 (ж) + Н2
Определите, возможна ли эта реакция, 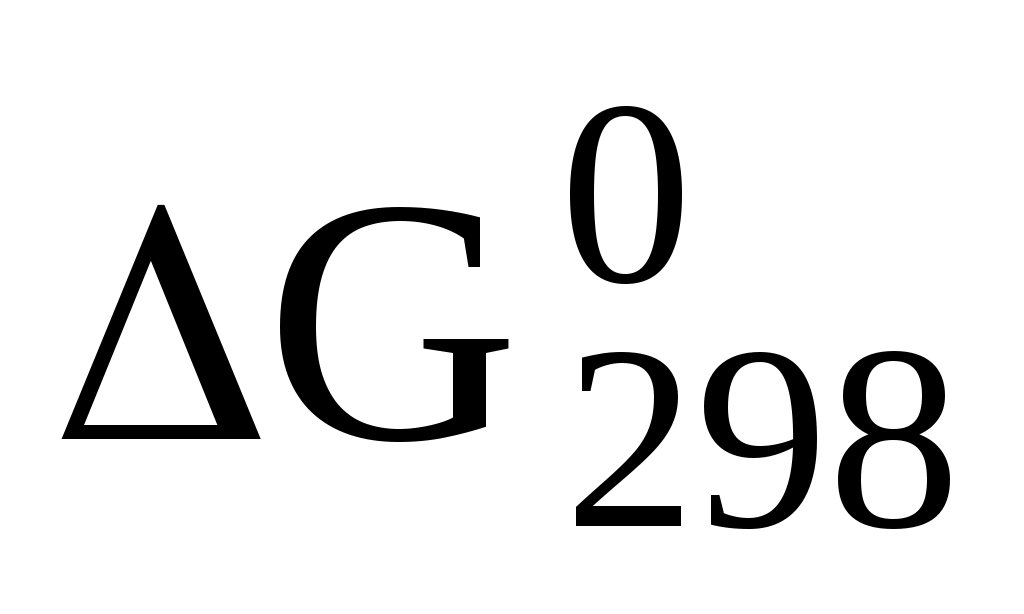 C6H5 – NH3 (ж) = 153,22 кДж/моль. C6H5 – NH3 (ж) = 153,22 кДж/моль.
104. (Р.51) Рассчитайте 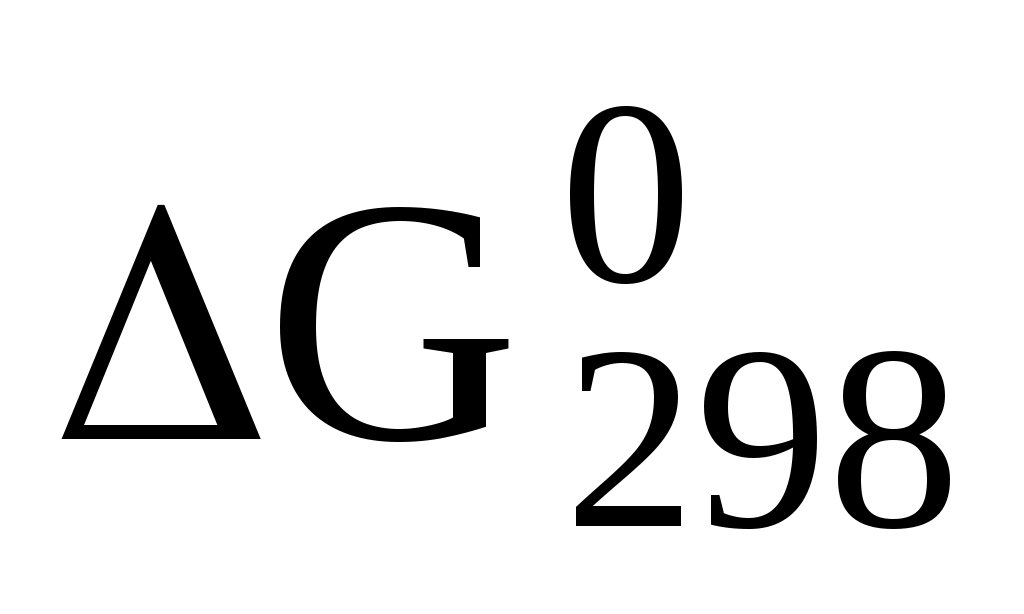 реакции N2 + 2H2O = NH4NO2 и сделайте вывод о возможности ее протекания, реакции N2 + 2H2O = NH4NO2 и сделайте вывод о возможности ее протекания, 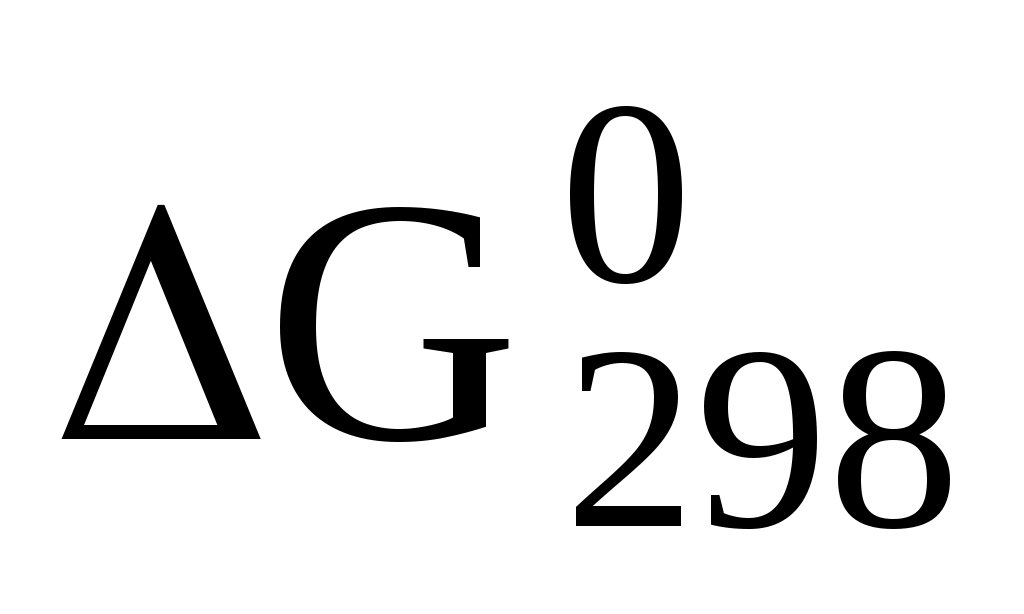 NH4NО2 = 115,94 кДж/моль. NH4NО2 = 115,94 кДж/моль.
105. (Р.54) Как изменяются основные свойства оксидов элементов II–А группы? Ответ подтвердите расчетом 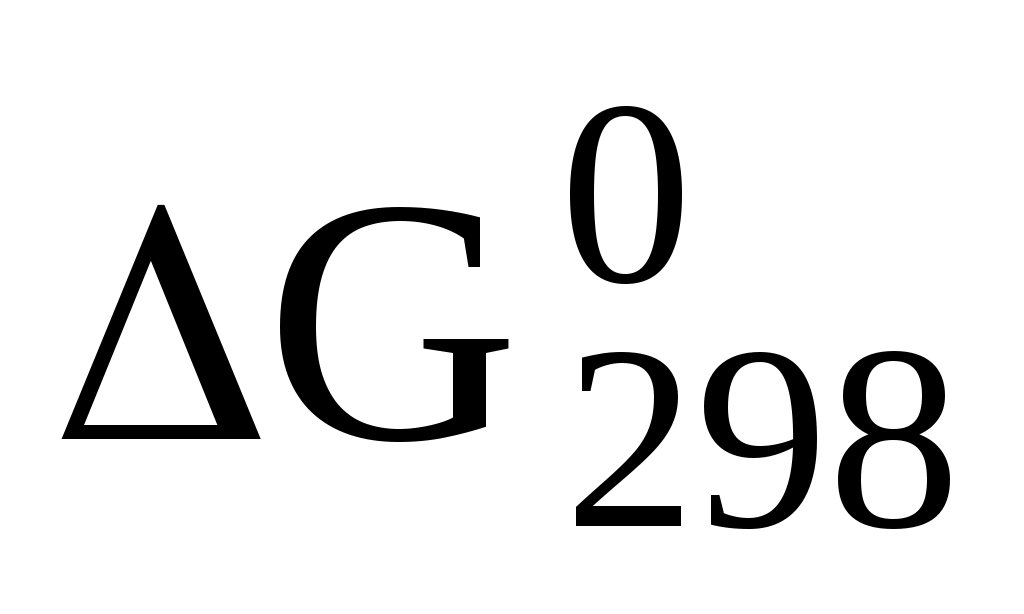 реакций взаимодействия оксидов металлов с диоксидом реакций взаимодействия оксидов металлов с диоксидом
углерода (IV)
ЭО (к) + СО2 (г) = ЭСО3 (к)
106. (Р.56) Определите изменение энтропии в следующих реакциях:
а) 2С (графит) + Н2 (г) ® С2Н2 (г)
б) А1 (к) + Сг2О8 (к) ® Сг + А12О3 (к)
в) 2С (графит) + СО2 (г) ® 2СО (г)
107. (Р.60) Изменение энтропии при плавлении 100 г меди равно 1,28Дж/К. Рассчитайте удельную теплоту плавления меди, если температура плавления меди 1083 °С.
Ответ: 174,00 Дж/К.
108. (Р.61) Удельная теплота плавления льда 33 480 Дж/кг. Определите изменение молярной энтропии при плавлении льда.
Ответ: 22,07 Дж/(моль × К).
109. (Р.62) Определите 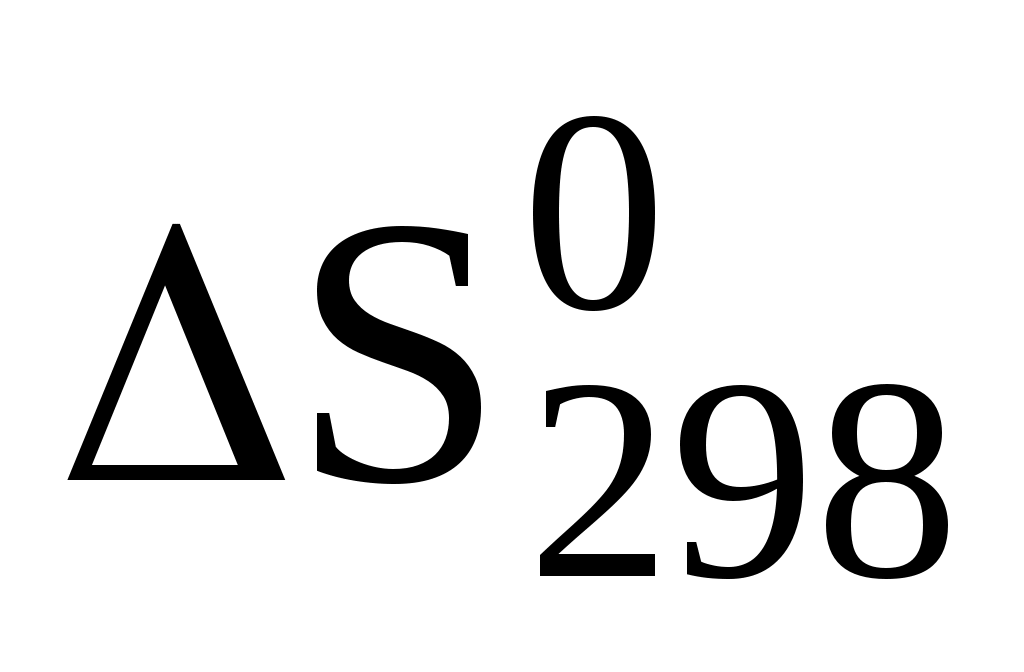 системы системы
H2 (г) + S (к) = H2S (г)
Ответ: 43,16 Дж/(моль × К).
110. (Р.64) Рассчитайте 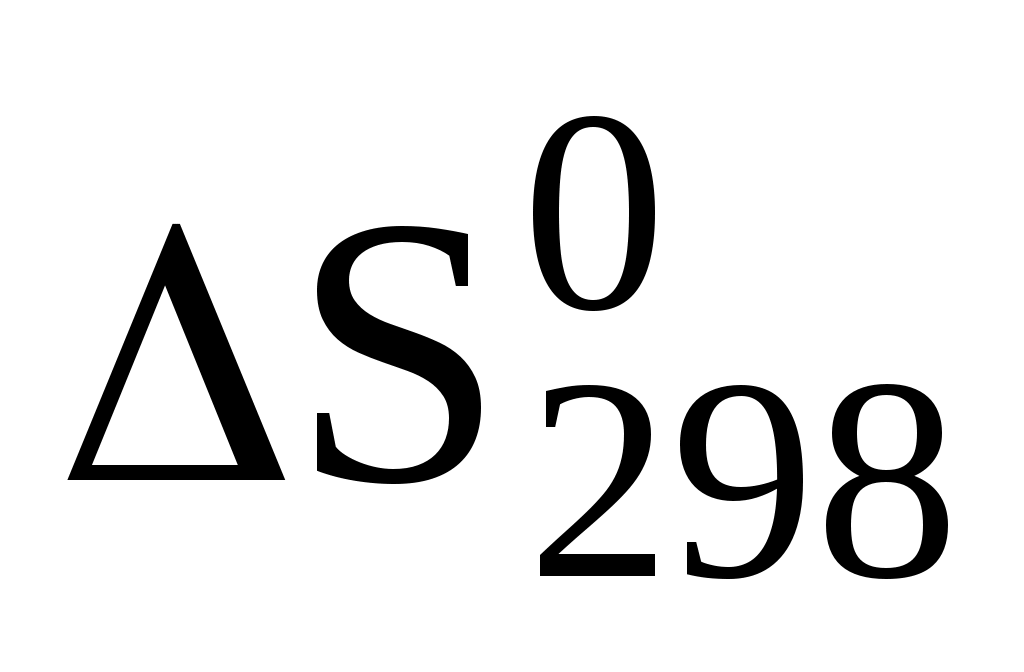 реакции разложения бертолетовой соли, если реакции разложения бертолетовой соли, если 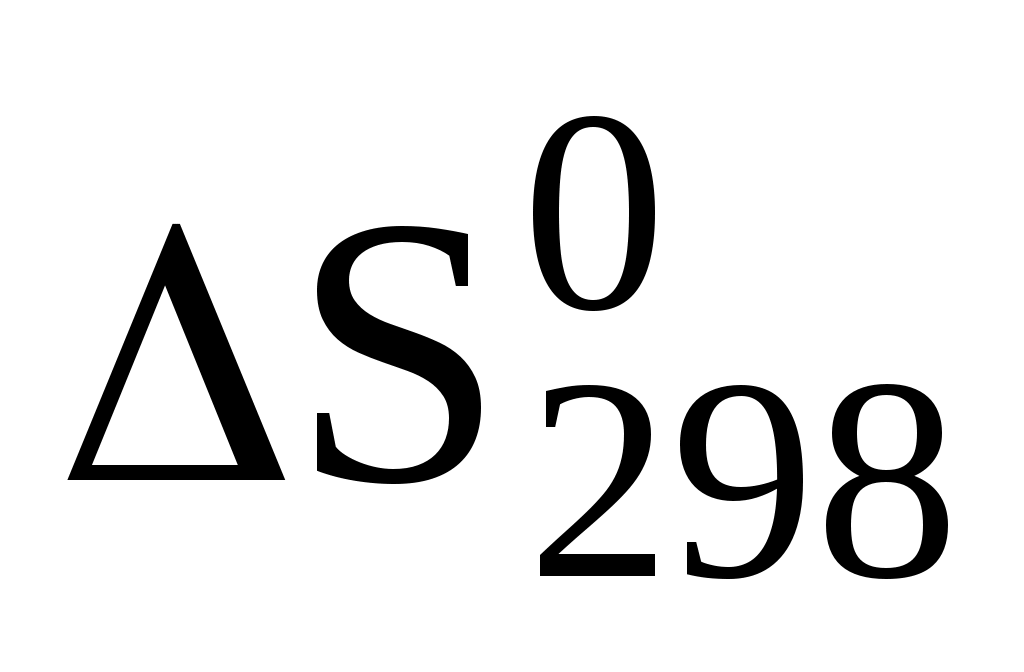 , KClO3 = 142,97 Дж/(моль × К), а , KClO3 = 142,97 Дж/(моль × К), а 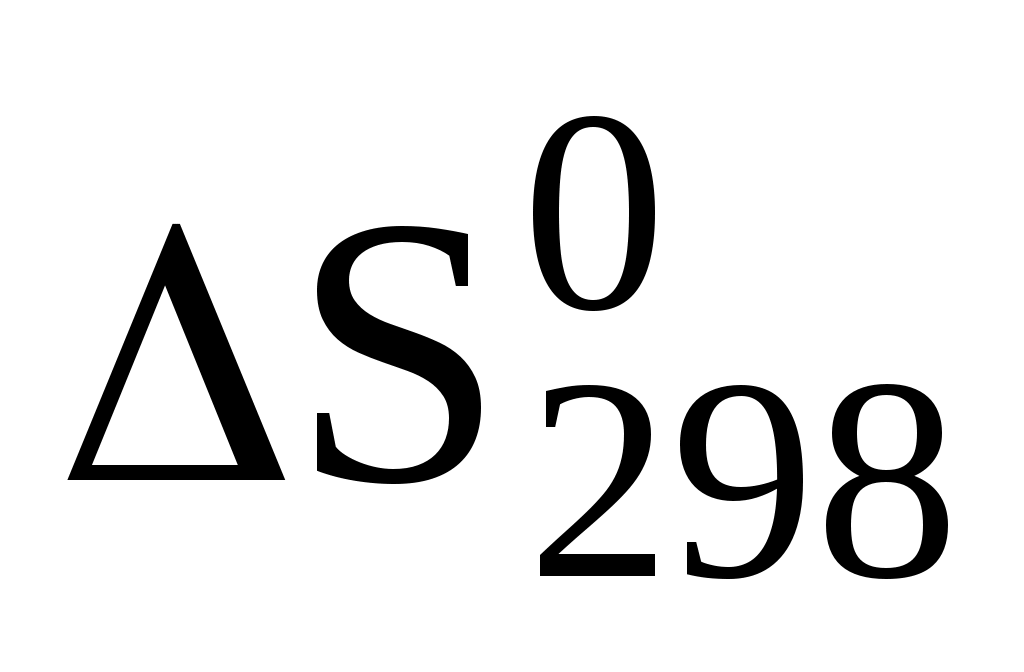 , KCl = 82,68 Дж/(моль × К). , KCl = 82,68 Дж/(моль × К).
Ответ: 494,50 Дж/(моль × К).
111. (Р.65) Теплота плавления нафталина С10Н8 равна 149 600 Дж/кг, а температура плавления 80,4 °С. Найдите изменение энтропии при плавлении 3,1 моль нафталина.
Ответ: 165,10 Дж/К.
112. (Р.68) Вычислите значения  , , 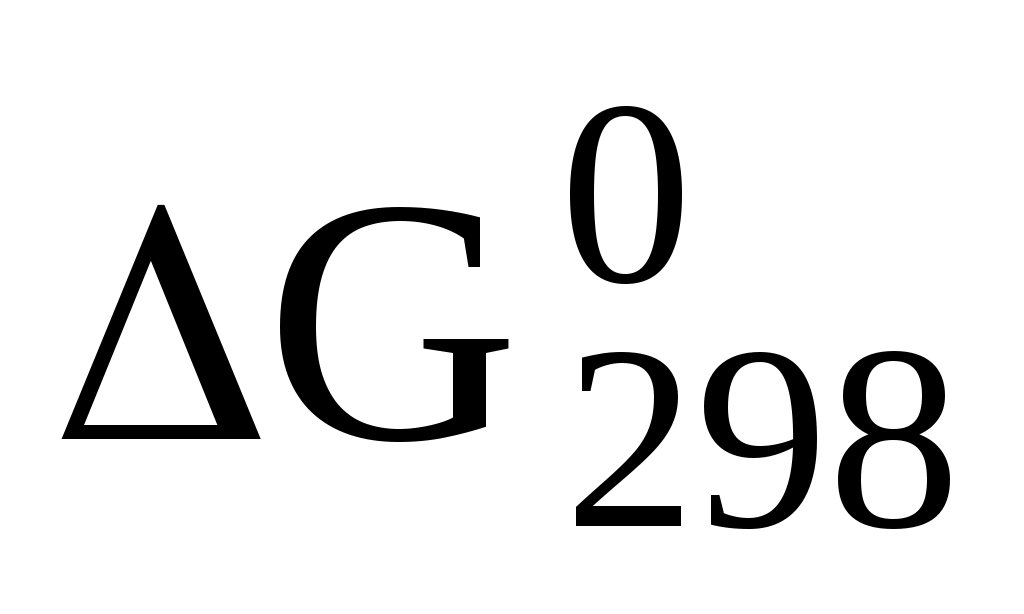 , , 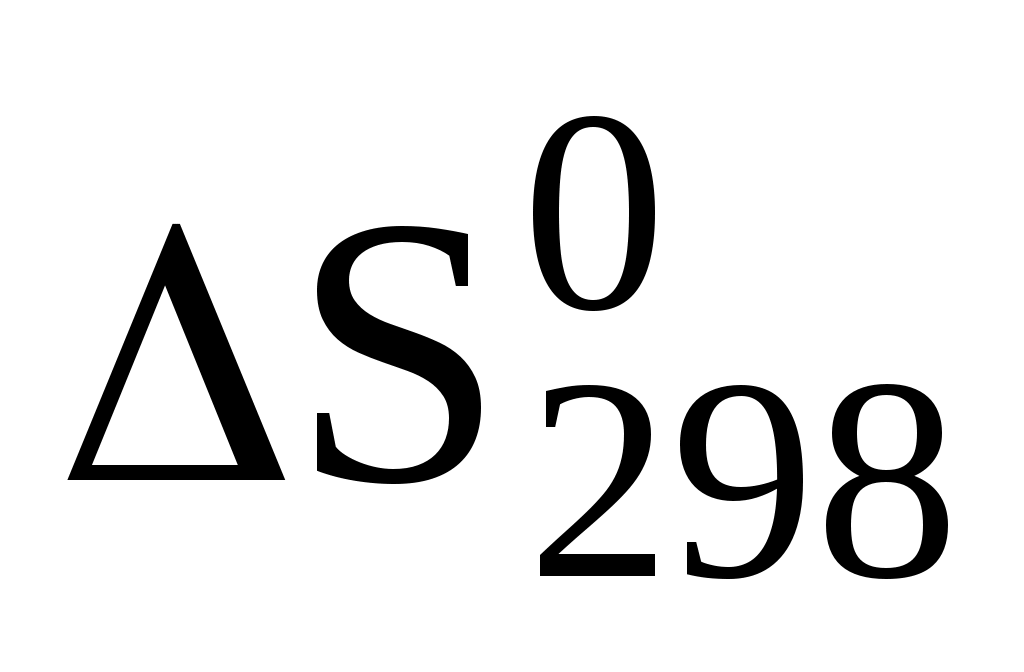 для процесса для процесса
МеСО3 (к) ® МеО (к) + СО2 (г)
и составьте ряд термической стабильности карбонатов MgCO3, ВаСО3, СаСО3. Как влияет на течение этих процессов температура?
113. (Р.69) На основании значений 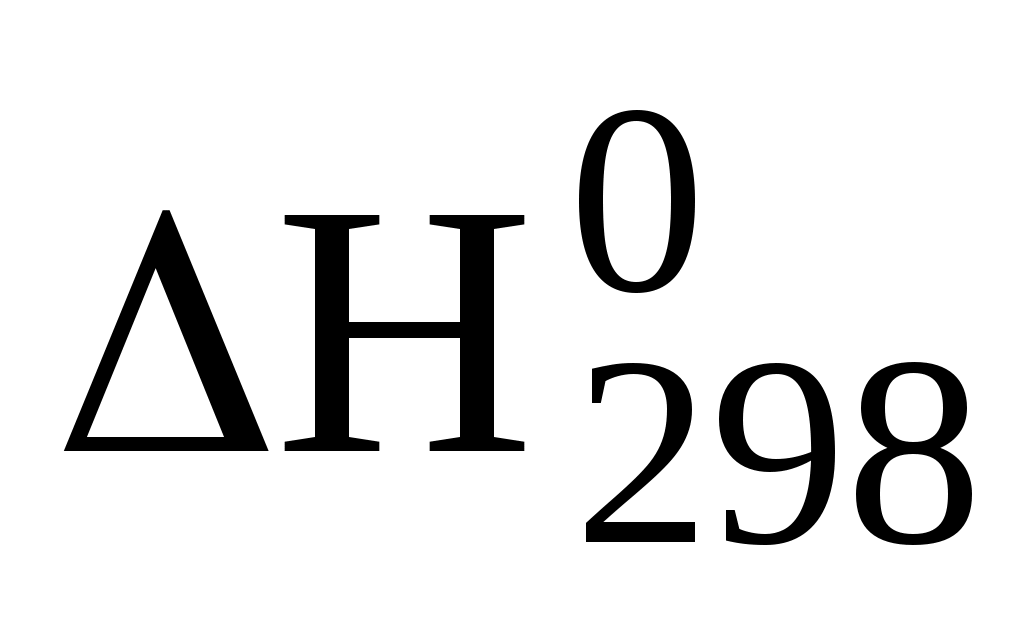 и и 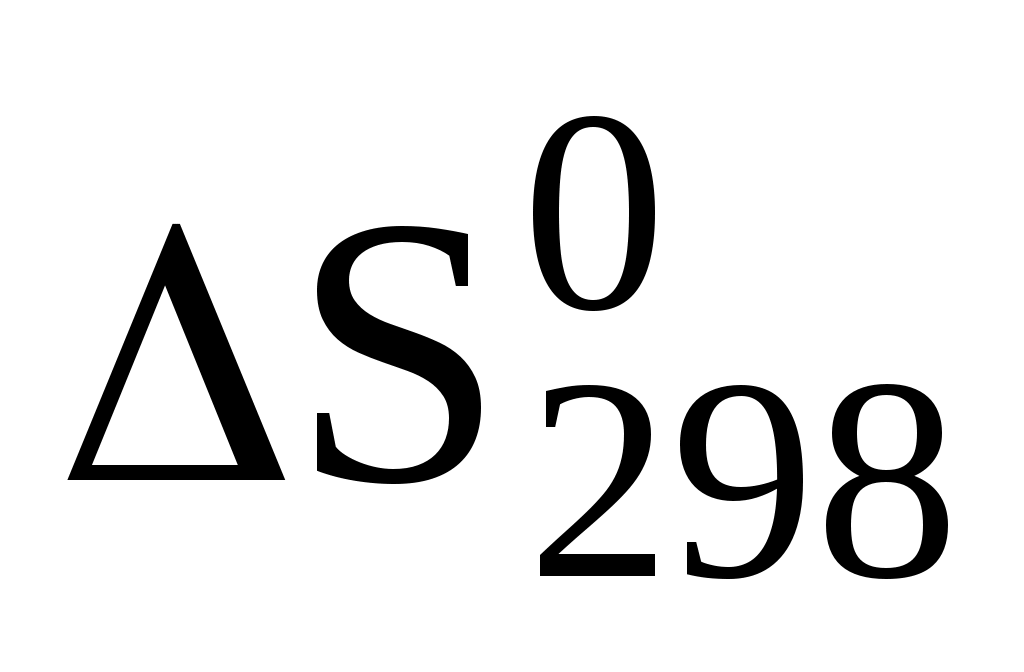 реагирующих веществ вычислите реагирующих веществ вычислите 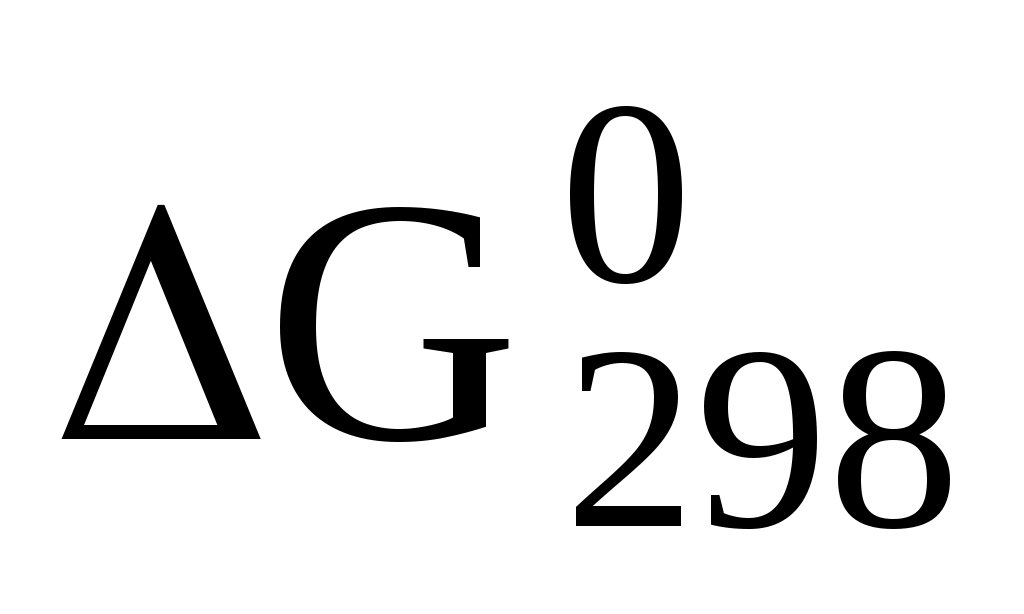 для следующих процессов: для следующих процессов:
а) SO2 (г) + 0,5O2 (г) ® SO3 (г)
б) СО (г) + Н2О (г) ® СО2 (г) + Н2 (г)
в) H2(г) + 0,5O2 (г) ® H2О (г)
Укажите, в каком направлении эти реакции будут протекать, приближаясь к равновесию.
114. (Р.70) Вычислив 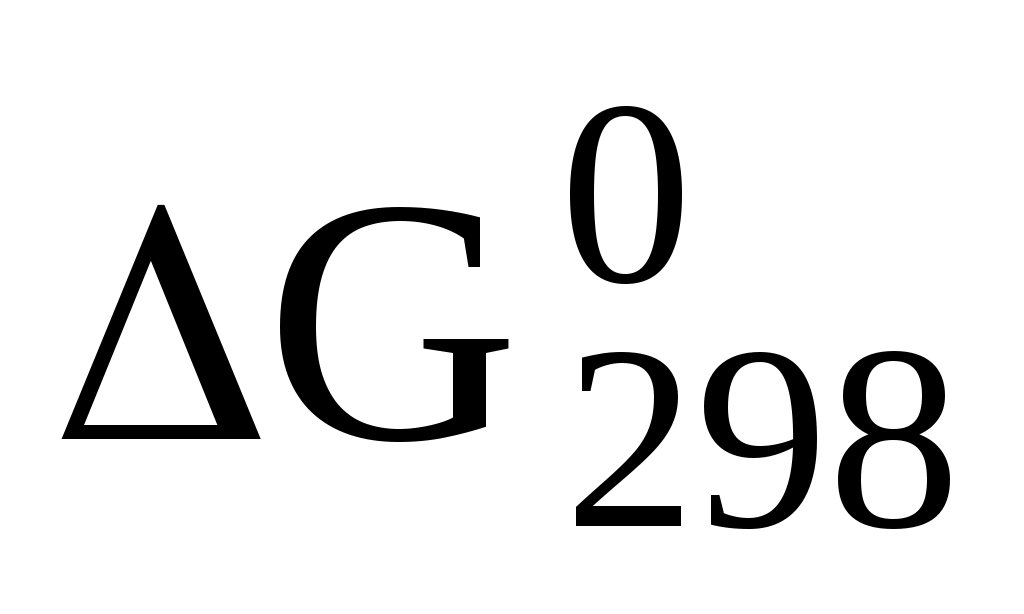 системы РbО2 + Рb = 2РbО на основании системы РbО2 + Рb = 2РbО на основании 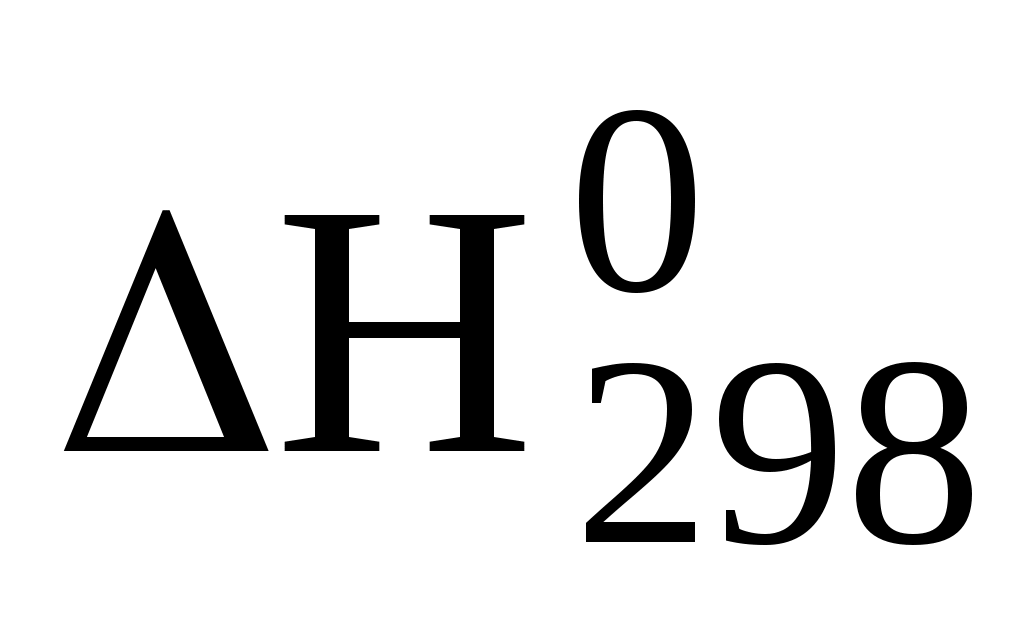 и и 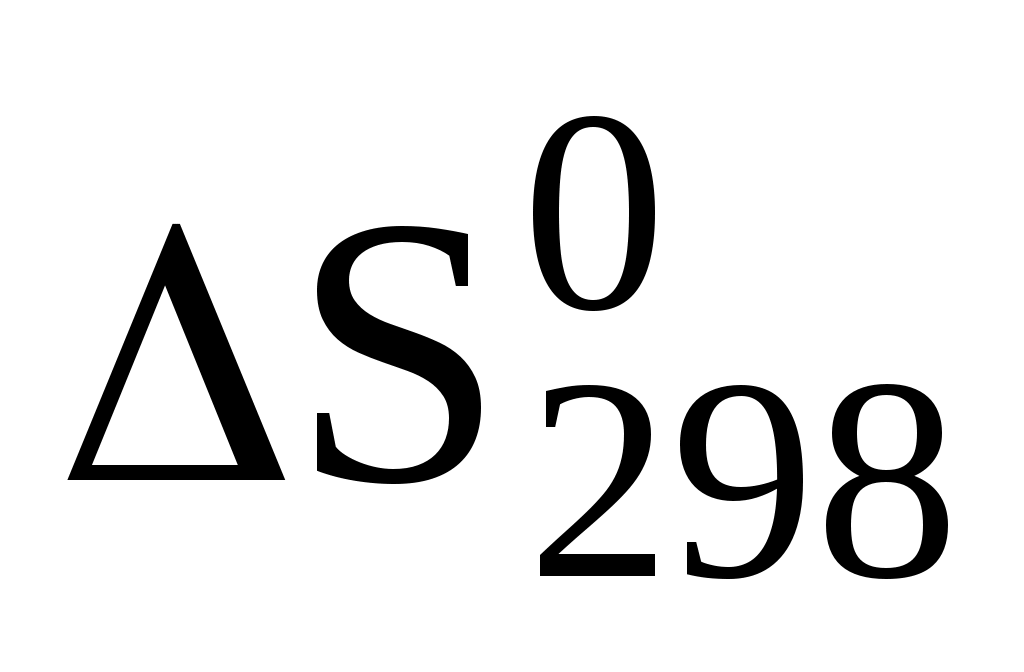 реагирующих веществ, определите, возможна ли эта реакция. реагирующих веществ, определите, возможна ли эта реакция.
115. (Р.72) Вычислите изменение энергии Гиббса при 25 °С для процесса
С (графит) + 2Н2 (г) = СН4 (г)
зная 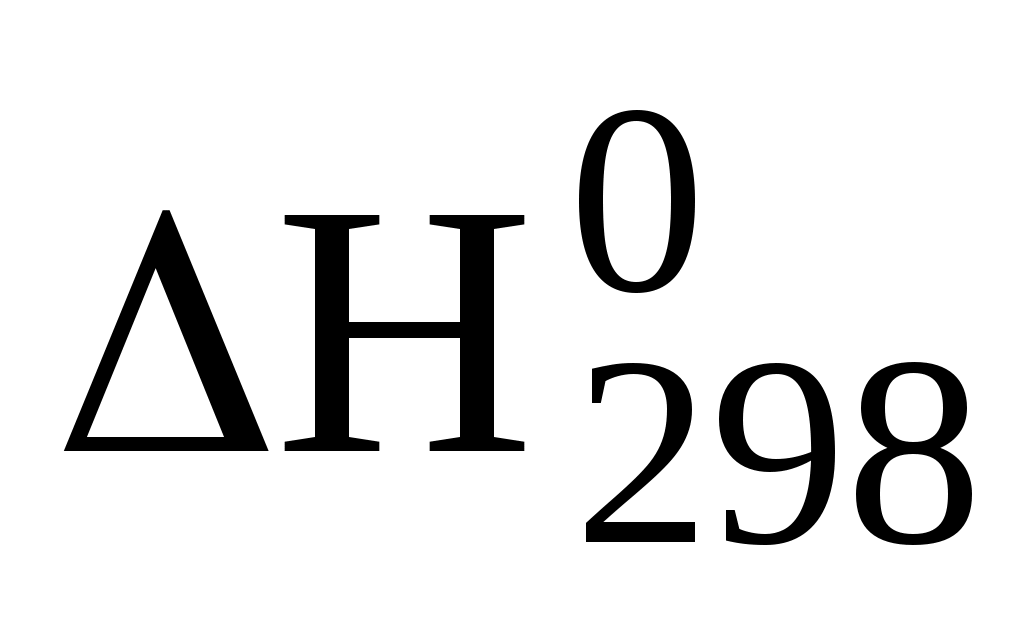 и и 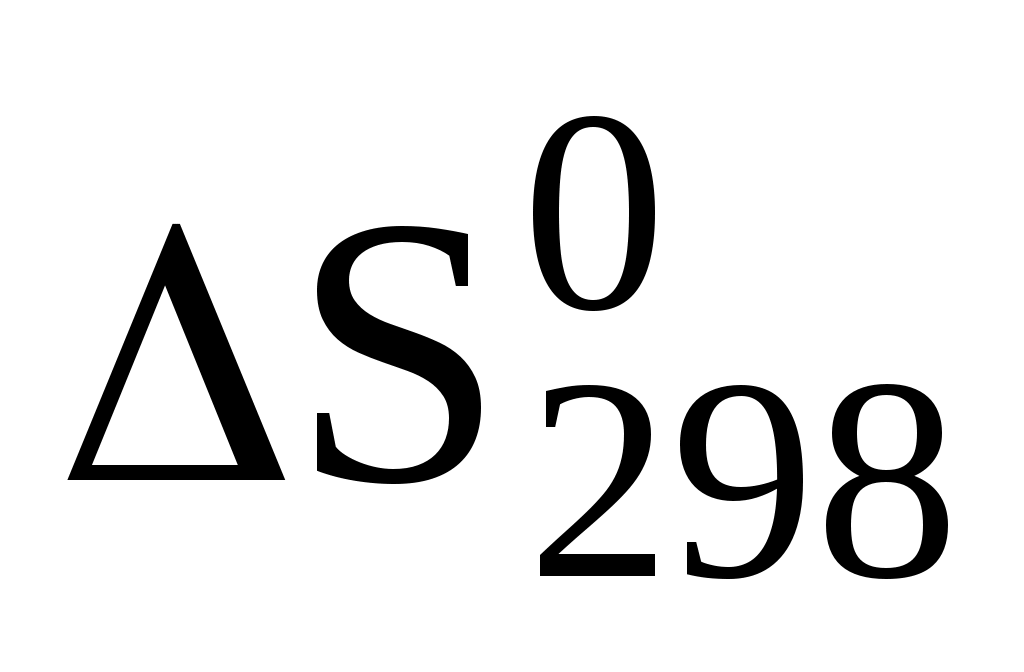 реагирующих веществ и стандартную теплоту сгорания метана. реагирующих веществ и стандартную теплоту сгорания метана.
Ответ: – 50,88 кДж.
116. (Р.75) В каком направлении нижеприведенная реакция будет протекать самопроизвольно:
Fe203 (к) + ЗН2 (г) = Fe (к) + ЗН2О (г)
Необходимые для расчета 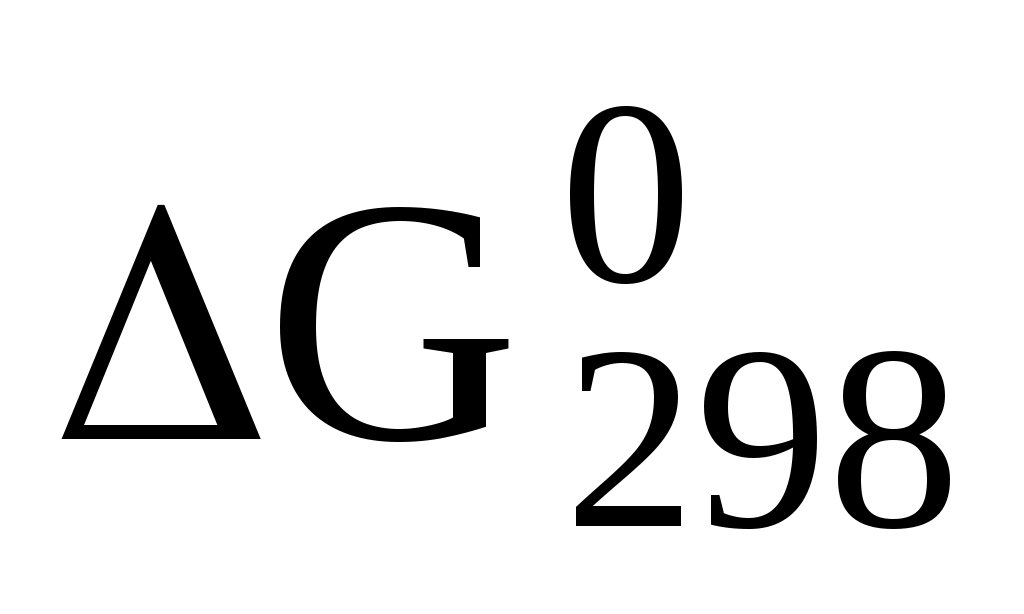 реакции значения реакции значения 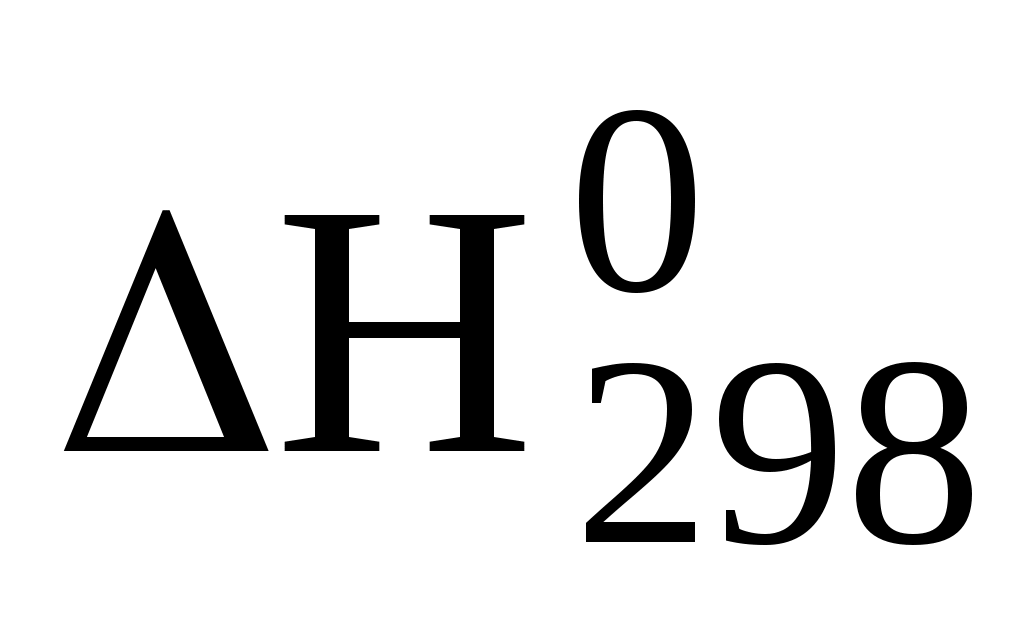 и и 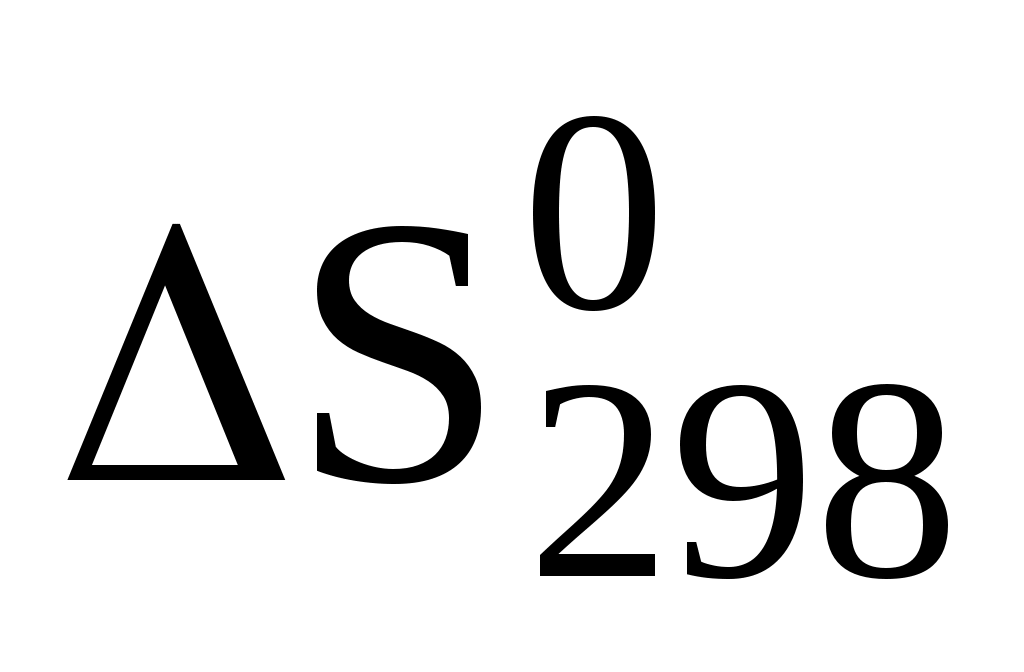 реагирующих веществ найти в справочной литературе. реагирующих веществ найти в справочной литературе.
117. (Г.318) Теплоты растворения SrCl2 и SrCl2 × 10H2О составляют соответственно
– 47,7 и 31,0 кДж/моль. Вычислите изменение энтальпии реакции
SrCl2 + 10Н2О = SrС12 × 10Н2О
Ответ: – 78,8 кДж/моль.
118. (Г.319) Теплота растворения CuSO4 составляет – 66,1 кДж/моль, а теплота перевода CuSO4 в CuSO4×5H2О равна – 78,8 кДж/моль. Вычислите теплоту растворения CuSO4×5H2O.
Ответ: 11,7 кДж/моль.
119. (Г.320) Теплота сгорания метана 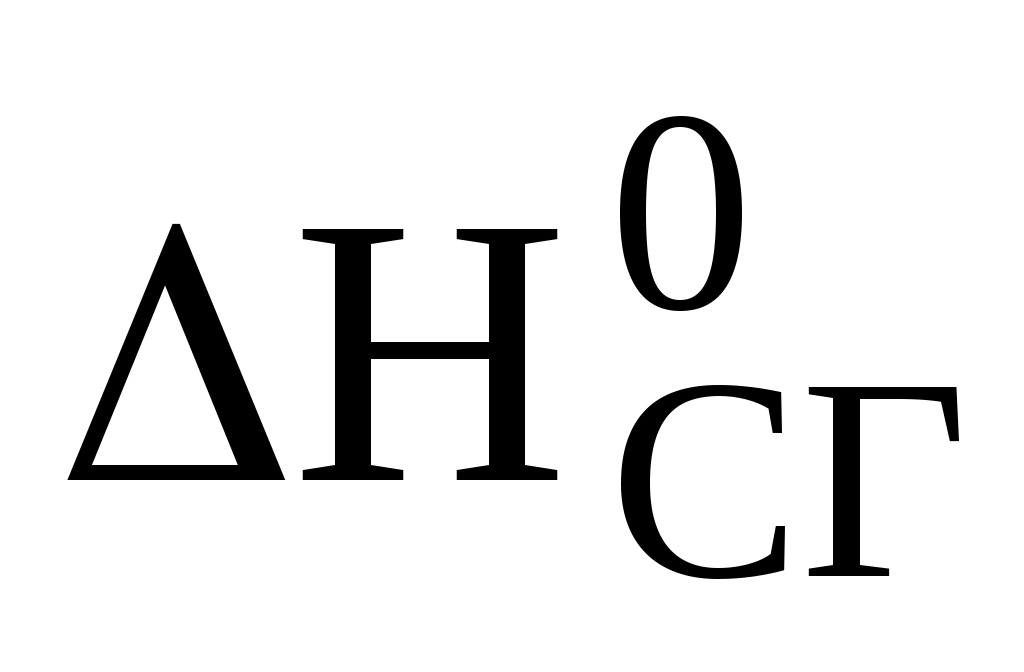 = – 890 кДж/моль. Вычислите теплотворную способность метана (в кДж/м3) и теплоту его образования. = – 890 кДж/моль. Вычислите теплотворную способность метана (в кДж/м3) и теплоту его образования.
Ответ: 39730 кДж/м3.
120. (Г.324) Исходя из теплоты образования воды (ж) и теплового эффекта реакции
Н2О2 = Н2О (ж) + 0,5O2;  = – 98,3 кДж/моль, = – 98,3 кДж/моль,
вычислите теплоту образования Н2О2.
Ответ: – 187,5 кДж/моль.
121. (Г.328) Вычислите теплоту сгорания этилена С2Н4, если известно, что теплота его образования 52,3 кДж/моль. Каков тепловой эффект сгорания 10 л С2Н4 (27° С и 98,64 кПа)?
Ответ: – 1411 кДж/моль; – 558 кДж.
122. (Г.329) Вычислите теплоту образования карбида кальция СаС2, исходя из теплового эффекта реакции
СаО + ЗС = СаС2 + СО; 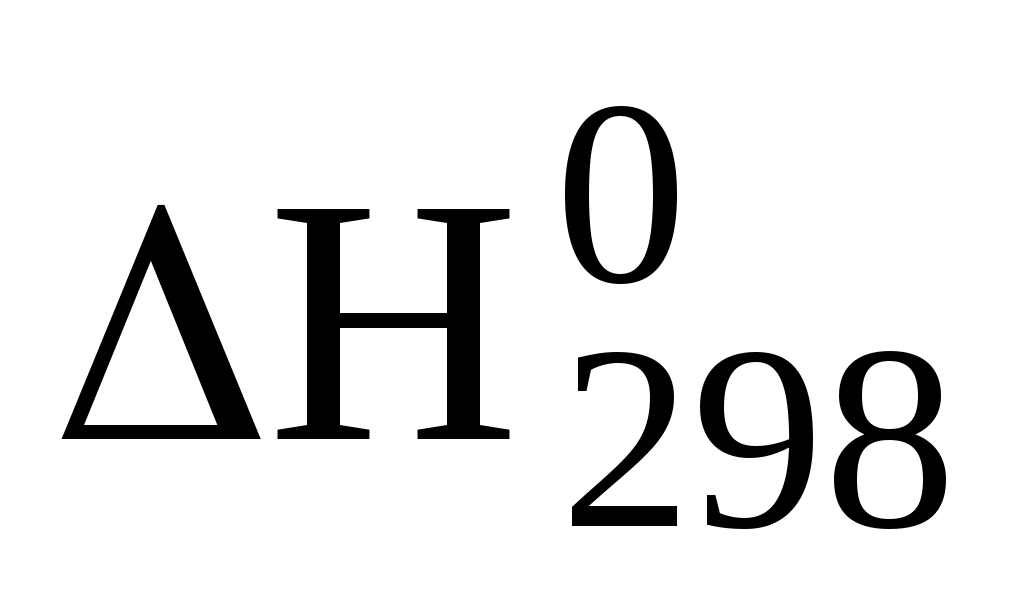 = 460 кДж/моль = 460 кДж/моль
Ответ: -65,1 кДж/моль.
123. (Г.331) При сгорании одного литра ацетилена (27° С и 101,3 кПа) выделяется
58,2 кДж. Вычислите 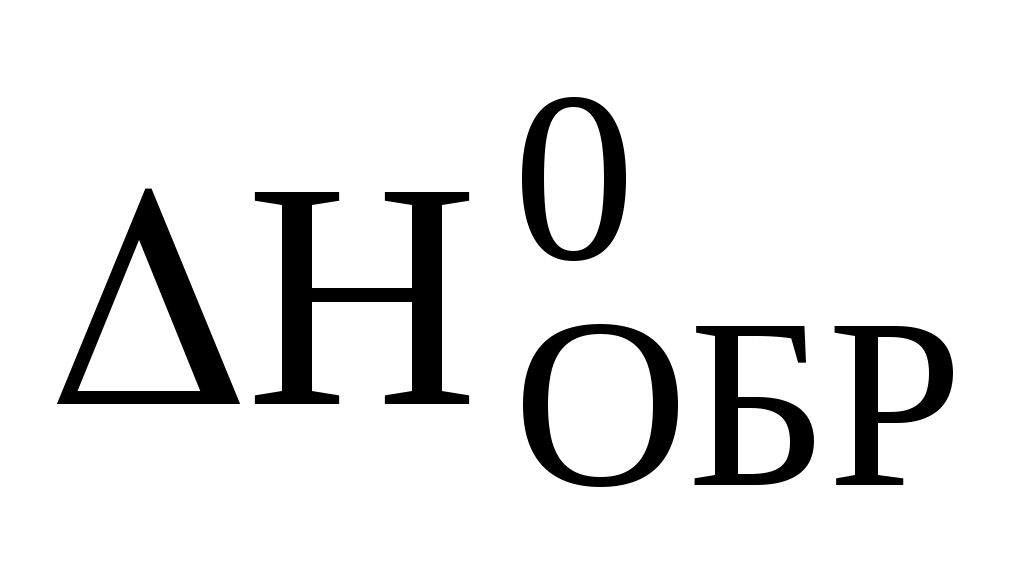 ацетилена. ацетилена.
Ответ: 230 кДж/моль.
124. (Г.332) Теплоты сгорания этана C2H6 и этилена C2H4 соответственно составляют
– 1560 и – 1411 кДж/моль. Вычислите 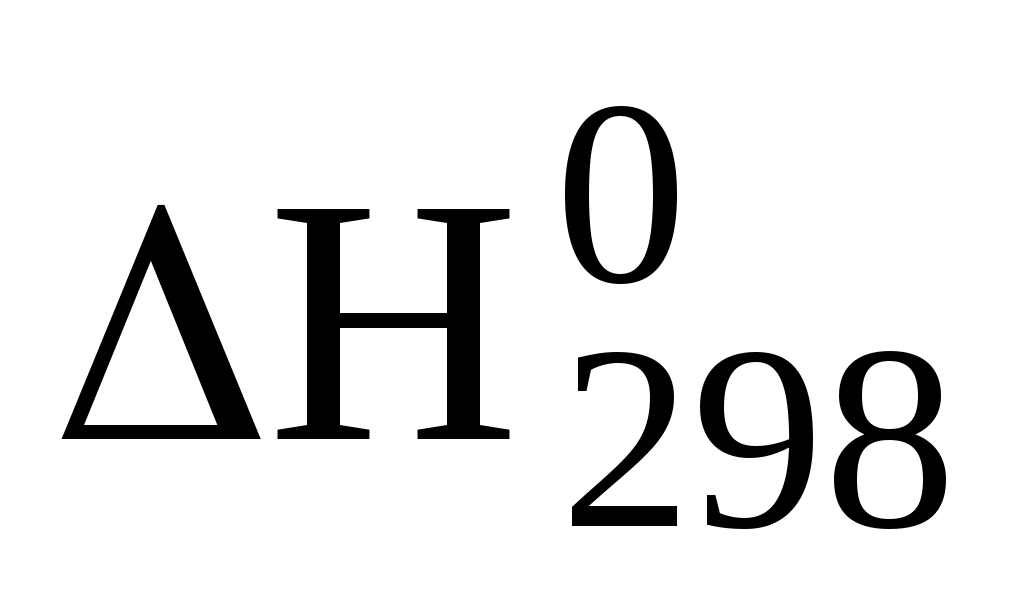 реакции гидрирования этилена реакции гидрирования этилена
С2Н4 + Н2 = C2H6
Ответ: – 137 кДж/моль.
125. (Г.334) Теплота сгорания этилового спирта составляет – 1409 кДж/моль. Вычислите 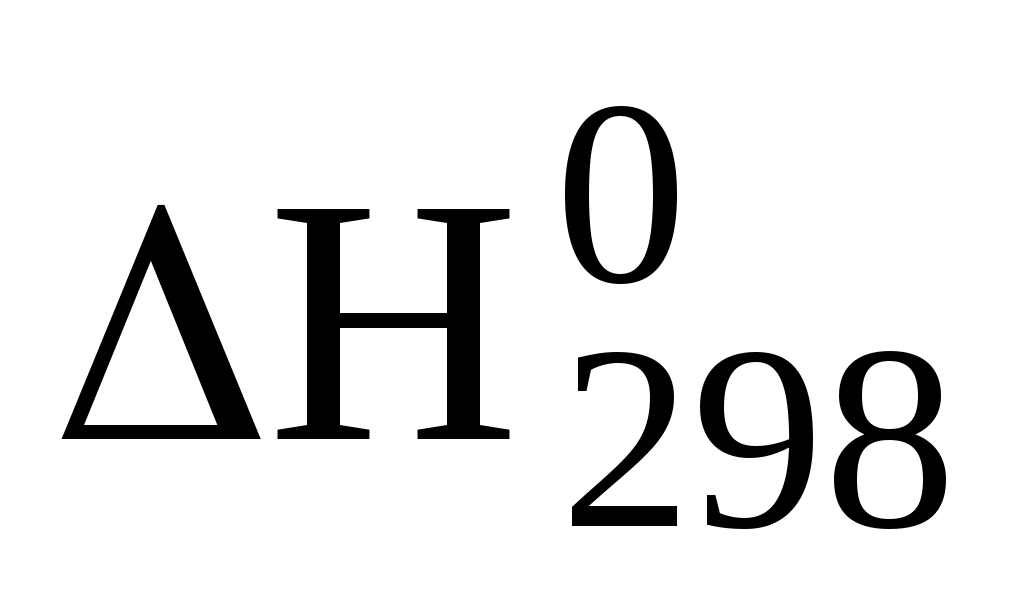 реакции реакции
2СО + 4Н2 = С2Н5ОН + Н2О(ж)
Ответ: – 301 кДж/моль.
126. (Г.335) Рассчитайте энергию гидратации иодида цезия:
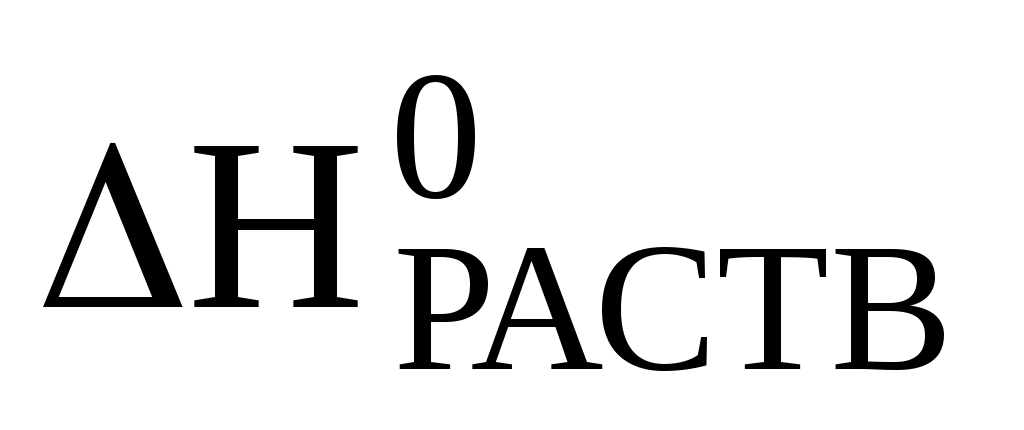 CsI = – 35 кДж/моль. CsI = – 35 кДж/моль.
Ответ: – 571 кДж/моль.
127. (Г.336) Рассчитайте энергию гидратации хлорида бария:
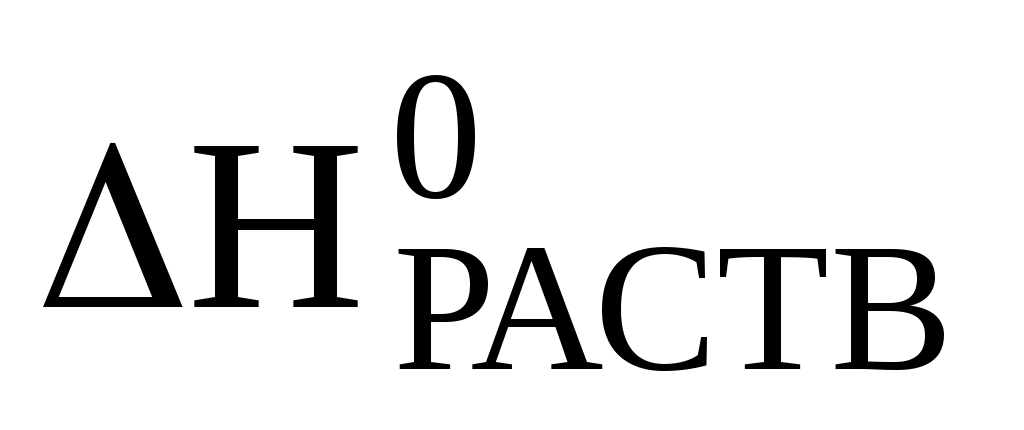 BaCl2 = – 10,5 кДж/моль. BaCl2 = – 10,5 кДж/моль.
Ответ: – 2060 кДж/моль.
128. (Г.351) Вычислите 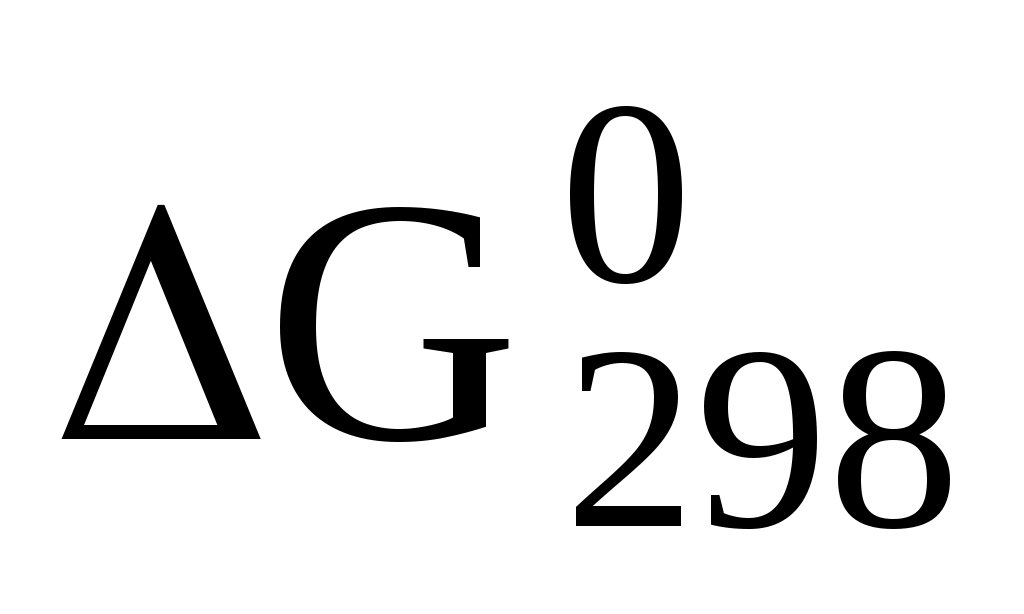 образования СН4, С2Н4 и NН3, исходя из значений образования СН4, С2Н4 и NН3, исходя из значений 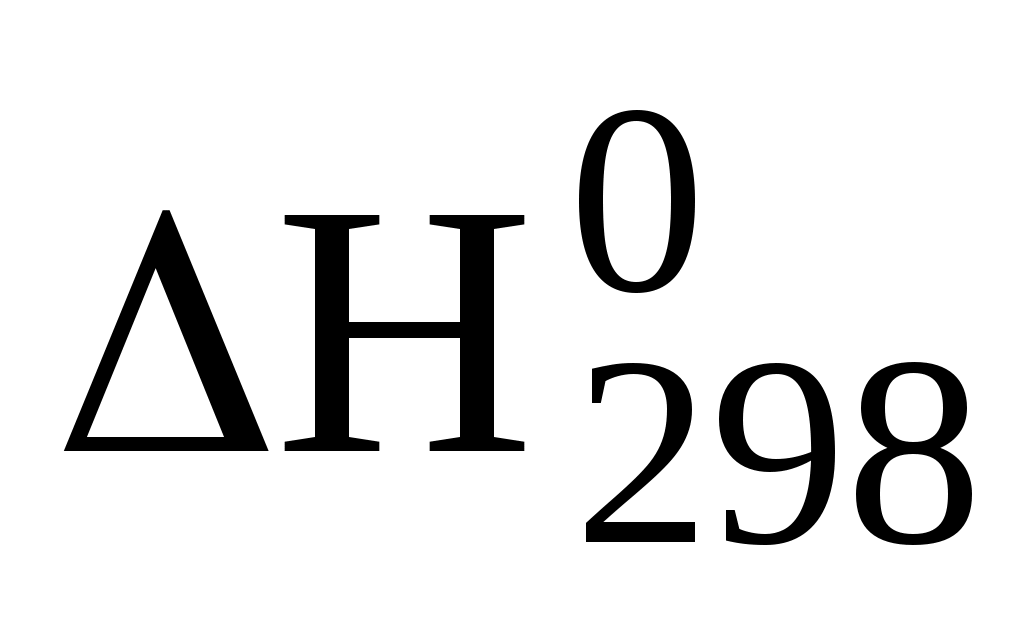 и изменения энтропии и изменения энтропии 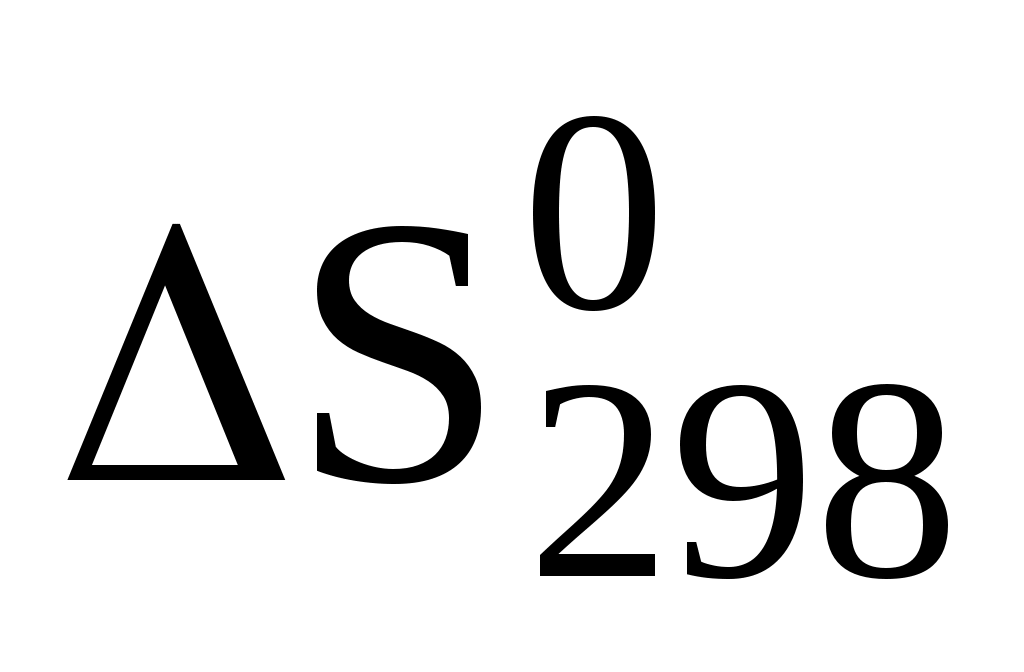 . Полученные величины сравните с данными, приведенными в справочной литературе. . Полученные величины сравните с данными, приведенными в справочной литературе.
Ответ: – 50,9 кДж/моль, 68,1 кДж/моль, – 16,5 кДж/моль.
129. (Г.353) Какие из перечисленных оксидов можно восстановить водородом:
а) Li2O; б) CuO; в) MnO; г) PbO?
Ответ: а) нельзя; б) можно; в) нельзя; г) можно.
Скорость химических реакций
Теоретические сведения.
Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени в единице реакционного пространства. Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации, температуры, наличия катализатора и др.).
Зависимость скорости реакции от концентрации выражается основным постулатом химической кинетики, законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции
3H2(г) + N2(г) → 2NH3(г)
|
 Скачать 0.73 Mb.
Скачать 0.73 Mb.