неорганика. Методические указания содержат теоретические сведения по основным разделам курсов Общая и неорганическая химия
 Скачать 0.73 Mb. Скачать 0.73 Mb.
|
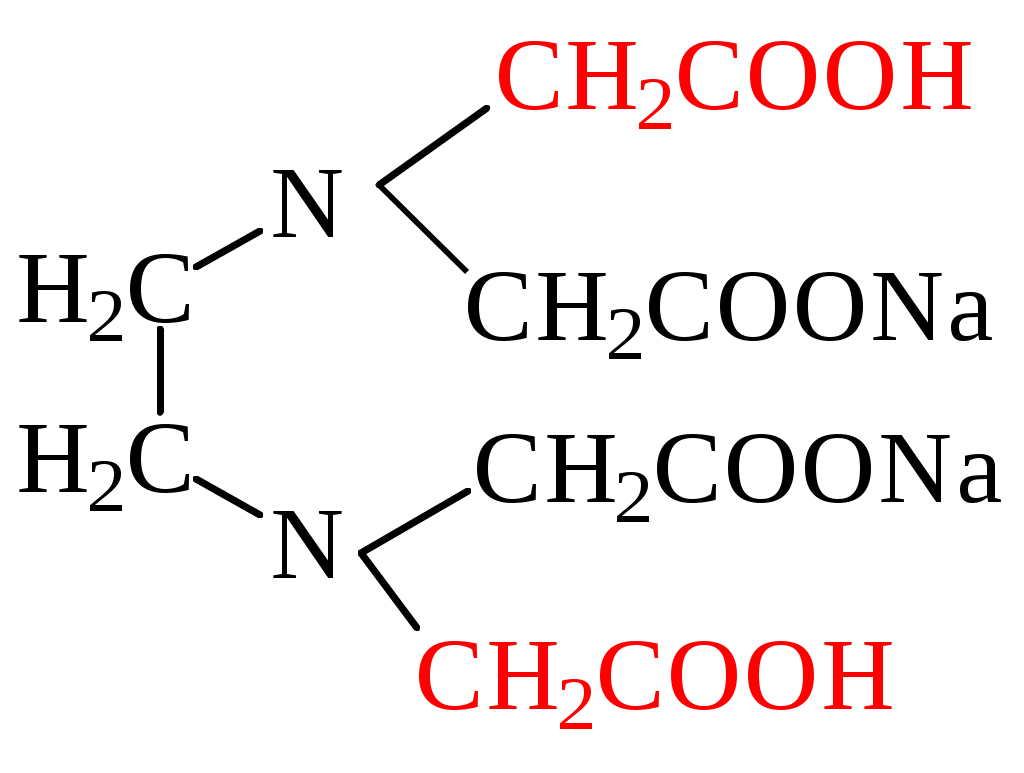
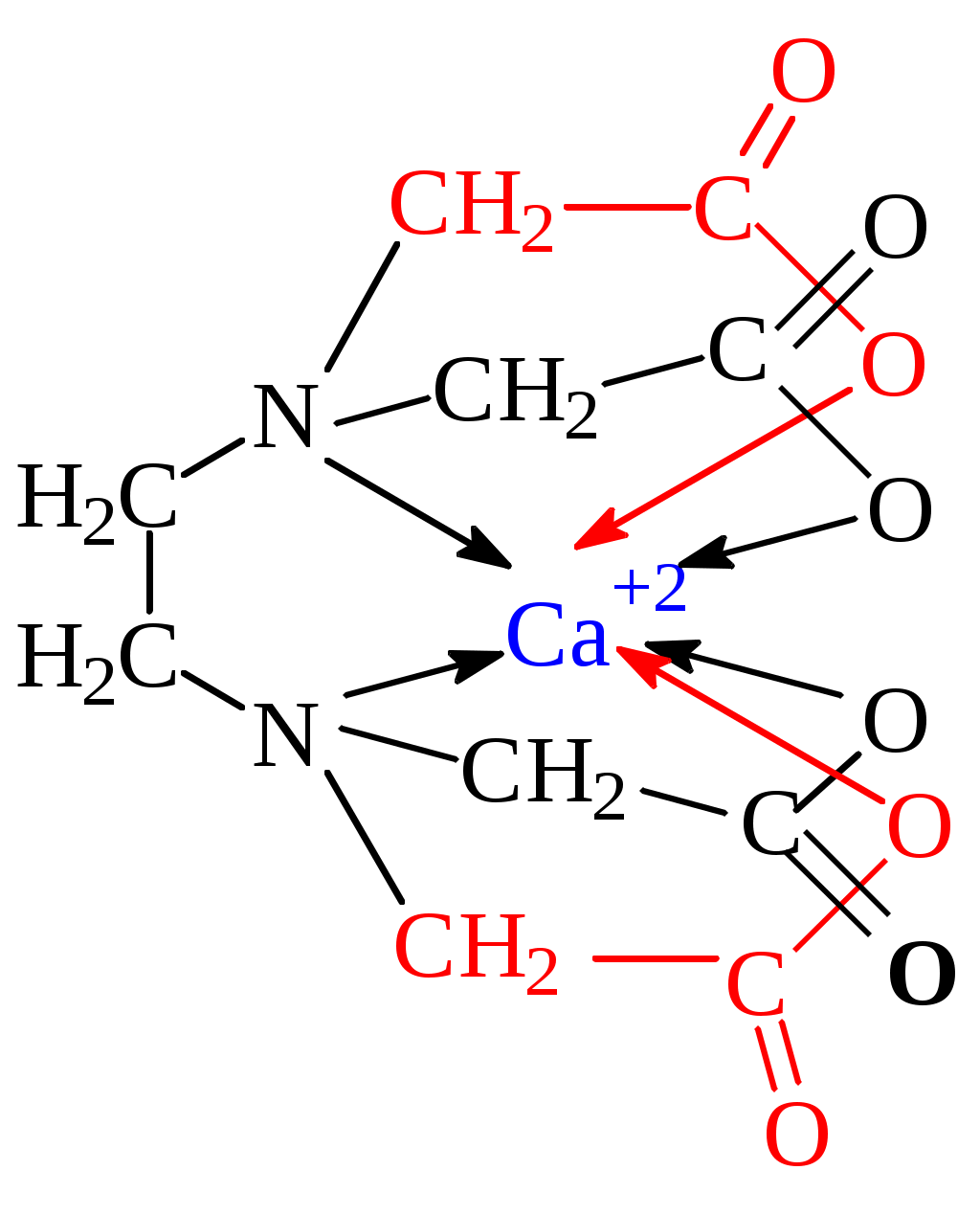
Теоретические сведенияЖесткость воды обусловлена содержанием в ней растворимых солей кальция и магния, гидрокарбонатов, хлоридов и сульфатов. Различают временную и постоянную жесткость воды. Временная жесткость определяется содержанием в воде растворимых гидрокарбонатов кальция и магния. При кипячении воды гидрокарбонаты переходят в малорастворимые карбонаты: Ca(HCO3)2 = CaCO3 + CO2 + H2O Mg(HCO3)2 = Mg(OH)2 + 2CO2 Карбонатную жесткость также можно удалить химическими способами, например, известкованием: Ca(HCO3)2 + Ca(OH)2 = CaCO3 + 2H2O Таким образом временная жесткость устраняется. Постоянная (некарбонатная) жесткость обусловлена присутствием в воде хлоридов и сульфатов кальция и магния. Некарбонатную жесткость можно удалить химическими способами: CaCl2 + Na2CO3 = CaCO3 + 2NaCl Сумма временной и постоянной жесткости составляет общую жесткость. Выражается жесткость в миллимоль эквивалентных ионов Ca+2 и Mg+2 на литр воды. Вода с жесткостью менее 4 ммоль-экв/л называется мягкой, от 4 до 8 – средней и от 8 до 12 – жесткой. В настоящее время жесткость воды определяют комплексонометрическим методом с применением реактива Na2H2Y.2H2O двунатриевой соли ЭДТА (этилендиаминтетрауксусной кислоты) – Комплексона III или Трилона Б.
Реакция взаимодействия катиона с ЭДТА в растворе можно представить уравнением Ca2+ + H2Y2– = 2H+ + CaY2– где Y2– - анион ЭДТА. Задачи 338. (Р.624) Чему равна жесткость (в ммоль/л и град.) 0,005 М СаС12? Ответ: 10 ммоль/л; 28 С. 339. (Р.626) На титрование 0,05 л образца воды израсходовано 4,8 × 10–3 л 0,1 н. НС1. Чему равна карбонатная жесткость воды? Ответ: 9,6 ммоль/л. 340. (Р.627) При определении временной жесткости на титрование 0,1 л воды израсходовано 5,25 × 10–3 л 0,101 н. НС1. Чему равна временная жесткость воды? Ответ: 5,3 ммоль/л. 341. (Р.628) Какую массу гашеной извести надо прибавить в 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 ммоль/л? Ответ: 0,41 г. 342. (Р.629) Для умягчения 100 л воды потребовалось 12,72 г Na2CO3. Чему равна жесткость воды (в град, и ммоль/л)? 343. (Р.631) Общая жесткость волжской воды равна 6,52 ммоль/л, а временная 3,32 ммоль/л. Какую массу Са(ОН)2 и Na2CO3 надо взять, чтобы устранить жесткость 5 л воды? Ответ: 0,61; 0,85 г. 344. (Р.633) Чему равна постоянная жесткость воды, если для ее устранения к 25 л воды добавлено 21,6 г буры Na2B4O4 × 10Н2О? Ответ: 6,04 ммоль/л. 345. (Р.634) Рассчитайте обменную емкость катионита марки КУ-2, если через адсорбционную колонку, содержащую 100 г этого ионита, пропустили 25 л воды общей жесткостью 13,6 ммоль/л. Ответ: 3,4 ммоль/л. 346. (Р.636) Объемная емкость каолиновой глины составляет 13,5 ммоль/л. Какой объем воды общей жесткостью 3,5 ммоль/л можно профильтровать через 150 г глины для полного удаления катионов Са2+ и Mg2+? Ответ: 578,6 л. Окислительно-восстановительные реакции Теоретические сведения. Степень окисления – это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна. Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью – положительные. Степень окисления – формальное понятие; в ряде случаев степень окисления не совпадает с валентностью. Например: N2H4 (гидразин) степень окисления азота – -2; валентность азота – 3. |