Закон действующих масс может быть записан 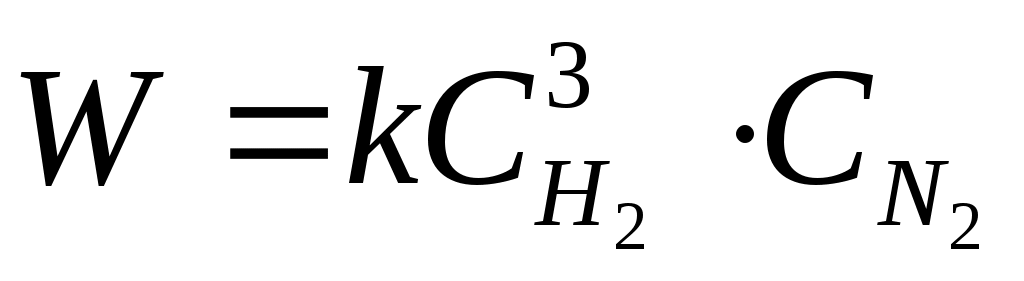 , ,
где W – скорость химической реакции; k – константа скорости; 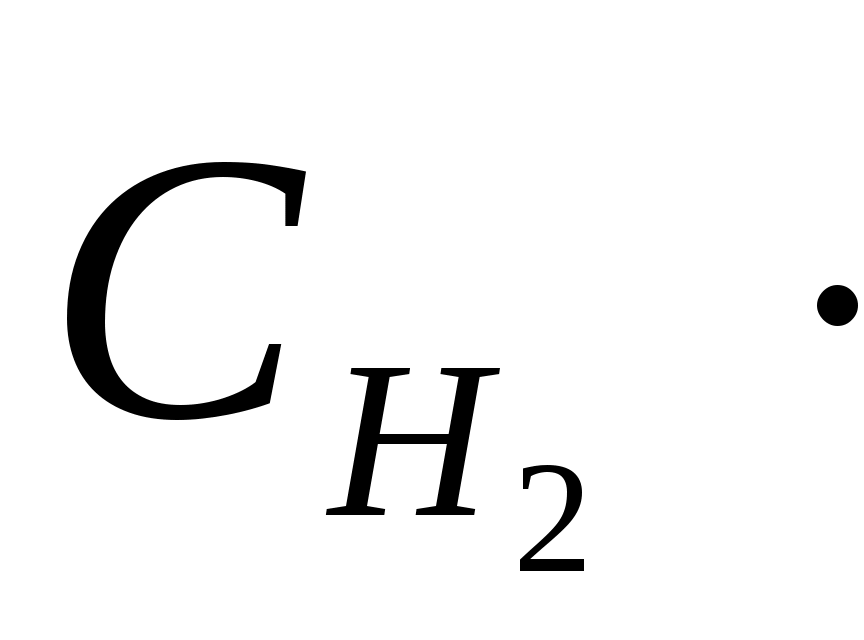 и и 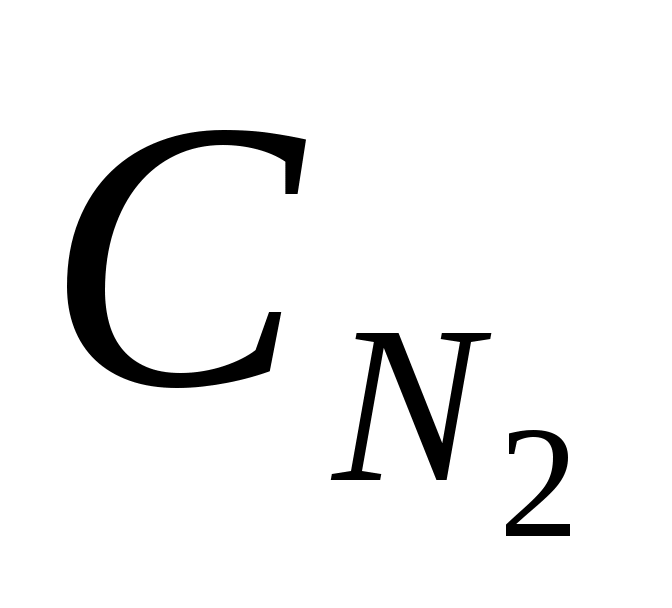 – концентрации реагирующих веществ. Данное уравнение называется кинетическим. – концентрации реагирующих веществ. Данное уравнение называется кинетическим.
Реакции в гетерогенной системе осуществляются на поверхности раздела фаз. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела. Так, для реакции
C(к) + O2(г) → CO2 (г)
закон действующих масс имеет вид
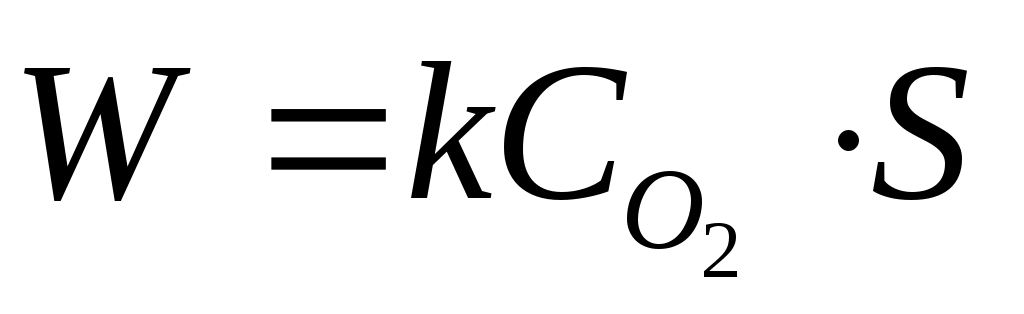
где W – скорость химической реакции; k – константа скорости; 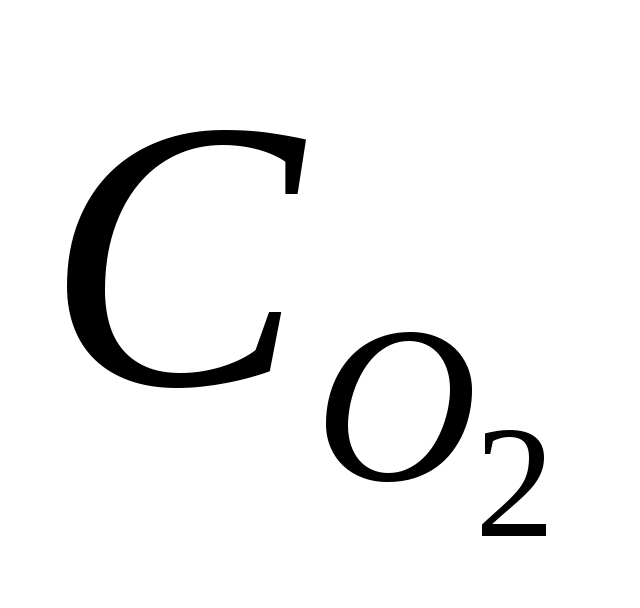 – концентрация кислорода; – концентрация кислорода;
S – площадь поверхности раздела между фазами.
Зависимость скорости от температуры выражается правилом Вант-Гоффа
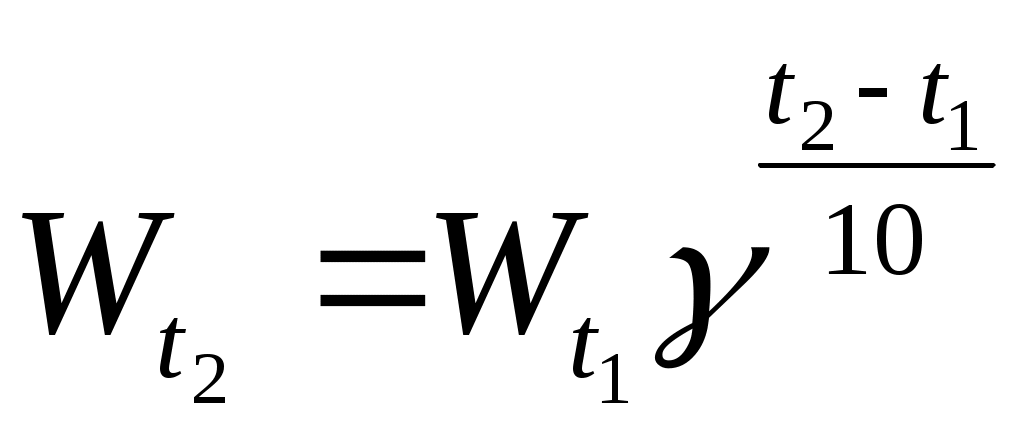
где 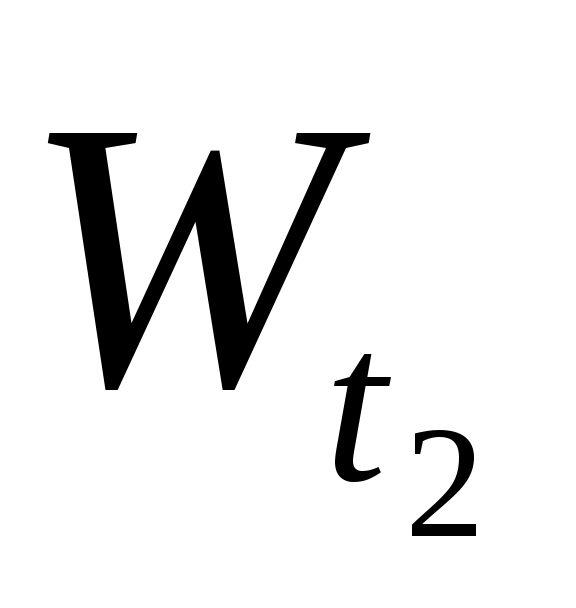 и и 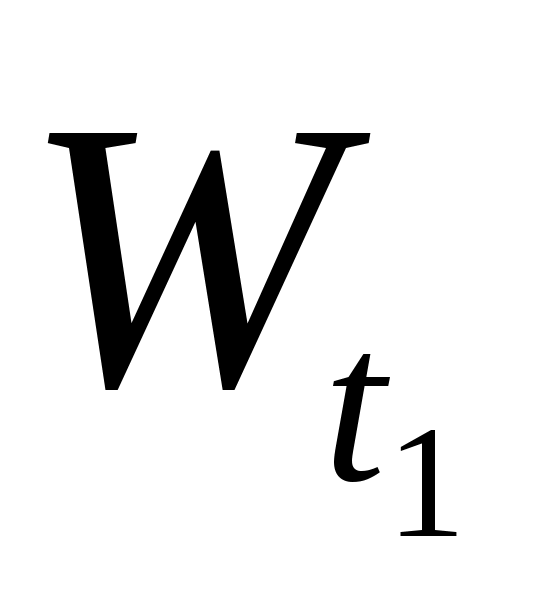 - скорости реакции при температурах Т2 и Т1; γ – температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 С. - скорости реакции при температурах Т2 и Т1; γ – температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 С.
Одним из способов ускорения химической реакции является катализ, который осуществляется при помощи веществ – катализаторов – увеличивающих скорость реакции, но не расходующихся в результате ее протекания.
Механизм действия катализаторов сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией активных молекул исходных веществ. Скорость химической реакции при этом увеличивается.
Задачи
130. (Р.308) В начальный момент протекания реакции
N2 + 3H2 2NH3
концентрации были равны (моль/л): С(N2) = 1,5; С(Н2) = 2,5; C(NH3) = 0. Каковы концентрации азота и водорода при концентрации аммиака 0,5 моль/л?
Ответ: 1,25; 1,75 моль/л.
131. (Р.309) Начальные концентрации веществ в реакции
СО + Н2О СО2 + Н2
были равны (моль/л): С(СО) = 0,05; С(Н2О (г)) = 0,06; С(СО2) = 0,4; С(Н2) = 0,2. Вычислите концентрации всех участвующих в реакции веществ после того, как прореагировало 60 % Н2О.
Ответ: 0,24; 0,14; 0,76; 0,56 моль/л.
132. (Р.310) Константа скорости реакции
А + 2В ЗС
равна 0,6 л2 × моль–2 × с–1. Начальные концентрации: С(А) = 2,0 и С(В) = 2,5 моль/л. В результате реакции концентрация вещества В оказалась равной 0,5 моль/л. Вычислите, какова концентрация вещества А и скорость прямой реакции.
Ответ: 1,0 моль/л; 0,15.
133. (Р.311) Реакция идет по уравнению
4NH3 + 5O2 4NO + 6H2O
Как изменится скорость реакции, если увеличить давление в 2 раза?
Ответ: Возрастет в 512 раз.
134. (Р.312) Реакция между веществами А и В выражается уравнением
2А + В 2C.
Начальная концентрация вещества А равна 0,3 моль/л, а вещества В – 0,5 моль/л. Константа скорости реакции равна 0,8 л2 × моль–2 × мин–1. Рассчитайте начальную скорость прямой реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшается на 0,1 моль.
Ответ: 0,036; 0,0144 моль × л–1 × мин–1.
135. (Р.313) Разложение N2O на поверхности золота при высоких температурах протекает по уравнению
2N2О = 2N2 + О2
Константа скорости данной реакции равна 5 × 10–4 л × моль–1 × мин–1 при 1173 К. Начальная концентрация N2O – 3,2 моль/л. Определите скорость реакции при заданной температуре в начальный момент и в тот момент, когда разложится 25 % N2O.
Ответ: 51,2 × 10–4, 22,8 × 10–4 моль × л–1 × мин–1.
136. (Р.314) Реакция идет по уравнению
2NO + О2 2NO2
Начальные концентрации реагирующих веществ были (моль/л): С(NO) = 0,8; С(О2) = 0,6. Как изменится скорость реакции, если концентрацию кислорода увеличить до 0,9 моль/л, а концентрацию оксида азота до 1,2 моль/л?
Ответ: Возрастет в 3,4 раза.
137. (Р.315) Реакция протекает по уравнению
Na2S2O3 + H2SO4 = Na2SO4+H2SO3 + S
Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза?
Ответ: Уменьшится в 16 раз.
138. (Р.316) Реакция выражается уравнением
4НС1 + О2 2Н2О + 2С12
Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): C(НС1) = 0,85; С(О2) = 0,44; C(С12) = 0,30. Какими были концентрации НС1 и О2 в начале реакции?
Ответ: 1,45; 0,59 моль/л.
139. (Р.319) Рассчитайте константу скорости реакции первого порядка, учитывая, что за 25 мин реакция проходит на 25 %, т. е. прореагировала четвертая часть веществ.
Ответ: 0,0115 моль–1.
140. (Р.320) Константа скорости реакции первого порядка равна 2,5 × 10–5 с–1. Какое количество останется непрореагировавшим через 10 ч после начала реакции? Начальная концентрация равна 1 моль/л.
Ответ: 0,407 моль/л.
141. (Г.362) Во сколько раз следует увеличить концентрацию оксида углерода в системе
2СО = СО2 + С,
чтобы скорость реакции увеличилась в четыре раза?
Ответ: В 2 раза.
142. (Г.363) Во сколько раз следует увеличить концентрацию водорода в системе
N2 + ЗН2 2NH3,
чтобы скорость реакции возросла в 100 раз?
Ответ: В 10 раз.
143. (Г.364) Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции
2NO + О2 2NO2
возросла в 1000 раз?
Ответ: В 10 раз.
144. (Г.365) Напишите уравнение скорости реакции
С + О2 = = СО2
и определите, во сколько раз увеличится скорость реакции при увеличении концентрации кислорода в три раза.
Ответ: В 3 раза.
145. (Г.366) Реакция между оксидом азота(II) и хлором протекает по уравнению
2NO + С12 2NOC1.
Как изменится скорость реакции при увеличении: а) концентрации оксида азота в два раза; б) концентрации хлора в два раза: в) концентрации обоих веществ в два раза?
Ответ: В 4 раза, в 2 раза, в 8 раз.
146. (Г.367) Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40, если = 3,2?
Ответ: В 105 раз.
147. (Г.368) На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз ( = 2,5)?
Ответ: На 37.
148. (Г.369) При повышении температуры на 50 скорость реакции возросла в 1200 раз. Вычислите .
Ответ: 4,13.
149. (Г.370) Вычислите реакции, если константа скорости ее при 120 °С составляет
5,88 × 10–4, а при 170 °С равна 6,7 × 10–2.
Ответ: 2,6.
Химическое равновесие
Теоретические сведения
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции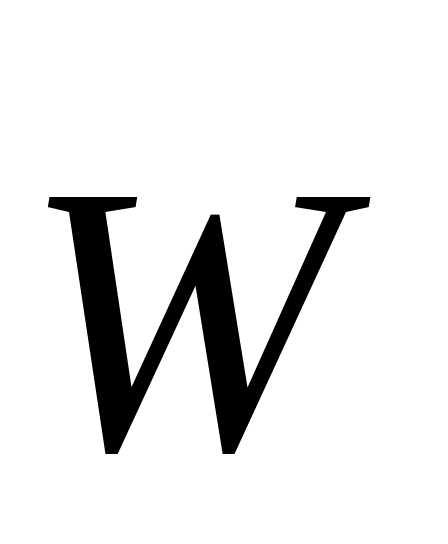 равна скорости обратной реакции равна скорости обратной реакции 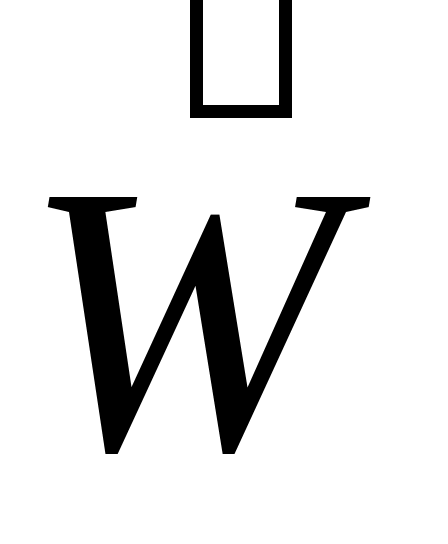 . Равенство . Равенство 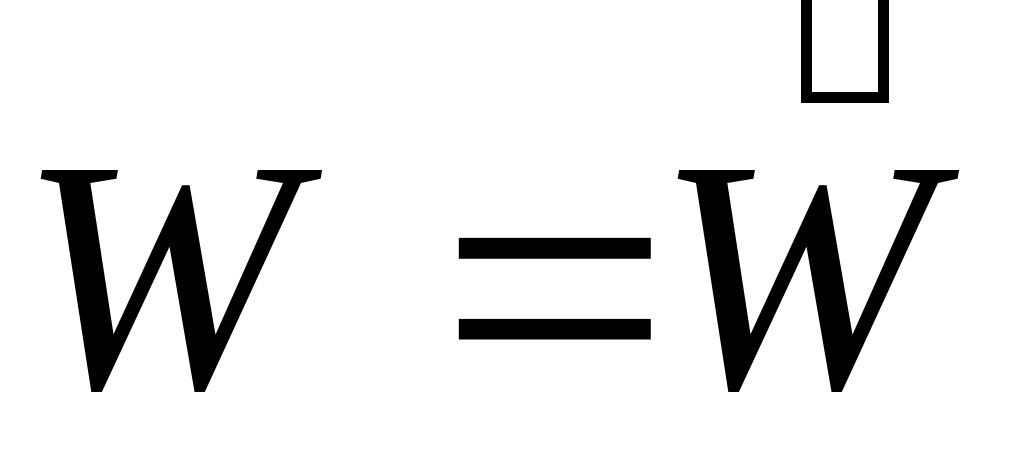 является кинетическим условием химического равновесия. является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянством величин энергии Гиббса системы GT.Равенство ΔGT = 0 является термодинамическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам, называется константой равновесия. Для обратимой реакции
Н2(г) + I2(г)↔2HI(г)
константа равновесия имеет вид
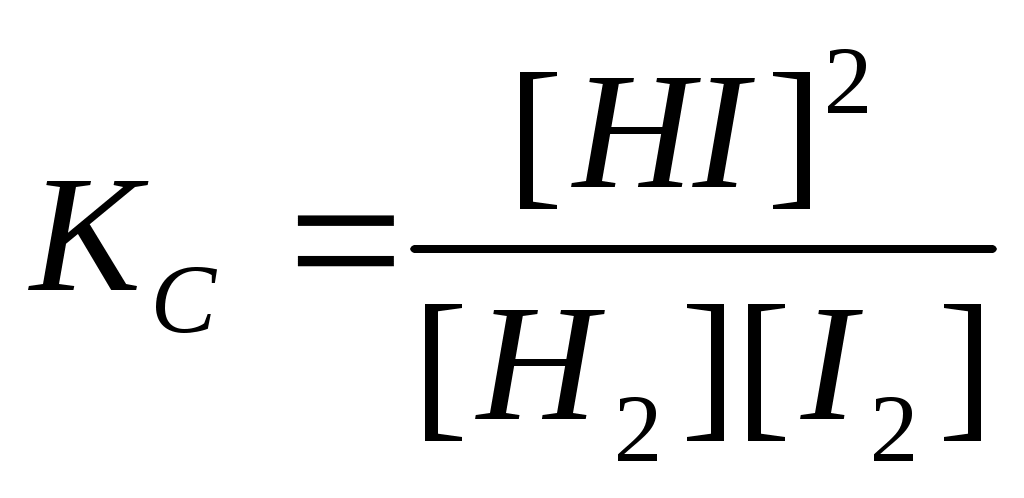 или или 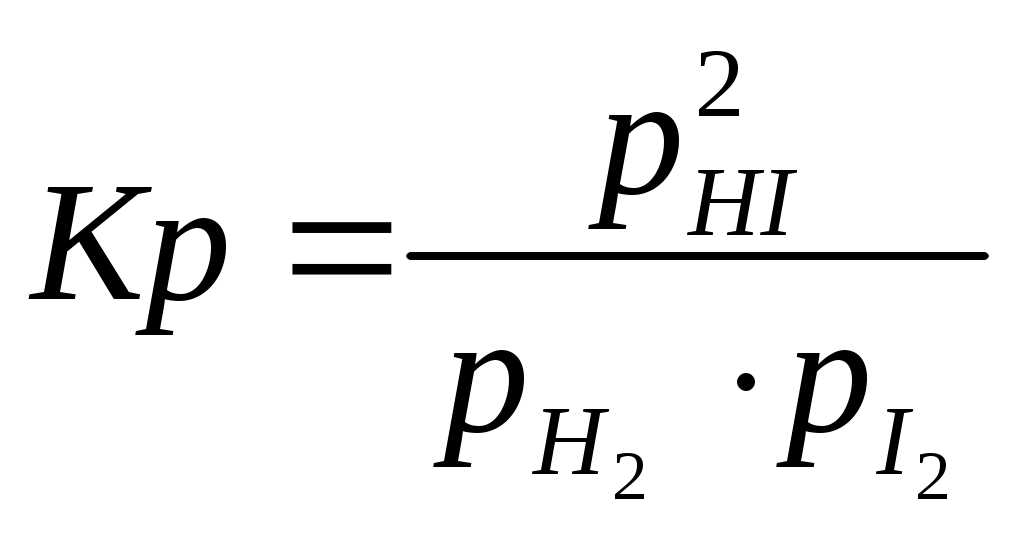 , ,
где КС, КР – константы равновесия в случае отношения молярных концентраций и парциальных давлений соответственно; [HI], [H2], [I2] – равновесные молярные концентрации;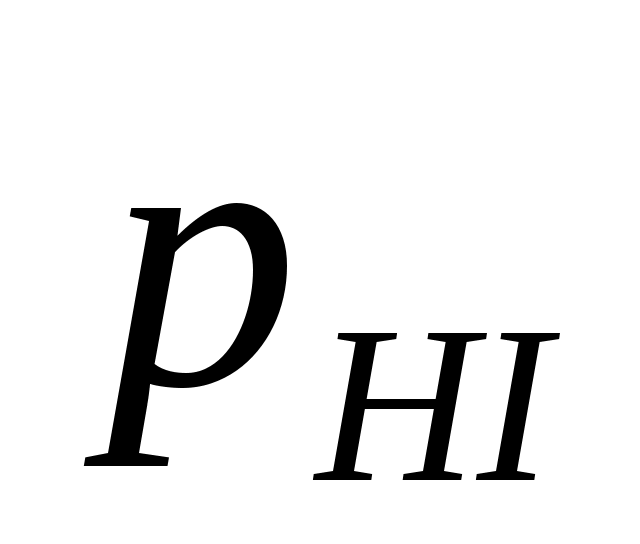 , , 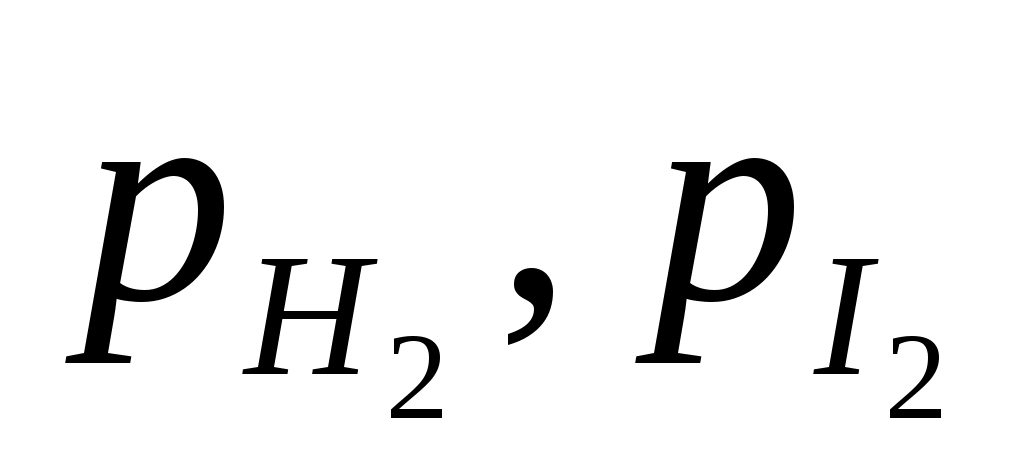 - парциальные давления. - парциальные давления.
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в сиcтеме. Показывает на сколько скорость прямой реакции больше скорости обратной; характеризует глубину протекания процесса.
Константа равновесия связана со стандартной энергией Гиббса данной реакции (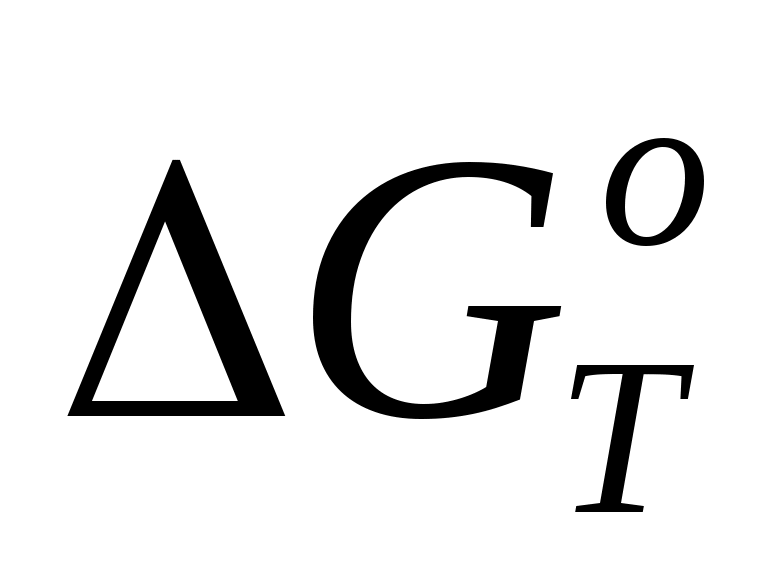 ) следующим соотношением ) следующим соотношением
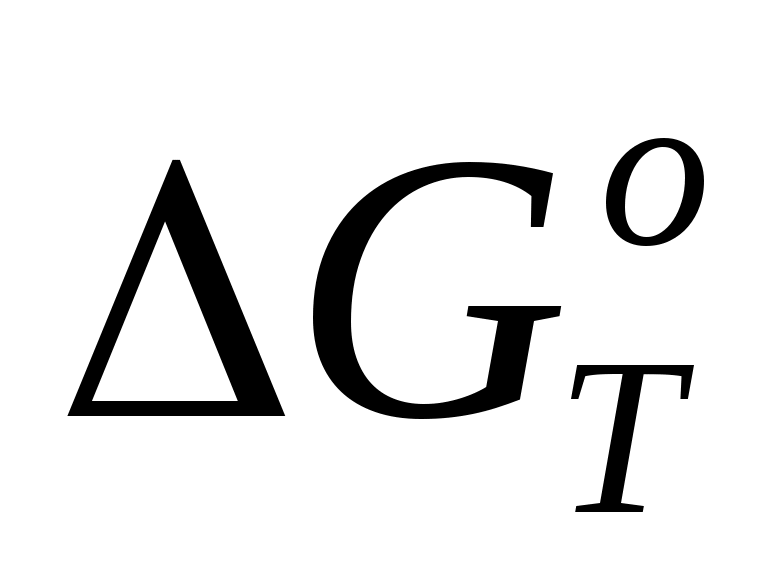 = – RTlnKС = – RTlnKС
где R – универсальная газовая постоянная [8,31 Дж/(моль.К)]; Т – абсолютная температура, К;
КС — константа равновесия.
Если КС > 1 (ΔG < 0), то в равновесной системе преобладают продукты реакции, а если
КС < 1 (ΔG > 0), то в равновесной системе преобладают исходные вещества.
Химическое равновесие остается неизменным до тех пор, пока постоянны параметры (p,T,CM), при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
В общем случае, направление смещения равновесия определяется принципом
Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится в сторону, противодействующую этому воздействию.
При увеличении концентрации реагирующих веществ, равновесие сместится в сторону продуктов реакции, а при уменьшении концентрации исходных веществ – в сторону их образования.
При увеличении общего давления в системе равновесие смещается в сторону меньшего числа моль газообразных веществ, а при уменьшении – в сторону большего числа моль газообразных веществ.
Увеличение температуры в системе смещает равновесие в сторону эндотермической реакции, а уменьшение – в сторону экзотермической реакции.
Задачи
150. (Р.351) Константа равновесия реакции
N2 + ЗН2 2NH3,
KС = 0,1 при 673 К. Равновесные концентрации (моль/л): С(Н2) = 0,6 и С(NH3) = 0,18. Вычислите начальную и равновесную концентрации азота.
Ответ: 1,50 моль/л, 1,59 моль/л.
151. (Р.352) Определите равновесную концентрацию водорода в реакции:
2HI I2 + Н2,
если исходная концентрация HI составляет 0,55 моль/л, а константа равновесия KС = 0,12.
Ответ: 0,11 моль/л.
152. (Р.353) При некоторой температуре константа равновесия термической диссоциации
N2O4 2NO2,
KС = 0,26. Равновесная концентрация NO2 равна 0,28 моль/л. Вычислите равновесную и первоначальную концентрации N2O4. Какая массовая доля в % этого вещества продиссоциировала к моменту установления равновесия?
Ответ: 0,44 моль/л, 31,8 %.
153. (Р.354) При синтезе фосгена имеет место равновесие реакции
Cl2 + CO COCl2.
Определите исходные концентрации хлора и оксида углерода, если равновесные концентрации равны (моль/л): С(Cl2) = 2,5; С(CO) = 1,8; С(COCl2) = 3,2.
Ответ: 5,0 моль/л, 5,7 моль/л.
154. (Р.356) В состоянии равновесия системы
CO2 + H2 CO + H2O.
Реакционная смесь имела объемный состав: 22 % CO2, 41 % H2, 17 % CO, 20 % H2O. Вычислите КР и КС для этой реакции при 1900 К и давлении 98 501 Па.
Ответ: 0,38.
155. (Р.358) Реакция синтеза аммиака
N2 + ЗН2 2NH3,
протекает при 723 К. Константа равновесия при этой температуре равна КР = 5,34 × 10–8. Определите парциальное давление аммиака, если парциальное давление азота и водорода соответственно равно 65 717 и 20 380 Па.
Ответ: 1,75 × 105 Па.
156. (Р.360) При 873 К константа равновесия КС реакции
Cl2 + CO COCl2
равна 12,12. Вычислите реакции при этой температуре.
Ответ: 1,67 × 10-6 .
157. (Р.361) При нагревании протекает реакция
SO2Cl2 SO2 + Cl2.
При некоторой температуре из 1 моль SO2Cl2, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,5 моль. Определите константу равновесия при этой температуре.
Ответ: 0,025.
158. (Р.364) 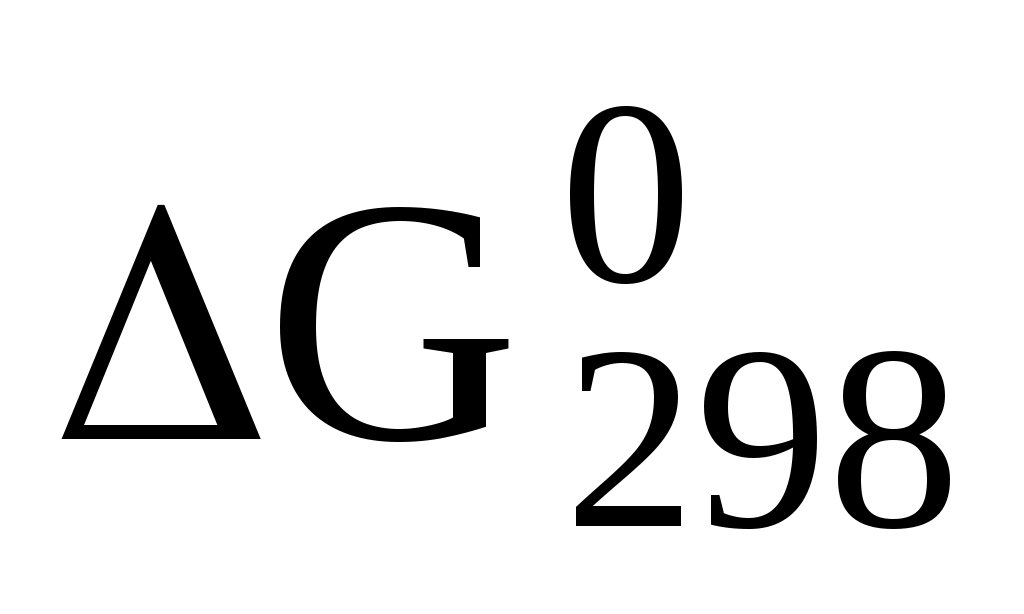 образования NH3 равна –16,64 кДж/моль. Вычислите КР реакции образования NH3 равна –16,64 кДж/моль. Вычислите КР реакции
N2 + ЗН2 2NH3,
для данной температуры.
Ответ: 8,06 × 10-8.
159. (Р.365) Определите, будет ли при 525 К протекать реакция
4HCl + O2 2H2O + 2Cl2,
если КР = 4,84 × 10–3, а парциальные давления реагирующих веществ следующие:
р(HCl) = р(O2) = 105 Па; р(H2O) = р(Cl2) = 104 Па.
160. (Р.366) Вычислите КР реакции
2NO + Cl2 2NOCl
при 298 К по следующим данным:
Вещество
|
NO
|
Cl2
|
NOCl
|
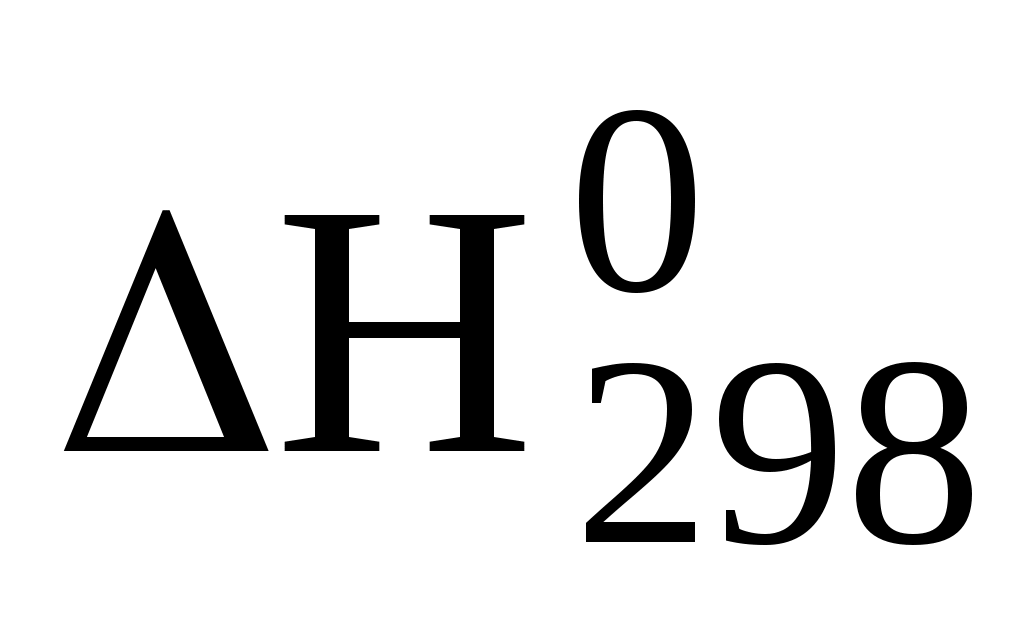 , кДж/моль , кДж/моль
|
90,37
|
0,00
|
53,55
|
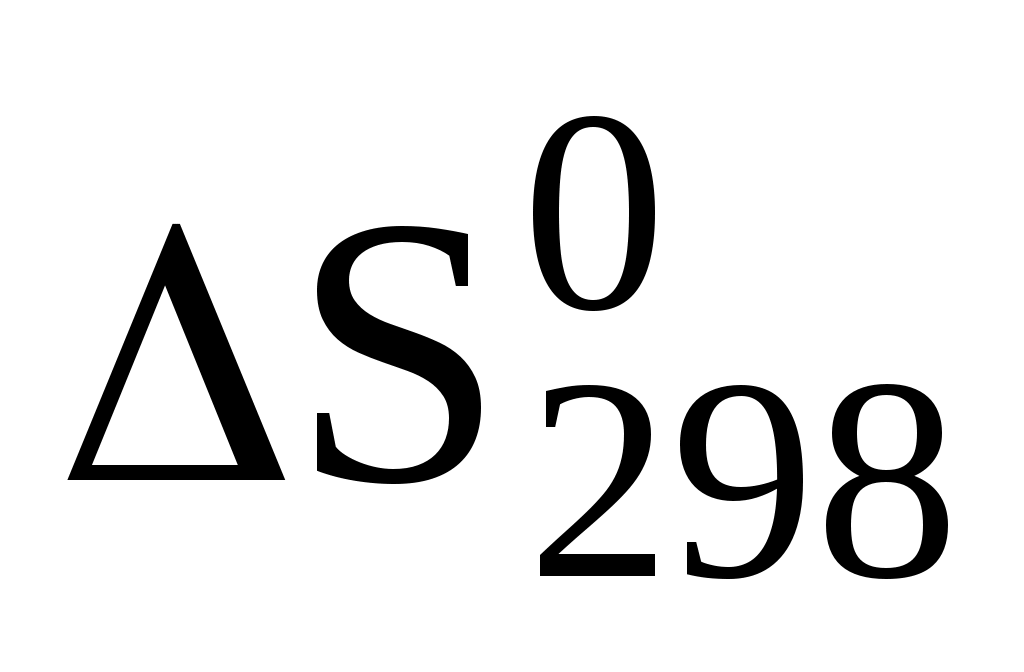 , Дж/(моль*К) , Дж/(моль*К)
|
210,62
|
223,00
|
263,60
|
Ответ: 61,50.
161. (Р.367) Определите, может ли при 900 К протекать реакция
2SO2 + O2 2SO3,
если КР = 2,043 × 10–2, а исходные парциальные давления реагирующих веществ равны: р(SO2) = 3 × 10–4 Па; р(O2) = 10–4 Па; р(SO3) = 1,5 × 10–4 Па.
162. (Г.375) В каком направлении сместится равновесие системы
N2 + ЗН2 2NH3, 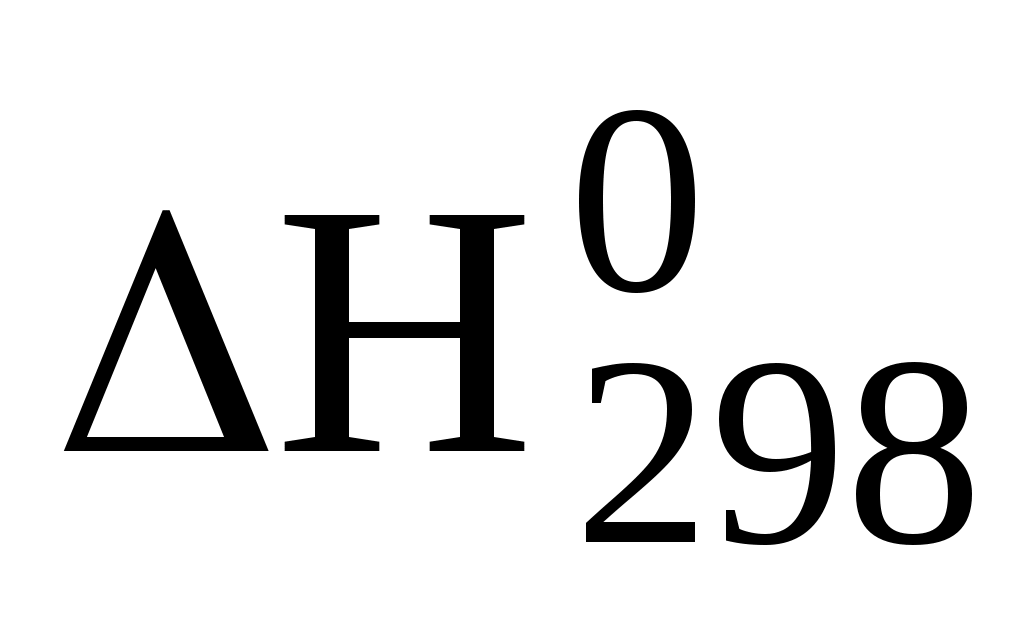 = –92 кДж/моль = –92 кДж/моль
при снижении температуры? Как объяснить, что на практике синтез аммиака ведут при повышенной температуре (не ниже 400 – 500 °С)?
163. (Г.376) В системе
N2O4 2NO2
при 60 °С и стандартном давлении установилось равновесие. Во сколько раз следует уменьшить объем, чтобы давление возросло в два раза?
Ответ: В 2,17 раза.
164. (Г.377) В системе
N2 + ЗН2 2NH3
при 200 °С и стандартном давлении установилось равновесие. Во сколько раз увеличится давление, если объем уменьшить в два раза?
Ответ: В 1,9 раза.
165. (Г.378) В системе
N2 + ЗН2 2NH3
равновесие установилось при следующих концентрациях (в моль/л): С(H2) = 3; С(N2) = 2; С(NH3) = 4. Рассчитайте равновесные концентрации после введения в 1 л смеси газов дополнительно 0,5 моль водорода.
Ответ: 3,17; 1,89; 4,22.
|
 Скачать 0.73 Mb.
Скачать 0.73 Mb.
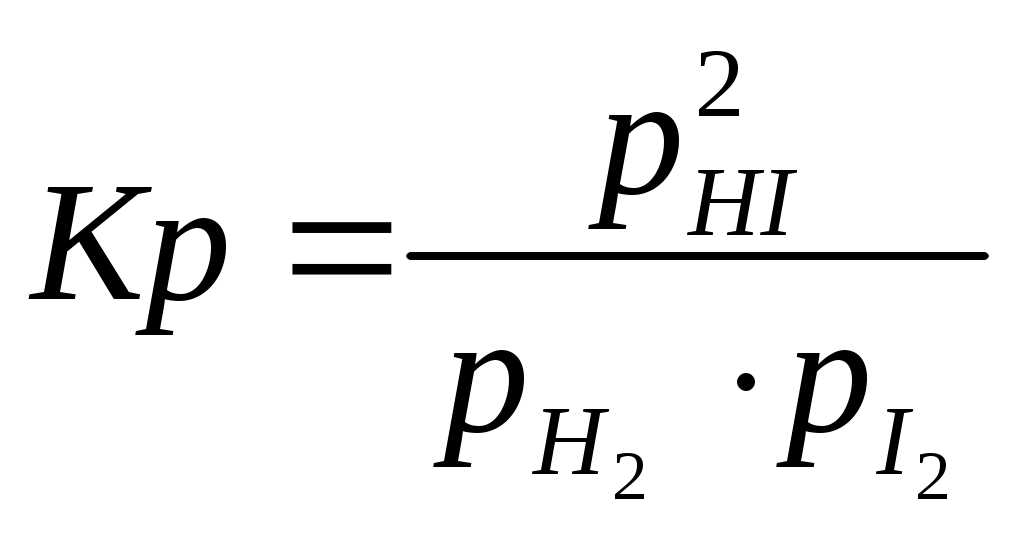 ,
,