Методические указания в сжатой форме знакомят студентов с основными теоретическими положениями, относящимися к данной лабораторной работе или группе лабораторных работ со схожей тематикой,
 Скачать 1.55 Mb. Скачать 1.55 Mb.
|
Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. Лабораторная работа № 6. Кинетика окисления иодида калия персульфатом аммонияЦель работыОпределить константу скорости реакции окисления иодида персульфатом аммония при заданных начальных концентрациях реагентов. Сущность работыРеакция окисления иодида калия персульфатом аммония 2KI + (NH4)2S2O8 = I2 + K2SO4 + (NH4)2SO4 (или в ионной форме: Оборудование и реактивыБюретка объемом 25 мл – 4 шт.; мерная пипетка объемом 5 мл (для крахмала) – 1 шт.; секундомер; колба круглая объемом 100 мл – 5 шт.; химический стакан объемом 50 мл – 5 шт; химический стакан объемом 25 мл (для персульфата) – 1 шт.; иодид калия – 0,2 М раствор; тиосульфат натрия – 0,02 М раствор; крахмал – 1 % раствор; персульфат аммония – 0,2 М раствор. Выполнение работы1. В каждую из 5 колб при помощи маркированных бюреток отмерить порции растворов иодида калия, тиосульфата натрия и дистиллированную воду в количествах, указанных в таблице 1. Мерной пипеткой объемом 5 мл в каждую колбу отобрать порцию крахмала. Содержимое колб перемешать. 2. В маркированный химический стакан объемом 25 мл отмерить указанный объем персульфата, вылить в колбу с приготовленной реакционной смесью и одновременно включить секундомер. 3. При появлении синего окрашивания секундомер останавливают и записывают время опыта. 4. П.п. 2 и 3 выполнить для всех колб.
Содержание протокола лабораторной работы1. Концентрация раствора иодида калия 2. Концентрация раствора тиосульфата натрия 3. Концентрация раствора персульфата аммония (или натрия) 4. Часть таблицы 1, соответствующая номеру Вашего варианта с отмеченным временем протекания реакции Обработка результатов экспериментаЗаполнить таблицу:
Cреакция(KI) – концентрация иодида калия, израсходованного на реакцию с персульфатом натрия (аммония) где, Сисх(Na2S2O3) – концентрация тиосульфата натрия, указанная на емкости с реактивом, моль/л; V(Na2S2O3) – объем тиосульфата натрия, взятый на приготовление реакционной смеси согласно номеру варианта по табл. 1, мл; Vобщ – общий объем реакционной смеси согласно номеру варианта по табл. 1, мл. С(KI) – концентрация иодида калия в данный момент времени где С0(KI) – концентрация иодида калия в реакционной смеси в начальный момент времени ( = 0 с.), моль/л где Сисх(KI) – концентрация иодида калия, указанная на емкости с реактивом, моль/л; V(KI) – объем иодида калия, взятый на приготовление реакционной смеси согласно номеру варианта по табл. 1, мл; Vобщ – общий объем реакционной смеси согласно номеру варианта по табл. 1, мл. Константа скорости реакции k рассчитывается по формуле: Среднее значение константы скорости реакции: где n – количество опытов, n = 5. 2. Рассчитать вероятную (для 95 %) ошибку определения средней константы скорости процесса: 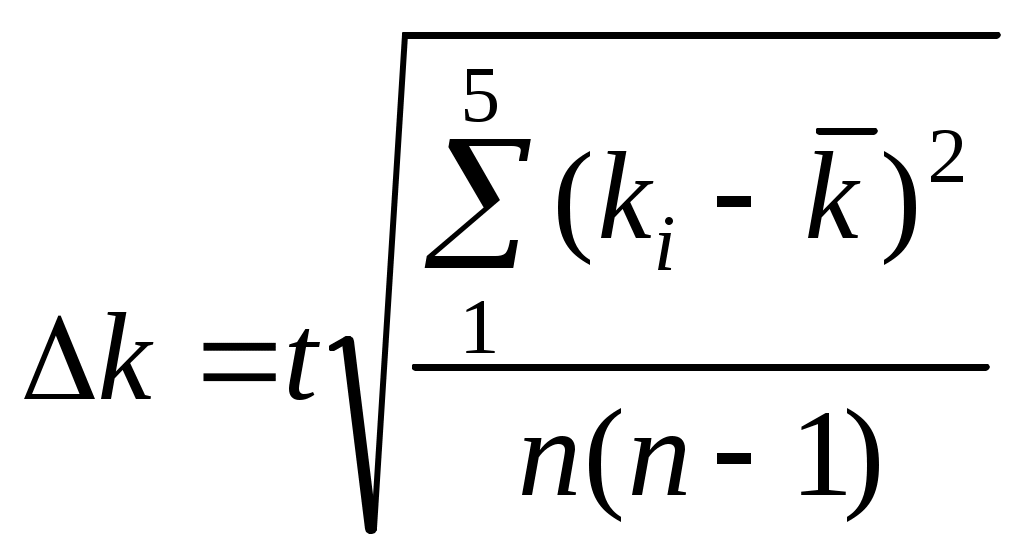 . .3. Найти относительную погрешность: Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
