Методические указания в сжатой форме знакомят студентов с основными теоретическими положениями, относящимися к данной лабораторной работе или группе лабораторных работ со схожей тематикой,
 Скачать 1.55 Mb. Скачать 1.55 Mb.
|
Лабораторная работа № 7. Кинетика ионного обменаЦель работыИсследовать процесс очищения воды ионообменным методом. Определить величину статической обменной емкости и лимитирующую стадию процесса ионного обмена. Сущность работыВеличину статической обменной емкости определяют по величине максимального поглощения, которую получают, перемешивая заданное количество катионита и раствор соли металла до состояния равновесия. Лимитирующую стадию процесса определяют, изучая зависимость изменения концентрации металла от продолжительности перемешивания. Оборудование и реактивыТубус (реактор); мешалка; мерный цилиндр объемом 500 мл; мерный цилиндр объемом 10 мл; пипетка мерная объемом 10 мл; колба коническая объемом 250 мл – 2 шт.; кобы конические объемом 100 мл – 10 шт.; бюретка объемом 25 мл – 1 шт.; трилон Б – 0,05 М раствор; мурексид; хлорид аммония – 1 н. раствор; гидроксид аммония – разбавленный 1:1; сульфаты меди, кобальта, никеля – 0,1 М растворы. Выполнение работы1. Получить от преподавателя раствор соли металла для исследования. 2. Отобрать пробу раствора соли металла в маркированный химический стакан объемом 100 мл. 3. Провести анализ исходного раствора соли металла. Анализ содержания меди (2+): отобрать мерной пипеткой в конические колбы аликвоту объемом 5 мл; прилить дистиллированную воду до объема 20-30 мл; добавить по каплям при перемешивании аммиак до получения прозрачного синего раствора, добавить немного сухого индикатора «мурексид»; отобрать раствор трилона Б в химический стакан объемом 50 мл; из стакана раствор трилона Б налить в бюретку, выпустить воздух из носика бюретки, для чего поднять носик бюретки, подставить стакан с трилоном Б и нажать на шарик; довести объем трилона Б в бюретке до отметки «0»; титровать одну из колб с пробой раствором трилона Б до перехода окраски до перехода окраски индикатора в эквивалентной точке от желтой (хаки) к сиренево-фиолетовой; довести объем щелочи в бюретке до отметки «0»; провести титрование пробы во второй конической колбе. Анализ содержания кобальта и никеля: отобрать мерной пипеткой в конические колбы аликвоту объемом 5 мл; прилить дистиллированную воду до объема 20-30 мл; с помощью мерного цилиндра добавить 5 мл раствора хлорида аммония; добавить немного сухого индикатора «мурексид» отобрать раствор трилона Б в химический стакан объемом 50 мл; из стакана раствор трилона Б налить в бюретку, выпустить воздух из носика бюретки, для чего поднять носик бюретки, подставить стакан с трилоном Б и нажать на шарик; довести объем трилона Б в бюретке до отметки «0»; титровать одну из колб с пробой раствором трилона Б до перехода окраски до перехода окраски индикатора в эквивалентной точке от желтой к фиолетовой; довести объем щелочи в бюретке до отметки «0»; провести титрование пробы во второй конической колбе. Желтую окраску раствора поддерживают аммиаком: если в процессе титрования раствор краснеет, то добавить несколько капель аммиака. 4. Заполнить реактор установки катионитом (10 мл катионита перенести в реактор в виде водной взвеси). 5. Залить в реактор 450 мл раствора соли металла. 6. Настроить блок управления мешалки: = нажать кнопку «сеть»; = нажать кнопку «установка» для входа в режим настройки блока управления; = кнопками «выбор» и ▲▼ установить число оборотов (1200); = нажать кнопку «установка» для выхода из режима настройки; = погрузить мешалку в реактор и нажать кнопку «пуск». 7. Через каждые 3 минуты отбирать пробы раствора объемом 10 мл (Vп), которые хранят в конических колбах объемом 100 мл. Всего отобрать 10 проб. 8. Определить концентрацию соли металла в каждой пробе, отбирая для анализа 2 аликвоты по 5 мл. Анализ выполнять, используя конические колбы объемом 250 мл. Внимание!!!! Основная ошибка – неаккуратное проведение аналитических работ. Для избежания этого при анализе проб отбирать аликвоту 5 мл, ее анализировать, показывать результаты анализа преподавателю и только потом анализировать вторую аликвоту 5 мл, которая должна оставаться в конической колбе на 100 мл. Содержание протокола лабораторной работы1) название соли металла и ее химическая формула; 2) ориентировочное значение концентрации соли металла, указанное на емкости с раствором; 3) объем раствора соли металла; 4) объем катионита; 5) объем аликвоты при титровании раствора соли металла Va = 5 мл; 6) Объем раствора трилона Б, израсходованного на титрование исходного раствора VТ,1 = ………….мл VТ,2 = ………….мл VТ, ср = ………….мл 7) концентрация раствора трилона Б Таблица экспериментальных данных
Обработка результатов экспериментаПо данным п. 8 заполнить таблицу:
α − текущая степень очистки воды, которую вычислить по уравнению где Сz – текущая концентрация катиона металла в растворе, моль/л; С0 – исходная концентрация катиона металла в растворе, моль/л. Концентрации катиона металла (С0 и Сz) в растворе вычислить по формуле: где СТ – концентрация трилона Б (0,05 моль/л); VТ – эквивалентный объем трилона Б, мл; Va – объем пробы, взятый для определения концентрации катиона металла, мл, Va = 5 мл. Сτ − текущая концентрация соли металла в пробе, приведенная к исходному объему, моль/л, которую вычислить по формуле: где nτ – количество моль катионов металла, оставшихся в растворе на текущий момент времени, nτ рассчитывается по формуле: где Vпр – объем пробы, отобранный для последующего определения концентрации катиона металла, Vпр = 10 мл; z – номер пробы. Построить зависимость концентрации соли металла от продолжительности перемешивания Сz = f(τ). Построить зависимость степени очистки воды от продолжительности перемешивания α = f(τ). Вычислить величину статической обменной емкости: где VK – объем катионита, м3; n∞ − количество молей катионов металла, оставшихся в растворе на момент равновесия, Построить зависимость ln(C0/Cτ) = f(τ). Построить зависимость Определить характер лимитирующей стадии процесса. При линейной зависимости ln(C0/Cτ) = f(τ) стадией, определяющей скорость процесса обмена ионов, является диффузия обменивающихся ионов в тонком слое раствора в непосредственной близости от зерна ионита («пленочная кинетика» или внешнедиффузионная кинетика). Кинетическая зависимость процесса адсорбции в этом случае подчиняется уравнению первого порядка. В данном случае можно константа скорости реакции ионного обмена соответствует тангенсу угла наклона зависимости ln(C0/Cτ) = f(τ). При линейной зависимости 8. Определить константу скорости процесса ионного обмена. Для графика ln(C0/Cτ) = f(τ) или Пример обработки результатов эксперимента 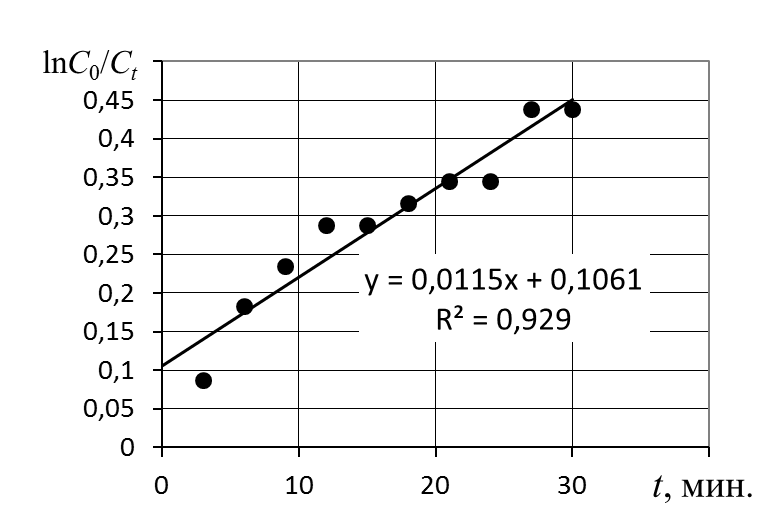  Рис. 6. Пример обработки экспериментальных данныхОбе зависимости аппроксимированы линейной функцией. Для зависимости Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
