Методическое пособие введение
 Скачать 189.21 Kb. Скачать 189.21 Kb.
|
|
ЭПИГЕНЕТИКА. МЕТОДИЧЕСКОЕ ПОСОБИЕ ВВЕДЕНИЕ Наука эпигенетика рассматривает механизмы молекулярных модификаций гистонов и ДНК, которые могут регулировать активность генов, не затрагивая последовательности нуклеотидов в молекуле ДНК. Признанными эпигенетическими регуляторами являются метилирование ДНК, посттрансляционные модификации гистонов и некодирующие РНК (нкРНК). Одним из важнейших отличий эукариотических клеток от прокариот является наличие у эукариот сложного нуклео-протеинового комплекса хроматина. Именно в такой форме молекула ДНК хранится в наших клетках. С одной стороны, сложная структурная организация хроматина обеспечивает компактное расположение ДНК в ядре клетки. С другой стороны, хроматин непосредственно участвует в процессе регуляции экспрессии генов. При этом, изображенная на рис.1 нуклеосома (структурно-функциональная единица хроматина) рассматривается в качестве ключевого компонента в процессах регуляции экспрессии генов 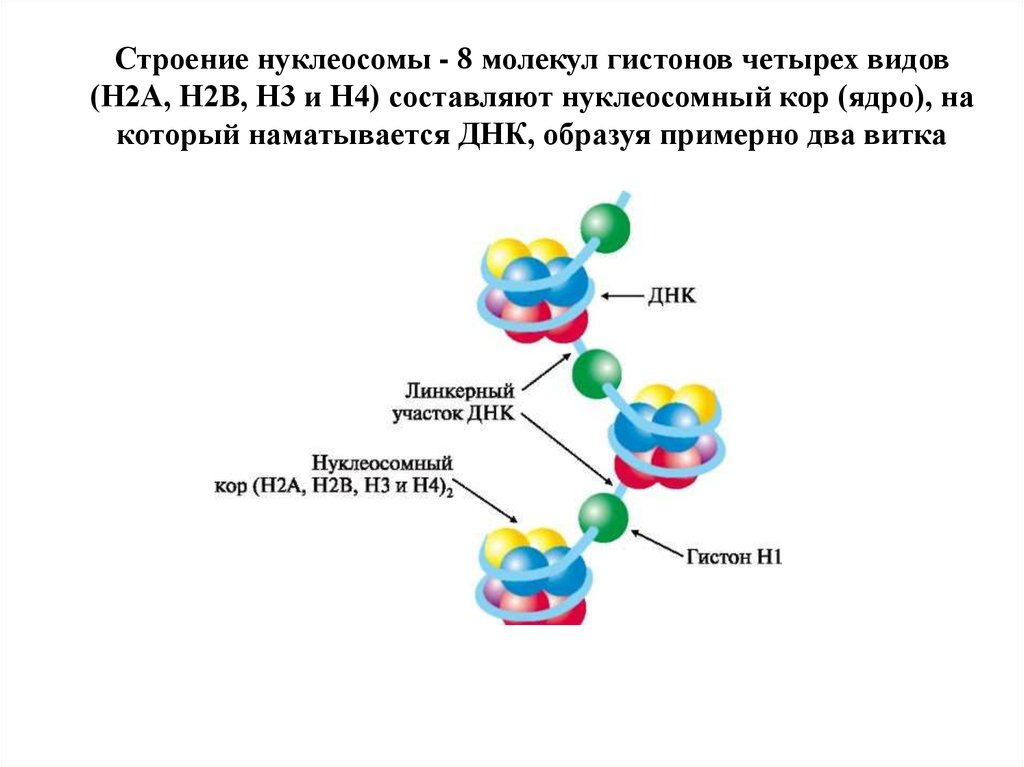 Рисунок 1. Строение нуклеосомы. Ядром нуклеосомы являются белки гистонов. В состав ядра нуклеосомы входят по две копии каждого из гистоновых белков H2A, H2B, H3 и H4. Цепь ДНК, включающая 147 нуклеотидов сворачивается в 1,65 раза вокруг октамера гистонов в левостороннем тороиде. Нуклеосомы расположены в виде линейного массива вдоль молекулы ДНК в виде "бусин на нитке’. Соединяющий сопредельные нуклеосомы линкерный участок ДНК (транскрипционно неактивный) уплотнен H1-гистоновым белком. Протяженность линкерного участка составляет 30 нм. Причем, сайт начала транскрипции обычно находится внутри нуклеосомы. Следовательно, нуклеосома служит репрессором генов, предотвращая инициацию транскрипции. Напротив, транскрипция становится возможной в результате ремоделирования хроматина факторами, которые разрушают или иным образом изменяют структуру и организацию нуклеосом. Таким образом, репрессия (инактивация) генов начинается с обертывания молекулы ДНК вокруг гистонов в нуклеосоме, а освобождение генов от репрессии (активация) включает в себя освобождение ДНК от связи с белками гистонами и разворачивание ДНК факторами, ремоделирующими хроматин (Lorch Y., Kornberg R.D., 2017). Благодаря такому механизму возможна избирательная экспрессия только тех генов, которые необходимы в данный момент времени клетки или ткани. Следует подчеркнуть, что репрессия нуклеосомами распространяется не только на транскрипцию, но и на большинство других биологических процессов, связанных с молекулой ДНК, таких как митотическое деление, восстановление двухцепочечных разрывов и поддержание теломер. Таким образом, эпигенетические механизмы управляют различными физиологическими и патологическими процессами посредством регуляции экспрессии соответствующих генов путем изменения доступности эпигенетических систем контроля к хроматину. Сфера применения эпигенетических методов исследования стремительно расширяется. В настоящее время мы наблюдаем активное внедрение эпигенетических подходов в области практической медицины, направленные на диагностику и лечение опасных заболеваний человека. 1.КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ГИСТОНОВ Хроматин - это не инертная структура, а скорее, специфический каркас ДНК, обладающий способностью воспринимать и реагировать на внешние сигналы, тем самым регулируя участие молекулы ДНК в различных обменных процессах. При этом, одним из центральных механизмов, который демонстрирует такую реакцию хроматина на внешние воздействия, является ковалентная модификация белков-гистонов нуклеосомы. В настоящее время известно, что амино (N)-концевые хвосты гистонов могут выступать из их собственной нуклеосомы и вступать в контакт с соседними нуклеосомами. Поэтому модификация этих хвостов оказывает влияние на межнуклеосомные взаимодействия и, таким образом, повлияет на общую структуру хроматина. Известно, что ковалентная модификация гистонов нуклеосомы путем ацетилирования и фосфорилирования (пояснения ниже) способствуют снижению величины положительного заряда белков гистонов и ослабляет силу электростатического взаимодействия между гистонами и ДНК. Этот процесс формирует менее компактную структуру нуклеосомы, облегчая доступ белковых факторов транскрипции к молекуле ДНК. Установлено множество сайтов ацетилирования гистонов, в том числе связанных с некодирующими участками ДНК, в частности, с промоторами генов. Расположение ацетилированных меток в этих участках гистонов облегчают доступ факторам транскрипции. Фосфорилирование гистонов также высоко специфично, однако затрагивает меньше сайтов фосфорилирования гистонов по сравнению с ацетилированными сайтами. Модификации гистонов в процессе фосфорилирования могут индуцировать глубокие структурные изменения хроматина, причем, эти изменения не всегда повышают доступность ДНК для факторов транскрипции. Например, фосфорилирование специфического сайта в Н3 гистоне во время митоза происходит по всему геному и усилению конденсации хроматина. Локализация ковалентных модификаций гистоновых белков также необходима для распознавания их специфическими белками (или белковыми комплексами), принимающих участие в регуляции функциональной активности хроматина. В частности, модификации белков-гистонов вовлекают высокомолекулярные комплексы ферментов ремоделирования нуклеосом, которые используют энергию гидролиза АТФ, для изменения структуры нуклеосом (Patel A.B. et al.. 2019). Установлено, что белки, входящие в состав комплексов ремоделирования нуклеосом обладают высокой степенью консервативности в ряду эукариот. 1.1 Ацетилирование и деацетилирование гистонов. Как уже отмечалось, пострансляционная модификация гистонов может оказывать влияние на транскрипцию, репарацию и репликацию. Известно, что ацетилирование аминокислотных остатков лизина в составе белков гистонов является одним из основных путей такой модификации. По данным литературы, процесс ацетилирования лизинов гистонов является очень динамичным и регулируется противоположным действием двух семейств ферментов, гистоновых ацетилтрансфераз (HAT) и гистоновых деацетилаз (HDAC) (Bannister A.J., Kouzarides T., 2011). HAT используют ацетил CoA в качестве субстрата и катализируют перенос ацетильной группы на ε-аминогруппу боковых цепей остатков аминокислоты лизина в составе гистонов (Su X. et al., 2016). В свою очередь, процесс ацетилирования способствует нейтрализации положительного заряд лизина, ослабляя силу электростатического взаимодействия между гистонами и ДНК, тем самым увеличивая доступность хроматина для РНК-полимеразы и факторов транскрипции. Однако ацетилирование гистонов связано не только с активацией экспрессии генов, но и с репликацией и репарацией ДНК. Напротив, деацетилирование гистонов – удаление ацетильных групп гистон-деацетилазами HDACs приводит к подавлению экспрессии гена. Синтез гистонов в основном происходит во время S-фазы митотического цикла параллельно с репликацией ДНК, и вновь синтезированные гистоны быстро модифицируются в цитоплазме перед их сборкой в нуклеосому. В частности, стабильные димеры гистона H3/H4 сопровождаются в ядро после ацетилирования вновь синтезированного гистона H4 в Lys5 и Lys12 в цитоплазме. Два гетеродимера H2A/H2B входят в ядро как часть другого комплекса гистонов-шаперонов, но остаются неацетилированными и только затем ассоциируются с тетрамерами H3/H4. Когда коровый октамер гистонов нуклеосомы полностью сформирован, метки ацетилирования гистонов удаляются с H3 и H4 с помощью HDACs (Poziello A. et al., 2021). Существует два основных класса HAT: тип А и тип В. Тип-В HAT преимущественно локализованы в цитоплазме, подвергая ацетилированию молекулы гистонов, свободные от ацетилирования, не вошедшие в состав хроматина. Привлекает внимание тот факт, что у всех эукариот (простейших, насекомых и человека) ацетилирование гистона H4 в положенияк Лизин-5 (К-5) и Лизин-12 (К-12) является основной модификацией гистонов (Sobel R.E. et al., 1995). Класс ферментов ацетилтрансфераз гистонов - HAT является высококонсервативным, и все HAT типа B имеют общую гомологию последовательности с scHat1, белком-основателем этого семейства изоферментов HAT. HAT типа В ацетилируют вновь синтезированный гистон H4 в K5 и K12 позициях (в данном случае, К5 и К12 – указание на расположение присоединенной ацетильной группы к аминокислоте лизин в 5 и 12 положении, это положение указывается, например, как Н4К5 – т.е. в гистоне 4 лизин в 5 положении), а также в определенных участках гистона H3. Указанная модель ацетилирования важна для укладки гистонов в нуклеосому, после чего метки удаляются. HAT типа А представляют собой более разнообразное семейство ферментов, чем тип B. Тем не менее, их можно разделить, по меньшей мере, на три отдельные группы в зависимости от гомологии аминокислотных последовательностей и конформационной структуры: семейства GNAT, MYST и CBP/p300. Ферменты типа А обладают способностью модифицировать несколько участков в N-концевых хвостах гистонов. Способность ферментов типа А нейтрализовать положительные заряды, тем самым нарушая стабилизирующее влияние электростатических взаимодействий (между гистоновыми белками, а также между гистонами и ДНК) положительно коррелирует с их способностью регулировать процессы транскрипции, поскольку в этой регуляции участвуют не только хвосты гистонов, но и дополнительные участки ацетилирования, присутствующие в коровых гистонах (гистонах, формирующих ядро (кор) нуклеосомы) таких как H3K56, который ацетилируется у людей hGCN5. Ацетилирование в положении H3K56 непосредственно влияет на взаимодействие гистонов с ДНК. Как и многие гистон-модифицирующие ферменты, HAT типа A обнаруживаются в составе крупных мультипротеиновых комплексов. Белки, входящие в состав этих комплексов, играют важную роль в контроле набора ферментов, активности и специфичности к субстрату. Например, очищенный scGCN5 ацетилирует свободные белки-гистоны, но не оказывает влияния на гистоны, включенные в состав нуклеосомы. Ферменты-деацетилазы гистонов (HDAC), напротив противодействуют эффектам ацетилаз гистонов (HAT) и обеспечивают удаление ацетильных групп с остатков лизина, тем самым восстанавливая положительный заряд лизина. В свою очередь, это способствует стабилизации хроматина и подавляет процесс транскрипции. Выявлено четыре класса HDAC: Классы I и II включают в себя ферменты, которые гомологичны HDAC дрожжевых клеток scRpd3 и scHda1. Класс IV содержит только один фермент HDAC11. Между тем, в состав класса III (называемый sirtuins - сиртуины) входят HDAC, гомологичные дрожжевому scSir2. Ферменты класса III, в отличие от трех других классов, для реализации своей энзиматической активности, нуждаются в присутствии специфического кофактора NAD+. Необходимо отметить, что HDAC характеризуются достаточно низкой субстратной специфичностью, поскольку один фермент способен деацетилировать несколько ацетилированных сайтов в белках-гистонах. Кроме того, ферменты обычно присутствуют в составе многочисленных белковых комплексов, зачастую совместно с другими членами семейства HDAC. В частности, HDACs в основном ассоциированы со стабильными мультипротеиновыми комплексами, в которые входят HDAC1/2 и гистон-связывающий белок (Verdone L. et al., 2006). В результате чего, трудно определить, какая активность (конкретный фермент HDAC и/или комплекс) отвечает за наблюдаемый эффект. Тем не менее, в некоторых случаях можно, по крайней мере, определить, какой фермент требуется для данного процесса. Например, было показано, что HDAC1, но не HDAC2, контролирует дифференцировку эмбриональных стволовых клеток. 1.2 Метилирование и деметилирование гистонов. Метилирование гистонов в основном происходит на боковых цепях лизинов и аргининов. Метильные метки на молекулах гистонов воссоздаются после каждого цикла репликации ДНК. Гистоны нуклеосом во вновь синтезированной ДНК будут содержать новое ацетилирование, но не будут иметь других специфичных для хроматина эпигенетических меток, таких как метилирование. Чтобы восстановить исходные эпигенетические метки, новые гистоны должны подвергнуться деацетилированию, позволяя восстановить ландшафт эпигенетических меток, существовавших до репликации. Хотя основные области октамера гистонов остаются внутри нуклеосомы, N-концевые хвосты открыты и, таким образом, подвержены таким модификациям, как метилирование, ацетилирование, фосфорилирование и др. (Estève P.O. et al., 2006). В настоящее время установлены, по меньшей мере, пять остатков аргинина (H3R2, H3R8, H3R17, H3R26 и H4R3) и шесть остатков лизина (H3K4, H3K9, H3K27, H3K36, H3K79 и H4K20) на гистонах H3 и H4, которые могут подвергаться метилированию (Wu S.C., Zhang Y., 2009). Однако, в отличие от ацетилирования, метилирование гистонов не изменяет заряд гистонового белка. Тем не менее, метилированные метки гистонов могут служить сайтом связывания регуляторных белков, определяющих доступность ДНК для факторов транскрипции. В частности, метилированный H3K9 служит связующей платформой для белка гетерохроматина 1 (HP1). В свою очередь, HP1 ассоциируется с множеством других факторов, включая гистондеацетилазы (HDACs), репрессоры транскрипции и ферменты ремоделирования хроматина. Таким образом, белок HP1 обладает возможностью связывать специфические эухроматиновые локусы у млекопитающих, подавляя экспрессию генов (Smallwood A. et al., 2007). Кроме того, необходимо дополнительно учитывать уровень интенсивности метилирования; лизины могут подвергаться присоединению 1, 2 или 3 метил-радикалов, следовательно быть моно-, ди- или триметилированными. Тогда как аргинины могут быть монометилированными, а также симметрично или асимметрично диметилированными. Рассмотрим механизмы метилирования остатков лизина в белках-гистонах. Все гистоновые лизин-метилтрансферазы (HKMT) катализируют перенос метильной группы из S-аденозилметионина (SAM) в ε-аминогруппу лизина. Первой идентифицированой гистоновой лизин-метилтрансферазой (HKMT), была SUV39H1, предназначенная для метилирования лизина H3K9 (т.е. в составе белка гистон-3, 9 остатка лизина). Установлено, что все HKMT, которые метилируют N-концевые лизины, содержат так называемый домен SET, который обеспечивает ферментативную активность метилтрансферазы. Исключением является фермент Dot1, который метилирует остаток лизина в положении H3K79 внутри кора (ядра нуклеосомы) гистонов и не содержит SET-домена. Для гистоновых лизин-метилтрансфераз (HKMT) характерно проявление специфичности, во-первых, по отношению к субстрату (например, DIM5 специфически метилирует H3K9, тогда как объектом метилирования SET7/9 является H3K4). Во-вторых, специфичность ферментов HKMT проявляется в способности изменять степень метилирования лизина (т.е. трансформировать лизин в моно-, ди- и/или триметильное состояние). Например, DIM5 может триметилировать H3K9, но SET7/9 может только монометилировать H3K4. Метилирование аргинина осуществляют два класса аргинин-метилтрансфераз. Вместе два типа аргининметилтрансфераз образуют относительно большое семейство белков (11 членов), члены которого называются protein arginine methyltransferase (PRMTs). Все эти ферменты переносят метильную группу из S-аденозилметионина (SAM) в ω-гуанидиногруппу аргинина в различных субстратах. Что касается метилирования гистонового аргинина, наиболее важными ферментами являются PRMT1, 4, 5 и 6. Деметилирование гистонов. В течение многих лет полагали, что метки, созданные метилтрансферазами гистонов являются стабильной, статической модификацией гистоновых белков. Сейчас известно, что метилирование гистонов может быть устранено группой специфических ферментов - гистоновыми деметилазами, которые включают PADI4 (пептидиларгининдейминазу, тип 4), LSD1 (лизинспецифическую деметилазу 1) и JmjC (Jumonji C)-домен, содержащий белки. В 2002 году было показано, что механизмы метилирования и деметилирования лизина и аргинина достаточно динамичная система и был предложен ряд различных механизмов посттрансляционного процессинга гистонов, подтвержденных экспериментально (Bannister A.J. et al., 2002). Было показано, что белок jumonji JMJD6 способен проводить реакцию деметилирования остатков аргинина гистонов H3R2 и H4R3 (Chang B. et al., 2007). В данном случае буквой R обозначен остаток аргинина, следовательно, запись H3R2 следует читать так – в Н3 гистоновом белке во втором положении находится остаток аргинина. В 2004 году была идентифицирована первая лизиндеметилаза. Было обнаружено, что данный фермент использует FAD в качестве кофактора и получил название лизинспецифической деметилазой 1 (LSD1) (Shi Y et al., 2004). Однако, данная реакция деметилирования совместима только с моно- и диметилированными субстратами лизина. В исследованиях in vitro было установлено, что очищенный LSD1 катализирует удаление метильных групп из H3K4me1/2, но очищенный фермент не может деметилировать тот же сайт гистона, когда белок-гистон включен в состав нуклеосомы. С другой стороны, когда LSD1 образует комплекс с репрессорным комплексом Co-REST, он приобретает способность деметилировать нуклеосомные гистоны. Таким образом, дополнительные белки комплекса обеспечивают нуклеосомное распознавание LSD1. Кроме того, образование комплекса LSD1 со специфическими белками определяет, какой лизин должен быть деметилирован LSD1. Помимо регуляции метилтрования гистонов, некоторые ферменты данной группы могут непосредственно участвовать в регуляции экспрессии генов. Сообщается, что деметилаза лизина гистонов LSD1 (KDM1A), как компонент корепрессорного комплекса C-концевого связывающего белка 1 (CtBP1). Было обнаружено, что LSD1 (KDM1A) ассоциирован с другими подобными комплексами-корепрессорами, что позволяет предположить, что этот белок является кандидатом-репрессором (Black J.C. et al., 2012). Первым ферментом, идентифицированным как триметиллизиндеметилаза, был белок JMJD2, который деметилирует H3K9me3 и H3K36me3 (Whetstine J.R. et al., 2006). В настоящее время известно много деметилаз лизина гистонов. За исключением LSD1, все ферменты данной группы обладают каталитическим доменом jumonji. Этот класс ферментов использует домен JmjC для катализа деметилирования путем окисления метильных групп. Белки JmjC используют α-кетоглутарат, молекулярный кислород и Fe(II) в качестве кофакторов деметилирования (Black J.C. et al., 2012). Как и лизин-метилтрансферазы, деметилазы обладают высоким уровнем субстратной специфичности по отношению к их целевому лизину. Они также чувствительны к степени метилирования лизина; например, некоторые из ферментов способны деметилировать только моно- и диметильные субстраты, тогда как другие могут деметилировать все три состояния метилированного лизина. |
