ПРИМЕНЕНИЕ ЛЕКАРСТВЕННЫХ РАСТЕНИЙ ПРОТИВООПУХОЛЕВОГО ДЕЙСТВИЯ ПРИ ПРОИЗВОДСТВЕ ФУНКЦИОНАЛЬНЫХ ПИЩЕВЫХ ПРОДУКТОВ. Монография. Монография Семей 2017 удк 615. 3 Ббк 52. 8155. 6 П 75 Рецензенты
 Скачать 1.03 Mb. Скачать 1.03 Mb.
|
|
Современные направления исследований противоопухолевых свойств лекарственных растений Онкологические заболевания являются одной из основных проблем современной медицины, поскольку традиционные схемы лечения рака используют хирургические методы в комбинации с высокодозной терапией. Одной из серьезных проблем химиотерапии является высокая токсичность современных противоопухолевых препаратов в отношении жизненно важных органов и систем организма. Известно, что классические методы лечения, помимо уничтожения опухолевых клеток, нарушают также все функции органов и систем, значительно повреждая тем самым иммунную систему. А это, в свою очередь, может привести к рецидиву опухоли и метастазированию. Одним из решений данной проблемы, как показывает анализ литературных источников, может явиться использование фитотерапии с применением лекарственных растений. Лекарственные растения защищают эпителий желудочно-кишечного тракта, клетки печени, почек, поджелудочной железы, костного мозга, яичек и яичников, головного и спинного мозга, эндокринных желез от токсического действия недоокисленных продуктов распада, образующихся при химио- и лучевой терапии [30]. Лекарственные растения, обладающие радиосенсибилизирующими и радиопротекторными свойствами, все шире используются медициной в сопроводительном лечении раковых заболеваний. Несмотря на то, что механизм радиопротекторного действия веществ растительного происхождения изучен не в полной мере, однако установлено, что полифенольные компоненты и флавоноиды, содержащиеся в лекарственных растениях, обладают способностью уменьшать явления оксидативного стресса в нормальных клетках во время проведения противоопухолевого лечения. Содержащиеся в лекарственных растениях биологически активные вещества обладают комплексным антиметастатическим и радиопротекторным действием через их адаптогенные, иммуномодулирующие свойства. Учитывая, что лекарственные растения представляют собой сбалансированные комплексы биологически активных компонентов с разным механизмом действия, то они являются хорошей альтернативой синтетическим монопрепаратам [31]. Так, например, была изучена динамика показателей крови больных раком шейки матки при использовании в сопроводительной терапии дикорастущих лекарственных растений. В результате проведенных исследований было установлено, что при лучевой терапии онкобольных, сопровождаемой фитотерапией у пациенток опытной группы отклонения показателей крови от нормальных уровней во время лечения носили менее выраженный характер и быстрее возвращались к нормальному уровню после лечения, чем у пациенток контрольной группы, к которым фитотерапия не применялась [32]. Также результаты лабораторных исследований иммунологических показателей крови больных раком шейки матки в период лучевого лечения дали возможность рекомендовать комплекс лекарственных растений для применения в период лучевого лечения злокачественных новообразований с целью улучшения иммунологических показателей [33]. В настоящее время учеными разработан сбор лекарственных растений из листьев мяты перечной, мелиссы лекарственной и цветков ромашки аптечной, который применяется в комплексе с терапией моноклональными антителами (МАТ) для лечения онкологических заболеваний. Данный сбор лекарственных растений приводит к повышению эффективности и понижению токсичности противоопухолевой терапии [34]. На протяжении ряда лет в медицине применяют биологически активные вещества, выделенные из лекарственных растений. Так, например, пептиды, полученные из лекарственных растений, рассматриваются как новый источник противоопухолевых средств. Было протестировано противоопухолевое действие пептидного экстракта PE-PM из смеси чистотела большого (Chelidonium majus L.), девясила высокого (Inula helenium L.), хвоща полевого (Equisetum arvense L.) и гриба чаги (Inonotus obliquus) в новой мышиной интраперитонеальной модели T-лимфолейкоза ASF-LL. В результате была обнаружена определенная противоопухолевая активность двух локальных инъекций PE-PM, в результате которых выживаемость подопытных животных увеличилось до 33%. Учеными, которые занимаются данной научной проблемой, было показано, что пептидный экстракт PE-PM, полученный из смеси растений: чистотела большого (Chelidonium majus L.), девясила высокого (Inula helenium L.), хвоща полевого (Equisetum arvense L.) и гриба чаги (Inonotus obliquus), обладает выраженной противоопухолевой активностью на медленнорастущей мышиной модели рака молочной железы (РМЖ) человека [35]. Помимо пептидов среди методов предупреждения и лечения злокачественных опухолей особый интерес представляют вещества класса терпеноидов (изопреноидов). Терпеноиды применяют в профилактике и комплексной терапии различных заболеваний организма человека, поскольку они обладают широким спектром фармакологической активности и практическим отсутствием побочных эффектов [36]. На основе анализа литературных данных установлено, что природные терпеноиды эффективно применяются в лечении онкологических заболеваний. Так, например, противоопухолевые свойства были выявлены у ряда терпеноидных соединений и их производных, как лимонен, бетулиновая кислота, витамины А, Д, Е и др. Наибольшее количество терпеноидов обнаружены в голосеменных растениях (лиственница, ель, пихта, сосна), которые широко распространены в растительном мире [37]. Однако наличие терпеноидов было обнаружено во многих видов растений, что свидетельствует в пользу перспективности их использования в лечении онкологических заболеваний. Так, например, установлены противоопухолевые свойства таких терпеноидов, как d-лимонен и его производных, обнаруженных в цитрусовых растениях. Их противоопухолевый эффект проявлялся через апоптоз и дифференцировку опухолевых клеток [38]. Экспериментально доказана эффективность противоопухолевого действия эфирного масла пихты сибирской, которое содержит большой набор монотерпенов (α– и β–пинены, камфен, лимонен, мирцен, борнилацетат, камфора и другие). Противоопухолевое действие заключалось в ингибировании роста опухолей и дальнейшего метастазирования после удаления опухолевого узла [39]. Терпеноид (арглабин), полученный из надземной части полыни гладкой, проявлял противоопухолевую активность против ряда онкологических заболеваний, таких как лимфосаркома Плиса, саркома М-1, карциносаркома Уокера, альвеолярный слизистый рак печени крыс РС-1, лимфоцитарная лейкемия Р-388, лимфоидная лейкемия Li210, аденокарцинома молочной железы Са-755 и др. [40]. При лечении рака яичников и молочной железы широко используется в качестве противоопухолевого средства такие сложные терпеноиды, как таксаны, выделенные из коры тихоокеанского тиссового дерева [41]. В настоящее время расшифрован антимитотический механизм действия таксановых соединений, который заключается в ингибировании формирования клеточного веретена, приводящего к прекращению деления опухолевой клетки, а также к нарушению ее подвижности, внутриклеточного транспорта и передачи трансмембранных сигналов [42]. Наиболее перспективным соединением, обладающим выраженным противоопухолевым действием, является бетулиновая кислота и ее производные, источником которых является широко распространенная береза повислая. Эти соединения приводили к торможению пролиферации опухолевых клеток и их апоптозу [43]. Глицирризиновая кислота (терпеноид амиранового ряда), выделенная из корня солодки, проявляла антиканцерогенные и антимутагенные действия, а также была способна избирательно ингибировать рост культуры опухолевых клеток [44]. Вместе с тем, внимание ученых привлекают лекарственные растения как источник биологически активных компонентов иммуномодулирующего свойства. Поскольку, иммуномодулирующее воздействие признано важным элементом противоопухолевого лечения. Несмотря на наличие достаточного количества иммуномодуляторов синтетического происхождения, сохраняется интерес к лечению лекарственными растениями, обладающими иммуномодулирующими свойствами. Среди хорошо изученных и внесенных в перечень разрешенных к применению в медицине лекарственных растений, которые можно использовать в онкологической практике в качестве иммуномодуляторов, практический интерес представляют элеутерококк колючий, подорожник большой, бадан толстолистный и солодка голая. Корни элеутерококка колючего содержит комплекс биологически активных веществ, объединенных под общим названием элеутерозидов. Некоторые элеутерозиды содержатся также и в листьях элеутерококка. Элеутерококк классифицируют как растение-адаптоген. К особенностям действия адаптогенов растительного происхождения относятся полная безвредность в терапевтических дозах, усиление неспецифического иммунитета больного и здорового человека, повышение сопротивляемости множеству физических, химических или биологических факторов, уравновешивание функций иммунной системы в целом. Высокая иммуномодулирующая активность растительных адаптогенов с разным механизмом действия на больных раком, ослабленных химиотерапией, доказана в клинических исследованиях. При добавлении сока подорожника большого во время химиотерапии повышается активность перитонеальных макрофагов, увеличиваются количество и активность Т-киллеров, уменьшается токсическое действие цитостатиков на лейкоциты, что приводит к повышению иммунного статуса онкологических больных. Выраженная иммуномодулирующая активность и широкий терапевтический диапазон дает основания для использования этого растения в медицине при различных заболеваниях. Изучение влияния бадана толстолистного на параметры специфического иммунитета мышей в экстремальных условиях (иммобилизационный стресс, введение циклофосфана) показало, что введение сухого экстракта этого растения приводит к нормализации количества иммунокомпетентных клеток в селезенке, уменьшению воспаления и снижению выработки клетками провоспалительных цитокинов. В экспериментах на курах был изучен иммуномодулирующий потенциал стандартизованных спиртовых экстрактов подорожника большого и солодки голой. Найдено их эффективное совместное влияние на клеточный иммунитет. Был проведен ряд клинических испытаний, в которых обнаружено, что у больных раком шейки матки, получавших во время лучевой терапии в качестве сопроводительной терапии экстракты из растений-иммуномодуляторов, наблюдались более высокие показатели иммунологического статуса (менее выраженная лейкопения, больше Т-лимфоцитов CD4 и CD8, выше уровень иммуноглобулинов) и более раннее восстановление данных показателей до исходного уровня. Таким образом, иммуномодулирующие свойства элеутерококка колючего, подорожника большого, бадана толстолистного и солодки голой были подтверждены в лабораторных и клинических экспериментах. На основании проведенных исследований эти лекарственные растения были рекомендованы в качестве сопроводительного лечения в онкологии с целью улучшения иммунологических показателей [45]. Для лечения лучевых и опухолей используется препарат азулен, полученный из тысячелистника. Экстракты хвоща полевого используются как препарат, обладающий противоопухолевым, гипотензивным и общеукрепляющим действием. На основе экстракта травы чистотела большого созданы противоопухолевые препараты «Амитозин» и «Ukrain». Экстракт и фумаровая кислота пастушьей сумки проявляли противоопухолевую активность в отношении саркомы Эрлиха. В сое культурной содержится N-ацилэтаноламины, которые проявляют противовоспалительные и противоопухолевые свойства, что делает это растение потенциальным источником сырья для применения в терапии. Показано, что флавоноиды, содержащиеся в гречихе обыкновенной, обладают гиполипимическими свойствами и ингибируют клетки линии HL-60 (клетки лейкемия) [46]. Многие растения с высокой противоопухолевой эффективностью произрастают в Республике Казахстан. Так, например, чага (березовый гриб) является традиционным противораковым средством, которое нашло широкое применение и в научной медицине. Водные настои и отвары чаги активно тормозят рост новообразований, применяются также для лечения воспалительных заболеваний желудочно-кишечного тракта. В качестве противоракового средства используется отвар цветов пижмы обыкновенной: он эффективен при различных формах рака кожи. Противораковые свойства различных видов подмаренника настоящего зафиксированы в медицине многих народов Евразии. Наиболее часто его рекомендует при злокачественных новообразованиях желудка и кишечника. Препараты календулы обыкновенной обладают противовоспалительными, противоопухолевыми, иммуностимулирующими, гипотензивными свойствами. Противоопухолевое действие препаратов календулы используют как профилактическое, так и терапевтическое средство. Препараты девясила высокого эффективны против злокачественных и доброкачественных новообразований, как за счет противоопухолевого действия, так и иммуностимулирующего и оздоровительного эффекта. В народной медицине отвар травы и корней девясила рекомендованы при злокачественных поражения кожи, опухолях печени и желудка. Противоопухолевое действие аира болотного издавна замечено как у славянских, так и у тюркских народов. В Сибири корневища аира применяли самостоятельно и в составе сборов для лечения запущенных форм рака. Кроме того, аир может быть использован для симптоматического лечения онкологических заболеваний желудочно-кишечного тракта для детоксикации организма при медикаментозной терапии, стимулирования аппетита у истощенных больных. Противоопухолевой активностью обладают и многие виды широко распространенных ядовитых растений, в их числе белена черная, болиголов пятнистый, ветреница белая [47]. Лекарственные растения издавна применяются в традиционной медицине многих народов. Так, например, лекарственные растения являются важным аспектом традиционной китайской медицины, а также богатым источником уникальных химических веществ. Среди лекарственных трав, дудник китайский (Angelica Sinensis) является наиболее популярным в китайской медицине. Основное терапевтическое действие на различные раковые клетки оказывают такие действующие вещества, обнаруженные в экстракте Angelica Sinensis феруловая кислота, фталиды и полисахариды. Исследования, полученные in vitro и in vivo показали, что фталиды подавляют пролиферацию опухолевых клеток и способствуют апоптозу опухолевых клеток: клеточных линий рака человека, включая А549, HepG2, Ястребаце-3, HeLa, К562 и SGC-790 [48]. В исследованиях филиппинских и иранских ученых было установлено, что экстракт плодов барбариса обыкновенного (L. вар. Asperma) проявлял противоопухолевую активность на раковых клетках толстой кишки (НТ-29) и молочной железы (MCF-7) человека. При этом, не наблюдались цитотоксические эффекты на нормальных человеческих фибробластах. На основании проведенных исследований экстракт плодов барбариса обыкновенного (L. вар. Asperma) был рекомендован в качестве потенциального источника нового химиопрофилактического и химиотерапевтического препарата [49]. Противоопухолевое действие трех растений из Иордании - земляничника мелкоплодного (Arbutus andrachne L.), хризантемы увенчанной (Chrysanthemum coronarium L.), дубровника белого (Teucrium polium L.), было изучено на шести линиях клеток рака молочной железы, ободочной и прямой кишки и кожи (A375.S2, WM-1361A, CACO-2, HRT-18, MCF-7, T47D). На основании проведенных исследований было установлено, что наибольшим антираковым действием обладал экстракт хризантемы увенчанной, в диапазоне концентраций от 25 до 400 мкг / мл наблюдалось значительное подавление роста раковых клеток (10 - 50%) всех шести клеточных линий. В то время как, экстракты двух других растений проявили более слабую антипролиферативную активность (2 - 10% ингибирование) [50]. Из коры широко распространенного во многих частях мира растения, а также являющееся декоративным растением Пакистана, голоптелея цельнолистная (Holoptelea Integrifolia (Roxb) Planch) были получены различные экстракты с использованием четырех органических растворителей – бутанолом, гексаном, этилацетатом и хлороформом. На основании проведенных исследований установлено, что экстракты, полученные с использованием растворителей – гексана и этилацетата, проявили более значительное цитотоксическое действие на клетки рака молочной железы и простаты. Эти данные дают возможность в дальнейшем использовании изученных экстрактов в химиопрофилактике и комбинированной противоопухолевой терапии [51]. В последние десятилетия поиски новых противораковых агентов природного происхождения, с селективной противоопухолевой активностью является важным приоритетным направлением для лечения рака. Так, изучено противоопухолевое действие болгарской пижмы обыкновенной Tanacetum vulgare L. на линии клеток рака молочной железы (MCF7) человека. Анализ показал, что воздействие растительного экстракта значительно уменьшило жизнеспособность клеток рака в зависимости от дозы и времени обработки. 50% ингибирующая концентрация (IC50) была равна 286,8 мкг/мл, а также произошли морфологические изменения в обработанных экстрактом клетках опухоли в сравнении с необработанными контрольными клетками [52]. Экстракт коры афанамиксиса многокистевого (Aphanamixis polystachya) традиционно используется для лечения опухолей селезенки и печени. Исследования in vitro показали, что данный экстракт в концентрациях 0, 5, 10, 25, 50, 75 или 100 мкг/мл вызывал снижение выживаемости культивируемых клеток HeLa. Снижение клоногенности клеток HeLa зависело от концентрации экстракта. Было обнаружено, что ингибирующая концентрация (IC50) экстракта соответствовала 25 мкг/мл, тогда как экстракт коры в концентрации 100 мкг/мл привел к 72% гибели клеток в сравнении с контрольной группой, необработанной данным экстрактом [53]. В лечении рака крови также применяются лекарственные растения. Так, например, изучено влияние экстракта семян пажитника греческого (Trigonella Foenum Graecum) на острый миелобластный лейкоз клеточных линий KG-1. Результаты исследования показали значительное цитотоксическое действие экстракта семян пажитника против этой клеточной линии, в результате которого наблюдалось ингибирование роста, гибель клеток и их морфологические изменения. В то же время данный экстракт не был токсичен для нормальных лимфоцитов: не изменилось их количество и морфология [54]. Растения рода тимьян являются важными лекарственными растениями, которые настоятельно рекомендуются при лечении различных заболеваний, благодаря широкому спектру фитохимических и противоопухолевых свойств их эфирных масел. С помощью газа хромато-масс-спектрометрии в эфирном масле тимьяна обыкновенного (T. vulgaris L.) было определено сорок два компонента, которые составляют более чем 97,6 % от состава масла, среди них thymol (54.26%), γ-terpinene (9.50%), p-cymene (7.61%), carvacrol (4.42%), terpinolene (3.27%), α-terpinene (2.36%), α-terpineol (1.63%), α-tujene (1.52%). Эфирное масло тимьяна обыкновенного оказалось наиболее эффективным против А-549, MCF-7 и HepG2 клеточных линий, 50 %-ное ингибирование данных линий наблюдалось при концентрациях 75, 60 и 41μg / мл, соответственно [55]. Египетскими учеными исследовано противоопухолевое действие подорожника большого (Plantago major) и циамопсиса четырехкрыльникового (Cyamopsis tetragonoloba). На основе анализа химического состава исследуемых растений установлено, что подорожник содержит высокий процент линоленовой кислоты (56,19%.), тогда как циамопсис содержит высокий процент линолевой кислоты (48,99 %). Подорожник характеризуется высоким содержанием флавоноидов и танинов, циамопсис – высоким содержанием белков, жиров и общего количества гидролизуемых углеводов. Незаменимые аминокислоты содержатся в обоих растениях, однако в циамопсисе обнаружено большое количество глутаминовой и аспарагиновой кислот, аргинина и лейцина. Был проведен сравнительный анализ антиоксидантной активности спиртовых, горячих и холодных водных экстрактов листьев и семена подорожника и семян циамопсиса. В результате проведенных исследований было установлено, что исследуемые экстракты проявляли противоопухолевую активность с различной степенью. При этом, отмечается, что спиртовый экстракт листьев подорожника оказывают наибольшее влияние на рост опухолевых клеток (74 %-ное ингибирование), чуть меньшим эффектом обладал горячий водный экстракт листьев подорожника (54,6 %-ное ингибирование). Вместе с тем, отмечено, что экстракты семян подорожника и циамопсиса обладают меньшим ингибирующим эффектом [56]. В 2016 году учеными исследована в сравнительном аспекте противоопухолевая активность неочищенных водных экстрактов листьев подорожника большого и подорожника ланцетолистного против линии клеток аденокарциномы молочной железы человека (MCF-7). Наибольшей противоопухолевой активностью обладал экстракт из листьев подорожника большого [57]. В исследованиях индийских ученых проведен сравнительный анализ противоопухолевой активности этанольных экстрактов трех лекарственных растений: мяты перечной (Mentha Piperita), базилика душистого (Ocimum basilicum) и шпороцветника ароматного (Coleus aromaticus) против линии клеток плоскоклеточного рака (Нер-2). Результаты показали, что наибольшим цитотоксическим действием обладал экстракт мяты перечной, наименьший эффект проявлял экстракт шпороцветника ароматного (рисунок 1). 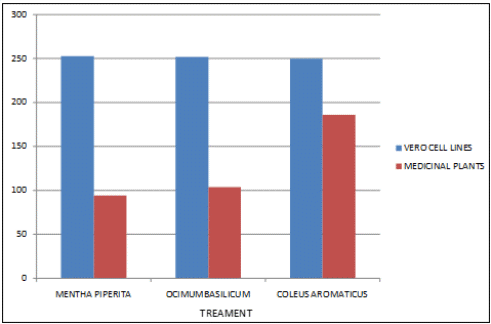 Рисунок 1 – Противораковые эффекты мяты перечной (Mentha Piperita), базилика душистого (Ocimum basilicum) и шпороцветника ароматного (Coleus aromaticus) против линии клеток плоскоклеточного рака (Нера-2). Самый высокий противораковый эффект мяты перечной, по-видимому, объясняется присутствием монотерпенов - d-карвон и D-лимонен в экстракте ее листьев. D-карвон уменьшает образование опухоли легочной аденомы. А, D-лимонен вызывает ингибирование одного из этапов клеточного деления, что приводит к снижению роста раковых клеток (рисунок 1). Антираковые свойства базилика душистого возможно связаны с наличием в его экстракте эвгенола, который как известно подавляет рост раковых клеток, индуцируя апоптоз. Наименьшее противоопухолевое действие шпороцветника ароматного связано, вероятно, с низкой концентрацией вторичных метаболитов, к которым относятся вышеперечисленные действующие вещества [58]. Российскими учеными был исследован компонентный состав эфирного масла мяты перечной и изучена антирадикальная активность его компонентов: ментона, ментола, изоментона, пулегона и изоментилацетата. Было показано, что антирадикальная активность IC50 исследованных образцов составляла 2,47-17,47 мг/мл. Наибольшей антирадикальной активностью обладали ментон, изоментон, пулегон [59]. Представляет интерес исследования противораковых свойств листьев и стеблей кирказона ломоносовидного (Aristolochia Indica L.) на примере линии раковых клеток MCF-7. Предварительные фитохимические исследования выявили наличие флавоноидов, дубильных веществ, гликозидов, фенола, сапонинов в хлороформном экстракта листьев и водном экстракте стеблей исследуемого растения. Результаты показали, что хлороформный экстракт обладал выраженной противоопухолевой активностью против линии клеток карциномы Эрлиха (MCF-7), чем водный и этаноловый экстракты [60]. Таким образом, согласно литературным данным лекарственные растения являются источником многочисленных видов биологически активных соединений, обладающих различными лечебными свойствами. В настоящее время терапевтический потенциал растений был достаточно изучен в течение очень длительного периода времени. Широкий спектр терапевтических эффектов лекарственных растений включает в себя противовоспалительную, противовирусную, противоопухолевую, противомалярийную, антибактериальную, антифунгицидную и обезболивающую активность. Как показывает анализ литературных источников, в последнее время в научном мире наблюдается всплеск интереса к лекарственным растениям как источнику биологически активных веществ противоопухолевого действия. Некоторые из самых первых противораковых средств, полученных из растений, являются алкалоиды барвинка, винбластин, винкристин, и цитотоксические подофиллотоксины. Статистические данные свидетельствуют о том, что противораковые препараты из 16 видов лекарственных растений подвергаются клиническим испытаниям до настоящего времени. Например, к ним относятся флавопиридол, выделенный из индийского дерева Dysoxylum binectariferum; 1- метилизоиндиго, выделенный из китайского растения индигофера красильная (Indigofera tincto-ria). На основании клинических испытаний было установлено, что эти вещества имеют меньшую токсичность в сравнении с синтетическими химиотерапевтическими противоопухолевыми препаратами. Эти открытия усилили научный интерес различных исследовательских групп в поиске новых противоопухолевых агентов (растительных вторичных метаболитов) из природных источников – лекарственных растений, поскольку они являются безопасными, экономически выгодными, биодоступностными при пероральном приеме. К вторичным метаболитам, обладающим противоопухолевыми свойствами, относятся флавоноиды, изофлавоны, антоцианы, кумарины, лигнаны, катехины, сапонины и изокатехины. Таким образом, возникает необходимость в разработке новых методов лечения раковых заболеваний с использованием наиболее эффективных и менее токсичных противоопухолевых препаратов, полученных из лекарственных растений в сравнении с существующими синтетическими препаратами. Как следует из литературных источников, лекарственные растения представляют собой общую альтернативу в лечении рака во многих странах мира. В настоящее время применение противораковых препаратов, основанных на лекарственных растениях, возросло с 10% до 40% по всему земному шару. На азиатском континенте оно достигает 50% [61]. Помимо высших растений в лечении рака также успешно применяются представители царства грибов. Трамета робиниелюбивая (Trametes robiniophila Μurr.) – один из наиболее изученных медициной грибов с ярко выраженными противоопухолевыми свойствами. В последнее время их противораковая активность была широко изучена. Однако механизмы еще до конца не изучены. Так, в работе китайских исследователей было изучено угнетающее действие экстракта траметы робиниелюбивой на ангиогенез и рост опухоли. Инкубация с экстрактом траметы ингибирует пролиферацию эндотелиальных клеток пупочной вены человека (HUVECs) и опухолевых клеток молочной железы мыши (4Т1) in vitro. И в условиях in vivo экспериментов экстракт траметы подавлял рост новых сосудов, как это было показано на курином эмбрионе и кольцевых анализов аорты крыс. Для дальнейшей оценки ингибирующего эффекта, раковые клетки 4T1 вводили подкожно мышам. Введение экстракта траметы через желудочный зонд в дозе 2,5 г/кг в сутки подавляло объем опухоли, снижало плотность микрососудов и индуцировало апоптоз. Эти данные свидетельствуют о том, что экстракт траметы может служить в качестве сильнодействующего антиангиогенного и противоопухолевого агента. Вместе с тем, экстракт траметы не оказывал никаких существенных побочных эффектов на вес тела подопытных мышей. Эти результаты указывают на возможность применения экстракта траметы в химиопрофилактике рака и является основой для клинического использования в организме человека [62]. Кроме макроскопических грибов ученые изучают противоопухолевые свойства микроскопических грибов, к которым относятся эндофитные грибы. Эндофитные грибы - вездесущие организмы, они найдены в растениях и проживают в межклеточных пространствах или внутри самих клеток растений, не вызывая явные симптомы инфекции. Эндофиты представляют интерес как химический резервуар новых соединений, обладающих противораковой, иммуномодулирующей, антиоксидантной, противопаразитарной, противовирусной, противотуберкулезной, инсектицидной активностью. Анализ литературных данных показал, что эндофитные грибы изучаются в качестве источника противораковых агентов. Так, например, на основе эндофитного гриба (Taxomyces andreanae) был создан препарат таксол, который является очень мощным противораковым агентом. Выделенный из эндофитного гриба Pestalotiopsis Microsporum цитостатический хинон - кислота Torreyanic, представляет собой мощный цитотоксический агент, и он оказался более эффективным (в 5-10 раз) против различных клеточных линий рака. Кроме того, из эндофитного гриба Entrophospora infrequens выделен алкалоид камптотецин - мощный антинеопластический агент против линий раковых клеток человека (рак легких A-549, рак печени Нер-2, рак яичников OVCAR-5). На основе противораковых соединений - 9-метоксикамптотецин и 10-гидроксикамптотецин, выделенных из эндофитного гриба Fusarium solani были созданы мощные антираковые препараты топотекан и иринотекан, применяемые в лечении рака яичников, шейки матки и легких [63]. В настоящее время известен ряд препаратов антиопухолевого действия, полученных на основе лекарственных растений и представляющих собой химически чистые вещества растительного происхождения. Вместе с тем, большой интерес, как в медицинской практике, так и в производстве пищевых продуктов функционального назначения вызывают галеновые препараты, полученные из лекарственных растений. В результате экспериментальных исследований, выполненных в рамках научно-исследовательской работы № 3028/ГФ4 «Разработка биотехнологических способов применения лекарственных растений противоопухолевого действия при производстве ферментированных молочных продуктов», были подобраны 5 растительных объектов из изученных лекарственных растений, произрастающих в Восточно-Казахстанской области. Из них были получены галеновые препараты в виде спиртовых настоек из двух композиций, отличающихся составом лекарственных растений. В состав композиции 1 входили следующие лекарственные растения: тимьян ползучий, береза повислая, девясил высокий. Состав композиции 2 состоял из мяты перечной, подорожника среднего, девясила высокого. Исследования химического состава полученных галеновых препаратов показали наличие в них таких биологически активных веществ, как лютеолин, кверцетин, апигенин, альфа-терпинеол, лимонен, метилизоэвгенол, тимол, которые оказывали цитотоксическое действие на рост опухолевых клеток. При этом исследованные нами биологически активные вещества проявляли различный противоопухолевый эффект. В работе было исследовано цитотоксические свойства вышеперечисленных веществ на раковые клетки толстой кишки - HCT-15, которые были проведены в лаборатории центра болезней пищеварения Медицинского колледжа Бэйлора в Хьюстоне (Техас, США), занимающейся проблемой колоректального рака на клеточном уровне. Для определения концентрации веществ (лютеолина, кверцетина, альфа-терпинеола, лимонена, метилизоевгенола), при которой рост раковых клеток HCT-15 замедляется на 50 %, на данном этапе работы была исследована цитотоксичность их химически чистыx природных соединений Определение концентрации исследуемых веществ, при которой вызывается гибель половины раковых клеток, необходимо для изучения механизма их действия на раковые клетки. О жизнеспособности раковых клеток судили по оптической плотности краски - метилтетразолиума (МТТ). При добавлении данной краски в культуру раковых клеток она проникает внутрь клеток. В живых клетках под действием ферментов – дегидрогеназ, данная краска восстанавливается до голубых нерастворимых кристаллов формазана, а мертвая клетка окрашивается в интенсивно синий цвет. При этом увеличивается плотность краски, которая определяется колориметрическим методом. Таким образом, по интенсивности окрашивания культуры клеток судили о степени подавления роста раковых клеток (о соотношении живых и мертвых раковых клеток). Результаты исследований изменения оптической плотности краски от концентрации лютеолина и кверцетина представлены на рисунках 2 и 3. Как видно из рисунка 2, лютеолин в концентрации 50 µM почти в два раза снижал содержание живых раковых клеток (уменьшение оптической плотности МТТ с 0,65 до 0,30). При концентрации же в 500 µM лютеолин вызывал гибель всех раковых клеток (оптическая плотность МТТ равна 0). 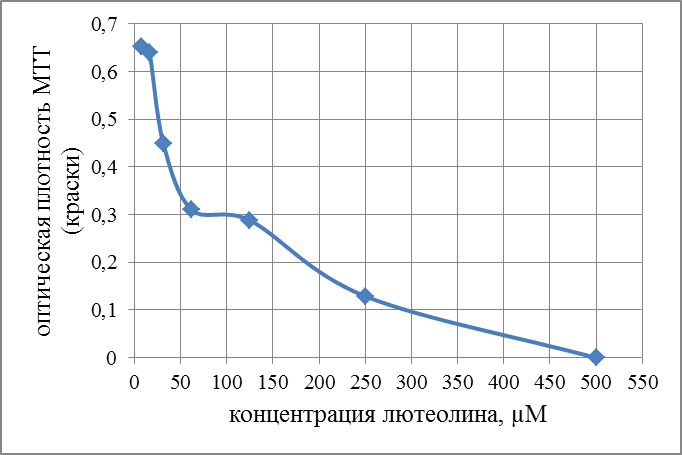 Рисунок 2 – Действие лютеолина на рост раковых клеток Из рисунка 3 видно, что для снижения содержания живых раковых клеток в два раза необходима была концентрация кверцетина в 100 µM. При концентрации же кверцетина даже в 500 µM 100 % гибели раковых клеток не наблюдалось. Отсюда следует, что в наших опытах лютеолин обладал большим, чем кверцетин, цитотоксическим действием. Таким образом, лютеолин в концентрации 50 µM и кверцетин - в концентрации 100 µM приводили к гибели 50 % раковых клеток НСТ-15 в соответствии с рисунками 2 и 3. 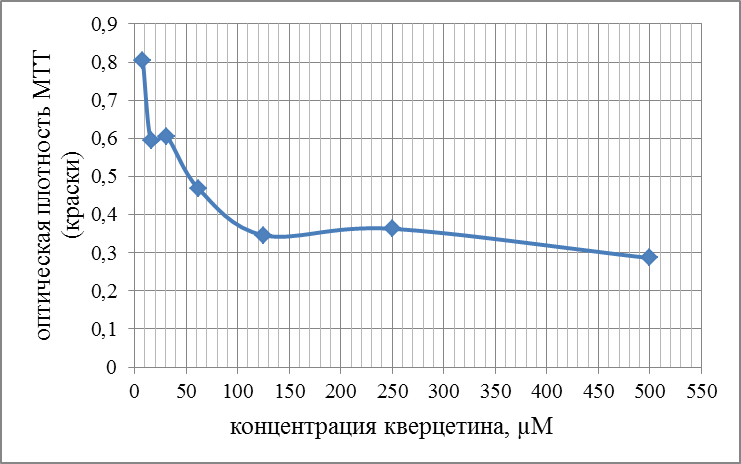 Рисунок 3 – Действие кверцетина на рост раковых клеток На следующем этапе были проведены исследования действия альфа-терпинеола, лимонена, метилизоэвгенола на рост клеток колоректального рака – НСТ-15. Результаты исследований представлены на рисунках 4, 5 и 6. Как видно из рисунка 4, лимонен при концентрации 10 мг/мл (что соответствует 73 мМ) почти в два раза снижает содержание живых раковых клеток (уменьшение оптической плотности в два раза). При концентрации же в 27 мг/мл лимонен вызывал гибель всех раковых клеток (оптическая плотность МТТ равна 0). 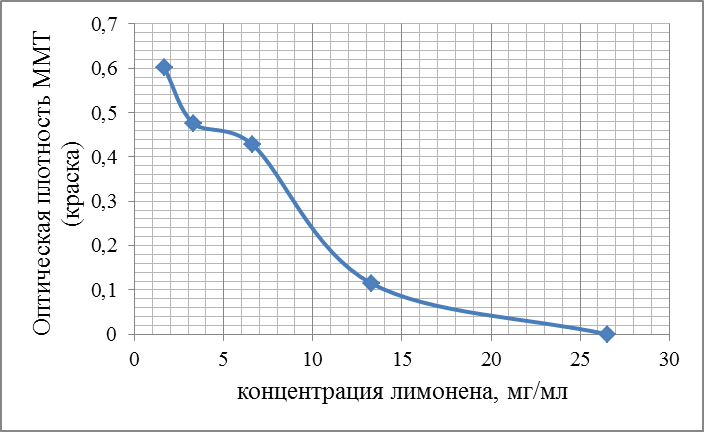 Рисунок 4 – Действие лимонена на рост раковых клеток Альфа-терпинеол также проявляет цитотоксическую активность на раковые клетки НСТ-15 (рисунок 5). 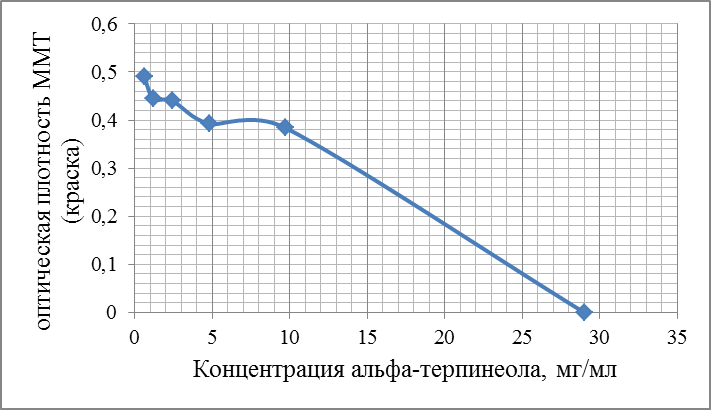 Рисунок 5 – Действие альфа-терпинеола на содержание раковых клеток Содержание раковых клеток уменьшается на 50 % при концентрации альфа-терпинеола в 15 мг/мл (что составляет 97 мМ). При концентрации же в 29 мг/мл альфа-терпинеол вызывал гибель всех раковых клеток. Как видно из рисунка 6, метилизоэвгенол также проявляет цитотоксическую активность, но чуть в меньшей степени, чем альфа-терпинеол. Содержание раковых клеток уменьшается на 50 % при концентрации метилизоэвгенола в 20 мг/мл (что составляет 117 мМ), тогда как альфа-терпинеол оказывает такое же действие при меньшей концентрации– 15 мг/мл. При концентрации же в 40 мг/мл метилизоэвгенол вызывал гибель всех раковых клеток (рисунок 5). Такое же цитотоксическое действие альфа-терпинеол оказывал при концентрации 29 мг/мл (рисунок 6). 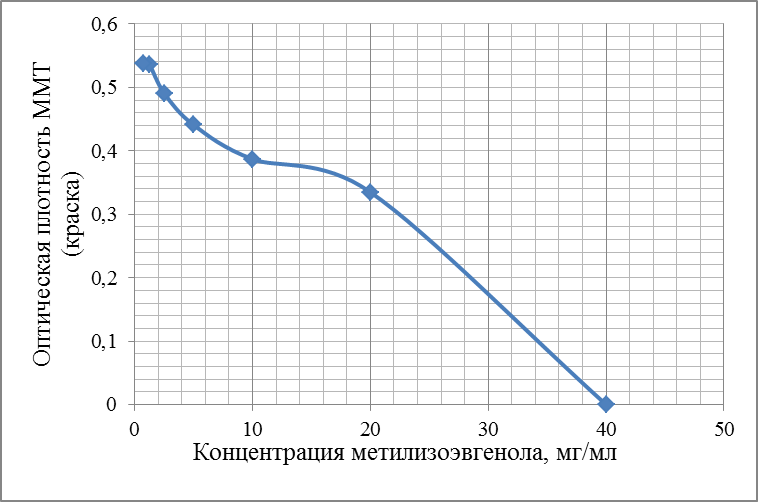 Рисунок 6 – Действие метилизоэвгенола на содержание раковых клеток Результаты исследования изменения оптической плотности краски, т.е. содержания живых и мертвых раковых клеток НСТ-15, в зависимости от концентрации линамарина представлены на рисунке 7. Линамарин обладал слабым цитотоксическим действием на раковые клетки НСТ-15, даже при концентрации 125 μМ. 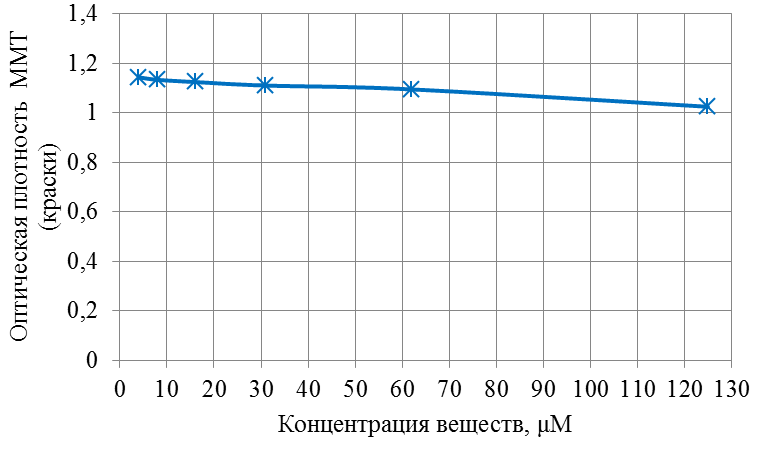 Рисунок 7 - Действие линамарина на рост раковых клеток В отличие от линамарина апигенин обладал большим цитотоксическим эффектом. Как видно из рисунка 8, апигенин при концентрации 8 µM уже на 11 % понижает количество раковых клеток (до плотности МТТ 1,075). Тогда как линамарин при этой же концентрации таким действием не обладал. 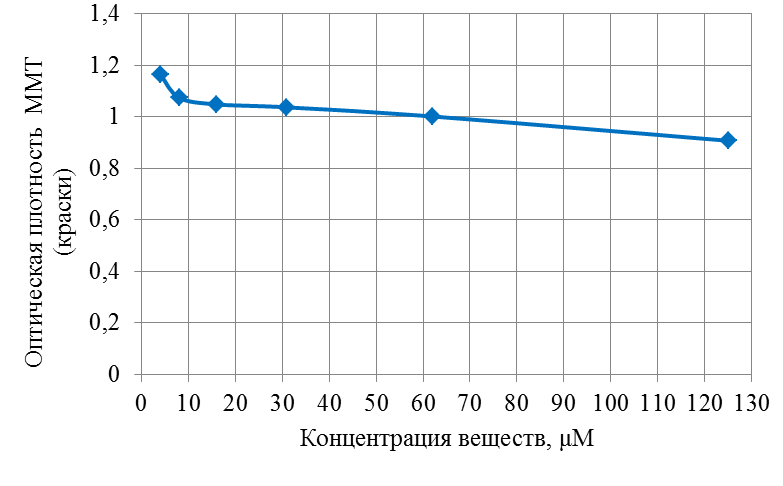 Рисунок 8 - Действие апигенина на рост раковых клеток При концентрации 62 µM апигенин понижает количество раковых клеток (до плотности МТТ 1,002), такое ингибирующий эффект линамарин проявлял при концентрации вдвое больше - 125 µM (рисунок 8). При концентрации же 125 µM апигенин на 25 % понижает количество раковых клеток (до плотности МТТ 0,908). Таким образом, исследуемый нами апигенин обладает большим цитотоксическим действием на клетки колоректального рака, чем линамарин. Результаты исследования по влиянию тимола на жизнеспособность раковых клеток НСТ-15 представлены на рисунке 9. При концентрации 30 µM тимол снижал количество живых раковых клеток в два раза. Полумаксимальное ингибирование (IC50) раковых клеток, которое является показателем эффективности противоракового действия, апигенин и линамарин, в отличие от тимола. При концентрации же 125 µM тимол подавлял жизнеспособность почти всех клеток колоректального рака (оптическая плотность МТТ равнялась ,056). 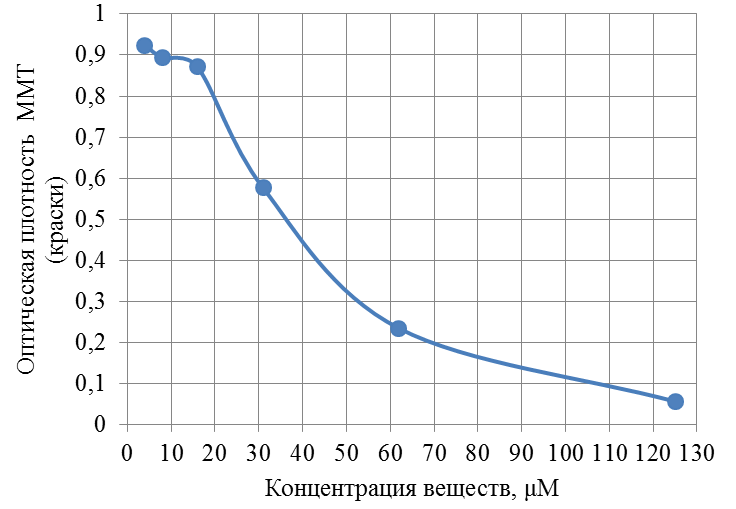 Рисунок 9 - Действие тимола на рост раковых клеток Итак, на основании проведенных исследований на клеточном уровне действия 8 биологически активных веществ исследуемых лекарственных растений на рост клеток колоректального рака (НСТ-15) было установлено, что 50 % подавление роста раковых клеток наблюдалось в следующем ряду концентраций: тимол (30 µM) ˃ лютеолин (50 µM) ˃ кверцетин (100 µM) ˃ лимонен (73 мM) ˃ альфа-терпинеол (97 мМ) ˃ метил изоэвгенол (117 мМ). Тогда как 50 %-ное ингибирующее действие на рост клеток колоректального рака апигенин и линамарин в исследуемых концентрациях (от 4 до 130 µM) не проявили, хотя снижение роста раковых клеток наблюдалось уже при их концентрациях в 8 µM. Таким образом, из исследуемых 8 биологически активных веществ наибольшими ингибирующими действиями на раковые клетки обладали тимол, лютеолин и кверцетин. Тимол был обнаружен в тимьяне и девясиле, которые входят в состав первой растительной композиции, а также в мяте, девясиле, подорожнике, которые входят в состав второй растительной композиции. Лютеолин и кверцетин обнаружены в лекарственных растениях обеих композиций. Лютеолин - в тимьяне (первая композиция) и в мяте (вторая композиция). Кверцетины – в тимьяне и березе (первая композиция) и в мяте (вторая композиция). Лимонен входит в состав растений обеих композиций. В первой композиции он обнаружен в составе тимьяна и березы, а во второй композиции - в мяте и подорожнике. Альфа-терпинеол входят в состав эфирных масел следующих исследуемых растений: тимьяна ползучего, березы повислой, девясила высокого, мяты перечной, подорожника среднего. На основании анализа литературы и результатов собственных исследований можно сделать вывод, что лекарственные растения содержат различные биологически активные вещества, проявляющие протираковые свойства. Для усиления их антиракового действия целесообразно при производстве функциональных пищевых продуктов использовать галеновые препараты, выделенные не из одного лекарственного растения, а из композиций нескольких лекарственных растений. При этом для получения галеновых препаратов необходимо подбирать наиболее эффективные методы извлечения из лекарственных растений концентратов веществ, обладающих противоопухолевым действием. |
