Н. И. Каракчиев военная токсикология и защита от ядерного и химического оружия
 Скачать 1.61 Mb. Скачать 1.61 Mb.
|
|
Рис. 9. Схема патогенеза действия ОВ (ядов) на организм. Состояние организма и нервной системы оказывает большое влияние на чувствительность организма к ядам и ОВ. Возраст, пол, беременность также играют роль в действии ядов на организм. Этими факторами определяется различная индивидуальная чувствительность людей к разным ядам. Психическое возбуждение, переутомление, холод, жара, неблагоприятные условия жизни могут снижать резистентность организма к ОВ. В токсикологии различают острые и хронические отравления. В боевых условиях наибольшее значение имеют острые поражения ОВ, но также возможны и повторные отравления. При повторных и хронических воздействиях ядов могут наблюдаться явления кумуляции, сенсибилизации и привыкания к ядовитым веществам, что приводит к изменению реакции организма на яд. Как уже указывалось выше, медленно детоксицирующиеся и медленно выделяющиеся яды способны кумулироваться в организме и при последующих воздействиях малые, не действующие на здорового человека дозы могут привести к поражению или небольшие дозы вызывают более тяжелое поражение. К таким ядам относятся свинец, ртуть, мышьяк, иприт, люизит, зарин, зоман и др. Кроме такой материальной кумуляции, возможна также функциональная кумуляция, когда происходит суммирование отдельных эффектов действия яда, например: инактивирование холинэстеразы при поражениях зарином и другими фосфорорганическими ОВ, поражения легких при отравлении фосгеном и т. п. Характерно, что иприт вызывает сенсибилизацию организма, и при повторных поражениях резко повышается чувствительность к нему, а само поражение протекает по типу аллергической реакции. Привыкания к ОВ, как правило, не наблюдается. Все внимание нужно уделять предупреждению поражений. 1.12. ЦИТОГЕНЕТИЧЕСКОЕ, ТЕРАТОГЕННОЕ И БЛАСТОМОГЕННОЕ ДЕЙСТВИЕ ЯДОВ Развитие молекулярной биологии и патологии, рассматривающей заболевания на молекулярном уровне нарушений генных и субклеточных структур, расширяет также задачи и возможности токсикологии. Важное значение приобретают вопросы радиационной и химической генетики (токсикогенетики), тератогенного и бластомогенного действия токсических веществ. Приведем некоторые данные структуры и функций субклеточных образований, необходимые для понимания принципов токсикогенетики. Наиболее важной составной частью клеточного ядра является ДНК (дезоксирибонуклеиновая кислота), которая соединена с белком гистоном и образует комплекс ДНП (дезоксирибонуклеопротеид). ДНП входит в состав ядерного белка хроматина, из которого образуются хромосомы как аппарат клеточного деления. ДНК состоит из 4 нуклеотидов (мономеров). Каждый нуклеотид в свою очередь состоит из фосфорной кислоты, углевода — дезоксирибозы и одного из четырех азотистых оснований: пуриновых оснований — А (аденина) и Г (гуанина) и пиримидиновых оснований — Т (тимина) и Ц (цитозина). Нуклеотиды соединены друг с другом в длинную спиральную нить, а ДНК в целом состоит из двух спиральных нитей, соединенных друг с другом водородными связями оснований (рис. 10). Молекулярная масса ДНК достигает 10 млн. дальтон и более. 28 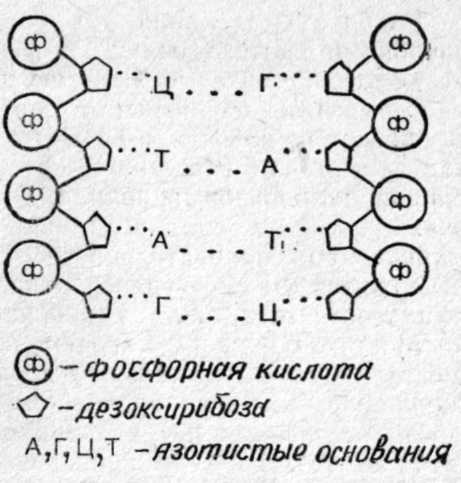 Рис. 10. Схема участка двухспиральной цепи ДНК. В настоящее время можно считать установленным, что ДНК является основным носителем наследственных признаков (ген), которые как буквами алфавита закодированы в ДНК путем определенного сочетания азотистых оснований (А, Г, Т, Ц). Одним из замечательных свойств ДНК является способность к репликации, то есть воспроизведению второй спирали ДНК, абсолютно идентичной исходной, несущей те же генетические признаки организма. Синтез ДНК происходит в период интерфазы жизненного цикла клетки, точнее в фазе S (синтетической фазе), с помощью фермента ДНК-полимеразы из нуклеотид-трифосфатидов. Во время митоза при расщеплении хромосом в каждую из вновь образующихся клеток попадает ДНК со всеми закодированными признаками. Вторым замечательным свойством ДНК является способность «строить» (синтезировать) РНК (рибонуклеиновую кислоту), которая обеспечивает синтез специфических белков и ферментов а значит, обеспечивает специфические функции клеток и тканей и их морфообразование (формирование клеток, тканей и органов). «Выдача» соответствующих РНК и синтез необходимых ферментов и белков регулируются генами «регуляторами» и «операторами». РНК также представляет собой спиралеобразную цепочку, состоящую из нуклеотидов, но отличается от ДНК: 1) в состав РНК в качестве углевода входит рибоза, а не дезоксирибоза (отсюда и название рибонуклеиновая кислота); 2) в качестве азотистых оснований в РНК входят А (аденин) Г (гуанин), Ц (цитозин) и У (урацил вместо тимина); 3) молекулярная масса РНК значительно меньше, чем у ДНК (до 1—2 млн.). Синтез РНК происходит в ядре на матрице ДНК, а потом она выходит и находится в цитоплазме клетки Цитоплазма клетки представляет собой сложный коллоидный раствор различных веществ, в котором находятся структурные органеллы клетки: рибосомы, митохондрии, лизосомы, тельца Гольджи и др. Рибосомы являются своеобразными химическими лабораториями синтеза белков и ферментов. По современным представлениям, синтез белков осуществляется в рибосомах (полирибосомах) из аминокислот при участии различных видов РНК. В рибосомах имеется р-РНК (рибосомная РНК), которая создает условия для синтеза. В цитоплазме находится m-РНК (матричная, или информационная, РНК), которая содержит полученную от ДНК и закодированную азотистыми основаниями информацию о последовательности аминокислот. В цитоплазме же содержится т-РНК (транспортная РНК), являющаяся «подносчиком» соответствующих аминокислот к рибосомам. Митохондрии играют роль «энергоустановок», где осуществляются окислительные процессы и окислительное фосфорилирование, то есть образование высокоэнергетичных соединений (АТФ и др.), обеспечивающих организм необходимой энергией. Лизосомы — это образования, богатые гидролитическими и протеолитическими ферментами, расщепляющими белки, жиры, углеводы. С точки зрения молекулярной патологии и конечного биологического эффекта в действии химических токсических веществ необходимо различать: — непосредственное общетоксическое действие яда на биоструктуры и физиологические функции макроорганизма, ведущее к нарушению определенных жизненных функций и отравлению организма; — токсикогенетическое действие (цитогенетическое), ведущее к нарушениям генетического аппарата соматических и половых клеток, размножения клеток, формирования тканей и органов. Цитогенетическое действие проявляется не только на данные клетки и организм, но и на последующие поколения клеток и организмов. Цитогенетическое действие может проявляться генетическими нарушениями соматических клеток: нарушения митозов, синтеза белков и ферментов, нарушения иммунитета, злокачественное перерождение клеток (бластомогенное действие), нарушение развития эмбриона и плода (тератогенное действие). Цитогенетиче-ские изменения половых клеток могут стать причиной наследственных изменений в последующих поколениях организма. В настоящее время можно считать установленным, что цитогенетические нарушения вызываются, главным образом, действием химических веществ на элементы ядра — ДНК и хромосомы, а не действием на элементы цитоплазмы. Мутагенное действие. Действие на ядро и ДНК является причиной различных хромосомных мутаций. Мутации могут быть генные (точковые), обычно связанные с действием яда на азотистые основания, и хромосомные аберрации, связанные с разрывами хромосом и неправильными склейками их (делении, инверсии, транслокации и др.). Причем в организме мутагенные вещества в наибольшей степени проявляют свое действие в отношении тех тканей, в которых происходит усиленное размножение клеток (кроветворная ткань, желудочно-кишечный тракт и т. д.). Имеется некоторое сходство с действием ионизирующей радиации, также оказывающей мутагенное действие на недифференцированные размножающиеся клетки и ткани организма. Известно большое количество химических мутагенных веществ. Приведем примеры. 1. Аналоги азотистых оснований ДНК (5-бромурацил, 5-бромдезоксиуридин, 2-аминопурин, 6-меркаптопурин и др.). Эти вещества (антиметаболиты) включаются в ДНК вместо соответствующих оснований, что приводит к «ошибке спаривания» нитей ДНК при последующей репликации (соединяются с гуанином вместо тимина и т. д.). 2. Азотистая кислота вызывает окислительное дезаминирование оснований, при этом аденин превращается в гипоксантин, который спаривается с цитозином вместо тимина; цитозин превращается в урацил, который спаривается с аденином вместо гуанина. Кроме этого, азотистая кислота может вызывать разрывы хромосом, выпадения и вставки отдельных участков. 3. Гидроксиламин (NН2ОН) реагирует с цитозином, который после этого спаривается с аденином вместо тимина. 4. Обширна группа алкилирующих веществ, которые легко присоединяются к нуклеофильным группам биосубстратов, несущим отрицательный заряд (сульфгидрильные, тиоэфирные, фосфатные и др.). К алкилирующим соединениям относятся иприт, азотистый иприт и его аналоги, азасерин, эпоксиды, этиленимины, эфиры кислот, ТиоТЭФ, ß-пропиолактон и др. Алкилирующие элементы могут реагировать с фосфорной кислотой и азотистыми основаниями ДНК, вызывать разрывы ее цепи, депуринизацию (отщепление пуриновых оснований), ошибку спаривания азотистых оснований. Они резко тормозят размножение клеток, оказывают цитостатическое действие, поэтому находят применение в терапии злокачественных новообразований и заболеваний крови. Некоторые химические вещества и антибиотики включаются в процессы размножения клеток, синтеза ДНК, РНК и ферментов. Актиномицин-Д образует комплекс с ДНК, препятствует синтезу m-РНК и блокирует синтез белков. Мономицин-С блокирует синтез ДНК, оказывает деполимеризующее действие на нее. Стрептомицин соединяется с рибосомами и затрудняет присоединение к ним m-РНК. Колхицин задерживает митозы клеток в стадии профазы. Многие химические токсические вещества оказывают тератогенное действие на эмбрион и плод у беременных женщин. Широкую известность получила трагедия с талидомидом. Талидомид (контерган) был выпущен в 1958 г. в ФРГ, без достаточной проверки широко рекламировался и быстро распространился в ряде стран как седативное и снотворное средство. Результатом его применения явилась «эпидемия» рождения младенцев с характерными уродствами: фокомелия (недоразвитые конечности), амелия (отсутствие конечностей) и другие тяжелые аномалии. В общей сложности пострадало более 10 тысяч детей. Известны десятки лекарственных веществ, оказывающих тератогенное действие на беременных женщин (все алкилирующие агенты, аминазин, аминоптерин, 6-меркаптопурин, толбутамид, актиномицин колхицин и др.). К бластомогенным (канцерогенным) веществам относятся полициклические углеводороды (3—4-бензпирен и др.), ароматические амины и анилиновые красители, иприты, некоторые неорганические соединения (хрома, никеля, селена) и др. Причем тератогенное и бластомогенное действие проявляется при таких малых, но длительно применяющихся (или даже при однократном применении) дозах, которые не вызывают клинических признаков отравления организма. Механизмы их действия еще недостаточно изучены, но, очевидно, они, как и все мутагенные вещества, вызывают генетические нарушения клеточного ядра, синтеза РНК и морфогенных ферментных систем. 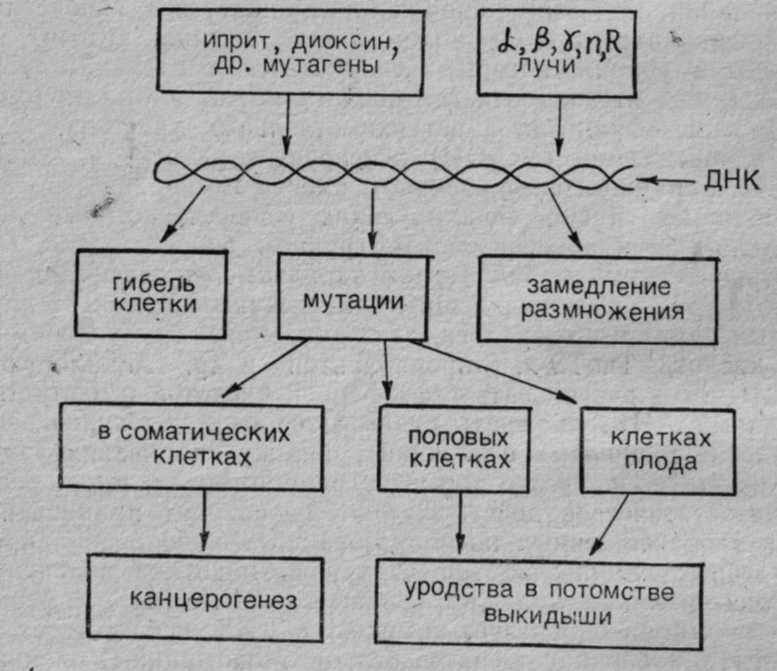 Рис. 11. Схема цитогенетического действия ядовитых веществ и ионизирующей радиации. Краткое ознакомление с проблемами токсикогенетики приводит к выводу о необходимости специальных исследований токсических и лекарственных веществ с целью изучения их мутагенного, тератогенного и бластомогенного действия (рис. 11). С другой стороны, генетически обусловленные особенности обмена веществ во многом определяют индивидуальную чувствительность животных и человека к химическим соединениям и веществам. Например, известно, что собаки и кролики мало чувствительны к атропину. Это объясняется тем, что у этих животных отмечается высокая активность фермента атропиназы, которая быстро разрушает данное вещество. В этом отношении представляет интерес развитие фармакогенетики. В отличие от токсикогенетики, изучающей влияние химических веществ на генетику соматических и половых клеток, фармакогенетика изучает влияние генетически обусловленных особенностей активности ферментов и обмена веществ на индивидуальную чувствительность человека к лекарственным средствам и ядам (Е. Г. Ильин, 1984; Scholz, 1967). Например, встречаются случаи повышенной чувствительности к миорелаксанту дитиллину, ведущие к осложнениям в виде длительного трудно восстанавливаемого нарушения дыхания. Анализы показали, что причиной этого является генетически обусловленное снижение активности фермента холинэстеразы. Этот признак является рецессивным, около 25% людей гетерозиготны по данному признаку, а около 0,05% людей являются дитиллиночувствительными (Scholz, 1967). Аналогичными нарушениями синтеза ферментов объясняется наличие лиц, «медленно выделяющих» изониазид (противотуберкулезное средство), имеющих повышенную чувствительность к наркотикам, антикоагулянтам, метгемоглобинообразующим веществам и т. д. 1.13. МЕТОДЫ ТОКСИКОЛОГИЧЕСКИХ ИССЛЕДОВАНИИ. ХАРАКТЕРИСТИКА ТОКСИЧНОСТИ ОВ В токсикологии широко используются экспериментальные методы исследования. Только эксперименты на животных, сопровождаемые современными патофизиологическими, биохимическими, клиническими, морфологическими и другими методами исследования, могут решать теоретические задачи токсикологии по изучению механизма действия и патогенеза отравления, методов антидотного лечения и профилактики поражений и т. д. Применяются различные методы воздействия ОВ на животных, методы затравки животных: ингаляционные — в затравочных камерах, куда распыляют ОВ; кожно-резорбтивные — путем нанесения ОВ на выстриженные участки кожи; внутривенные, внутримышечные и подкожные — путем введения растворов ОВ; пероральные — путем введения раствора ОВ через зонд в желудок или дачи ОВ с водой и пищей; путем внесения ОВ или его растворов в глаза и рану. Все эти работы должны проводиться под вытяжным шкафом с соблюдением мер предосторожности в целях исключения отравлений персонала. Для токсикологии важно количественно определить степень токсичности ядов и ОВ. Токсичность их при кожно-резорбтивном и пероральном поражениях, а также при введении внутривенно, в мышцы или под кожу определяется дозой ОВ, попавшего в организм, и выражается обычно в миллиграммах на 1 кг массы животного или человека (мг/кг). При ингаляционных поражениях токсичность ОВ и ядов определяется двумя величинами: концентрацией паров или аэрозолей в воздухе, выражаемой в миллиграммах на 1 л (мг/л) воздуха или в граммах на м3 воздуха (г/м3), и экспозицией, то есть временем вдыхания зараженного воздуха. На основании этого при ингаляционных поражениях за величину токсической дозы, вызывающей тот или иной эффект поражения, принято произведение концентрации ОВ на экспозицию. Токсическую дозу обычно определяют для экспозиции 1 мин. Например, токсическая доза, вызывающая 100% смертность, в мг. мин. равна (по зарубежным данным): л
Сравнение токсических доз показывает, что фосген в 700 раз менее токсичен, чем V-газы, зарин — в 14 раз и т. д. Однако токсическая доза еще не показывает, какое количество ОВ при этом попадает в легкие и какое всасывается в организм. Доза проникшего в организм ОВ (в мг) при ингаляционных поражениях определяется по формуле: D=c·t·v·k, где с — концентрация ОВ в мг/л воздуха, t — экспозиция в минутах, v — минутный объем легочного дыхания в литрах, к — коэффициент всасывания или резорбции ОВ в легких. В военной токсикологии приняты следующие категории токсических доз (D)и концентраций (С) паров и аэрозолей ОВ: — предельно допустимые, безвредные концентрации и дозы, которые не вызывают никаких признаков поражения при длительной или определенной экспозиции и употреблении зараженных продуктов и воды; — минимально действующие (пороговые) концентрации и дозы, которые вызывают начальные, легкие симптомы поражения и снижение боеспособности или работоспособности человека; — средневыводящие дозы и концентрации, вызывающие потерю боеспособности (трудоспособности) у 50% людей, обозначаются ID50 и IС50 (I — первая буква английского слова incapacity, то есть неспособный); — условно смертельные (среднесмертельные) концентрации (СL50) и дозы (DL50), вызывающие летальный исход у 50% пораженных; — абсолютно смертельные концентрации (СL100) и дозы (LD100), вызывающие летальный исход у 90—100% пораженных. Иногда определяют концентрации и дозы, вызывающие поражение легкой и средней степени тяжести. Концентрации и дозы, вызывающие поражение с потерей боеспособности, называют боевыми. Для ОВ раздражающего действия определяют условно непереносимые концентрации, вызывающие очень сильное раздражение слизистых оболочек глаз и органов дыхания. Для токсикологии важна экстраполяция (перенос) токсичности ОВ и ядов, определяемых обычно на животных, к токсичности их для людей. Для этого определяют токсичность на разных животных (собаки, кролики, кошки, мыши, обезьяны и др.), сопоставляют эти данные и делают ориентировочные выводы о токсичности для человека. Также учитывают токсичность для людей при случайных авариях и отравлениях (табл. 1). Таблица I Токсичность ОВ для людей (по литературным данным, В. В. Мясников, 1984)
1.14. ОРГАНИЗАЦИЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПОРАЖЕННЫХ ОВ Первостепенное значение, конечно, занимает задача профилактики поражений в мирное время при /работах с различными токсическими веществами и, тем более, в условиях возможного применения вероятным противником химического оружия. При поражениях ОВ медицинская помощь в очаге химического заражения должна оказываться немедленно с целью спасения жизни и обеспечения быстрейшего выздоровления пораженных. В боевых условиях оказание первой медицинской помощи резко затрудняется в связи с тем, что пораженные находятся на поле боя на зараженной территории. Сбор пораженных, оказание им первой медицинской помощи, эвакуация и лечение их организуются на базе существующей системы медицинской службы армии и ГО, все звенья которых должны быть подготовлены к этому. Первую медицинскую помощь оказывают прежде всего в порядке само- и взаимопомощи сами военнослужащие, используя индивидуальные аптечки и противохимические пакеты, а также санитары и санитарные инструкторы, а по линии ГО — санитарные посты и санитарные дружины. В дальнейшем оказывается доврачебная помощь в медицинском пункте батальона (МПБ), первая врачебная помощь - в медицинском пункте полка (МПП); в отдельном медицинском батальоне дивизии (омедб) или в отдельном медицинском отряде (ОМО) оказывается квалифицированная медицинская помощь; специализированная медицинская помощь и лечение пораженных проводятся в военных полевых терапевтических госпиталях (ВПТГ). В системе ГО первая врачебная помощь оказывается в отрядах первой медицинской помощи (ОПМ), специализированная медпомощь и лечение пораженных проводятся в специализированных терапевтических больницах загородной зоны. В токсикологии, как и вообще в терапии, различают этиологическое, патогенетическое и симптоматическое лечение. Этиологическое лечение направлено на недопущение или прекращение действия этиологического фактора— ядовитого вещества на организм и включает: — надевание противогаза и средств защиты кожи; — удаление или обеззараживание ОВ (яда) с кожных покровов и одежды путем проведения санитарной обработки и снятия зараженной одежды; — удаление ОВ (яда) из желудочно-кишечного тракта путем промывания желудка, дачи адсорбентов (активированного угля); — применение специальных антидотов; — применение других средств и методов детоксикации — форсированный диурез, гемодиализ (искусственная почка), перитонеальный диализ, гемосорбция путем пропускания крови через колонки с адсорбентом, лимфосорбции, обменного переливания крови. Более подробно об этих методах удаления ядовитых веществ сообщается в соответствующих главах. Одно ясно: если ядовитое вещество остается в организме, не удалось удалить его или обезвредить и прекратить его действие, другие лечебные мероприятия могут оказаться не эффективными. Следует также учитывать, что патогенетические и симптоматические средства при тяжелых, угрожающих жизни состояниях также играют важную роль, позволяют временно поддерживать жизненные функции и стимулировать эффективность антидотного лечения. В зависимости от важнейших симптомов и синдромов отравления важное значение имеют следующие лечебные мероприятия: — предупреждение или устранение асфиксии и острого кислородного голодания; — восстановление функционирования нервной системы, снятие судорожного синдрома; _ восстановление функций сердечно-сосудистой системы и ликвидация явлений экзотоксического шока; _ предупреждение нарушений и восстановление функций печени, почек и других нарушений в организме. 1.15. АНТИДОТНОЕ ЛЕЧЕНИЕ Антидотами (противоядиями) называются специфические лекарственные средства, предупреждающие или устраняющие действие ОВ (ядов) на организм. По механизму действия различают антидоты детоксицирующего и функционального действия. Антидоты первого типа могут активно вступать в химическую реакцию с ОВ (ядом) с образованием нетоксичного или малотоксичного вещества. Антидоты функционального действия не вступают вреакцию с ядом, но устраняют действие его на организм на основании фармакологических свойств данного лекарственного вещества. Список известных в настоящее время антидотов весьма обширен. Приведем некоторые наиболее важные и распространенные антидоты. Активированный уголь — адсорбент, часто применяется для удаления многих ядовитых веществ из желудка при промывании. Ряд веществ применяется для нейтрализации (обезвреживания) ядов в желудке с последующим промыванием: слабыми кислотами нейтрализуют щелочи, жженая магнезия нейтрализует кислоты, перманганат калия нейтрализует в желудке некоторые алкалоиды (стрихнин, никотин, физостигмин). Комплексоны (ЭДТА, ДТПА и др.) применяются для связывания солей тяжелых металлов в желудке (ртути, например, сулемы, свинца). Ряд антидотов применяется для нейтрализации ядов во внутренней среде организма: реактиваторы ацетилхолинэстеразы связывают фос-форорганические вещества, унитиол — люизит, тиосульфат натрия — цианиды и др. Функциональные антидоты: атропин и другие холинолитики — ослабляют действие холиномиметиков; амилнитрит и нитрит натрия вызывают образование метгемоглобина, который связывает цианиды, кислород вытесняет окись углерода из карбоксигемоглобина; налорфин ослабляет действие морфина и т. д. (табл. 2). Если заболевание вызвано ядовитым веществом, прежде всего надо знать и своевременно применять противоядие, антидот, нейтрализовать действие яда, ускорить его выведение из организма. В заключение следует отметить, что не исключена возможность применения агрессивными империалистическими армиями новых неизвестных ОВ, разрабатываемых в секретных НИИ в ряде стран. В странах НАТО химические военные средства деля» на боевые ОВ и диверсионные яды (Schumacher, 1970). В качестве таких ядов для заражения водоисточников и продуктов питания могут применяться различные высокотоксичные соединения (в скобках указана смертельная доза вещества в граммах для взрослого человека рег os): фториды (4—5), цианиды (0,1—0,2), арсины (0,1—0,2), сулема (0,2—1,0), алкалоиды (вератрин, аконитин, рицин — 0,01—0,02), фторкарбоновые соединения (0,05), тетродотоксин — яд из икры рыбы фугу (0,07), тарихотоксин — яд, вырабатываемый тритоном (0,07), палитоксин — яд, содержащийся у кишечнополостных, вызывает смертельное отравление в дозе 0,0003 г, нейротоксин кобры (0,00001) и др. Таблица2 Антидоты и лекарственные средства, применяемые при поражении ОВ, некоторых отравлениях и инкорпорировании РВ внутрь организма
Важное значение имеет умение врачей и среднего медперсонала правильно оказать медицинскую помощь при отравлении неизвестным ядовитым веществом, исходя из ранее изложенных принципов: возможно быстрое и полное удаление и обезвреживание токсического вещества с кожи и одежды, слизистых, желудка, дача адсорбентов, симптоматические средства в зависимости от состояния нервной, сердечно-сосудистой системы, дыхания, печени, почек и др., проведение общих детоксикационных мероприятий (усиление диуреза, вливания крови, гемодеза, глюкозы, витаминов, десенсибилизирующих средств, димедрола и т. д.). Вопросы и задания 1. Что такое химическое оружие? Краткая история и вероятность применения его в будущих войнах? 2. Классификации ОВ и средства применения? 3. Особенности поражающего действия химического оружия, почему оно относится к оружию массового поражения? 4. Что такое токсикология, военная токсикология и медицинская защита? 5. Что вы понимаете под биохимическим механизмом действия ядов? Приведите примеры. 6. Что такое бластомогенное, мутагенное и тератогенное действие ядовитых веществ? 7. Принципы оказания медицинской помощи при отравлениях, понятие об антидотах. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
