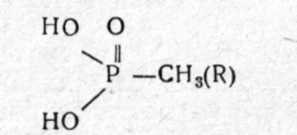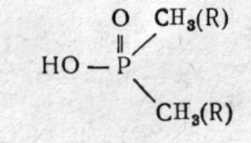Н. И. Каракчиев военная токсикология и защита от ядерного и химического оружия
 Скачать 1.61 Mb. Скачать 1.61 Mb.
|
|
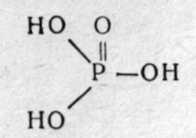
Глава 2. ФОСФОРОРГАНИЧЕСКИЕ ОТРАВЛЯЮЩИЕ ВЕЩЕСТВА (ОВ НЕРВНО-ПАРАЛИТИЧЕСКОГО ДЕЙСТВИЯ) Фосфорорганические ОВ (ФОВ) являются в настоящее время самыми опасными веществами быстрого и смертельного действия в арсенале химического оружия зарубежных империалистических армий. Вот почему на их изучение обращается особое внимание. Впервые они появились в фашистской Германии в годы второй мировой войны. Синтез их был осуществлен в лабораториях Фарбениндустри Шрадером. В 1937г. синтезирован табун, в 1938г.— зарин и в 1944г.— зоман. Был налажен массовый выпуск этих ОВ. В Англии в эти годы синтезирован диизопропилфторфосфат и введен на вооружение как штатное ОВ. В 50-х годах шведский химик Таммелин синтезировал высокотоксичные аминотиоловые эфиры фосфоновых кислот, на основании которых в США с 1955г. на вооружении появились наиболее высоко токсичные ОВ под условным названием V-газы (вигазы). На вооружении стран НАТО состоят зарин, зоман, V-газы и др. Фосфорные соединения являются жизненно необходимыми для организма веществами, в частности аденозинтрифосфорная кислота (АТФ) — одно из основных макроэргических соединений, обеспечивающих энергоресурсы организма. В то же время фосфорорганические эфиры являются высокотоксичными веществами нервно-парадитдщесдого действия. В настоящее время синтезировано около 12 тысяч фосфорорганических соединений(ФОС) типа эфиров различных фосфорсодержащих кислот. Многие из них нашли широкое применение в качестве инсектицидов для уничтожения насекомых-вредителей сельскохозяйственных культур и в системе санитарно-противоэпидемических станций; некоторые эфиры применяются в медицине в качестве лекарств, а ряд соединений состоят на вооружении как ОВ. Особая опасность ФОВ объясняется следующими характерными свойствами этих соединений: 1) они являются наиболее токсичными среди всех ОВ; 2) могут проникать в организм всеми возможными путями, в том числе через кожу, что затрудняет защиту от них; 3) многие из них не имеют цвета и запаха, практически трудно обнаруживаются органами чувств (их можно обнаружить только химическими реакциями) и момент поражения может проходить незаметно; 4) обладают значительной стойкостью на местности; 5) могут вызывать так называемую молниеносную форму поражения, когда смерть наступает в первые 5—10 мин. на поле боя до получения необходимой медицинской помощи. Эти обстоятельства приводят к выводу, что ФОВ могут вызывать массовые потери войск и населения с высокой, смертностью пораженных. 2.1 ФИЗИКО-ХИМИЧЕСКИЕ И ТОКСИЧЕСКИЕ СВОЙСТВА Фосфорорганические соединения (ФОС) по своей химической структуре могут быть производными фосфорной (фосфаты), алкилфосфоновой (фосфонаты), диалкилфосфиновой (фосфинаты), тиофосфорной кислот (тиофосфаты) и других производных фосфорных кислот:
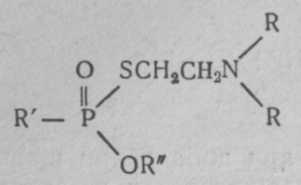
Зарин (gВ) — изопропиловый эфир метилфторфосфоновой кислоты: 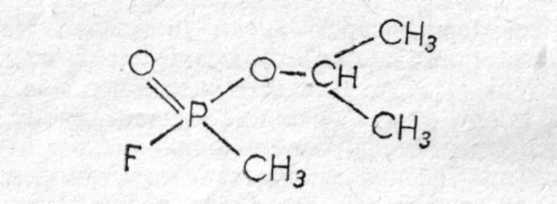 Физические свойства. Зарин — бесцветная жидкость, практически без запаха (некоторые отмечают слабый фруктовый запах). Температура кипения 158°С (при кипении разлагается), поэтому обладает значительной летучестью (при 20°—13,2 мг/л воздуха) и сравнительно небольшой стойкостью (летом на местности держится до 10 ч). Температура плавления (затвердевания) —56°С, может применяться в зимних условиях. Молекулярная масса 140,1; плотность 1,094 (тяжелее воды); плотность паров по воздуху 4,86. Зарин хорошо растворяется в жирах, липидах и органических растворителях (дихлорэтан, бензол, бензин, спирт и др.) и сравнительно хорошо растворяется в воде. Проникает через кожные покровы в капельно-жидком и парообразном состоянии. Химические свойства. Наиболее подвижной и реакционно способной является фторфосфорная связь, поэтому по этой связи легче всего идут химические и биохимические реакции зарина. Зарин гидролизуется водой, но медленно (при комнатной температуре на 50% гидролизуется за 5 ч), при этом образуются значительно менее токсичная фтористоводородная кислота и нетоксичный остаток. 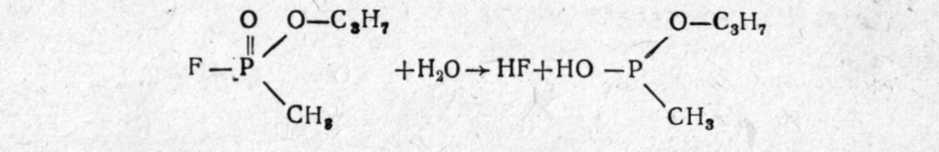 Гидролиз зарина резко ускоряется при добавлении щелочных веществ и кипячении. Зарин легко разрушается и дегазируется щелочными веществами, аммиаком: 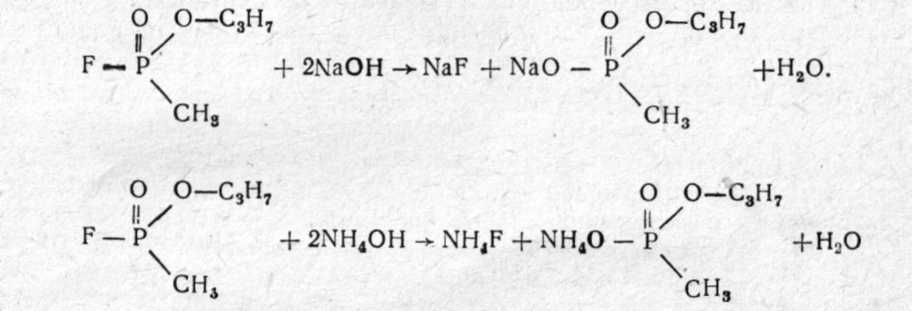 Для дегазации, предметов, зараженных зарином, применяются 5% растворы едких щелочей, 25% раствор аммиака, или аммиачно-щелочной раствор № 2-ащ и др. 3оман, (gD) — пинаколиновый эфир метилфторофосфоновой кислоты. Представляет собой бесцветную жидкость, практически без запаха (некоторые отмечают слабый камфорный запах). 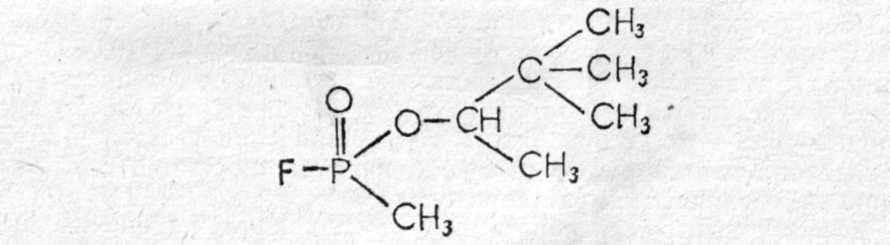 Физические свойства. Температура кипения зомана около 200°С (с разложением), относится к стойким ОВ (стойкость летом около суток). Температура затвердевания —80°С (по другим данным —42°С). Молекулярная масса 182; плотность, 1,013; плотность паров по воздуху 6,3. Хорошо растворяется в жирах, липидах, органических растворителях; в воде растворяется умеренно. Хорошо проникает через кожу человека и животных. Химические свойства близки к свойствам зарина (реакции по Р—F связи), но в воде гидролизуется очень медленно (в холодной воде может держаться месяцами). Дегазируется также щелочными веществами. V-газы. Под этим названием объединяют различные соединения с общей формулой:
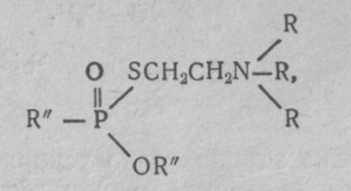
где R' —алкильный радикал, ОR" — алкильный эфир, R —два или три алкильных радикала. Известно около 15 таких соединений, отличающихся радикалами. Более токсичным и вероятным ОВ считается О-этил-S-диизопропиламиноэтил-метилфосфонотионат (Vх ): 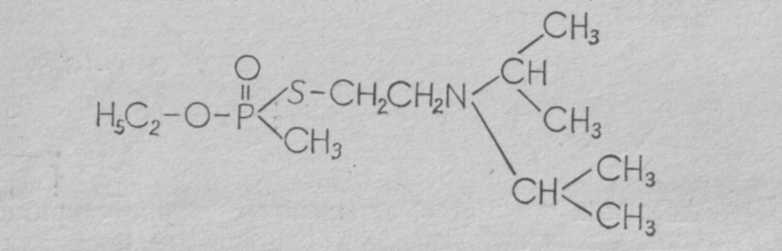 V-газы являются аминотиоловыми эфирами фосфоновых кислот, причем аминотиоловая группа содержит две СН2-группы, как и ацетилхолин. Возможно этим объясняется более высокая токсичность V-газов. Физические свойства. V-газы представляют собой бесцветную жидкость без запаха. Температура кипения около 300°С, поэтому они обладают очень малой летучестью (0,003 мг/л воздуха) и наибольшей стойкостью на местности. Стойкость V-газов на местности при температуре 15°С может быть до 20 сут, а при —10°С — до 16 нед. Температура плавления V-газов —50°С. В воде они растворяются до 5%, хорошо растворяются в жирах, липидах, органических растворителях. Характерными особенностями V-газов являются наиболее высокая по сравнению с другими ОВ токсичность и способность хорошо проникать через кожу, вызывая поражения в минимальных дозах. В США предлагают применять V-газы главным образом в аэрозольном состоянии или капельно-жидком виде для создания стойких очагов химического заражения. Химические свойства. V-газы гидролизуются водой очень медленно. Дегазируются легче веществами, содержащими активный хлор (гипохлоритом кальция), труднее — щелочными веществами. Бинарные ФОВ. Как уже сообщалось, в США создается бинарное химическое оружие. Внутри бинарного боеприпаса (артхимснаряда или бомбы) в отдельности находятся два неядовитых компонента, разделенных перегородкой. При выстреле или резком ударе перегородка разрушается, компоненты соединяются и реагируют с образованием зарина или V-газов, не отличающихся в принципе от собственно зарина или V-газов. В качестве компонентов для зарина могут быть использованы фтор-хлоран-гидрид-метилфосфоната и изопропиловый спирт: 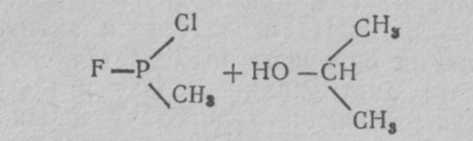 Бинарные ФОВ в США условно получили название gВ-2 и Vх -2. Фосфорорганические инсектициды широко применяются в сельском хозяйстве и дезстанциях для уничтожения насекомых и вредителей: дихлофос (аэрозоль), хлорофос, карбофос, тиофос и др. При неправильном обращении с ним могут быть тяжелые и смертельные отравления, по клинике мало отличающиеся от поражений ФОВ. Способы боевого применения. ФОВ могут применяться в химических ракетах, бомбах, артхимснарядах и минах, реактивных химических снарядах, химических фугасах и путем распыления с самолетов из выливных авиационных приборов и различных генераторов аэрозолей. Токсические свойства. Как уже указывалось, ФОВ являются высокотоксичными веществами (ультраяды) быстрого и смертельного действия. Токсичность их при разных путях поступления в организм на основании обобщения данных литературы представлена в табл. 3 (В. В. Мясников, С. Н. Голиков и др.). Таблица 3 Токсичность ФОВ
При длительных экспозициях ФОВ могут вызывать тяжелые поражения в концентрациях 0,0001—0,001 мг/л воздуха. Например, зарин в концентрации 0,001 мг/л при экспозиции 15 мин может вызвать тяжелое поражение. Для создания смертельных концентраций в атмосфере, по данным зарубежных специалистов, достаточно заражать территорию с плотностью заражения 0,1— 0,2 г на 1 м2 поверхности. При попадании на кожу V-газы в дозе 5—10 мг (то есть мельчайшей капельки в 10 раз меньше капли воды) могут вызвать тяжелое поражение человека. 2.2. МЕХАНИЗМ ДЕЙСТВИЯ И ПАТОГЕНЕЗ ПОРАЖЕНИЯ Фосфорорганические ОВ, как и другие фосфорорганические соединения (инсектициды), относятся к антихолинэстеразным ядам. Действие их на организм объясняется способностью угнетать (ингибировать) ацетилхолинэстеразу и нарушать гидролиз ацетилхолина, осуществляющего передачу нервного импульса в холинэргических синапсах. Эти вопросы подробно излагаются в специальных монографиях (С. Н. Голиков и В. И. Розенгарт, М. Я. Михельсон, Ю. С. Каган, В. Б. Прозоровский и Н. В. Саватеев, Б. Сондерс, О. Брайн и др.). В данном пособии эти вопросы рассматриваются очень кратко. Физиология нервных синапсов. Синапсом называют область (место) контакта окончания нервного волокна с другим нейроном (межнейронные синапсы) или с органом (концевые синапсы). Синапсы обеспечивают передачу нервного импульса на другой нейрон или орган, причем только в одном направлении (по нервному волокну импульсы могут идти в любом направлении). Согласно биохимической теории, передача нервного импульса в синапсах происходит посредством медиаторов (переносчиков, посредников). В холинэргических нейронах медиатором служит ацетилхолин, в адренэргических — норадреналин. Синапс представляет собой весьма сложное микроскопическое образование, в котором электронной микроскопией установлены: концевое утолщение нерва, вакуоли, содержащие связанный ацетилхолин, пресинаптическая мембрана с утолщениями и отверстиями, синаптическая щель шириной 20—50 нм и постсинаптическая мембрана, с которой неразрывно связаны холинорецепторы (холинореактивные системы, рис. 12). 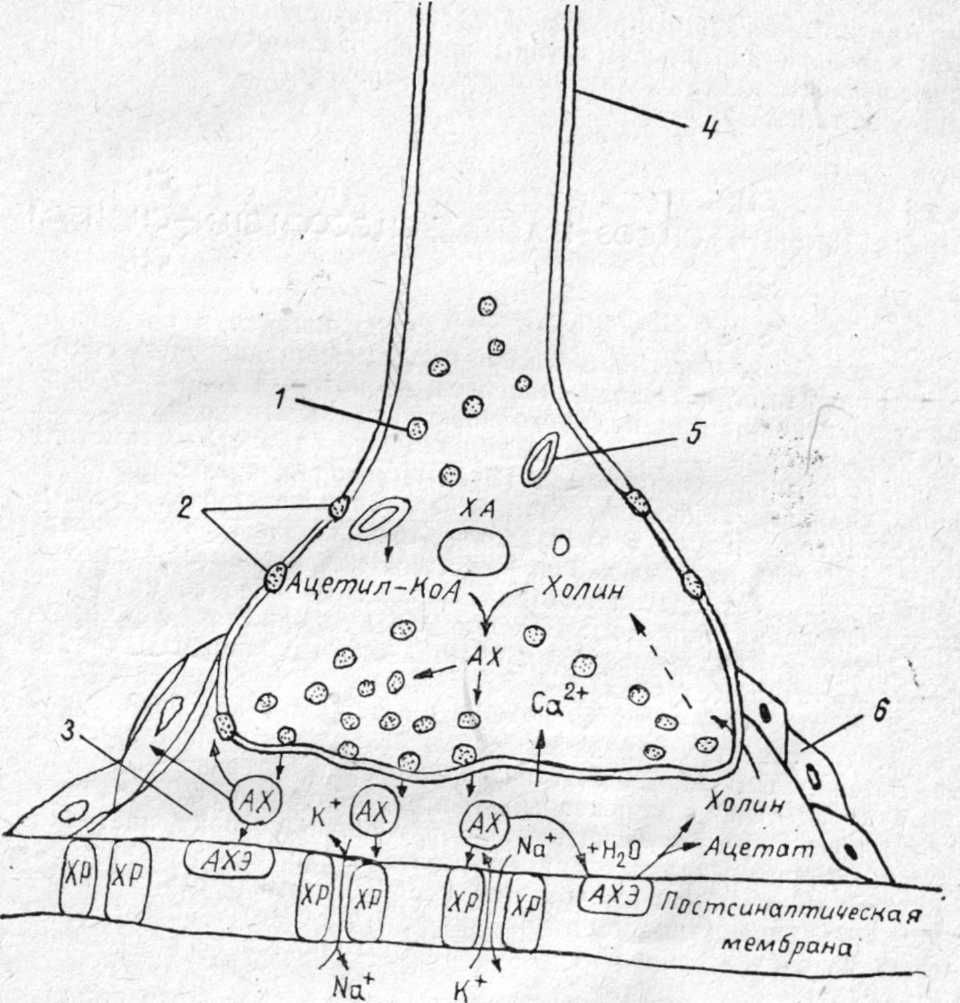 Рис. 12.Основные структурные элементы и схема функционирования холинэргического синапса (С. Н. Голиков, Ю. И. Фишзон-Рысс): 1 — синаптические пузырьки, 2 — пресинаптические центры связывания ацелхолина, 3 — синаптическая щель, 4 — миелиновая оболочка, 5 — митохондрии, 6 — шванновские клетки; ХР — холинорецептор. АХ – ацетилхолин, АХЭ – ацетилхолинэстераза, ХА – холинацетилтрансфераза (холинацетилаза). В состоянии покоя ацетилхолин находится в связанном состоянии, постсинаптическая мембрана — в состоянии электрической поляризации: внутри клетки содержится больше отрицательно заряженных анионов, снаружи — положительно заряженных ионов натрия и калия, создается мембранный потенциал покоя около 50—90 мВ. Когда нервный импульс достигает синапса, под влиянием тока ионов кальция ацетилхолин высвобождается из вакуолей в виде отдельных порций («квантов») и выходит в синаптическую щель, где он сразу же вступает во взаимодействие с холинорецептором постсинаптической мембраны, передавая импульс на другой нейрон или на эффекторный орган, и обеспечивает выполнение определенных функций органа (например, быстрое сокращение поперечнополосатых мышц или медленное сокращение гладкой мускулатуры). При этом одновременно происходит деполяризация постсинаптической мембраны вследствие повышения ее проницаемости и диффузии ионов натрия внутрь. После передачи импульса ацетилхолин почти мгновенно (за 0,002 с) гидролизуется под действием фермента ацетилхолинэстеразы, одновременно происходит поляризация мембраны за счет выхода ионов, натрия под действием «натриевого насоса» и готовность синапса к проведению следующего импульса. Гидролиз ацетилхолина: 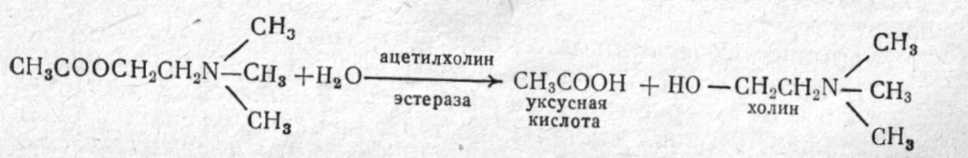 Ацетилхолин синтезируется в пресинаптическом окончании путем переноса ацетильной группы ацетилкоэнзима-А на холин с помощью фермента холинацетилтрансферазы (холинацетилазы) при участии АТФ: 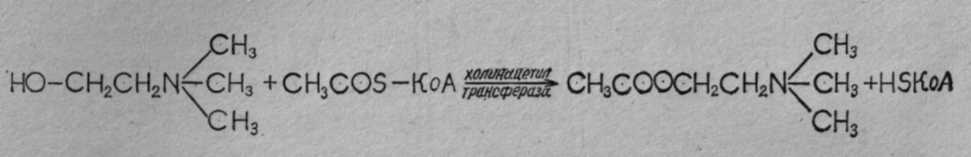 Холинэстераза — фермент, содержащийся в организме всех животных, птиц, рыб, насекомых, имеющих нервную систему. В зависимости от вида субстрата, на который действует фермент, различают три вида холинэстераз: ацетилхолинэстераза (АХЭ), которая гидролизует ацетилхолин___(и ацетилбетаметилхолин); бутирилхолинэстераза (БуХЭ), которая, кроме ацетилхолина, гидролизует бутирилхолин, и бензоилхолинэстераза (БеХЭ), которая гидролизует бензоилхолин. Ацетилхолинэстераза содержится во всех отделах нервной системы и эритроцитах, именно она гидролизует ацетилхолин в синапсах (раньше ее называли истинной холинэстеразой). БуХЭ и БеХЭ содержатся в сыворотке крови, печени, почках; они, видимо, играют защитную роль в каких-то особых случаях. Холинэстераза — фермент белковой природы, не содержащий простатической группы. Установлено, что на ее активном центре имеются два активных участка: анионный и эстеразный. Анионный отрицательно заряженный участок образован СОО-радикалом, притягивает положительно заряженную головку ацетилхолина. Эстеразный участок имеет более сложную структуру, образован гидроксилом аминокислоты серина и имидазольным кольцом гистидина (акцептором и донором протона), обеспечивает связь со сложноэфирной группой ацетилхолина и ее разложение (рис. 13). Холинорецепторы представляют собой белковолипидные комплексы, реагирующие с ацетилхолином, воспринимающие нервный импульс и передающие действие на следующий нейрон или эфферентный орган. Предполагают, что в холинорецепторах, как и в холинэстеразе, имеется два активных центра: анионный, притягивающий положительно заряженную головку ацетилхолина, и эстерофильный, реагирующий со сложноэфирной связью ацетилхолина (но не разлагающий ее). При этом наступают изменения холинорецептора и постсинаптической мембраны, деполяризация ее вследствие выхода ионов калия и проникновения ионов натрия. Фармакологическими методами установлено два вида холинорецепторов: М- и Н-холинорецепторы. Мускариночувствительные М-холинорецепторы находятся в синапсах центральной нервной системы, постганглионарных нервных окончаниях парасимпатической нервной системы и симпатических нервных окончаниях потовых желез, они чувствительны к мускарину, блокируются холинолитиками (атропином и др.). Никотиночувствительные Н-х олинорецепторы содержатся в парасимпатических и симпатических ганглиях, где они возбуждаются малыми дозами никотина и угнетаются большими дозами никотина и ганглиоблокаторами, а также в мионевральных синапсах и поперечнополосатой мускулатуре, возбуждаются никотином, блокируются кураре, и в центральной нервной системе, где они блокируются пентафеном. 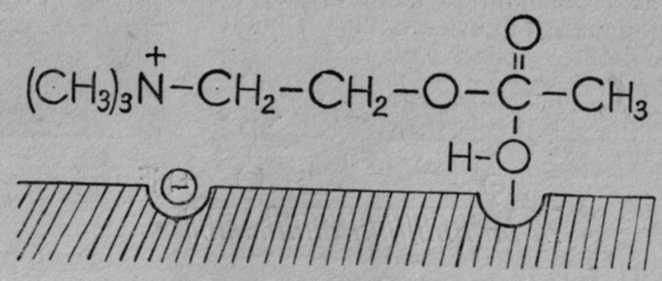 | ||||||||||||||||||||||||||||