синтез аммиака реферат. Надымовой Марины Сергеевны Тема курсовой работы Синтез аммиака в производстве аммиака Содержание пояснительной записки Введение. Сжатое изложение
 Скачать 1.76 Mb. Скачать 1.76 Mb.
|
3.Теоретический анализ1. Термодинамический анализ Синтез аммиака протекает в соответствии со стехиометрическим уравнением: N2 + 3H2 2NH3 Для расчета энергии Гиббса воспользуемся формулой: dG298 = dH298 – T*dS298 Термодинамические константы исходных веществ и продуктов реакции представлены в таблице 1 Термодинамические константы основных участников реакции Таблица 1
Расчет dH298 и dS298 производится по формулам: dH298 = ∑ (dH298)пр. - ∑ (dH298)исх. dS298 = ∑ (dS298)пр. - ∑ (dS298)исх. dH298 = 2*(-46,19) – 0 – 0 = -92,38 кДж/моль Qp = 92,38 кДж/моль, реакция идет с выделением тепла, она экзотермическая. Для смещения равновесия вправо нужно уменьшить температуру. dS298 = 2*192,5 – (191,5 + 3*130,52) = -198,06 Дж/моль*К Температура инверсии: dT = dH298/dS298 = -92380/-198,06 = 466 K С учетом этого температурный интервал расчета энергии Гиббса принимаем 300-600 K. Расчет энергии Гиббса, с учетом выбранного интервала dG(300) = -92380 – 300*(-198,06) = -32,962 кДж/моль dG(350) = -92380 – 350*(-198,06) = -23,059 кДж/моль dG(400) = -92380 – 400*(-198,06) = -13,156 кДж/моль dG(450) = -92380 – 450*(-198,06) = -3,253 кДж/моль dG(500) = -92380 – 500*(-198,06) = 6,650 кДж/моль dG(550) = -92380 – 550*(-198,06) = 16,553 кДж/моль dG(600) = -92380 – 600*(-198,06) = 26,456 кДж/моль График зависимости энергии Гиббса от температуры 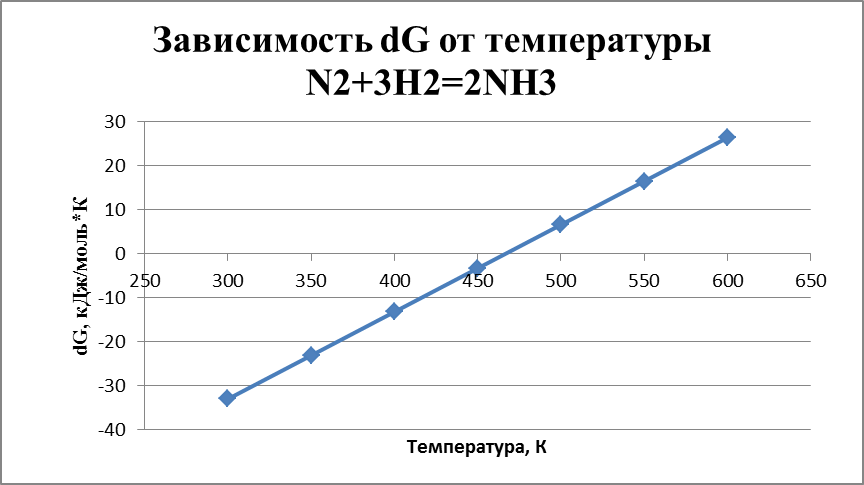 Из полученных расчётов и графика можно сделать вывод, что реакция возможна и вероятность реакции увеличивается с уменьшением температуры. Константа равновесия реакции выражается уравнением: Kp = (PNH3) /( (PN2)*(PH2)3) Зависимость константы равновесия от температуры может быть представлена в виде: dG = -RTlnKp lgKp = (-dG) / (2,3*R*T) Kp = 10-G/2,3RT Значения констант равновесия при различных температурах представлены в таблице 2 Таблица 2
Соотношение реагентов выбирают исходя из требований стехиометрии и максимальной производительности, которая как раз соответствует стехиометрическому соотношению H2:N2=3:1. Tермодинамический анализ синтеза аммиака позволил сделать следующие выводы: 1. В рассматриваемом интервале температур (300-600 К ) термодинамическая вероятность протекания процесса уменьшается с ростом температуры, этот вывод сделали по значения энергии Гиббса и константы равновесия. Реакция экзотермическая, увеличение температуры сместит равновесие в сторону реагентов. 2. Реакция синтеза аммиака протекает с уменьшением объема. По принципу Ле Шателье в условиях равновесия содержание аммиака в смеси будет больше при высоком давлении. 3. Соотношение реагентов соответствует стехиометрическому соотношению H2:N2=3:1. 2.Кинетический анализ процесса Синтез аммиака из азота и водорода протекает с измеримой скоростью только в присутствие твёрдых катализаторов. Катализаторами являются железо, осмий, уран, молибден, вольфрам. В промышленности к катализаторам предъявляются требования: Он должен быть активным в течение длительного времени, Катализатор должен быть стойким к действию примесей, которые могут поступать в колону синтеза аммиака с азотоводородной смесью. В результате исследований было установлено, что катализаторы, состоящие из нескольких вещество, более активны, чем отдельные состоящие их вещества. Особенно активными и дешёвыми являются железные катализаторы, активированные некоторыми металлами. Очень высокой активностью обладает пористое железо, полученное восстановлением магнитного смешанного оксида железа Fe3O4 при температурах 570-670 К. При температурах синтеза аммиака происходит рост кристаллов железа, вследствие чего уменьшается количество неуравновешенных атомов железа (наличие энергетического поля, которое создаётся этими атомами, и определяет каталитическую активность железа) и уменьшается поверхность катализатора, что приводит к снижению его активности. Чтобы поддерживать активность катализатора вводят активаторы (промоторы), например оксид алюминия, оптимальное количество в сплаве с железом составляет 2-4%. Дальнейшее увеличение содержания оксида не целесообразно т.к. оксид алюминия не участвует в реакции синтеза аммиака, но может задержать на поверхности катализатора уже образовавшийся аммиак. Поэтому вводят дополнительно оксид калия, который способствует удалению с поверхности катализатора аммиака в газовый объем. Гетерогенный - каталитический синтез аммиака имеет сложный механизм, который может быть описан следующими стадиями: 1. молекулы азота реагируют с атомами железа, образуя нитриды FeN; 2. молекулы водорода, взаимодействуя на поверхности катализатора с нитридами железа, образуя ряд промежуточных соединений FexNH, FexNH2, FexNH3; 3. десорбция аммиака; 4. диффузия продукта реакции (аммиака) в газовую фазу. Исследование кинетики и механизма реакции позволило сделать вывод: лимитирующей стадией процесса является хемосорбция азота. Скорость обратимой реакции получения аммиака из элементов на большинстве известных катализаторов описывается уравнением Темкина-Пыжева: 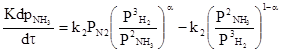 где k1 и k2 - константы скоростей образования и разложения аммиака; PN2, PH2, PNH3 - парциальные давления азота, водорода, аммиака. α – постоянная, удовлетворяющая неравенству 0<α<1 и характеризующая степень покрытия поверхности катализатора азотом. При проведении процесса при атмосферном давлении α промышленных катализаторов в интервале температур 400-500̊ С равна 0,5. По уравнению скорости реакции можно сделать вывод, что при увеличении парциальных давлений исходных веществ, скорость прямой реакции увеличивается. На процесс синтеза аммиака значительное влияние оказывает давление. Однако общее давление газовой смеси не является эффективным давлением процесса синтеза. Эффективное давление – это давление, при котором показатели синтеза (выход продукта, скорость) являются максимальными. Значение эффективного давления зависит от содержания инертных примесей(инерты) (например, аргон, метан) в газе: Р=Р(1- i)2, Где, Р - общее давление синтеза, МПа, i – содержание инертных примесей в газе, об. доли. Инерты снижают парциальные давления реагентов, что негативно влияет на скорость. Растворимость аргона в жидком аммиаке примерно в 2 раза, а метана – в 3,5 раза больше растворимости водорода. Поэтому для увеличения выхода продукта синтеза необходимость убирать примеси. Но наличие примесей влияет не только на выход синтеза. По расчетным данным С.П.Челобовой, Т.А.Аксельрод, В.И.Гагановой, с увеличением концентрации инертных примесей в циркуляционном газе до 10%, производительность 1 м3 катализатора при 30 МПа снижается в 1,43 раза, а при 50 МПа – в 1,3 раза. Инерты препятствуют образованию активированных комплексов железа и азота, и молекулам водорода нужно дольше диффундировать, чтобы «найти» активированные комплексы, что уменьшает скорость процесса. Инертные примеси частично растворяются в конденсирующемся аммиаке. Однако снижение их концентрации вследствие растворимости недостаточно для того, чтобы инертные примеси не накапливались в циркулирующей азотоводородной смеси. Поэтому часть циркуляционного газа необходимо удалять из цикла путём продувки (продувочные газы). При установившимся процессе количество инертных примесей, удаляемых из цикла, равно их количеству, поступающему в цикл со свежим газом. Объём азотоводородной смеси, которая должна быть выведена на 1 т получаемого аммиака, с учетом растворимости инертных газов в жидком аммиаке определяется по уравнению: Vпр=(iсвVсв-iр):iц Где Vпр- объём продувочных газов, м3/т NH3; iсв- концентрация инертных примесей в свежей азотоводородной смеси, доли единицы; Vсв- объём свежей азотоводородной смеси, необходимой для производства 1 т аммиака, м3/т, iр - объём инертных примесей растворённых в аммиаке, м3/т; iц - концентрация инертных примесей в циркуляционном газе, доли единицы. С учетом количество продувочных газов и газов, растворяющихся в жидком аммиаке, расход свежей азотоводородной смеси на выработку 1 т аммиака достигает 2800-2900 м3(теоретически необходимое количество смеси составляет 2633 м3). [1] Зависимость константы скорости от температуры определяется уравнением Аррениуса. k=A*exp(-E/RT) Обратимые экзотермические реакции нужно проводить в соответствии с линией оптимальных температур. В этом случае оптимальной является не какая-то одна температура, а температурная последовательность. Для приближения процесса к линии оптимальных температур (ЛОТ) необходимо начинать процесс при высокой температуре, а затем, по мере увеличения X, температуру необходимо снижать. Для этого в колонне синтеза предусмотрена подача холодного байпасного газа после каждого слоя катализатора. После этого Х уменьшается и температура тоже, соединив максимум полученных кривых, получаем линию оптимальных температур. 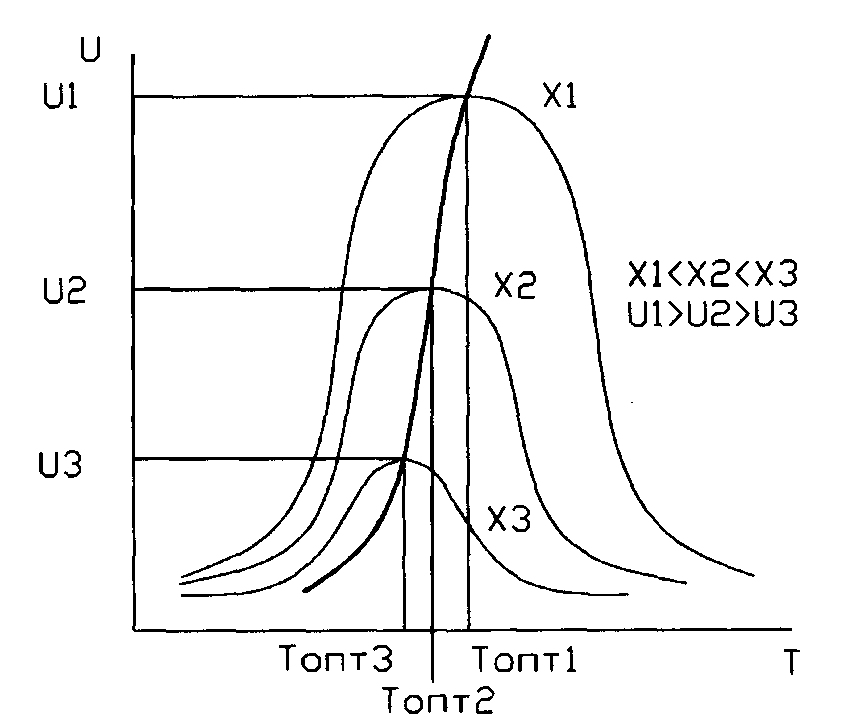 Рисунок 3. Линия оптимальных температур. По данным кинетического анализа, можно сделать следующие выводы. 1)Скорость реакции синтеза аммиака зависит от температуры, давления и состава реакционной смеси. 2) С ростом давления наблюдаемая скорость процесса увеличивается. 3) С повышением содержания аммиака, скорость реакции падает и наоборот с повышением концентрации исходных веществ скорость возрастает. 4)Лимитирующей стадией является хемосорбция азота. Следовательно, скорость реакции зависит от содержания в системе азота. 5)На синтез большое влияние оказывает наличие примесей в исходной смеси. Накапливаясь в циркулирующей смеси, они влияют на эффективное давление и полноту протекания процесса. Поэтому часть циркуляционного газа необходимо удалять из цикла путём продувки. 6) Синтез аммиака нужно проводить в соответствии с линией оптимальных температур. Вывод теоретического анализа: Выход продукта синтеза аммиака зависит от многих параметров технологического режима: давление, температура, времени соприкосновения с катализатором, состава газовой смеси. По теоретическому анализу можно сделать следующие выводы: Синтез аммиака нужно проводить при высоком давлении (увеличивается равновесный выход, повышается скорость синтеза). Конденсация аммиака из газовой смеси также облегчается при высоких давлениях. Однако расход энергии на компрессию увеличивается и повышается требования к машинам, аппаратам и арматуре. При пониженных давлениях упрощается аппаратное оформление процесса, снижается расход энергии на компрессию, но увеличиваются энергозатраты на циркуляцию газа и выделение аммиака. Процесс проводят в присутствии катализатора. Лимитирующая стадия процесса хемосорбция азота, поэтому катализатор должен иметь высокую удельную активную поверхность, а так же хорошо восстанавливаться. Любое изменение соотношения H2:N2 содействует изменению давления в системе газа, температуры в зоне катализа, содержание аммиака в выходящем из реактора газе, поэтому соотношение придерживают оптимальным H2 : N2 = 3 : 1. Анализируя кинетическое уравнение Темкина-Пыжова, видим, что скорость прямой реакции обратно пропорциональна парциальному давлению аммиака, а для обратной реакции характерна прямая пропорциональность. Таким образом, с повышением содержания аммиака общая скорость реакции падает. Реакция синтеза аммиака обратимая, поэтому полного превращения азота и водорода в аммиак за время их однократного прохождения через аппарат не происходит. Для более полного использования реагентов необходима их многократная циркуляция через колонну синтеза. Синтез аммиака нужно проводить в соответствии с линией оптимальных температур. На синтез большое влияние оказывает наличие примесей в исходной смеси. Поэтому часть циркуляционного газа необходимо удалять из цикла путём продувки. | |||||||||||||||||||||||||||||||||||||||
