Реферат по генетике. Кузнецова Дарья Лд 19-01(2 подгруппа) Генетика. Нарушение при биосинтезе белка
 Скачать 97.27 Kb. Скачать 97.27 Kb.
|
|
ГОСУДАРСТВЕННОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «ЧИТИНСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ» Сообщение По дисциплине: «Генетика человека с основами медицинской генетики» на тему «Нарушение при биосинтезе белка». Выполнил: студентка II курса Лд-19-01 Кузнецова Д.Е. Проверил преподаватель: Шокпарова Е.С. Чита, 2020 Обеспечение организма белками из нескольких источников определяет разнообразную этиологию нарушений белкового обмена. Последние могут носить первичный или вторичный характер. Одной из наиболее частых причин общих нарушений белкового обмена является количественная или качественная белковая недостаточность первичного (экзогенного) происхождения. Дефекты, связанные с этим, обусловлены ограничением поступления экзогенных белков при полном или частичном голодании, низкой биологической ценностью пищевых белков, дефицитом незаменимых аминокислот (валина, изолейцина, лейцина, лизина, метионина, треонина, триптофана, фенилаланина, гистидина, аргинина). При некоторых заболеваниях нарушения белкового обмена могут развиваться в результате расстройства переваривания и всасывания белковых продуктов (при гастроэнтеритах, язвенном колите), повышенного распада белка в тканях (при стрессе, инфекционных болезнях), усиленной потери эндогенных белков (при кровопотерях, нефрозе, травмах), нарушения синтеза белка (при гепатитах). Следствием указанных нарушений часто является вторичная (эндогенная) белковая недостаточность с характерным отрицательным азотистым балансом. При длительной белковой недостаточности резко нарушается биосинтез белков в различных органах, что ведет к патологическим изменениям обмена веществ в целом. Белковая недостаточность может развиться и при достаточном поступлении белков с пищей, но при нарушении белкового обмена. Она может быть обусловлена: нарушением расщепления и всасывания белков в ЖКТ; замедлением поступления аминокислот в органы и ткани; нарушением биосинтеза белка; нарушением промежуточного обмена аминокислот; изменением скорости распада белка; патологией образования конечных продуктов белкового обмена. Нарушения расщепления и всасывания белков. В пищеварительном тракте белки расщепляются под влиянием протеолитических ферментов. При этом, с одной стороны, белковые вещества и другие азотистые соединения, входящие в состав пищи, теряют свои специфические особенности, с другой стороны, из белков образуются аминокислоты, из нуклеиновых кислот — нуклеотиды и т.д. Образовавшиеся при переваривании пищи или находившиеся в ней азотсодержащие вещества с небольшой молекулярной массой подвергаются всасыванию. Различают первичные (при различных формах патологии желудка и кишечника — хронических гастритах, язвенной болезни, раке) и вторичные (функциональные) расстройства секреторной и всасывательной функции эпителия в результате отека слизистой оболочки желудка и кишечника, нарушения переваривания белков и всасывания аминокислот в желудочно-кишечном тракте. Основные причины недостаточного расщепления белков заключаются в количественном уменьшении секреции соляной кислоты и ферментов, снижении активности протеолитических ферментов (пепсина, трипсина, химотрипсина) и связанном с этим недостаточным образованием аминокислот, уменьшении времени их воздействия (ускорение перистальтики). Так, при ослаблении секреции соляной кислоты снижается кислотность желудочного сока, что ведет к уменьшению набухания пищевых белков в желудке и ослаблению превращения пепсиногена в его активную форму — пепсин. В этих условиях часть белковых структур переходит из желудка в двенадцатиперстную кишку в неизмененном состоянии, что затрудняет действие трипсина, химотрипсина и других протеолитических ферментов кишечника. Дефицит ферментов, расщепляющих белки растительного происхождения, ведет к непереносимости злаковых белков (риса, пшеницы и др.) и развитию целиакии. Недостаточное образование свободных аминокислот из пищевых белков может происходить в случае ограничения поступления в кишечник сока поджелудочной железы (при панкреатите, сдавлении, закупорке протока). Недостаточность функции поджелудочной железы ведет к дефициту трипсина, химотрипсина, карбоангидразы А, Б и других протеаз, воздействующих на длинные полипептидные цепи или расщепляющих короткие олигопептиды, что снижает интенсивность полостного или пристеночного пищеварения. Недостаточное действие пищеварительных ферментов на белки может возникнуть вследствие ускоренного прохождения пищевых масс по кишечнику при усилении его перистальтики (при энтероколитах) либо уменьшении площади всасывания (при оперативном удалении значительных участков тонкого кишечника). Это ведет к резкому сокращению времени контакта содержимого химуса с апикальной поверхностью энтероцитов, незавершенности процессов энзиматического распада, а также активного и пассивного всасывания. Причинами нарушения всасывания аминокислот являются повреждение стенки тонкого кишечника (отек слизистой оболочки, воспаление) или неравномерное по времени всасывание отдельных аминокислот. Это ведет к нарушению (дисбалансу) соотношения аминокислот в крови и синтеза белка в целом, поскольку незаменимые аминокислоты должны поступать в организм в определенных количествах и соотношениях. Чаще всего имеет место нехватка метионина, триптофана, лизина и других аминокислот. Помимо общих проявлений нарушения аминокислотного обмена, могут быть специфические нарушения, связанные с отсутствием конкретной аминокислоты. Так, недостаток лизина (особенно в развивающемся организме) задерживает рост и общее развитие, понижает содержание в крови гемоглобина и эритроцитов. При недостатке в организме триптофана возникает гипохромная анемия. Дефицит аргинина приводит к нарушению сперматогенеза, а гистидина — к развитию экземы, отставанию в росте, угнетению синтеза гемоглобина. Кроме того, недостаточное переваривание белка в верхних отделах желудочно-кишечного тракта сопровождается усилением перехода продуктов его неполного расщепления в толстый кишечник и ускорением процесса бактериального расщепления аминокислот. В результате увеличивается образование ядовитых ароматических соединений (индола, скатола, фенола, крезола) и развивается общая интоксикация организма этими продуктами гниения. Замедление поступления аминокислот в органы и ткани. Всосавшиеся из кишечника аминокислоты поступают непосредственно в кровь и частично в лимфатическую систему, представляя собой запас разнообразных азотистых веществ, которые затем участвуют во всех видах обмена. В норме аминокислоты, всосавшиеся в кровь из кишечника, циркулируют в крови 5 — 10 мин и очень быстро поглощаются печенью и частично другими органами (почками, сердцем, мышцами). Увеличение времени этой циркуляции указывает на нарушение способности тканей и органов (в первую очередь печени) поглощать аминокислоты. Поскольку ряд аминокислот является исходным материалом при образовании биогенных аминов, задержка их в крови создает условия для накопления в тканях и крови соответствующих протеиногенных аминов и проявления их патогенного действия на различные органы и системы. Повышенное содержание в крови тирозина способствует накоплению тирамина, который участвует в патогенезе злокачественной гипертонии. Длительное повышение содержания гистидина ведет к увеличению концентрации гистамина, что способствует нарушению кровообращения и проницаемости капилляров. Кроме того, повышение содержания аминокислот в крови проявляется увеличением их выведения с мочой и формированием особой формы нарушений обмена — аминоацидурии. Последняя может быть общей, связанной с повышением концентрации в крови нескольких аминокислот, или избирательной — при увеличении содержания в крови какой-либо одной аминокислоты. Нарушение синтеза белков. Синтез белковых структур в организме является центральным звеном метаболизма белка. Даже небольшие нарушения специфичности биосинтеза белка могут вести к глубоким патологическим изменениям в организме. Среди причин, вызывающих нарушения синтеза белка, важное место занимают различные виды алиментарной недостаточности (полное, неполное голодание, отсутствие в пище незаменимых аминокислот, нарушение количественных соотношений между незаменимыми аминокислотами, поступающими в организм). Если, например, в тканевом белке триптофан, лизин, валин содержатся в равных соотношениях (1:1:1), а с пищевым белком эти аминокислоты поступают в соотношении (1:1:0,5), то синтез тканевого белка будет обеспечиваться при этом только наполовину. При отсутствии в клетках хотя бы одной из 20 незаменимых аминокислот прекращается синтез белка в целом. Нарушение скорости синтеза белков может быть обусловлено расстройством функции соответствующих генетических структур, на которых происходит этот синтез (транскрипция ДНК, трансляция, репликация). Повреждение генетического аппарата может быть как наследственным, так и приобретенным, возникшим под влиянием различных мутагенных факторов (ионизирующего излучения, ультрафиолетового облучения и др.). Нарушение синтеза белка могут вызывать некоторые антибиотики. Так, ошибки в считывании генетического кода могут возникнуть под влиянием стрептомицина, неомицина и некоторых других антибиотиков. Тетрациклины тормозят присоединение новых аминокислот к растущей полипептидной цепи. Митомицин угнетает синтез белка за счет алкилирования ДНК (образование прочных ковалентных связей между ее цепями), препятствуя расщеплению нитей ДНК. Одной из важных причин, вызывающих нарушение синтеза белков, может явиться нарушение регуляции этого процесса. Интенсивность и направленность белкового обмена регулируют нервная и эндокринная системы, действие которых заключается, вероятно, в их влиянии на различные ферментные системы. Клинический и экспериментальный опыт показывают, что отключение органов и тканей от ЦНС приводит к местному нарушению процессов обмена в денервированных тканях, а повреждение ЦНС вызывает расстройства белкового обмена. Удаление коры головного мозга у животных ведет к снижению синтеза белка. Соматотропный гормон гипофиза, половые гормоны и инсулин оказывают стимулирующее воздействие на синтез белка. Наконец, причиной патологии синтеза белка может стать изменение активности ферментных систем клеток, участвующих в биосинтезе белка. В крайне выраженных случаях речь идет о блокировке метаболизма, представляющей собой вид молекулярных расстройств, составляющих основу некоторых наследственных заболеваний. Результатом действия всех перечисленных факторов является обрыв или снижение скорости синтеза как отдельных белков, так и белка в целом. Выделяют качественные и количественные нарушения биосинтеза белков. О том. какое значение могут иметь качественные изменения биосинтеза белков в патогенезе различных заболеваний, можно судить на примере некоторых видов анемий при появлении патологических гемоглобинов. Замена только одного аминокислотного остатка (глутамина) в молекуле гемоглобина на валин приводит к тяжелому заболеванию — серповидноклеточной анемии. Особый интерес представляют количественные изменения в биосинтезе белков органов и крови, приводящие к сдвигу соотношений отдельных фракций белков в сыворотке крови — диспротеинемии. Выделяют две формы диспротеинемий: гиперпротеинемия (увеличение содержания всех или отдельных видов белков) и гипопротеинемия (уменьшение содержания всех или отдельных белков). Так, ряд заболеваний печени (цирроз, гепатит), почек (нефрит, нефроз) сопровождаются выраженным уменьшением содержания альбуминов. Ряд инфекционных заболеваний, сопровождающихся обширными воспалительными процессами, ведет к увеличению содержания γ-глобулинов. Развитие диспротеинемии сопровождается, как правило, серьезными сдвигами в гомеостазе организма (нарушением онкотического давления, водного обмена). Значительное уменьшение синтеза белков, особенно альбуминов и γ-глобулинов, ведет к резкому снижению сопротивляемости организма к инфекции, снижению иммунологической устойчивости. Значение гипопротеинемии в форме гипоальбуминемии определяется еще и тем, что альбумин образует более или менее прочные комплексы с различными веществами, обеспечивая их транспорт между различными органами и перенос через клеточные мембраны при участии специфических рецепторов. Известно, что соли железа и меди (чрезвычайно токсичные для организма) при pH сыворотки крови трудно растворимы и транспорт их возможен только в виде комплексов со специфическими белками сыворотки (трансферрином и церулоплазмином), что предотвращает интоксикацию этими солями. Около половины кальция удерживается в крови в форме, связанной с альбуминами сыворотки. При этом в крови устанавливается определенное динамическое равновесие между связанной формой кальция и его ионизированными соединениями. При всех заболеваниях, сопровождающихся снижением содержания альбуминов (заболевания почек) ослабляется и способность регулировать концентрацию ионизированного кальция в крови. Кроме того, альбумины являются носителями некоторых компонентов углеводного обмена (гликопротеиды) и основными переносчиками свободных (неэстерифицированных) жирных кислот, ряда гормонов. При поражении печени и почек, некоторых острых и хронических воспалительных процессах (ревматизме, инфекционном миокардите, пневмонии) в организме начинают синтезироваться особые белки с измененными свойствами или несвойственные норме. Классическим примером болезней, вызванных наличием патологических белков, являются болезни, связанные с присутствием патологического гемоглобина (гемоглобинозы), нарушения свертывания крови при появлении патологических фибриногенов. К необычным белкам крови относятся криоглобулины, способные выпадать в осадок при температуре ниже 37 °С, что ведет к тромбообразованию. Появление их сопровождает нефроз, цирроз печени и другие заболевания. Патология промежуточного белкового обмена (нарушение обмена аминокислот). Основные пути промежуточного обмена белка — это реакции переаминирования, дезаминирования, амидирования, декарбоксилирования, переметилирования, пересульфирования. Центральное место в промежуточном обмене белков занимает реакция переаминирования, как основной источник образования новых аминокислот. Нарушение переаминирования может возникнуть в результате недостаточности в организме витамина В6. Это объясняется тем, что фосфорилированная форма витамина В6 — фосфопиридоксаль — является активной группой трансаминаз — специфических ферментов переаминирования между амино- и кетокислотами. Беременность, длительный прием сульфаниламидов тормозят синтез витамина В6 и могут послужить причиной нарушения обмена аминокислот. Патологическое усиление реакции переаминирования возможно в условиях повреждения печени и инсулиновой недостаточности, когда значительно увеличивается содержание свободных аминокислот. Наконец, снижение активности переаминирования может произойти в результате угнетения активности трансаминаз из-за нарушения синтеза этих ферментов (при белковом голодании) либо нарушения регуляции их активности со стороны некоторых гормонов. Так, тирозин (незаменимая аминокислота), поступающий с белками пищи и образующийся из фенилаланина, частично окисляется в печени до фумаровой и ацетоуксусной кислот. Однако это окисление тирозина совершается только после его переампнирования с α-кетоглутаровой кислотой. При белковом истощении переаминирование тирозина заметно ослаблено, вследствие этого нарушено его окисление, что приводит к увеличению содержания тирозина в крови. Накопление тирозина в крови и выделение его с мочой могут быть связаны и с наследственно обусловленным дефектом тирозинаминотрансферазы. Клиническое состояние, развивающееся в результате этих нарушений, известно под названием «тирозиноз». Для болезни характерны цирроз печени, рахитоподобные изменения костей, геморрагии, поражения канальцев почек. Процессы переаминирования аминокислот тесно связаны с процессами окислительного дезаминирования. в ходе которого происходит ферментативное отщепление аммиака от аминокислот. Дезаминирование определяет образование конечных продуктов белкового обмена и вступление аминокислот в энергетический обмен. Ослабление дезаминирования может возникнуть вследствие нарушения окислительных процессов в тканях (гипоксии, гиповитаминозов С, РР, В2). Однако наиболее резкое нарушение дезаминирования наступает при понижении активности аминооксидаз либо вследствие ослабления их синтеза (диффузное поражение печени, белковая недостаточность), либо в результате относительной недостаточности их активности (увеличение содержания в крови свободных аминокислот). Вследствие нарушения окислительного дезаминирования аминокислот происходит ослабление мочевинообразования, повышение концентрации аминокислот и увеличение выведения их с мочой (аминоацидурия). Промежуточный обмен ряда аминокислот совершается не только в форме переаминирования и окислительного дезаминирования, но и путем их декарбоксилирования (потеря СO2 из карбоксильной группы) с образованием соответствующих аминов, получивших название «биогенные амины». Так, при декарбоксилировании гистидина образуется гистамин, тирозина — тирамин, 5-гидрокситриптофана — серотонин и т.д. Все эти амины биологически активны и оказывают выраженное фармакологическое действие на сосуды. Если в норме они образуются в малых количествах и довольно быстро разрушаются, то при нарушении декарбоксилирования складываются условия для накопления в тканях и крови соответствующих аминов и проявления их токсического действия. Причинами нарушения процесса декарбоксилирования могут служить усиление активности декарбоксилаз, торможение активности аминооксидаз и нарушение связывания аминов белками. Изменение скорости распада белка. Белки организма постоянно находятся в динамическом состоянии: в процессе непрерывного распада и биосинтеза. Нарушение условий, необходимых для реализации этого подвижного равновесия, также может привести к развитию обшей белковой недостаточности. Обычно полупериод существования разных белков колеблется в пределах от нескольких часов до многих суток. Так, биологическое время уменьшения наполовину альбумина человеческой сыворотки составляет около 15 сут. Величина этого периода в значительной степени зависит от количества белков в пище: при уменьшении содержания белков он увеличивается, а при увеличении — уменьшается. Значительное увеличение скорости распада белков тканей и крови наблюдается при повышении температуры организма, обширных воспалительных процессах, тяжелых травмах, гипоксии, злокачественных опухолях, что связано либо с действием бактериальных токсинов (в случае инфицирования), либо со значительным увеличением активности протеолитических ферментов крови (при гипоксии), либо токсическим действием продуктов распада тканей (при травмах). В большинстве случаев ускорение распада белков сопровождается развитием в организме отрицательного азотистого баланса в связи с преобладанием процессов распада белков над их биосинтезом. Патология конечного этапа белкового обмена. Основными конечными продуктами белкового обмена являются аммиак и мочевина. Патология конечного этапа белкового обмена может проявляться нарушением образования конечных продуктов либо нарушением их выведения. 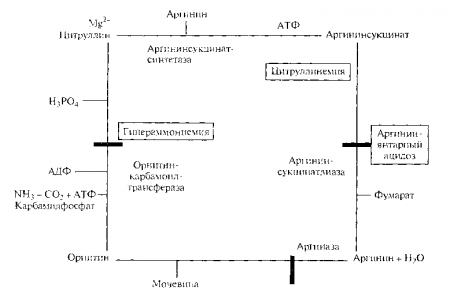 Рис. 9.3. Схема нарушения синтеза мочевины Связывание аммиака в тканях организма имеет большое физиологическое значение, так как аммиак обладает токсическим эффектом прежде всего в отношении центральной нервной системы, вызывая ее резкое возбуждение. В крови здорового человека его концентрация не превышает 517 мкмоль/л. Связывание и обезвреживание аммиака осуществляется при помощи двух механизмов: в печени путем образования мочевины, а в других тканях — путем присоединения аммиака к глутаминовой кислоте (посредством аминирования) с образованием глутамина. Основным механизмом связывания аммиака является процесс образования мочевины в цитруллин-аргининорнитиновом цикле (рис. 9.3). Нарушения образования мочевины могут наступить в результате снижения активности ферментных систем, участвующих в этом процессе (при гепатитах, циррозе печени), обшей белковой недостаточности. При нарушении мочевинообразования в крови и тканях накапливается аммиак и увеличивается концентрация свободных аминокислот, что сопровождается развитием гиперазотемии. При тяжелых формах гепатитов и цирроза печени, когда резко нарушена ее мочевинообразовательная функция, развивается выраженная аммиачная интоксикация (нарушение функции центральной нервной системы с развитием комы). В основе нарушения образования мочевины могут лежать наследственные дефекты активности ферментов. Так, увеличение концентрации аммиака (аммониемия) в крови может быть связано с блокированием карбамил-фосфатсинтетазы и орнитинкарбомо-илтрансферазы. катализирующих связывание аммиака и образование орнитина. При наследственном дефекте аргининсукцинатсинтетазы в крови резко увеличивается концентрация цитруллина, в результате с мочой экскретируется цитруллин (до 15 г в сутки), т.е. развивается цитруллинурия. В других органах и тканях (мышцы, нервная ткань) аммиак связывается в реакции амидирования с присоединением к карбоксильной группе свободных дикарбоновых аминокислот. Главным субстратом служит глутаминовая кислота. Нарушение процесса амидирования может происходить при снижении активности ферментных систем, обеспечивающих реакцию (глутаминаза), или в результате интенсивного образования аммиака в количествах, превосходящих возможности его связывания. Другим конечным продуктом белкового обмена, образующимся при окислении креатина (азотистое вещество мышц), является креатинин. Нормальное суточное содержание креатинина в моче составляет около 1—2 г. Креатинурия — повышение уровня креатинина в моче — наблюдается у беременных женщин и у детей в период интенсивного роста. При голодании, авитаминозе Е, лихорадочных инфекционных заболеваниях, тиреотоксикозе и других заболеваниях, при которых наблюдаются нарушения обмена в мышцах, креатинурия свидетельствует о нарушении креатинового обмена. Другая общая форма нарушения конечного этапа белкового обмена возникает при нарушении выведения конечных продуктов белкового обмена при патологии почек. При нефритах происходит задержка мочевины и других азотистых продуктов в крови, остаточный азот увеличивается и развивается гиперазотемия. Крайней степенью нарушения экскреции азотистых метаболитов является уремия. При одновременном поражении печени и почек возникает нарушение образования и выделения конечных продуктов белкового обмена. Наряду с общими нарушениями белкового обмена при белковой недостаточности могут возникать и специфические нарушения в обмене отдельных аминокислот. Например, при белковой недостаточности резко ослабляется функция ферментов, участвующих в окислении гистидина, а функция гистидиндекарбоксилазы, в результате действия которой из гистидина образуется гистамин, не только не страдает, но, наоборот, усиливается. Это влечет за собой значительное увеличение образования и накопления в организме гистамина. Состояние характеризуется поражением кожи, нарушением сердечной деятельности и функции желудочно-кишечного тракта. Особое значение для медицинской практики имеют наследственные аминоацидопатии, число которых на сегодня составляет около 60 различных нозологических форм. По типу наследования почти все они относятся к аутосомно-рецессивным. Патогенез обусловлен недостаточностью того или иного фермента, осуществляющего катаболизм и анаболизм аминокислот. Общим биохимическим признаком аминоаиидопатий служит ацидоз тканей и аминоацидурия. Наиболее частыми наследственными дефектами обмена являются четыре вида энзимопатии, которые связаны между собой общим путем метаболизма аминокислот: фенилкетонурия, тирозинемия, альбинизм, алкаптонурия. |
