Тесты. 4.1.5. Розчини ВМС. Навчальнометодичний посібник до практичних занять для студентів фармацевтичного факультету спеціальностей фармація і технологія парфумернокосметичних засобів
 Скачать 2.98 Mb. Скачать 2.98 Mb.
|
|
З термодинамічної точки зору розчинення полімеру, як будь-який мимовільний процес, повинен протікати із зменшенням вільної енергії системи (G < 0). Оскільки G = Н – TS, то зменшення вільної енергії сприяють наступні дві умови: Н < 0 (зменшення ентальпійного фактору) та S > 0 (збільшення ентропійного фактору). Розчинення полярного полімеру в полярному розчиннику (неполярного - у неполярному) найчастіше супроводжується зменшенням внутрішньої енергії системи, так як розчинення йде з виділенням теплоти (Н <0) внаслідок гідратації (сольватації) макромолекул полімеру. Ентропія розчинення високомолекулярних речовин завжди в багато разів вище ентропії розчинення низькомолекулярних речовин. Це пояснюється характерними особливостями хімічної будови макромолекул полімерів. Довгі гнучкі макромолекули можуть приймати в розчині безліч конформацій, які мало різняться між собою по внутрішній енергії. Відомо, що стан системи, якого можна домогтися більшим числом микростанів, має більшу термодинамічну ймовірністю W і, отже, характеризується відповідно до рівняння: S=klnW більш високою ентропією. Оскільки в розчині число можливих конформацій гнучких макромолекул набагато більше, ніж у твердому полімері, то розчинення полімеру супроводжується значним збільшенням ентропії. Ентропійний фактор особливо важливий для неполярних полімерів з гнучкими молекулами (каучук, полівінілацетат). Для таких полімерів збільшення ентропії забезпечує дотримання умови G < 0 навіть при збільшенні ентальпійного фактора (Н > 0). У макромолекулах полярних ВМС, зазвичай володіють жорсткими ланцюгами (полівініловий спирт, білки), число можливих конформацій в розчині зменшується, внаслідок чого для цих полімерів зростає значення ентальпійного фактора, тобто гідратація макромолекул. З вище сказаного випливає, що освіта розчинів ВМС супроводжується зменшенням вільної енергії Гіббса. Отже, процес розчинення в даному випадку йде мимовільно і утворений розчин буде термодинамічно стійкий. Процес розчинення ВМС протікає мимовільно, але протягом тривалого часу, і йому часто передує набухання полімеру в розчиннику. Полімери, макромолекули яких мають симетричну форму, можуть переходити в розчин, заздалегідь не набухаючи. Наприклад, гемоглобін, печінковий крохмаль - глікоген при розчиненні майже не набухають, а розчини цих речовин не володіють високою в'язкістю навіть при порівняно великих концентраціях. У той час, як речовини з сильно асиметричними витягнутими молекулами при розчиненні дуже сильно набухають (желатин, целюлоза, натуральні і синтетичні каучуки). Набрякання і розчинення полімерів Набрякання - це збільшення маси і об'єму полімеру за рахунок проникнення молекул розчинника в просторову структуру ВМС. Причиною набрякання є велика різниця в розмірах молекул розчиняється речовини і розчинника і, як наслідок цього, велика відмінність в швидкостях їх дифузії. Тому при набуханні спочатку відбувається практично одностороння дифузія молекул розчинника в просторову сітку полімеру , що має ту ж природу, що і осмос розчинника в осмотичну клітинку через пори напівпроникною мембрани. Обидва процеси викликаються прагненням системи до вирівнювання концентрацій компонентів. Механізм набухання зводиться до проникнення молекул розчинника в найближчі шари полімеру і сольватації відповідних ділянок полімерного ланцюга . У результаті цього макромолекули « розрихлюються » , що полегшує подальше проникнення молекул розчинника і збільшення маси і об'єму полімеру . Розрізняють два види набрякання: необмежену, що закінчується повним розчиненням ВМС (наприклад, набрякання желатини у воді, каучуку у бензолі, нітроцелюлози в ацетоні) і обмежене, що приводить до утворення набряклого полімеру - драглі (наприклад, набрякання целюлози у воді , желатину у холодній воді, вулканізованого каучуку у бензолі). Драглі являють собою просторову сітку, що складається з пов'язаних між собою макромолекул полімеру та заповнену молекулами розчинника. Ступінь обмеженості процесу набухання і можливість самовільного розчинення визначаються співвідношенням енергії зв'язку в решітці полімеру і енергії сольватації полімерного ланцюга з урахуванням ентропійного фактора. Весь процес набухання і розчинення ВМС можна умовно розділити на ряд стадій (мал. 2). 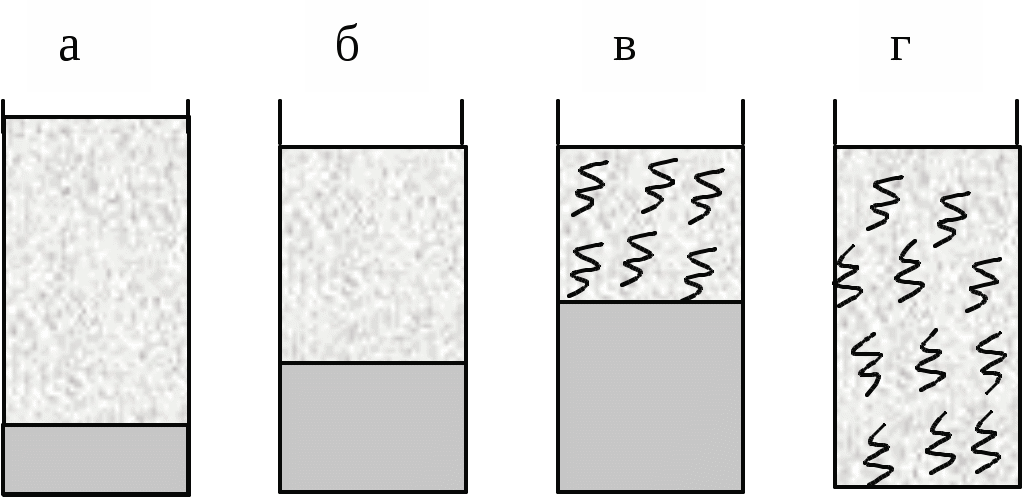 Мал. 2. Послідовні стадії (а - г) розчинення ВМС у низькомолекулярній рідині На початковій стадії (мал. 1а ) система складається з двох компонентів: полімеру і низькомолекулярної рідини. Перехід аб характеризується інтенсивним проникненням молекул низькомолекулярної рідини в структуру полімеру і сольватацією полімерного ланцюга , що супроводжується виділенням теплоти (Н < 0). Зміна ентропії у порівнянні з ентальпійного фактором незначно. При цьому обсяг полімеру зростає, але загальний об'єм системи полімер- розчинник зменшується. Це явище називається контракцією, а виділення теплоти говорить про фізико-хімічної природі процесу. Перехід бв являє собою початковий етап розподілу макромолекул полімеру по всьому об'єму розчинника і характеризується зростанням ентропії системи внаслідок зростання числа можливих конформацій. Ентальпія системи якщо і змінюється, то незначно. На даному етапі відбувається зазвичай основне збільшення обсягу і маси полімеру. Це результат подальшого проникнення молекул розчинника в полімерну сітку, її розпушення і пов'язане з цим часткове звільнення макромолекул. Окремі макромолекули починають відриватися один від одного і переходити в шар низькомолекулярної рідини. Обмежене набрякання закінчується на стадії б або в утворенням драглів. Подальший розвиток процесу - необмежене набрякання - призводить до розчинення полімеру, тобто утворенню розчину ВМС (мал.1г ). Перехід вг відбувається в результаті сил дифузії і характеризується значним збільшенням ентропії системи. При цьому макромолекули ВМС рівномірно розподіляються по всьому об'єму низькомолекулярного розчинника, утворюючи справжній розчин. Так як розчинення полімерів головним чином обумовлено зростанням ентропії, то і стійкість розчинів ВМС пояснюється в основному ентропійним фактором. Набрякання і, отже, розчинення ВМС залежать від природи розчинника і полімеру, будови макромолекул полімеру, температури, присутності електролітів, а також від рН середовища (для поліелектролітів ). Процеси набрякання і розчинення ВМС є селективними процесами. Іншими словами для утворення розчину ВМС необхідно його спорідненість з розчинником (ліофільність). Неполярні полімери добре набухають (розчиняються ) в неполярних розчинниках ( каучук в бензолі або бензині) і не набухають у полярних. Полярні полімери краще набухають (розчиняються) в полярних рідинах (білок у воді) і не набухають у неполярних. Зважаючи спорідненості полімеру з розчинником, при набряканні і розчиненні велика частина розчинника "пов'язується " в сольватні (гідратні) оболонки. Особливо це характерно для полярних макромолекул у водному середовищі. І оскільки макромолекули володіють великою поверхнею, то для необмеженого набрякання (розчинення) навіть у ліофільної системі потрібна достатня кількість рідини. Інакше процес набрякання може зупиниться на стадії обмеженого набрякання, тобто освіти холодцю. Істотну роль у набуханні грає будова макромолекул полімеру. Наприклад, полімери з довгими жорсткими ланцюгами і великою кількістю полярних груп добре набрякають, але не розчиняються навіть у відповідному розчиннику (целюлоза у воді). Якщо полімер розчиняється в рідини не досить добре , то також утворюються драглі. Температура на ці процеси впливає відповідно до принципу Ле Шательє. Оскільки набухання супроводжується виділенням теплоти на першому етапі, то з підвищенням температури ступінь набрякання, а так само розчинність полімеру, зменшуються. На другій стадії набрякання може стати ендотермічним процесом. Отже, в цьому випадку набрякання із зростанням температури збільшується. Наприклад, якщо в холодній воді желатину набухає обмежено, то з підвищенням температури - необмежена, тобто розчиняється. При охолодження отриманого розчину знову утворюється холодець. Проте швидкість набухання (розчинення) полімерів з збільшенням температури зростає через збільшення швидкості дифузії. Кількісною мірою набрякання є ступінь набухання α, яка може мати об`ємний оба масовий вираз: α = (V-Vₒ)/Vₒ або α = (m-mₒ)/mₒ, де: α - ступінь набухання; V0 і V, m0 і m - відповідно обсяги і маси вихідного полімеру і того, який набух. Набряканняможе бутиобмеженим і необмеженим. У першому випадку α досягає постійної граничної величини (наприклад, набухання желатину у воді при кімнатній температурі), у другому - значення m і α проходять через максимум, після якого полімер поступово розчиняється (наприклад, желатин у гарячій воді). У цьому випадку набухання є початковою стадією розчинення.  Мал. 3 Криві обмеженого (1) і необмеженого (2) набрякання Процес набухання включає дві стадії. На першій стадії відбувається виділення теплоти набухання, і спостерігається контракція системи, при цьому «α» не досягає високих значень. Друга стадія майже не супроводжується контракції і виділенням теплоти, але характеризується збільшенням «α» та обсягу набухає полімеру. На першій стадії відбувається специфічне взаємодія ВМС і низькомолекулярного розчинника з виділенням теплоти (∆Н <0), а ΔS ≈ 0 або навіть ΔS <0 (у тих випадках, коли сольватація призводить до збільшення жорсткості ланцюга полімеру). Однак | ∆Н |> | T ΔS | і ΔG <0. Процес набухання на першій стадії визначається ентальпійного (енергетичним ефектом). На другій стадії теплота майже або зовсім не виділяється (∆ Н ≈ 0), але зате зростає ентропія, оскільки розпушення сітки і пов'язане з ним часткове звільнення макромолекул збільшує число їх конформацій: ТΔS> 0 і-ТΔS <0. Таким чином, друга стадія набрякання обумовлена збільшенням ентропійного ефекту. Обмежене набухання зазвичай закінчується на другій стадії. Необмежене набрякання приводить до розчинення полімеру. Одним з факторів, що впливає на процес набрякання і розчинення полімерів, є ступінь полярності ланок полімеру і молекул розчинника. Якщо полярності ланок ланцюга і молекул розчинника близькі між собою, то набрякання і розчинення таких полімерів відбувається відносно легко. Другим чинником, що сприяє цим процесам, є гнучкість ланцюгів полімеру, так як процес розчинення пов'язаний з відділенням кіл один від одного і дифузією їх в розчиннику. Обмеженість або необмеженість набухання визначаються співвідношенням енергій зв'язків у полімері з енергією сольватації і ентропійним фактором. У лінійних і розгалужених полімерах молекули пов'язані ван-дер-ваальсовимі силами, енергія цих зв'язків невелика, тому енергія сольватації і ентропійний чинник вже при кімнатній температурі перевищують їх. За таких умов набрякання йде необмежено. Якщо між ланцюгами полімеру є хімічні зв'язки, то для їх розриву недостатньо буває енергії сольватації і ентропійного фактору. Набрякання протікає обмежено, і полімер перетворюється у студень. Необхідно відзначити, що студень можна отримати і конденсацією макромолекул з розчину ВМС. В основі процесу набрякання лежить сольватація макромолекулярних ланцюгів. Про сольватаційний механізм набрякання свідчать виділення теплоти набухання і контракція. У той час як при набуханні обсяг полімеру завжди збільшується, обсяг всієї системи (полімер + розчинник) зазвичай зменшується. Це особливо видно при набуханні полярних полімерів в полярних розчинниках. Причиною контракції є упорядкована орієнтація молекул розчинника в сольватних шарах. Набрякання, як і сольватація, специфічно, так як полімер набрякає в розчиннику, відповідному його природі. У процесі набрякання відбувається одностороння дифузія молекул розчинника в полімер. Це пояснюється тим, що великі макромолекули, пов'язані в надмолекулярних структури, практично не можуть переходити в розчинник, а малі і добре дифундуючі молекули розчинника легко проникають в полімер, збільшуючи його об'єм. При набряканні окремі молекул и надмолекулярних структур сольватуються, міжмолекулярні взаємодії значно слабшають, внаслідок чого стає можливою дифузія макромолекул в розчинник.  Мал. 4. Взаємодія розчинника з полімером: 1 - міжструктурні набрякання; 2 - внутрішньоструктурне набрякання; 3 - розчинення Певне значення в процесах набрякання і розчинення ВМС має молярна маса полімеру, оскільки з подовженням ланцюгів енергія взаємодії між ними зростає і для відділення їх одного від одного потрібно більше енергії. Чим вище молярна маса полімеру, тим важче він розчиняється. Ступінь набухання полімеру і його здатність до розчинення залежать від гнучкості полімерних ланцюгів. Так, волокна незрілого колагену (в якому ще не встановили поперечні ковалентні «зшивання») досить добре набухають і можуть переходити в розчин, тоді як волокна зрілого колагену нерозчинні. Експериментально встановлено, що на набухання біополімерів аніони роблять більший вплив, ніж катіони. Причому одні аніони посилюють набрякання, а інші послаблюють. Оскільки аніони гідратуются більше, ніж катіони, то останні впливають на набухання цих полімерів несуттєво. Аніони за ступенем впливу на набухання білків розташовуються в ліотропний ряд (ряд Гоффмейстера): CNSIBrNO3 ClCH3COOSO42-. Аніони, розташовані до хлорид-іона, посилюють набухання у спадному порядку. Хлорид займає близьке до нейтрального положення, а наступні аніони зменшують набухання. Іони CNS-посилюють набухання внаслідок того, що слабо гідратуючись, вони добре адсорбуються на макромолекулах ВМС. А Вплив концентрації водневих іонів і солей на набухання знайшло велике практичне застосування, наприклад під час дублення шкір, у варінні целюлози та ін. На швидкість набрякання впливає ступінь подрібнення ВМС. При подрібненні збільшується загальна поверхня речовини, завдяки чому прискорюється проникнення низькомолекулярної рідини всередину ВМС. Вплив віку: чим свіже (молодше) ВМС, тим більше ступінь і швидкість набрякання. На інтенсивність процесу набрякання окрім температури, тиску, присутності електролітів, впливає також і величина pH середовища. Вплив рН середовища на набрякання добре вивчений для білків. Молекула білка має електричний заряд, обумовлений майже виключно дисоціацією йоногенних груп Схематично дисоціацію цих груп білка, враховуючи гідратацію аміногруп, можна представити так: 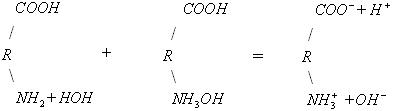 Заряд білкової молекули в нейтральному середовищі визначається співвідношенням кількості вільних груп – У кислому середовищі білок заряджається позитивно: 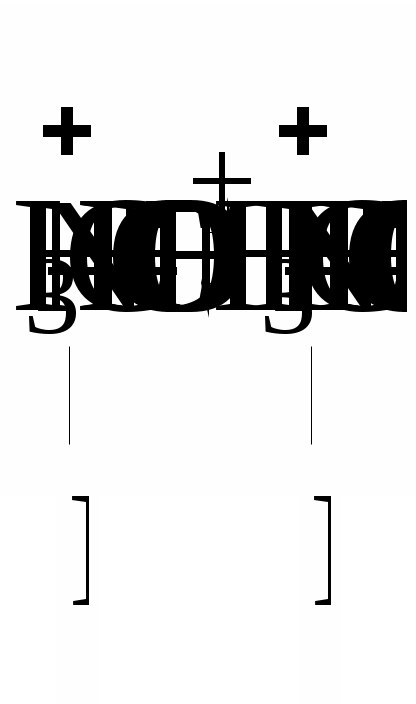 або а в лужному середовищі - негативно: 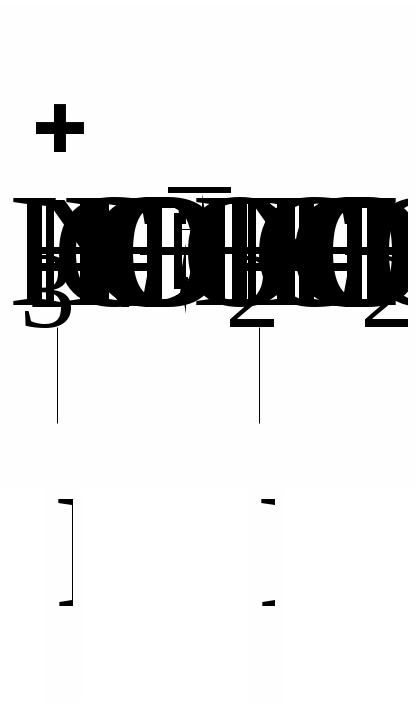 або Таким чином, заряд білка залежить від реакції середовища, а також від співвідношення кількості його карбоксильних і аміногруп і їх ступенів дисоціації. Значення pH, при якому білок знаходиться в ізоелектричному стані, тобто в стані, при якому число різнойменних зарядів у білкової частці однаково і її загальний заряд дорівнює нулю, називається ізоелектричної точкою даного білка. Більшість природних білків містить значну кількість (25-30%) дикарбонових амінокислот (глутамінової та аспарагінової) і, отже, відносяться до кислих білків. Існує і відносно невелика група основних білків з перевагою аміногруп за рахунок підвищеного (до 80%) вмісту діаміновой кислот (лізину, цитрулліна). ІЕС кислих білків лежить в слабокислою (рН = 4,6 - 4,8), основних у слаболужною середовищі (рН = 8,5 - 8,6). ІЕС пепсину шлункового соку спостерігається при рН = 2.0, меланоцитів (гормону гіпофіза свині) - при рН = 11,0. В ІЕС гнучка макромолекула згортається в щільний клубок у силу тяжіння різнойменних зарядів. У лужному середовищі пригнічена дисоціація аміногруп і молекула білка набуває негативний заряд; в кислому - позитивний. У результаті того, що по довжині макромолекули з'являються однойменно заряджені групи, молекула розпрямляється, і щільність молекулярного білка зменшується як в кислому, так і в лужному середовищі. Але в надлишку через високу концентрацію іонів і зменшення ступеня дисоціації білка макромолекули знову будуть згортатися в більш щільний клубок. 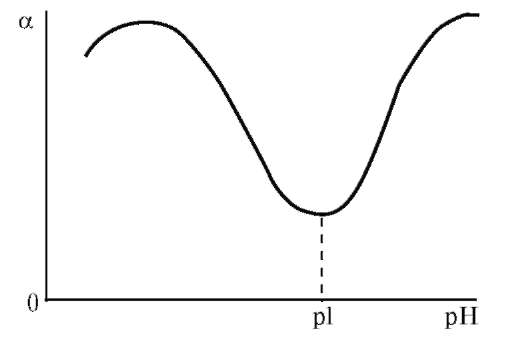 Мал. 5. Залежність ступеня набухання білка від pH середовища Зі зміною форми макромолекул пов'язана зміна в'язкості розчинів, так як молекули в розгорнутому стані чинять найбільший опір потоку і надають розчинів високу в'язкість. А найбільш щільні молекулярні клубки відповідають найменшою в'язкості розчинів. З малюнка 5, на якому представлена залежність відносної в'язкості розчину желатину від рН, видно, що найменша в'язкість спостерігається при рН = 4,7. З віддаленням від ІЕТ в обидві сторони в'язкість розчину зростає, так як макромолекули розпрямляються. Однак при високій кислотності і лужності в'язкість знову починає падати, оскільки молекули знову згортаються в клубок. В ізоелектричній точці набрякання мінімальне, оскільки ступінь гідратації йоногенних груп найменша. Зміна рН в кислу або лужну ділянку відносно ізоелектричної точки призводить до зростання ступеня набрякання. Це пояснюється тим, що поява електричного заряду посилює ступінь гідратації макромолекул, а також збільшує силу електростатичного відштовхування між ними. У ізоелектричному стані властивості розчинів білків різко змінюються, при цьому вони мають, наприклад, найменшу в'язкість, погану розчинність, що пов'язано із зміною форми макромолекул. При значенні рН, близькому до ізоелектричної точці, різнойменно заряджені групи –NH3+ і –СОО- притягуються один до одного і нитка закручується в спіраль. При зсуві рН середовища від ізоелектричної точки однойменно заряджені групи відштовхуються і ланцюг випрямляється. Молекули ВМС в розгорнутому стані надають розчинів більш високу в'язкість, ніж молекули ВМС, згорнуті в спіраль або клубок . Виникнення електричного заряду в стані, відмінному від ізоелектричного, обумовлює електрофоретична рухливість білків. Напрямок руху макромолекул білків в електричному полі (до катода або анода) залежить від значення pH. Білки, як і всі амфоліти, мають певну величину ізоелектричної точки. У таблиці наведені значення ізоелектричної точок деяких найбільш поширених білків. Ізоелектрична точка деяких білків
Описані закономірності використовуються в електрофоретичному методі аналізу білків. За допомогою електрофорезу можна розділити на окремі фракції складні суміші білків. Методи визначення ІЕТ 1. За електрофоретичної рухливості. Досліджуваний білок піддають електрофорезу в буферних розчинах з різним значенням рН. У буфері, рН якого збігається з ІЕТ даного білка, переміщення білка до електродів не буде. 2. За ступенем коагуляції. У пробірки наливають буферні розчини з різним значенням рН, потім туди вносять різні кількості досліджуваного білка і додають спирт. Найбільш виражене помутніння відбудеться в пробірці з буфером, рН якого відповідає ІЕТ. 3. За швидкістю желатинування. У пробірки наливають буферні суміші з різним значенням рН і додають концентрований розчин досліджуваного білка. Желатинування швидше за все відбудеться в розчині, рН якого найближче до ІЕТ. 4. За величиною набухання. Однакова кількість сухого білка насипають в ряд пробірок, туди ж наливають рівні об'єми буферних розчинів з різним значенням рН. Найменшим набухання білка опиниться в пробірці, де рН середовища буде найближче до ІЕТ. Для висолювання або желатинування білків доцільно переводити їх у ізоелектричному стані. Цього можна досягти, помістивши білки в буферний розчин із значенням рН, рівним їх ІЕТ. В інших випадках, наприклад, потрібно, щоб вони навпаки мали достатній заряд. Для цього білкову суміш поміщають в буферні розчини із значенням рН, що відрізняється від ІЕТ. Набрякання полімерів супроводжується виникненням тиску, який має назву тиск набрякання (5105–10105 Па). Механізм його виникнення подібний до механізму виникнення осмотичного тиску. Осмотичний тиск розчинів ВМС Осмотичний тиск розчинів низькомолекулярних і високомолекулярних речовин визначається теоретично рівнянням Вант-Гоффа: Росм. = CRT, Осмотичний тиск можна представити виразом і по іншому: Росм. де: С - концентрація розчиненої речовини в г / л, М - молярна маса розчиненої речовини. Таким чином, перше рівняння можна використовувати для визначення молярних мас. Розглянемо систему, в якій розчин, що містить 20 г гемоглобіну в 1 л, поміщений у правий посудину, а чиста вода - в лівий, відділений від правого напівпроникною мембраною (мал. 6). Після досягнення рівноваги висота стовпа води в правому посудині на 7,78 см перевищує висоту в лівому посудині.  Мал. 6. Схема приладу для демонстрації осмотичного тиску З підвищенням концентрації ВМС (крім глобулярних полімерів) їх осмотичний тиск перестає підкорятися закону Вант-Гоффа і росте швидше (мал. 6). Причиною відхилень від закону Вант-Гоффа є відносна незалежність теплового руху окремих сегментів лінійних макромолекул ВМС. Кожна макромолекула веде себе як сукупність декількох молекул меншого розміру. Це і проявляється у збільшенні осмотичного тиску. Для розрахунку осмотичного тиску розчинів ВМС Галлер запропонував рівняння: Росм. де: С - концентрація розчину ВМС, г/л; М - молярна маса ВМС, г / моль; - коефіцієнт, що враховує гнучкість і форму макромолекули в розчині. Коефіцієнт залежить від природи розчинника і розчиненої речовини, але не залежить від молярної маси розчиненої полімеру. Зі збільшенням довжини макромолекули і розгалуженості ланцюга величина зростає. Збільшення ефективного числа рухомих одиниць (кінетично активних одиниць) в розчині враховується додатковим доданком С2. При невеликих концентраціях полімеру значення доданка невелике і рівняння Галлера переходить в рівняння Вант-Гоффа. Рівняння Галлера можна перетворити в рівняння прямої, розділивши обидві частини його на С: 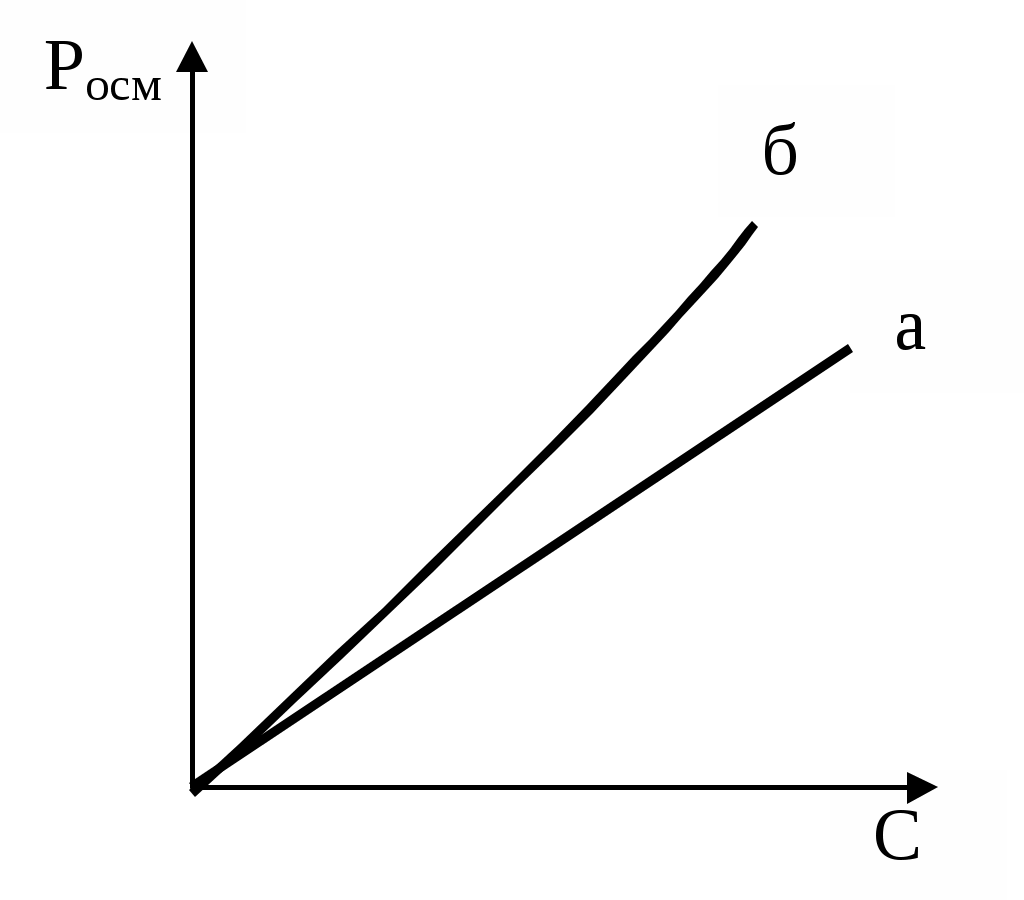 Мал.7. Залежність осмотичного тиску від концентрації розчину ВМС: а - теоретична крива у відповідності з рівнянням Вант-Гоффа; б - експериментальна крива. Вимірявши осмотичний тиск розчинів з різною концентрацією С, можна побудувати графічну залежність величини Росм./С від С і знайти значення молярної маси М полімеру і коефіцієнта (мал.8). 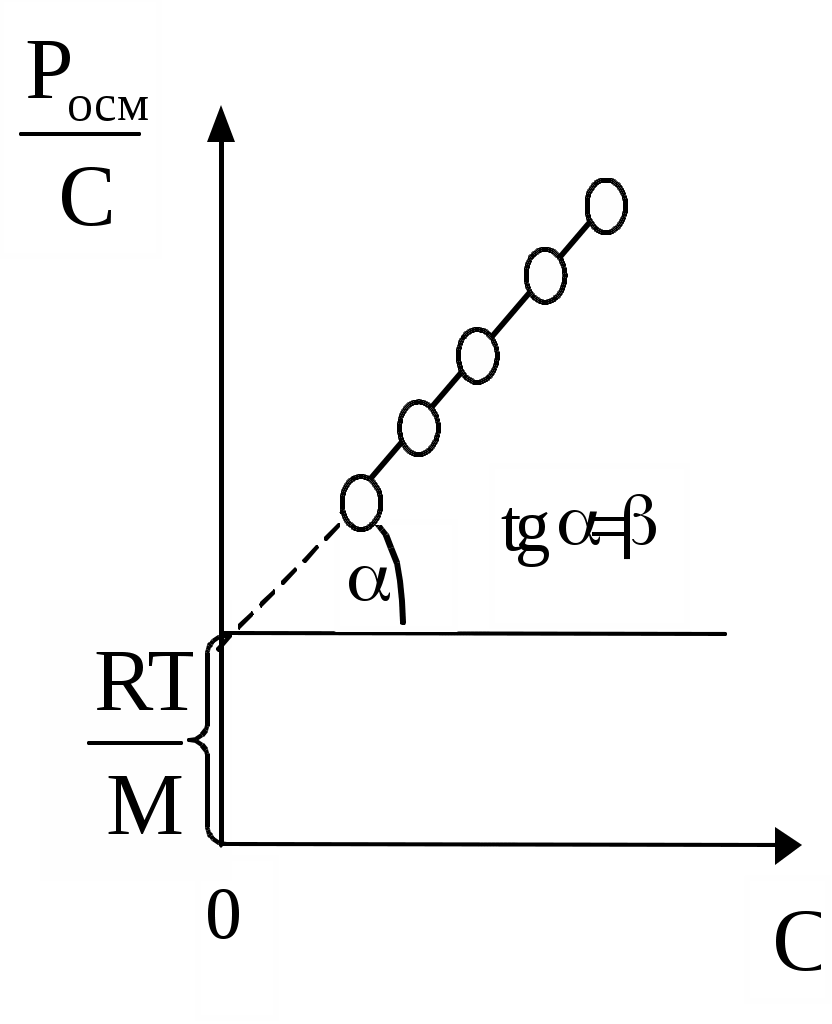 Мал.8. Графік залежності Росм/С від концентрації С. Осмометричним методом звичайно користуються для визначення молярних мас ВМС в інтервалі від 10000 до 70000 г/моль. Нижня межа залежить від властивостей мембран, а верхній визначається тією чутливістю, при якій можна вимірювати осмотичний тиск. Похибка результатів вимірювань осмотичного тиску розчинів ВМС може бути пов'язано з присутністю в розчині низькомолекулярних електролітів. Щоб запобігти впливу останніх, розчин ВМС попередньо діалізу. Слід зауважити, що молярні маси ВМС не можна визначити традиційним кріоскопічним методом. Це пояснюється тим, що розбавлені розчини ВМС в загальному випадку не підкоряються закону Рауля. Тому, крім описаного вище осмометричного методу розроблені й інші методи визначення молярних мас ВМС: хімічний, віскозіметричний, методи седиментації і світлорозсіювання розчинів, метод гель-фільтрації, електрофоретичні і т.д. Жоден з перерахованих методів не є універсальним, так як кожен з них можна застосовувати тільки при певному діапазоні молярних мас полімерів. Мембранна рівновага Доннана Будь яка рідина організму містить одинакові кількості позитивно та негативно заряджених йонів. Відомо, що осмотичний тиск у клітині вище, чим в позаклітинній рідини. Підвищення осмотичного тиску в клітині у порівнянні з позаклітинною рідиною Ф. Доннан пояснив за допомогою йоної рівноваги по обидві сторони клітинної мембрани. Мембранним рівновагою Доннана (ефект Доннана) називають рівновагу, яка установлюється в системі розчинів, розділених мембраною, непроникною хоча б для одного виду присутніх у системі іонів. Затримуваний мембраною іон називається недіалізуючі. Присутність такого іона призводить до нерівномірного розподілу іонів по обидві сторони мембрани при рівноважному стані системи. Нехай ліворуч від мембрани знаходиться білок у вигляді солі RNa, де R - аніон, що має колоїдні розміри і не проходить через мембрану. Справа знаходиться розчин NaCl, для іонів якого мембрана проникна: [R–]1 [Na+]1 | [Na+]2 [Cl–]2 [R–]1 [Na+] [Cl–] | [Na+] [Cl–] c1 c1 c2 c2 c1 (c1+x) x (c2 –x) (c2–x) При рівновазі добуток концентрацій дифундуючих іонів по обидві сторони мембрани має бути однаковим. Тоді: (c1 + x) x = (C2 - x)2. Концентрація NaCl в рівноважних розчинах однакова. При c1 >> c2 значення х дуже мало, тобто NaCl практично не переходить через мембрану, і осмотичний тиск визначається тільки поліелектроліти. При c1 << C2 електроліт NaCl рівномірно розподіляється по обидві сторони мембрани. Осмотичний тиск визначається в цьому випадку тільки іонами низькомолекулярного електроліту NaCl і становить половину від осмотичного тиску поліелектроліту. При проміжних співвідношеннях концентрацій у вимірювані значення осмотичного тиску необхідно вводити виправлення, що враховує мембранне рівновагу. З рівноваги Доннана випливає, що білок не здатний дифундувати крізь мембрану, змінює розподіл концентрацій електроліту. Чим більше концентрація білка і чим менше концентрація електроліту в розчині, тим більшою буде різниця у кінцевому розподілі йонів. Таким чином ефект Доннана обумовлює розподіл електролітів у тканинах організму і є причиною виникнення біопотенціалів. Розчини ВМС за своїми властивостями різко відрізняються від розчинів низькомолекулярних сполук: |
