Тесты. 4.1.5. Розчини ВМС. Навчальнометодичний посібник до практичних занять для студентів фармацевтичного факультету спеціальностей фармація і технологія парфумернокосметичних засобів
 Скачать 2.98 Mb. Скачать 2.98 Mb.
|
|
1) Осмотичний тиск розчинів ВМС не підкоряється закону Вант-Гоффа. 2) Швидкість дифузії макромолекул полімеру невелика, вона порівнянна зі швидкістю діффузії типових колоїдних частинок. Для розрахунку коефіцієнта дифузії ВМС застосовано рівняння Ейнштейна: де: В - коефіцієнт тертя дифундуючих частинок даної форми. Для сферичних частинок В = 6πηr. Однак макромолекули ВМС рідко мають форму, близьку до сферичної. 3) Розчини ВМС здатні розсіювати світло, хоча й меншою мірою, ніж типові колоїдні системи. У розчинах ВМС ефект Тіндаля виявляється не зовсім чітко внаслідок того, що показник заломлення сольватованих часток розчиненої речовини n мало відрізняється від показника заломлення розчинника n0, тому різницю (n - n0) > 0, але інтенсивність розсіювання світла розчинами ВМС незначна. З цієї ж причини макромолекули неможливо виявити під ультрамікроскопа. Крім того, макромолекули сумірні з колоїдними частинками тільки по довжині, а в інших напрямках відповідають розмірам звичайних молекул. 4) Розчини ВМС є істинними розчинами, агрегативно стійкими системами. Однак при додаванні електролітів спостерігається виділення високомолекулярних сполук з розчину. Це явище називається висолюванням. 5) Для розчинів ВМС характерне явище коацервації. Коацервація - це поділ системи на дві фази, з яких одна представляє собою розчин ВМС в розчиннику, а інша - розчин розчинника у ВМС, при зміні температури або рН або при вве деніі низькомолекулярних речовин. 6) Для розчинів ВМС характерне явище спонтанного, мимовільного зміни в'язкості при тривалому зберіганні розчинів. Це явище носить назву старіння розчину. Старіння відбувається або в результаті деструкції макромолекул полімеру, або в результаті зв'язування макромолекул. Старіння відбувається під впливом кисню та деяких інших домішок. 7) При збільшенні концентрації розчинів ВМС, зміни температури або при додаванні електроліту можливе утворення просторової сітки, що приводить до утворення холодцю. 8) Розчини ВМС мають високу в'язкість. Тільки дуже розбавлені розчини підчиняються законам Ньютона і Пуазейля. В'ЯЗКІСТЬ РОЗЧИНІВ ВМС Розчини ВМС відрізняються від істинних і колоїдних дуже високою в'язкістю. Навіть розбавлені розчини полімерів мало "текучі в порівнянні з чистими рідинами. В'язкість рідини можна визначити як опір рідини пересуванню одного її шару щодо іншого. Будь-яке переміщення однієї частини рідини відносно іншої гальмується силами тяжіння між її елементами. Інакше кажучи, в'язкість рідини характеризує внутрішнє тертя, що виникає при переміщенні шарів рідини відносно один одного. Велика в'язкість розчинів ВМС пояснюється їх високою гідрофільністю, макромолекули досить сильно пов'язані з молекулами розчинника. Основи теорії в'язкості. При теоретичному розгляді в'язкості рідина представляється у вигляді безструктурної безперервного середовища. Якщо прикласти силу до рідини, вона починає текти. Для рідин характерні два основних типи течії: ламінарне і турбулентний. Ламінарним називають протягом рідини у вигляді паралельних шарів, не перемішується між собою. Таке протягом існує доти, поки величина градієнта швидкості не надто велика. При збільшенні градієнта швидкості шари рідини утворюють завихрення і перемішуються. У таких випадках ламінарний потік переходить в турбулентний і ситуацію важко трактувати як теоретично, так і експериментально. Розглянуті нами закономірності в'язкості будуть ставитися тільки до ламінарного режиму течії. Розглянемо два примикають об'ємних елемента якоїсь рідини. Якщо один з об'ємних елементів переміщається щодо іншого під дією зовнішньої сили, то між ними виникають сили, які будуть перешкоджати такому переміщенню, намагаючись повернути об'ємні елементи в їх становище рівноваги. Ця перешкоджає сила називається силою (F) внутрішнього тертя (опору). 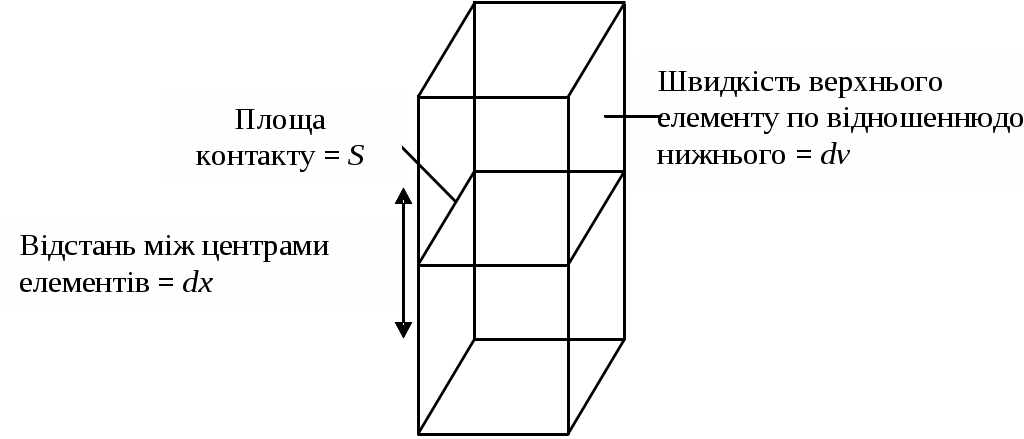 Мал. 9. Визначення коефіцієнта в'язкості . Сила зсуву між двома елементами дорівнює (dv / dx) S, що визначає, таким чином, величину . Щоб визначити в'язкість кількісно, можна скористатися мал. 9. Припустимо, що один з об'ємних елементів рідини, представлених на цьому малюнку, рухається зі швидкістю dv щодо другого елементу. Можна очікувати, що сила тертя буде пропорційна відносної швидкості dv і площі контакту S між сусідніми елементами об'єму. Вона буде обернено пропорційна відстані dx між центрами цих елементів. Константа пропорційності, що зв'язує силу тертя і ці змінні, називається коефіцієнтом в'язкості або просто в'язкістю . Позначивши силу тертя через F, отримаємо: Таким чином, в’язкість дорівнює силі опору між шарами рідини площею 1м2, що знаходиться на відстані 1м один від одного, за градієнта швидкості течії, що дорівнює одиниці. Це визначення в'язкості спочатку дав Ньютон. Воно є мікроскопічним, вираженим через величини, які не можна виміряти. Одиницею в'язкості служить ньютон-секунда на квадратний метр (Н с/м2) або паскаль-секунда (Па с); раніше за одиницю в'язкості брали пуаз: 1 пуаз = 0,1 Па с. Особливості в'язкості розчинів полімерів. Коефіцієнт в'язкості, обчислений за вище наведеним рівнянням, визначається як константа пропорційності і, таким чином, не залежить ні від прикладеного тиску, ні від градієнта швидкості (в умовах рівномірного ламінарного течії). Рідина, що підкоряється закону Ньютона, називається ньютонівської. Розчини ВМС не є такими, оскільки величина їх в'язкості () залежить від градієнта швидкості. Справа в тому, що для розчинів ВМС саме явище течії обумовлює орієнтацію розчинених макромолекул (мал. 10). 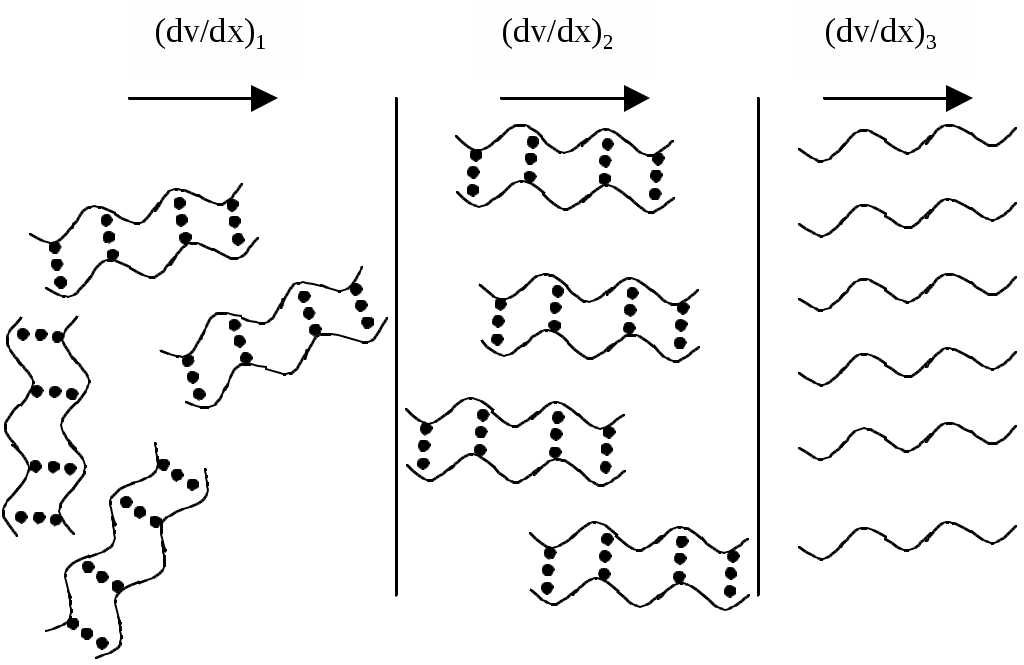 Мал. 10. Зміна структури розчинів ВМС при збільшенні градієнта швидкості. При збільшенні градієнта швидкості макромолекули орієнтуються уздовж осі потоку, у зв'язку з чим в'язкість розчину ВМС знижується і при певних значеннях градієнта швидкості надмолекулярних структури можуть руйнуватися, внаслідок чого розчин придбає властивості ньютонівської рідини. Рідини, що проявляють подібні ефекти орієнтації, називають неньютонівскими. В'язкість розчинів, що містять макромолекули полімеру, зазвичай значно вища в'язкості розчинів низькомолекулярних сполук і колоїдних розчинів тих же концентрацій. Тому тільки дуже розбавлені розчини ВМС в умовах ламінарного течії можна вважати ньютонівськими. Збільшення в'язкості розчину полімеру в порівнянні з в'язкістю розчинника обумовлено не тільки його концентрацією, а й рядом параметрів макромолекули. Такими параметрами є об'єм розчину, займаний макромолекулою (питома обсяг), відношення довжини молекули до її ширини (осьове ставлення), а також жорсткість молекули. Для глобулярних молекул, якими є молекули багатьох білків, принципове значення має молекулярний об'єм. Його можна легко зв'язати з відносною молекулярною масою . У випадку дуже жорстких тонких молекул, як, наприклад, ДНК, основний ефект надає осьовий ставлення; воно також є функцією відносної молекулярної маси. Якщо ж відома відносна молекулярна маса, то існує можливість отримати інформацію про загальну форму молекули. Оскільки вимірювання абсолютної в'язкості ускладнено, частіше визначають відносну в'язкість. При додаванні полімеру до розчинника з в'язкістю 0 в'язкість розчину збільшується до . Ставлення в'язкості розчину до в'язкості чистого розчинника називається відносної в'язкістю отн.: отн. = Відносне підвищення в'язкості розчину ВМС у порівнянні з в'язкістю розчинника називається питомою в'язкістю (уд. ). І вона дорівнює: Відносна і питома в'язкості є безрозмірними величинами і залежать від концентрації полімеру, а також градієнта швидкості. Але їх неможливо пов'язати безпосередньо з параметрами макромолекули (наприклад, з її формою і об'ємом), тому були введені поняття наведеної і характеристичної в’язкості. Питома в'язкість, віднесена до одиниці концентрації, називається наведеної в'язкістю прив.. Її розраховують за формулою: де: С – масова концентрація полімеру, г/см 3. Граничне значення наведеної в'язкості в нескінченно розбавленому розчині назвали внутрішньою чи характеристичною в'язкістю []: Експериментально її визначають шляхом побудови графіка залежності наведеної в'язкості (уд/С) від різних концентрацій полімеру (мал. 11). 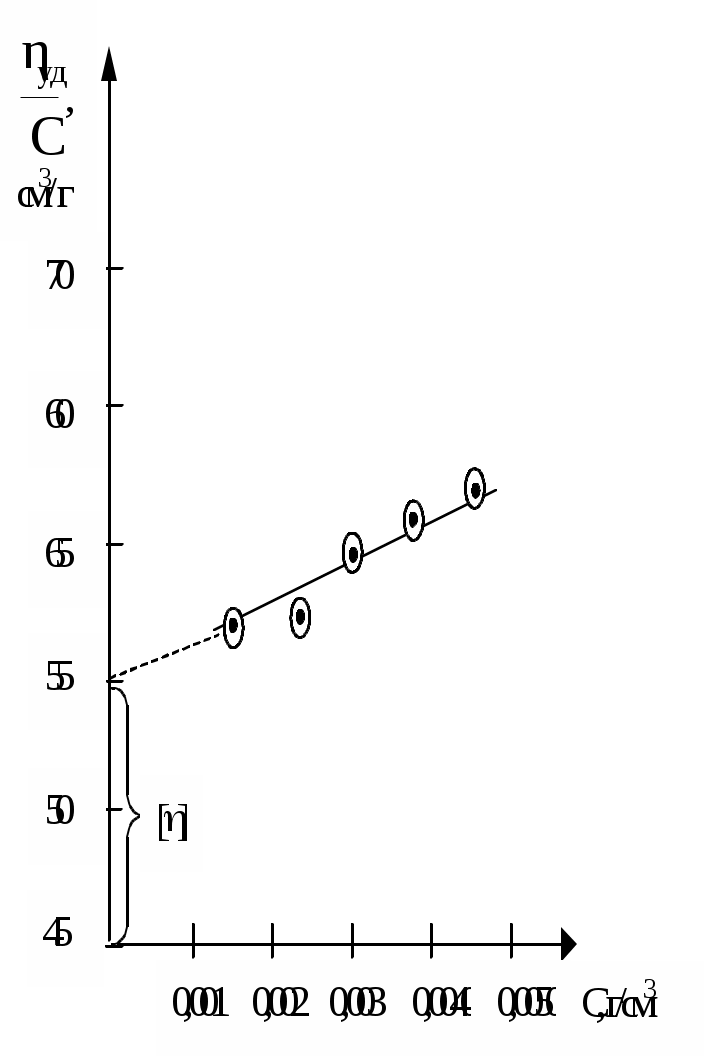 Мал. 11. Графік залежності наведеної в'язкості від концентрації розчину ВМС. Такий графік для досить розбавлених розчинів полімерів носить прямолінійний характер. Екстраполюючи пряму уд./С = f(С) к С=0, на осі ординат відсікають відрізок, який відповідає граничному значенню наведеної в'язкості, тобто характеристичної в'язкості []. Наведена і характеристична в'язкості мають розмірності, зворотні концентрації, тобто см3/м. Характеристична в'язкість характеризує гідродинамічний опір потоку рідини молекул полімеру. Вона залежить від відносної молекулярної маси, форми і питомої обсягу макромолекули, її здатності змінювати форму залежно від природи розчинника (конформаційні зміни), але вона не залежить від концентрації полімеру в розчині і швидкості взаємного переміщення шарів рідини. Залежність в’язкість від різних чинників. В’язкість рідин залежить від багатьох чинників: температури, рН середовища, термін зберігання дисперсної системи, концентрації розчиненої речовини. Вплив рН середовища. Найменшу в’язкість розчини білків мають в ізоелектричній точці. Зі збільшенням та зменшенням рН відносно ізоелектричної точки в’язкість розчинів білків зростає у зв’язку зі зміною структури та появою довгих гнучких макромолекул, які створюють більший гідродинамічний опір. Термін зберігання. Часто в’язкість розчинів полімерів зростає при їх зберіганні. Це зумовлене посиленням утворення асоціатів та внутрішніх структур. Вплив концентрації. Основними факторами, що визначають структуру і реологічні властивості дисперсної системи, є концентрація частинок дисперсної фази і енергія взаємодії частинок. У розведених агрегативностійких дисперсних системах частинки зберігають повну свободу взаємного переміщення. Такі системи відносяться до ньютонівским. Рівняння залежності в’язкості дисперсних систем від концентрації дисперсної фази запропонував А. Ейнштейн. Цей зв'язок висловлюється рівнянням: η = η0 + (1 +α∙φ) де: η0 - в’язкості дисперсійного середовища; α - коефіцієнт форми частинки (дорівнює 2,5 при кулеподібної, сферичній формі); φ – об’ємна концентрація дисперсної фази. Розчини ВМС не підлягають закону Ейнштейна і їх в’язкість завжди більше за теоретично обчислену. Із збільшенням концентрації в’язкість розчинів ВМС зростає в наслідок утворення молекулами полімерів внутрішніх просторових структур. При цьому не спостерігається лінійної залежності від концентрації (мал. 10, крива ІІ), що пов’язано з процесом структурування та збільшення гідродинамічного опору. В’язкість розчинів ВМС не є сталою величиною та може зменшуватись із збільшенням швидкості течії розчину. Це пов’язано із руйнуванням асоціатів, розпрямлянням макромолекул та їх орієнтацією у напрямку течії. Руйнування відносно неміцних структур можна досягти механічним способом, наприклад, перемішуванням, струшуванням. 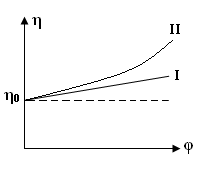 Мал 12. Залежність в'язкості від об'ємної частки дисперсної фази для: I - безструктурної (ньютоновcкой) дисперсної системи; II - структурованої (неньютонівської) дисперсної системи. Отже в'язкості розчинів полімерів не підпорядковується рівнянню Ейнштейна. Розчини ВМС – не ньтонівскі рідини. Вплив температури. З підвищенням температури в’язкість розчинів полімерів звичайно зменшується, тому що збільшується інтенсивність руху молекул, що перешкоджає структуруванню частинок. Така залежність характерна для розчинів полімерів, макромолекули яких мають розгалужену будову. Для полімерів, що містять довгі нерозгалужені ланцюги, в’язкість може збільшуватись, оскільки з підвищенням температури інтенсивний рух макромолекул перешкоджає їх орієнтацію вздовж потоку. Залежність питомої в'язкості не надто концентрованих розчинів полімерів від концентрації зазвичай задовільно описується рівнянням, запропонованим Хаггінсом: ηпит/С= [η] + k1[η]2С, де: ηпит. = (η - η0) / η0 - питома в'язкість; [η] - характеристична в'язкість; С - концентрація розчину, г/100 мл; k1- коефіцієнт званий константою Хаггінса. Коефіцієнт k1 служить характеристикою взаємодії макромолекул в системі полімер - розчинник. Його значення практично не залежить від молярної маси полімеру і змінюється лише в залежності від природи розчинника. У взаємодіючих з ВМС розчинниках, значення константи Хаггінса становить 0,2 - 0,3. Позначення та назви величин, прийняті в віскозиметрії розчинів полімерів
Характеристична в'язкість, що відображає гідродинамічний опір молекул полімеру течії рідини, може бути визначена для розбавлених розчинів полімерів, в яких взаємодією макромолекул можна знехтувати. Для знаходження характеристичної в'язкості встановлюють залежність наведеної в'язкості від концентрації у вузькому інтервалі малих концентрацій і отримані результати екстраполюють до нульової концентрації. 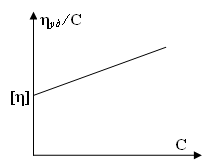 Мал. 13. Графік для визначення характеристичної в'язкості розчину ВМС Співвідношення між характеристичної в'язкістю та відносною молекулярною масою полімеру. Штаудінгер запропонував формулу для визначення відносної молекулярної маси ВМС: уд. = КМС де: уд. – питома в'язкість розчину; К – константа, см3/г; С – концентрація ВМС у розчині, г/см3; М – відносна молекулярна маса ВМС. З попереднього рівняння витикає, що: Іншими словами, відношення питомої в'язкості до концентрації полімеру (тобто приведена в'язкість ) пропорційна його відносній молекулярній масі та не залежить від його концентрації в розчині. При виведенні рівняння питомої в'язкості Штаудінгер припустив, що наведена в'язкість не залежить від концентрації полімеру і що лінійні макромолекули в розчині ведуть себе як жорсткі стержні. Але насправді це не так. Були запропоновані численні емпіричні формули, в яких їх автори намагалися усунути недоліки рівняння Штаудінгера . Найбільш широке застосування знайшло так зване узагальнене рівняння Штаудінгера або рівняння Марка - Хаувінка – Куна: [] = KM де: К та – сталі для даного полімергомологіческого ряду та розчинника. Ці константи зазвичай визначають дослідним шляхом для кожної системи розчинник - розчинена речовина, використовуючи з'єднання з відомою відносною молекулярною масою, тому що до цих пір немає теорії, придатної для їх розрахунку. Константи К і , визначені для даної системи полімер - розчинник, не можна використовувати для іншої системи. Константа К має величину порядку 10–4. У жорстких макромолекул 1, для гнучких полімерних молекул, наближаються за формою до сфери, 0,5, а у сильно заряджених поліелектролітів 2. Рівняння Марка - Хаувінка – Куна можна записати також у наступному вигляді: ln[] = lnK + lnM Дане рівняння є рівнянням прямої в координатах lnM, ln[]. Вимірявши характеристичну в'язкість декількох стандартних препаратів з відомими відносними молекулярними масами і розмістивши відповідні точки в координатах lnM, ln[]- мал. 14, можна переконатися у справедливості даного виразу для даного випадку. Якщо нанесені на графік точки дійсно лежать на одній прямій, то довжина відрізка, що відсікається нею на осі ln[], і тангенс кута її нахилу дають відповідно величини lnK та у наведеній формулі. Тепер не складає труднощів обчислити або визначити безпосередньо за графіком невідому відносну молекулярну масу фракції полімеру, для якої виміряна характеристична в'язкість. 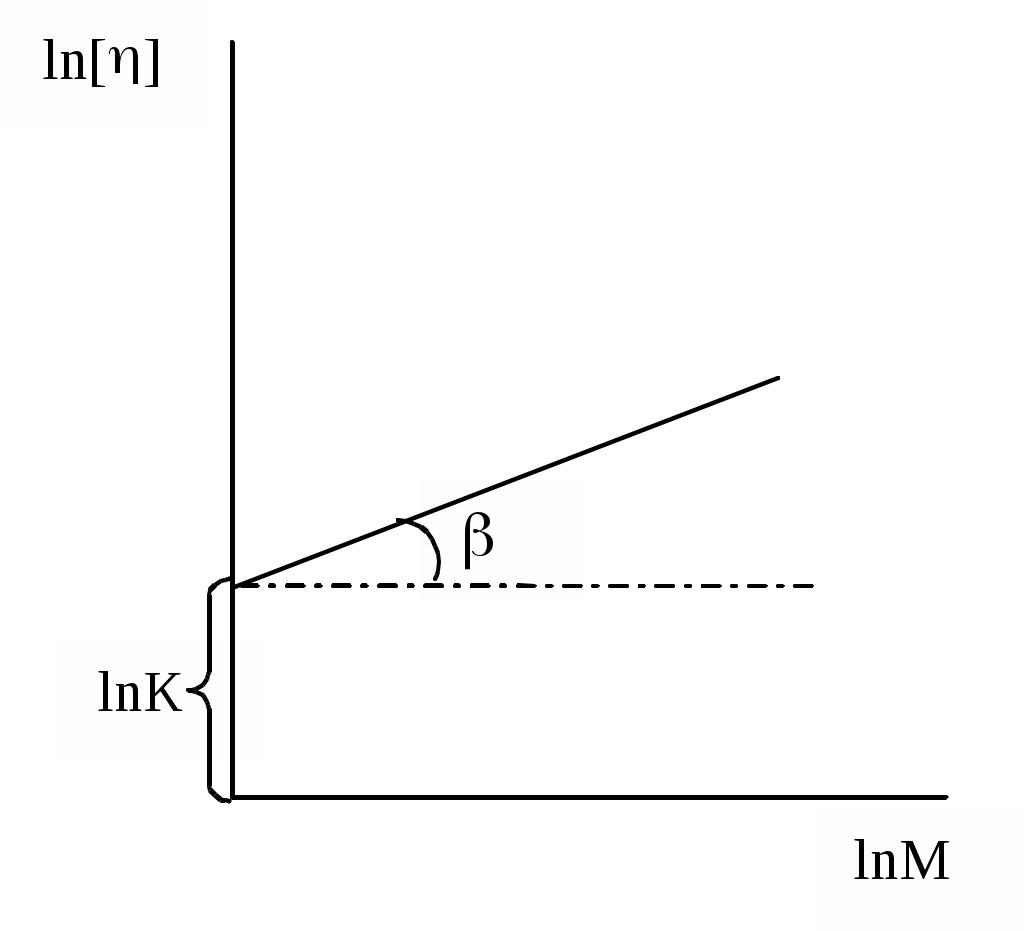 Мал. 14. Залежність характеристичної в'язкості від відносної молекулярної маси фракцій полімергомологічного ряду. |
