Низкомолекулярные пептиды. Низкомолекулярные пептиды Дать характеристику
 Скачать 64.83 Kb. Скачать 64.83 Kb.
|
|
Низкомолекулярные пептиды
Белки – это высокомолекулярные вещества, состоящие из аминокислот, соединенных пептидной связью. Именно белки являются продуктом генетической информации, передаваемой из поколения в поколение, и осуществляют все процессы жизнедеятельности в клетке. В настоящее время условились считать белками полимеры, состоящие из 100 и более аминокислотных остатков, полипептидами – полимеры, состоящие из 50-100 аминокислотных остатков, низкомолекулярными пептидами – полимеры, состоящие из менее 50 аминокислотных остатков. В зависимости от количества остатков они называются дипептиды, трипептиды, тетрапептиды, пентапептиды и т.д. Общие формулы:  И т.д. Традиционно выделяют следующие группы низкомолекулярных пептидов:
α1 – антитрипсин, антихимотрипсин, протромбин, транскортин, переносящий кортикостероиды, переносчик прогестерона, тироксин-переносящий глобулин; α2 – антитромбин, холинэстераза, плазминоген, макроглобулин, связывающий протеиназы и переносящий ионы цинка, ретинол-переносящий белок, витамин D-переносящий белок; β – содержит трансферрин, переносящий железо, церулоплазмин, переносящий медь, фибриноген, глобулин, переносящий половые гормоны, транскобаламин, переносящий витамин В12, С-реактивный протеин, активирующий систему комплемента; γ – фракция иммуноглобулинов. Существуют также глобулины растений, они характеризуются повышенным содержанием аргинина, аспарагина и глутамина и состоят из двух фракций. 7. Склеропротеиды – белки, нерастворимые или ограниченно растворимые в воде, водных растворах нейтральных солей, этаноле и смесях этанола с водой. Это фибриллярные белки (кератины, коллаген, фиброин и другие), они отличаются высокой устойчивостью к химическим реактивам, действию протеолитических ферментов и выполняют в организме структурную функцию. 8. Токсические белки – токсины яда змей, скорпионов, пчел. Они характеризуются очень низкой молекулярной массой. Низкомолекулярные пептиды проявляют все свойства белков и пептидов. Различают физические, химические и биологические свойства пептидов. Физическими свойствами пептидов являются наличие молекулярной массы, двойное лучепреломление (изменение оптической характеристики раствора пептида, находящегося в движении, по сравнению с раствором, находящимся в покое), обусловленное несферической формой пептидов, подвижность в электрическом поле, обусловленная зарядом молекул пептида. Кроме этого для пептидов характерны оптические свойства, заключающиеся в способности вращать плоскость поляризации света, рассеивать световые лучи ввиду значительных размеров пептидных частиц и поглощать ультрафиолетовые лучи. Одним из характерных физических свойств пептидов являются их способность адсорбировать на поверхности молекул, а иногда и захватывать внутрь молекулы, низкомолекулярные органические соединения и ионы. Химические свойства пептидов отличаются исключительным разнообразием, так как для пептидов характерны все реакции аминокислотных радикалов и характерна реакция гидролиза пептидных связей. Имея значительное число кислотных и основных групп, пептиды проявляют амфотерные свойства. В отличие от свободных аминокислот кислотно-основные свойства пептидов обусловлены не α-амино- и α-карбоксигруппами, занятыми в образовании пептидных связей, а заряженными радикалами аминокислотных остатков. Основные свойства пептидов обусловлены остатками аргинина, лизина и гистидина. Кислые свойства обусловлены остатками аспарагиновой и глутаминовой кислоты. Кривые титрования пептидов достаточно сложны для интерпретации, так как в любом пептиде имеется слишком большое число титруемых групп, между ионизированными группами пептида имеются электростатические взаимодействия, на рК каждой титруемой группы оказывают влияние рядом расположенные гидрофобные остатки и водородные связи. Наибольшее практическое применение имеет изоэлектрическая точка пептида – значение рН, при котором суммарный заряд пептида равен нулю. В изоэлектрической точке белок максимально инертен, не перемещается в электрическом поле и имеет наиболее тонкую гидратную оболочку. Пептиди проявляют буферные свойства, но их буферная емкость незначительна. Исключение составляют пептиди, содержащие большое число остатков гистидина. Например, содержащийся в эритроцитах гемоглобин за счет очень высокого содержания остатков гистидина имеет значительную буферную емкость при рН около 7, что весьма важно для той роль, которую играют эритроциты в переносе кровью кислорода и углекислого газа. Для пептидов характерна растворимость в воде, причем с физической точки зрения они образуют истинные молекулярные растворы. Однако для растворов пептидов характерны некоторые коллоидные свойства: эффект Тендаля (явление светорассеяния), неспособность проходить через полупроницаемые мембраны, высокая вязкость, образование гелей. Растворимость пептида сильно зависит от концентрации солей, то есть от ионной силы раствора. В дистиллированной воде пептиди чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов связывается с поверхностью пептида и тем самым уменьшается степень его агрегации. При высокой ионной силе ионы солей забирают гидратную оболочку у молекул пептида, что приводит к агрегации и выпадению пептидов в осадок (явление высаливания). Используя различие в растворимости, можно с помощью обычных солей разделить смесь пептидов. К числу биологических свойств пептидов относят в первую очередь их каталитическую активность. Другое важное биологическое свойство пептидов – их гормональная активность, то есть способность воздействовать на целые группы реакций в организме. Некоторым пептидам присущи токсические свойства, патогенная активность, защитные и рецепторные функции, ответственность за явления клеточной адгезии. Еще одно своеобразное биологическое свойство пептидов – денатурация. Пептиди в их естественном состоянии носят название нативных. Денатурация – это разрушение пространственной структуры пептидов при действии денатурирующих агентов. Первичная структура пептидов при этом не нарушается, но теряется их биологическая активность, а также растворимость, электрофоретическая подвижность и некоторые другие реакции. Радикалы аминокислот, формирующие активный центр пептида, при денатурации оказываются пространственно удаленными друг от друга, то есть разрушается специфический центр связывания пептида с лигандом. Гидрофобные радикалы, обычно находящиеся в гидрофобном ядре глобулярных пептидов, при денатурации оказываются на поверхности молекулы, тем самым создаются условия для агрегации пептидов, которые выпадают в осадок. Реагенты и условия, вызывающие денатурацию пептидов: - температура выше 60оС – разрушение слабых связей в пептиде, - кислоты и щелочи – изменение ионизации ионогенных групп, разрыв ионных и водородных связей, - мочевина – разрушение внутримолекулярных водородных связей в результате образования водородных связей с мочевиной, - спирт, фенол, хлорамин – разрушение гидрофобных и водородных связей, - соли тяжелых металлов – образование нерастворимых солей пептидов с ионами тяжелых металлов. При удалении денатурирующих агентов возможна ренативация, так как пептидная цепь стремится принять в растворе конформацию с наименьшей свободной энергией. В условиях клетки пептиды могут самопроизвольно денатурировать, хотя и с меньшей скоростью, чем при высокой температуре. Самопроизвольная ренативация пептидов в клетке затруднена, так как из-за высокой концентрации существует большая вероятность агрегации частично денатурированных молекул. Некоторые низкомолекулярные пептиды играют самостоятельную биологическую роль. Примеры некоторых таких пептидов: Глутатион – γ-глу-цис-гли – один из наиболее широко распространенных внутриклеточных пептидов, принимает участие в окислительно-восстановительных процессах в клетках и переносе аминокислот через биологические мембраны. Карнозин – β-ала-гис – пептид, содержащийся в мышцах животных, устраняет продукты перекисного расщепления липидов, ускоряет процесс распада углеводов в мышцах и в виде фосфата вовлекается в энергетический обмен в мышцах. Вазопрессин – гормон задней доли гипофиза, участвующий в регуляции водного обмена организма: 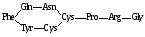 Фаллоидин – ядовитый полипептид мухомора, вызывающий в ничтожных концентрациях гибель организма вследствие выхода ферментов и ионов калия из клеток:  Грамицидин – антибиотик, действующий на многие грамположительные бактерии, изменяет проницаемость биологических мембран для низкомолекулярных соединений и вызывает гибель клеток:  Мет-энкефалин – тир-гли-гли-фен-мет – пептид, синтезирующийся в нейронах и ослабляющий болевые ощущения, он связывается с рецепторами, на которые воздействуют опиоидные анальгетики и представляет собой эндогенное вещество психотропного действия. Аспартам - дипептид, синтетический заменитель сахара, слаще которого в 300 раз. Добавляют в газированные напитки, жевательную резинку; вызывает некоторые заболевания, нарушает обмен веществ. Существует способ получения биологически активных низкомолекулярных пептидов из молока, молозива, стародойного молока, подсырной и творожной сыворотки, ультрафильтратов обезжиренного, цельного молока, подсырной или творожной сыворотки. Способ включает очистку от жировой фракции центрифугированием, сорбцию белков на ионообменнике, хроматографическое разделение на СМ-целлюлозе, элюирование, определение фракции с оптической плотностью при длине волны 280 нм более 1 ед., диализ и стабилизацию микрофильтрацией через полупроницаемые мембраны с селективностью более 50 кДа. Недостатком способа является использование в качестве сырья материалов, имеющих высокую пищевую ценность. Также существует способ получения БАД из низкомолекулярных катионных белков молока и полученная этим способом БАД, по которому катионные белки молочного происхождения отделяют от жировой фракции путем центрифугирования молочного сырья, проводят их сорбцию и хроматографическое разделение на СМ-целлюлозе, диализ полученной белковой фракции против дистиллированной воды, фосфатного буфера, стерилизуют микрофильтрацией через полупроницаемую мембрану. Для получения БАД используют вторичное сырье молочной промышленности. Способ осуществляется следующим образом. К 1 л гидролизата, полученного ферментативным гидролизом молозивной казеиново-сывороточной массы с использованием 0,3-0,6 г панкреатина на 1 л гидролизуемой смеси в течение 3-4 часов и с коррекцией среды 25%-ным водным раствором аммиака, добавляют 300 г сефадекса G-25, оставляют на 10 мин, полученную смесь центрифугируют при 3000 об/мин в течение 20 минут. Надосадочный раствор удаляют, набухший гель элюируют дистиллированной водой, вновь центрифугируют при 3000 об/мин в течение 20 минут. Полученные жидкие фракции стерилизуют фильтрацией через мелкопористые фильтры с диаметром пор 0,2 ммк. Из одного литра гидролизата получают 118-123 мл фракции, содержащей низкомолекулярные пептиды с молекулярной массой от 3000 до 15000 кДа. Для получения сухой формы фракции подвергают лиофильному высушиванию. Наличие низкомолекулярных пептидов во фракции проверяют электрофорезом в ПААГ. Проблемы, возникающие при недостатке: Недостаток в организме вызван недополучением его необходимого количества или количества аминокислот, необходимых для синтезирования белка. Как правило, недостаток протеинов является регулярным явлением у строгих вегетарианцев, у людей с большими физическими нагрузками по причине несбалансированности питания. Дефицит белка в организме имеет негативные последствия практически для всего организма. Недостаточное поступление в организм белка с пищей приводит к замедлению роста и развития детей, у взрослых - к нарушениям деятельности желез внутренней секреции, к изменениям в печени, изменениям гормонального фона, нарушениям выработки ферментов, вследствие чего, ухудшению усвоения питательных веществ, многих микроэлементов, полезных жиров, витаминов. Кроме того, дефицит белка способствует ухудшению памяти, снижению работоспособности, ослаблению иммунитета из-за снижения уровня образования антител, а также сопровождается авитаминозом. Недостаточное потребление белка приводит к ослаблению сердечной и дыхательной системы, потере мышечной массы. Суточная потребность женского организма в белке должна исходить из расчета 1,3 г, умноженное на килограмм веса. Для мужчин этот коэффициент увеличивается до 1,5 г. При занятиях тренировками или какими-либо физическими нагрузками, то потребление белков необходимо увеличивать до 2,5 г умноженное на килограмм. Лучше, если потребляемый белок будет легкоусваиваемым, то есть в виде молочных, соевых белков или специально приготовленных аминокислотных смесей. Избыток: Помимо недостатка белковой пищи может быть и её избыток, который также нежелателен для организма. При незначительном превышении белка в рационе питания по сравнению с нормой вреда никакого не будет, а вот превышение его потребления в 1,7 г на килограмм веса при отсутствии при этом сильных физических нагрузок приводит к негативным последствиям. Избыточный белок печень превращает в глюкозу и азотистые соединения (мочевина), которые должны выводить из организма почки. Кроме того, важное значение в данный момент приобретает соблюдение питьевого режима. Избыток белков провоцирует кислую реакцию организма, что приводит к потере кальция. Помимо этого, мясная продукция, в которой содержится огромное количество белков, содержит пурины, некоторые из которых в процессе обмена откладываются в суставах, что может вызвать развитие подагры. Случаи избытка белка в организме достаточно редки. Как правило, в нашем рационе его не хватает. Избыток белка перегружает пищеварительную систему, способствует ухудшению аппетита, повышенной возбудимости центральной нервной системы, а также желез внутренней секреции. Кроме того, накапливаются жировые отложения в печени, страдает сердечнососудистая система, печень и почки, нарушается витаминный обмен. |
