Клиническая химия в диагностике и лечении. Обмен натрия и воды обмен калия лечение диуретиками гомеостаз ионов водорода
 Скачать 3.99 Mb. Скачать 3.99 Mb.
|
ГОМЕОСТАЗ ИОНОВ ВОДОРОДА:СОДЕРЖАНИЕ ГАЗОВ В КРОВИ За сутки происходит освобождение от 50 до 100 ммоль ионов водорода из клеток в 15—20 л ВКЖ. Скорость этого процесса в течение суток варьирует; быстро действующие гомеостатические механизмы удерживают внеклеточную концентрацию ионов водорода почти постоянной, примерно 40±5 нмоль/л (рН около 7,4). Баланс ионов водорода обеспечивается их секрецией преимущественно в мочу и поэтому поражения почек приводят к ацидозу. В результате происходящих при аэробных условиях реакций обмена веществ составляющие углеродный скелет органических соединений атомы углерода, водорода и кислорода превращаются в воду и двуокись углерода (С02). Не воздействуя на баланс атомов водорода непосредственно, образующаяся СОз представляет собой важный компонент буферной системы. Регуляция содержания С02 зависит от нормального функционирования легких. Высвобождение ионов водорода происходит в процессе метаболизма аминокислот или при промежуточных превращениях углеродных скелетов органических соединений. При превращении азота аминогрупп в мочевину пли сульфгидрильных групп некоторых аминокислот в сульфаты высвобождаются равномолярные количества ионов водорода. При потреблении с пищей богатых белками продуктов реакция мочи становится кислой. Клинически значение этого источника ионов водорода относительно невелико. При анаэробном метаболизме углеводов (например, во время мышечной деятельности) образуются лактаты, тогда как при анаэробном метаболизме жирных кислот (например, в период голодания) и кетогенных аминокислот накапливаются ацетоацетаты; в обоих случаях высвобождаются (непосредственно или опосредованно) эквимолярные количества Н+. При патологических состояниях скорость этих реакций может возрастать в такой степени, что они вызывают значительное снижение рН, приводя к лактатному ацидозу или кетоацидозу. Ионы водорода участвуют во многих процессах анаболизма, в том числе глюконеогенезе. Вероятность развития ацидоза выше, чем алкалоза, так как при реакциях обмена веществ образуются ионы водорода, но не гидроксила. Определения понятий Кислотами называют соединения, обладающие свойством диссоциировать с образованием ионов водорода (протона или Н+). Основаниями называют соединения, обладающие свойством присоединять ионы водорода. В табл. 9 представлены примеры кислот и оснований, имеющих важное значение в огранизме человека. Таблица 9.
Щелочами называют соединения, обладающие свойством диссоциировать с образованием гидроксильных (ОН-) ионов. Поскольку ОН- не является первичным продуктом метаболизма, значению щелочей в данной главе уделено меньше внимания. Сильными кислотами называют соединения, которые диссоциируют в значительной мере в водной среде; иными словами, они образуют много водородных ионов. Соляная кислота относится к числу сильных кислот; в ее растворах представлены почти исключительно ионы Н+ и Сl-. Кислоты, примеры которых приведены в табл. 9, химически являются слабыми; в водной среде они диссоциируют в небольшой степени и образуют относительно мало ионов водорода. В организме даже весьма небольшие изменения рН имеют важное значение и приводят к нарушениям физиологических функций. Термин буферное действие применяют для обозначения процесса, в результате которого происходит замена сильной кислоты (или основания) на слабую, что приводит к уменьшению числа свободных ионов водорода (Н+). В условиях «перехвата» ионов водорода буфером изменения рН меньше тех сдвигов, которые имели бы место в отсутствие буфера. 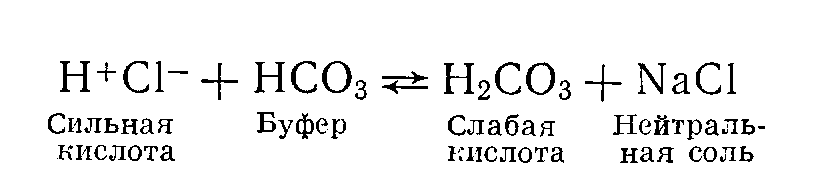 Например: Мерой активности ионов водорода является рН. Первоначально рН называли logio величины обратной концентрации ионов водорода ([Н+]) в моль/л. Хотя известно, что это определение строго говоря не совсем точно, для данного обсуждения оно удовлетворительно. Величина logio любого числа представляет собой показатель степени, в которую следует возвести 10 для того, чтобы получить данное число. Так Предположим, что [Н+] равна 10-7 (0,0000001) ммоль/л. Тогда log[H+]=—7 Тем читателям, которые не имеют склонности к математике, напомним лишь несколько положений. Поскольку при рН6 [Н+]=106 (0,000001) моль/л (1000 нмоль/л) и при рН7 [Н+]=107 (0,0000001) моль/л (100 нмоль/л), изменению величины рН на 1 соответствует сдвиг [Н+] в 10 раз. Такой сдвиг значительно превышает iu изменение, которое представляется очевидным при сопоставлении величин рН. Хотя подобные изменения не происходят в организме при жпзни, в условиях патологических состояний возможны сдвиги рН на 0,3 единицы. Величина 0,3 представляет собой log 2. Поэтому снижению рН на 0,3 (например, от 7,4 до 7,1) соответствует удваивание [Н+] от 40 до 80 нмоль/л. И в этом случае прп использовании величин рН весьма значительные изменения [Н+] кажутся небольшими. (Сравните с изменением концентрации натрия в плазме крови от 140 до 280 ммоль/л.) Величины рН мочи варьируют в значительно большей мере, чем рН крови. В моче [Н+] может возрастать в 1000 раз, что соответствует снижению рН на 3 единицы. Уравнение Гендерсона — Гассельбалха. Мы уже видели, что буфер принимает на себя «удар» при добавлении кислоты к системе, как бы заменяя сильную кислоту на слабую. Когда основания, перечисленные в колонке 2 табл. 9, взаимодействуют с Н+, образуются соответствующие кислоты, указанные в колонке 1. Такие слабые кислоты и соответствующие им основания составляют буферные пары. В водном растворе величина рН зависит от соотношения этой кислоты и соответствующего ей основания. Рассмотрим в качестве примера бикарбонатную пару. Угольная кислота (Н2СОз) диссоциирует на Н+ и НСОз- до тех пор, пока не будет достигнуто равновесие (в этом случае значительно смещенное в пользу Н2СОз), при котором соотношение указанных продуктов остается постоянным (К). Поэтому мы можем записать: (т. е. при состоянии равновесия концентрации Н2СОз в К раз больше, чем произведение [Н+] и [НСОз-]). В результате перестановки получаем: Хотя в некоторых лабораториях выражают результаты в терминах [Н+], эта практика еще не получила широкого распространения. В этой книге мы будем применять понятие рН. В приведенном выше уравнении для [Н+] проделаем логарифмирование и превращение в обратные величины (при логарифмировании умножение заменяется сложением). 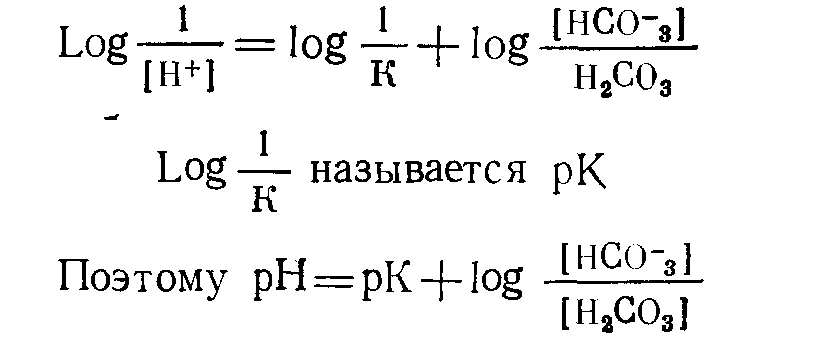 Данное уравнение (пример уравнения Гендерсона — Гассельбалха) применимо для любой буферной пары. Важно отметить, что величина рН зависит от соотношения концентраций основания (в данном случае [НСОз-]) и кислоты (в данном случае Н2СОз). Практически непосредственно измерить очень низкую концентрацию угольной кислоты невозможно. При равновесии с растворенным СО2 и после введения в уравнение концентрации двуокиси углерода вместо [Н2СОз-] общая константа диссоциации будет равпа сумме констант следующих двух реакций: Эту объединенную константу обычно обозначают К'. Величина рК' равна примерно 6,1. Уравнение Гендерсона—Гассельбалха для бикарбонатной системы приобретает теперь следующий вид: Практически в крови измеряют парциальное давление углекислого газа Рсо2. Концентрацию растворенного в плазме СО2 рассчитывают, умножая Рсо2 на константу растворимости для двуокиси углерода. Если Pcog выражено в килопаскалях (кПа), то константа равна 0,23, если в миллиметрах ртутного столба — 0,03. Поэтому, если Рсо2 выражено в кПа, уравнение приобретает следующую, используемую в дальнейшем изложении, форму: 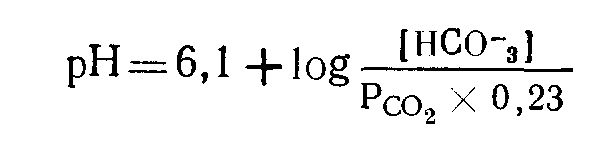 ГОМЕОСТАЗ ИОНОВ ВОДОРОДА Необходимо отметить следующие положения: 1. Ионы водорода могут взаимодействовать с водой, поддерживая рН в норме. Такое явление имеет место при окислительном фосфорилировании. В ходе превращения Н2СОз в CO2 и Н2О также происходит включение Н+ в молекулу воды. Поскольку реакция обратима, инактивация Н+ будет продолжаться до тех пор, пока происходит удаление СО2, что приводит к истощению резерва бикарбонатов. 2. Взаимодействие ионов водорода с буферными системами — процесс временный. Ионы водорода все еще остаются в организме; присутствие слабокислотного компонента буферной пары обеспечивает уменьшение сдвига рН (см. уравнение Гендерсона — Гассельбалха). Если Н+ не полностью нейтрализованы или удалены из организма, и их образование продолжается, буферная емкость истощается в такой мере, что происходит значительное изменение рН. 3. Ионы водорода могут быть выведены из организма только через почки и желудочнокишечный тракт. Функционирование этого механизма сопряжено с образованием бикарбонатного иона (НСОз-). В почках таким путем секреция избытка Н+ обеспечивает регенерирование буферной емкости. Системы регуляции Двуокись углерода и ионы водорода относятся к числу потенциально токсичных продуктов соответственно аэробных и анаэробных реакций обмена веществ. Хотя наиболее значительная доля СО2 выводится из организма через легкие, некоторая часть образующегося СО2 превращается в бикарбонаты, что приводит к созданию буферной системы. Таким образом, ивактивация одного токсического продукта создает условия для того, чтобы свести к минимуму эффект другого. Уравнение Гендерсона — Гассельбалха для любой буферной пары имеет следующий вид: Буферная пара наиболее эффективно стабилизирует рН в диапазоне, близком к величине рК для данной пары. Оптимальный рН для ВКЖ равен 7,4, но рК' для бикарбонатной системы составляет 6,1. Несмотря на этот кажущийся недочет, бикарбонатная система является наиболее важным буфером нашего тела, обеспечивающим свыше 60% буферной емкости крови. Более того, эта система занимает центральное положение среди всех других важных механизмов гомеостаза ионов водорода, включая гемоглобиновую буферную систему (которая обеспечивает в основном остающиеся 40% буферной емкости крови), а также секрецию ионов водорода в почках. Аэробные реакции обмена веществ обеспечивают в изобилии поступление СО2 (в уравнении знаменатель): Регуляция уровня СО; легкими и дыхательным центром Парциальное давление СО2 в плазме крови в норме составляет примерно 5,3 кПа (40 мм рт. ст.). Поддержание постоянства этого уровня зависит от равновесия между высвобождением CO2 в результате реакций обмена веществ и его потерями из организма через альвеолы легких. Последовательность этапов указанных процессов такова: 1) вдыхаемый кислород переносится гемоглобином от легких к тканям; 2) клетки тканей используют кислород при аэробных реакциях метаболизма, в ходе которых углерод органических соединений окисляется до СО2; 3) СО2 диффундирует в соответствии с концентрационным градиентом из клеток в ВКЖ и возвращается с кровью в легкие, где и поступает в выдыхаемый воздух; 4) частота дыхания и, следовательно, скорость выведения из организма СО2 регулируется хеморецепторами дыхательного центра гипоталамической области головного мозга, реагирующими на изменения СО2 (или рН) циркулирующей крови. Если Рсоз значительно превышает 5,3 кПа (или если рН понижается), частота дыхания возрастает. Для выведения СО2 из организма здоровые легкие обладают большими резервными возможностями. Следовательно, в организме осуществляются не только процессы, обеспечивающие в изобилии образование СО2, но в норме функционирование дыхательного центра и легких может точно регулировать в узком диапазоне также и концентрацию С02 (воздействуя таким путем на величину знаменателя в уравнении Гендерсона — Гассельбалха). При заболеваниях легких или отклонениях от нормы процессов регуляции дыхания прежде всего изменяется Рсо2. Регуляция уровня бикарбонатов почками и эритроцитами В клетках почечных канальцев и в эритроцитах часть СО2, задержанная легкими, используется для образования бикарбонатов (в результате чего изменяется величина числителя в уравнении Гендерсона—Гассельбалха). В физиологических условиях эритроциты осуществляют тонкую регуляцию уровня бикарбонатов в плазме в ответ на изменения Рсоз в легких и в тканях. Почки играют ведущую роль в поддержании постоянства концентрации бикарбонатов в циркулирующей крови. Система карбонатдегидратазы Карбонатдегидратаза (КД; карбоангидраза) катализирует первую реакцию в цепи превращений: В эритроцитах и в клетках почечных канальцев не только имеется высокая концентрация КД, но и существуют условия для удаления одного из продуктов, а именно Н+. Поэтому положение равновесия обеих реакций сдвинуто вправо, в результате чего образуется НСОз-. Поскольку один из компонентов реакций—вода — в избытке, а один из продуктов — Н+—выводится, образование НСОз- будет ускорено либо повышением внутриклеточной концентрации другого компонента — CO2, либо снижением таковой другого продукта — НСОз-. При Рсо2 плазмы крови 5,3 кПа (концентрация СО2 примерно 1,2 моль/л — см. с. 104) эти две ткани поддерживают в норме постоянную внеклеточную концентрацию бикарбонатов 25 ммоль/л. Соотношение во внеклеточной жидкости [НСОз-]: [С02] (обе величины в ммоль/л) несколько превышает 20:1. По уравнению Гендерсона—Гассельбалха можно рассчитать, что при рК, равном 6,1, это соотношение соответствует величине рН, очень близкой к 7,4. Увеличение внутриклеточного Рсоз или снижение внутриклеточной [НСОз-] ускоряет образование НСОз-, уменьшая до минимума изменения указанного соотношения и, следовательно, изменения рН. Образование бикарбонатов в эритроцитах (рис. 10) Гемоглобин является важным буфером крови Однако в организме он эффективно функционирует только в сочетании с бикарбонатной системой. Рис. 10. Образование бикарбонатов в эритроцитах. 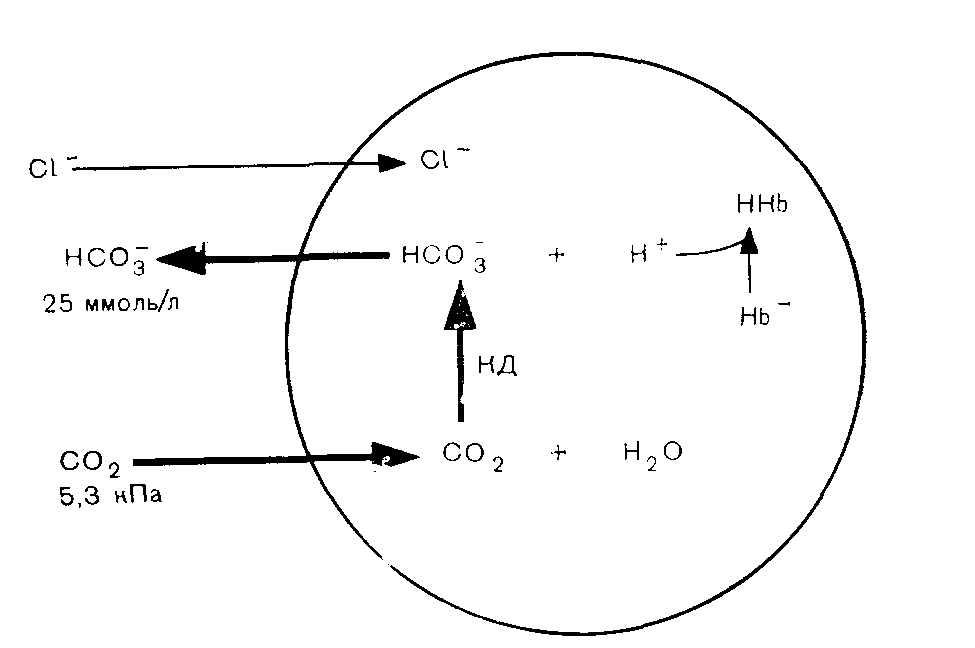 Поскольку аэробные процессы обмена веществ в эритроцитах почти не происходят, они вырабатывают относительно мало СО2. Из плазмы крови в соответствии с концентрационным градиентом СО2 диффундирует в клетки, где карбонатдегидратаза катализирует ее взаимодействие с водой, приводящее к образованию угольной кислоты. По мере диссоциации НаСОз освобождающийся Н в основном взаимодействует с гемоглобином как буферной системой. В эритроцитах повышается концентрация НСОз-, который диффундирует в ВКЖ в соответствии с концентрационным градиентом. При этом электрохимическая нейтральность обеспечивается диффузией в клетки хлорида (хлоридный сдвиг). В физиологических условиях повышение Рсо2 в крови, оттекающей от тканей, стимулирует образование НСОз- в эритроцитах; снижение Рсо2 в крови, оттекающей от легких, угнетает его. При этом обеспечивается относительное постоянство артерповенозной разницы соотношений [НСОз-]: [CO2] и, следовательно, величины рН. Указанные процессы не оказывают существенного влияния на общий баланс НСОз-. При патологических состояниях, влияющих на Рсо2, функционируют те же механизмы, что и в норме. Повышение внутриклеточного Рсо2 способствует увеличению, а понижение Рсо2 — уменьшению внеклеточных [НСОз-]. Однако поскольку буферная емкость гемоглобина ограничена, эритроциты лишь в небольшой мере обеспечивают гомеостаз при хронических расстройствах равновесия Н+. | |||||||||||||||||||||
