Рр. Биоенергетика-1. Обмен веществ и энергии
 Скачать 1.61 Mb. Скачать 1.61 Mb.
|
Свободное нефосфорилирующее окислениеЕсли процесс тканевого дыхания отключен от процесса фосфорилирования, то энергия окисляемых субстратов превращается в теплоту, не используемую для выполнения клеточных функций. Такой путь окисления клеточных субстратов был назван А. Ленинджером нефосфорилирующим, или свободным окислением. Оно необходимо в тех ситуациях, когда потребность в теплоте для организма больше, чем в АТФ. Например, для поддержания температуры тела при охлаждении теплокровных животных. В организме имеется ткань – бурый жир. Физиологическое назначение этой ткани – продукция тепла в процессе окисления триацилглицеринов для поддержания необходимой температуры тела. Особенность внутренней митохондриальной мембраны клеток бурой жировой ткани – отсутствие у нее способности синтезировать АТФ. Эта мембрана имеет особые проводящие поры, проницаемые для ионов водорода (H+). Выделяющиеся при работе дыхательной цепи переноса электронов ионы водорода попадают обратно в матрикс митохондрий не через протонный канал АТФ-азного комплекса, а через эти проводящие поры. Энергия окисления превращается в тепло. Бурого жира много у новорожденных, с возрастом у человека его количество убывает. Особенно много бурого жира у зимнеспящих животных, чутко реагирующих на температуру окружающей среды. Необычная для бурого жира коричневая окраска объясняется большим содержанием в нем митохондрий. Эти митохондрии отличаются тем, что в них примерно в 10 раз больше ферментов дыхания, чем фосфорилирования, т.е. они в меньшей степени настроены на производство АТФ. Свободнорадикальное окисление Основные пути потребления кислорода в клетках. Основная масса молекулярного кислорода (80–90%) используется в митохондриях в процессах тканевого дыхания, сопряженного с окислительным фосфорилированием, и сопровождается образованием воды. Из оставшегося количества кислорода (10–20%) большая часть его расходуется по пути микросомального окисления, причем, главным образом в окислительных цепях эндоплазматического ретикулума печени и других тканей, а также в митохондриях клеток коры надпочечников. Для клетки очень важно, чтобы молекула кислорода, присоединив четыре электрона, полностью восстановилась до двух молекул воды. При неполном восстановлении кислорода, в случае присоединения одного или двух электронов, образуется пероксид водорода и различные свободные радикалы – крайне токсичные для клеток, так как могут повреждать клеточные мембраны, взаимодействуя с остатками ненасыщенных жирных кислот мембранных липидов. Свободным радикалом называют группу атомов, имеющих свободную валентность, способных активно реагировать с другими веществами (например, гидроксильный радикал – Молекулярный кислород в основном триплетном состоянии имеет два неспаренных электрона, занимающих самостоятельные внешние орбитали с одинаково направленным вращением (спинами). Каждая из этих орбиталей может принять еще один электрон. Присоединение одного электрона образует свободный радикал – супероксидный анион ( Полное восстановление кислорода до двух молекул воды требует четырех электронов и четырех протонов: Однако в организме в большинстве случаев полное восстановление кислорода происходит не сразу, а поэтапно – с переносом одного электрона на каждом этапе. Образовавшийся при приеме одного электрона супероксидный анион ( Во втором случае Донорами или акцепторами электронов здесь могут быть разнообразные соединения. Возможна также реакция дисмутации, когда в одной и той же реакции одна молекула супероксида служит донором электрона, а другая – акцептором: Образовавшийся пероксид водорода, в свою очередь, может восстанавливаться супероксидом: В данной реакции образуется свободный гидроксильный радикал Кислородные радикалы: В последние годы особый интерес проявляется к свободнорадикальному окислению ненасыщенных жирных кислот липидов биологических мембран, так называемому перекисному окислению липидов (ПОЛ) или липопероксидации. Короткоживущие свободные радикалы ( С этих реакций начинается цепной процесс окисления жирных кислот, впрочем, как и других веществ. Эта стадия перекисного окисления определена как стадия инициирования цепей. Свободные радикалы ( Таким образом, в цепную свободнорадикальную реакцию вовлекаются все новые и новые молекулы молекулярного кислорода и жирных кислот. Продуктами пероксидного окисления ненасыщенных жирных кислот могут быть альдегиды, кетоны, диальдегиды, эпоксиды и др., например: 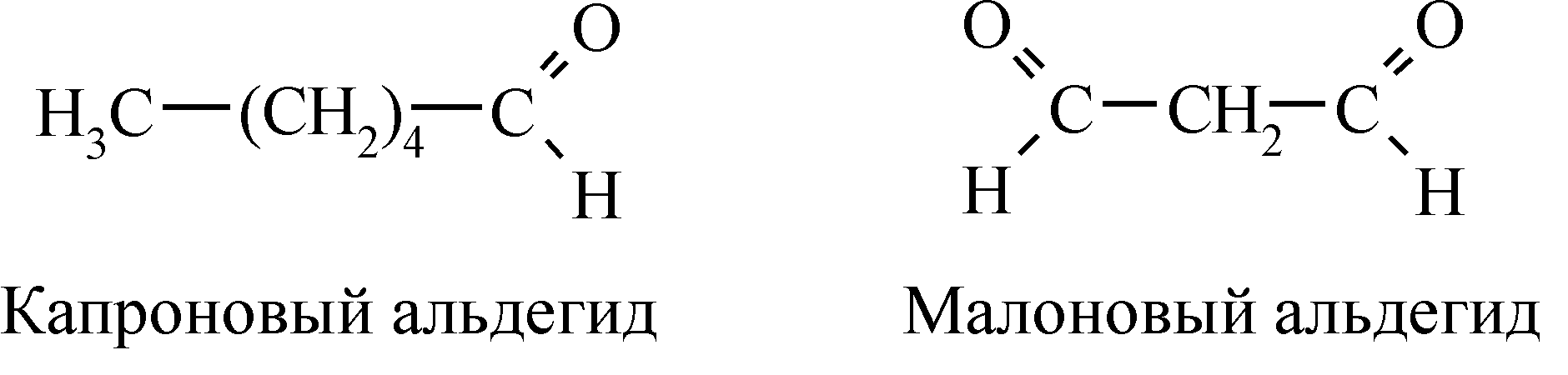 Это происходит путем разрыва в жирной кислоте углерод-углеродной связи, соседствующей с пероксидной группой. Количество образовавшегося малонового диальдегида находится в прямой зависимости от числа двойных связей в молекуле полиненасыщенной жирной кислоты. Так, линолевая кислота образует одну молекулу малонового диальдегида, линоленовая – две. Таким путем могут окисляться как свободные ненасыщенные жирные кислоты, так и их остатки, входящие в состав липидов, особенно фосфолипидов. Этот процесс называют пероксидным окислением липидов. О его уровне можно судить по количеству образовавшегося в клетках малонового диальдегида. Очевидно, что функциональная роль реакций этого типа состоит в регуляции обновления и проницаемости липидов биологических мембран. В частности, образовавшиеся продукты пероксидного окисления лучше растворимы в воде, чем исходные ненасыщенные высшие жирные кислоты, поэтому они легче вымываются из мембран, что способствует процессам самообновления мембранных структур и необходимо для нормального их функционирования. Кроме того, пероксидное окисление необходимо для биосинтеза ряда биологических активных веществ, например, кортикостероидов – гормонов коры надпочечников, прогестерона – женского полового гормона, простагландинов – клеточных гормонов и др. В то же время усиление пероксидного окисления липидов может изменять их конформацию, уменьшать гидрофобность, приводить к образованию ковалентных сшивок между молекулами липидов или липидов и белков. Вследствие этого при окислении мембранных липидов резко изменяются их структура и функции. Активные формы кислорода в организме образуются в реакциях самопроизвольного (неферментативного) окисления ряда веществ. Так, одним из важных примеров может служить окисление гемоглобина в метгемоглобин, при котором образуется супероксид. Усиление процессов свободнорадикального окисления, наблюдаемое при ультрафиолетовом облучении, действии ультразвука, радиации и других воздействиях, может вызвать серьезные нарушения в обмене веществ и энергии, функциях и структурах клетки. Например, при лучевой болезни происходит нарушение уникальной структуры биологических мембран, разрыхление их и, как следствие, нарушение структурированности ферментов и их систем. Накопление пероксидов в значительных количествах в митохондриях вызывает их набухание и разрушение, что приводит к нарушению упорядоченности, фиксации и функций ферментативных систем дыхания, которые сосредоточены на внутренней и внешней мембранах митохондрий. Одним из серьезнейших нарушений энергетического обмена при усилении свободнорадикального окисления является также разобщение дыхания и фосфорилирования, а следовательно, и ослабление биосинтеза макроэргических соединений, особенно АТФ. Это в свою очередь затормаживает процессы биосинтеза белков, нуклеиновых кислот и других соединений, а также нарушает функции организма. Такие сдвиги особенно тяжело сказываются на центральной нервной системе, поскольку головной мозг весьма чувствителен к нарушениям дыхания и к повышенному содержанию различных продуктов обмена. Проведение таких лечебных манипуляций, как вдыхание кислорода при повышенном давлении во время проведения гипербарической оксигенации в специальных камерах, также может привести к усилению пероксидного окисления. С возрастом накопление пероксидов липидов ускоряет процесс старения организма. Они также задерживают деление клеток и тем самым снижают процессы заживления поврежденных тканей. В организмах имеются многие водо- и липидрастворимые соединения, которые могут как активировать пероксидное окисление (их называют прооксидантами), так и тормозящие этот процесс – антиоксиданты. К антиоксидантамотносятся витамины группы Е (-, -, -токоферолы), большинство фосфолипидов (например, фосфатидилхолин), стероидные гормоны, тироксин – гормон щитовидной железы, соли селена, комплексоны, витаминоподобные флавоноидные соединения (витамины группы Р), аскорбиновая, лимонная, никотиновая кислоты, аминотиолы, мочевина и др. -Токоферол, присутствующий в мембранах, является своеобразной химической системой защиты мембран от пероксидного окисления. Прооксидантамиявляются легкоокисляющиеся соединения, образующие свободные радикалы: витамины группы ретинолов (А), кальциферолов (Д), нафтохиноны, восстановители НАДФH2, липоевая кислота, свободнорадикальные метаболиты, образуемые действием других прооксидантов. Антиоксиданты и прооксиданты широко используются в научно-исследовательской работе; антиоксиданты применяются в практике здравоохранения, в том числе и для лечения лучевой болезни, так как способствуют нормализации окислительно-восстановительных реакций в организме. В настоящее время синтезированы высокоактивные антиоксиданты (например, дибунол), во много раз превышающие эффект классического антиоксиданта -токоферола. Дибунол является ингибитором свободнорадикальных реакций и обладает свойствами антиоксиданта, проявляет противоопухолевую активность. Вещества, влияющие на энергетический обмен в клетках Многие вещества, в том числе и лекарственные средства, могут изменять энергетику клеток, влияя на образование энергии в ходе превращения питательных веществ, и на уровень окислительного фосфорилирования (образование АТФ). Их можно разделить на активаторы и ингибиторы энергетического обмена. Глюкоза, фруктоза, аминокислоты, кислоты цикла Кребса (лимонная, яблочная, янтарная), различные питательные смеси, например препараты гидролизатов белков: гидролизат казеина, аминокровин, фибриносол, амикин и др., улучшают энергетический обмен в тканях организма, вовлекаясь в окислительно-восстановительные реакции митохондрий, поэтому нашли применение в медицинской практике. Ингибиторами являются фториды, арсенаты, моноиодацетат и .др., блокирующие активность отдельных ферментов распада углеводов, липидов или выступающие как разобщители окислительного фосфорилирования. Они нашли применение в научных исследованиях при изучении отдельных этапов обмена веществ и энергии. По механизму действия вещества, влияющие на энергетический обмен в клетках, можно разделить на четыре группы. Ингибиторы дегидрогеназ – ингибируют процесс дегидрирования отдельных субстратов, снижая поступление атомов водорода (протонов и электронов) в дыхательную цепь. К ним относятся, например, противотуберкулезные препараты фтивазид, изониазид (ГИНК), салюзид и др., являющиеся производными изоникотиновой кислоты и имеющие структурное сходство с амидом никотиновой кислоты, являются конкурентными ингибиторами никотинамидных дегидрогеназ (НАД-зависимых), содержащих в составе своих коферментов амид никотиновой кислоты. Поэтому проявляется их конкурентное замещение, ведущее к подавлению действия НАД-зависимых дегидрогеназ и механизм клеточного дыхания у микроорганизмов подавляется, что ведет к их гибели. Малоновая кислота (HOOC–CH2–COOH) – нормальный промежуточный продукт обмена – является конкурентным ингибитором ФАД-зависимой дегидрогеназы (сукцинатдегидрогеназы), отщепляющей атомы водорода от янтарной кислоты (HOOC–CH2–CH2–COOH) – одного из субстратов цикла Кребса, в связи с чем скорость этого цикла снижается. Смесь ингибиторов НАД- и ФАД-зависимых дегидрогеназ может значительно угнетать тканевое дыхание, не влияя на образование протонного потенциала, так как поступление ионов H+ из матрикса обеспечивает убихинон. Ингибиторы тканевого дыхания на этапах фосфорилирования. Они блокируют одно их трех звеньев образования АТФ, прерывая поток электронов на определенных участках дыхательной цепи. Первая группа препаратов (снотворные препараты барбитурового ряда – амитал и др., прогестерон – женский половой гормон) прерывает поступление водорода на дыхательную цепь от субстратов, окисляющихся путем действия пиридинзависимых дегидрогеназ, но не мешает использованию субстратов, окисляющихся через ФАД (например, янтарной кислоты). На уровне второго звена дыхательная цепь блокируется противогрибковым антибиотиком антимицином А (блокируется перенос электронов между цитохромами b и c1). Дыхание возможно только при поступлении электронов и протонов на участок цепи после блока. Например, аскорбиновая кислота (витамин C) может окисляться цитохромом с. Поэтому в ее присутствии дыхание в митохондриях продолжается, даже несмотря на то, что дыхательная цепь ингибирована антимицином А. Третья группа ингибиторов дыхания: цианиды (NaCN, KCN), азиды (NaN3), оксид углерода (II) и др. блокируют цитохромоксидазу и делают невозможным сам процесс дыхания. Эти вещества вызывают кислородный голод для дыхательной цепи митохондрий, хотя кислород находится в изобилии (блокируется процесс переброса электронов на кислород). Здесь выключается образование протонного потенциала и связанного с ним фосфорилирования – прекращается жизнедеятельность клеток. Поэтому перечисленные ингибиторы цитохромоксидазы являются сильнейшими ядами, отравление которыми вызывает быструю гибель организма. Ингибиторы фосфорилирования могут действовать на H+-АТФ-синтетазу, препятствуя использованию протонного потенциала для синтеза АТФ. Например, антибиотик олигомицин, связываясь с белковой субъединицей H+-АТФ-синтетазы в месте соединения факторов F0 и F1, запечатывает выход канала и прекращает поступление ионов H+ к фактору F1, одновременно ингибируя синтез АТФ в активном центре F1. Этот антибиотик полностью останавливает фосфорилирование, что ведет к остановке дыхания. Разобщители окислительного фосфорилирования. Существует ряд веществ, которые блокируют процесс сопряжения между дыханием и фосфорилированием, т.е. непосредственно ингибируют процесс образования АТФ. Эти вещества получили название «разобщающих агентов». Разобщители не влияют на создание протонного потенциала. Они лишь способствуют его расходованию в обход H+-АТФ-синтетазы – основного потребителя энергии протонов для образования АТФ. Механизм действия разобщителей связан с тем, что они являются переносчиками протонов, катионов или других ионов через мембрану и «отключают» фосфорилирование от клеточного дыхания. Все разобщители относятся к мембранотропным веществам. Они делятся на протонофоры и прочие ионофоры. Протонофоры(т.е. переносчики протонов). Эти вещества обладают гидрофобностью, т.е. хорошо растворимы в липидах мембраны и содержат подвижные протоны, поэтому способствуют переносу через мембрану протонов, выравнивая их концентрацию и разность зарядов по обе стороны мембраны. Протонофоры в соответствующих концентрациях могут полностью разобщать дыхание и фосфорилирование, так как ликвидируют оба компонента протонного потенциала (pH и ), созданного дыханием. Фосфорилирующее окисление полностью переходит на свободное, и митохондрии выполняют роль «нагревательного прибора» в клетках. К разобщителям такого типа относятся природные вещества, например свободные жирные кислоты, которые в форме аниона (R–COO–) связывают H+ на внешней стороне мембраны, переносят их в недиссоциированной форме (R–COOH) и затем, диссоциируя, отдают H+ на внутренней стороне мембраны (R–COOH – R–COO– + H+). Разобщают дыхание и синтез АТФ и такие вещества, как 2,4-динитрофенол, производные бензимидазола и фенилгидразона, а также ряд лекарственных средств, например, салицилаты (противовоспалительные средства), дикумарин, фенилин (антикоагулянты непрямого действия) и др. Разобщающее действие проявляют тиреоидные гормоны – трииодтиронин и тироксин, которые применяются и как фармпрепараты. Ионофоры(т.е. переносчики ионов). К ним относятся вещества, способные связывать определенные ионы (К+, Na+ и др.) и переносить их через мембрану, нарушая изолирующий барьер мембраны. От разобщающих агентов они отличаются тем, что переносят через мембрану не ионы H+, а какие-нибудь другие катионы. Например, токсичный антибиотик валиномицин образует жирорастворимый комплекс с ионами К+, легко проходящий через внутреннюю мембрану митохондрий, тогда как в отсутствие валиномицина ионы К+ проникают сквозь нее с большим трудом. Антибиотики-ионофоры выравнивают ионные градиенты на любой, а не только на митохондриальной мембране, поэтому, прекращая выработку энергии и выравнивая ионные градиенты между внутренней и внеклеточной средой, вызывают быструю гибель микроорганизмов. Ионофор грамицидин является антибиотиком, обладающим бактериостатическим и бактерицидным действием. Он облегчает проникновение через мембрану К+ и Na+, причем действует на клетки как микроорганизмов, так и больного, поэтому его надо принимать только наружно, в виде мазей, паст при лечении гнойных ран, остеомиелитах и в виде промываний и полосканий при воспалительных заболеваниях уха, горла и др. Лекарственные средства как составные части дыхательной цепи. При многих нарушениях биологического окисления благотворно влияет терапевтическое применение составных компонентов дыхательной цепи. В большинстве случаев – это метаболитная (субстратная) терапия. Как уже указывалось, введение в организм глюкозы, фруктозы, аминокислот, молочной, лимонной, янтарной, яблочной кислот как продуктов универсализации «топлива» и источников атомов водорода может в случае недостатка субстрата оказать благотворное влияние на процессы окисления. Широкое применение находит использование витаминов, в частности никотинамида, рибофлавина, а также их кофакторов, например фармпрепаратов флавината (ФАД) и ФМН, как средств, входящих в состав ферментов, регулирующих окислительно-восстановительные процессы в организме. Положительный результат кислородной терапии при гипо- и аноксических состояниях известен давно. В последнее время большой интерес представляют попытки лечебного применения некоторых ферментов дыхательной цепи. Так, цитохром с – ферментный препарат, полученный путем экстракции из ткани сердца крупного рогатого скота, повышает использование кислорода в тканях. Применяют цитохром с для улучшения тканевого дыхания при асфиксии новорожденных, при астматических состояниях, хронической пневмонии, сердечной недостаточности, анемиях, некоторых отравлениях и др. |
