Инфекции в эндопротезировании. двухэтап рев эндопрот при инфекц. Общероссийская общественная организация ассоциация травматологовортопедов россии
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
ИНТРАОПЕРАЦИОННАЯ ДИАГНОСТИКА Интраоперационное гистопатологическое исследование образцов перипротезных тканей имеет очень высокую достоверность при наличии морфолога с опытом в интерпретации картины перипротезных тканей. Его необходимо выполнять во время ревизионного вмешательства, если клиническая картина позволяет заподозрить наличие инфекции, а её результат может изменить тактику лечения, например, выполнить ревизию в один или в два этапа (B-3). Не менее 3, а лучше 5-6 образцов перипротезных тканей (тканевых биоптатов) и удаленные компоненты эндопротеза должны забираться во время операции для дальнейшего бактериологического исследования на аэробы и анаэробы (B-2++). По возможности, следует приостановить антибактериальную терапию, как минимум, за 2 недели до забора тканей для посева. Это повышает вероятность выделения возбудителей (A-2++). Наличие свища, связанного с протезом, является однозначным подтверждением наличия ППИ (B-3). Наличие картины острого воспаления при гистопатологическом исследовании перипротезных тканей интраоперационно, описываемой патоморфологом, с высокой вероятностью свидетельствует о наличии ППИ (B-2+). Наличие гноя в области установки эндопротеза без другой известной причины, однозначно говорит о ППИ (B-3). Выделение одного и того же низковирулентного микроорганизма (к примеру, S.epidermidis, Propionibacteriumacnes), неотличимого на основании результатов общепринятых лабораторных тестов, включая генную и специальную идентификацию и антибиотикограмму, из двух и более тканевых биоптатов или из дооперационного аспирата и одного интраоперационного тканевого биоптата или удаленного компонента эндопротеза подтверждают наличие ППИ. Выделение низковирулентного возбудителя из одного образца биоматериала или удаленной конструкции нельзя однозначно расценивать как подтверждение ППИ и следует оценивать в комплексе с другими имеющимися данными (B-3). Рост вирулентного микроорганизма (например, S. aureus) хотя бы в одном из образцов биоматериала (аспират, тканевой биоптат, удаленный компонент) может также говорить о ППИ. Наличие ППИ возможно, даже если нет соответствия описанным выше критериям. Клиницист должен сам принимать решение на основании предоперационных и интраоперационных данных (B-3). ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ФЕДЕРАЛЬНЫХ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ Двухэтапное ревизионное эндопротезирование является операцией выбора у пациентов, которые в состоянии, с медицинской точки зрения, перенести несколько этапов хирургического лечения, а имеющиеся дефекты мягких тканей и костей позволяют выполнить реэндопротезирование с последующим хорошим функциональным результатом и которым не показана одноэтапная операция (B-3). Показания для выполнения двухэтапного ревизионного эндопротезирования: острая послеоперационная (менее 4 недель) ППИ при наличии острого воспаления окружающих мягких тканей, свищевого хода; поздняя хроническая (от 4 недель до одного года) ППИ; острая гематогенная (через год и более) ППИ с длительностью манифестации симптомов более одной недели; полирезистентные возбудители (MRSA, MRSE, ампициллинорезистентные Enterococci, грамотрицательные бактерии, грибы); в анамнезе не более 3-х рецидивов ППИ; существует возможность проведения длительной супрессивной антибиотикотерапии. Окончательное решение по варианту лечения принимает ортопед по согласованию с другими специалистами (например, пластическим хирургом, анестезиологом, специалистом по инфекционным заболеваниям), если это необходимо. (C-3). ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ ФЕДЕРАЛЬНЫХ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ Противопоказания для выполнения двухэтапного ревизионного эндопротезирования: отказ больного от этапных операций; выраженная сопутствующая патология, не позволяющая выполнить этапные операции; дефицит мягких тканей для укрытия операционной раны; обширные дефекты мягких тканей и костей, не позволяющие в дальнейшем имплантировать постоянный эндопротез; многократные (более 3-х) рецидивы инфекционного процесса после выполнения предыдущих методик лечения перипротезной инфекции; острый некротический фасциит; длительная супрессивная антибактериальная терапия невозможна. СТЕПЕНЬ ПОТЕНЦИАЛЬНОГО РИСКА ФЕДЕРАЛЬНЫХ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ Степень потенциального риска федеральных клинических рекомендаций – класс 3 – медицинские технологии с высокой степенью риска, включающий в себя медицинские технологии, оказывающие прямое (хирургическое) воздействие на органы и ткани организма (за исключением медицинских технологий, относящихся ко 2-му классу); реэндопротезирование суставов конечностей, удаление нестабильных (хорошо фиксированных) компонентов эндопротеза и костного цемента и имплантация ревизионных эндопротезиных систем с замещением костных дефектов аллотрансплантатами или биокомпозитными материалами и применением дополнительных средств фиксации. ОПИСАНИЕ ФЕДЕРАЛЬНЫХ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ Первый этап двухэтапного ревизионного эндопротезирования (этап санации) заключается в выполнении ревизии, удалении эндопротеза, радикальной хирургической обработке, дренировании области инфекционного воспаления и установке антимикробного спейсера. Цель I этапа – санация области ППИ, купирование инфекции, пластическое замещение дефектов мягких тканей, сохранение (восстановление) функции нижней конечности. а) Предоперационный период. Цель предоперационного периода – оценка состояния пациента, подтверждение показаний для выполнения I этапа. Предоперационная подготовка должна начинаться с амбулаторного этапа и может быть продолжена в стационаре в течение 3-5 дней. Необходимо выполнить следующие диагностические мероприятия перед госпитализацией: - ФГДС с целью профилактики желудочного кровотечения в послеоперационном периоде; - УЗИ вен нижних конечностей с целью диагностики и лечения тромботических осложнений. Предоперационная подготовка в стационаре должна включать диагностические и лечебные мероприятия. Диагностика ППА включает: - тщательный сбор анамнеза заболевания: тип протеза, дата имплантации, предшествующие операции на суставе, были ли проблемы с заживлением раны после имплантации, инфекции других локализаций, клинические симптомы при обращении, аллергия на лекарственные препараты и непереносимость лекарств, сопутствующая патология, предшествующие и нынешние результаты микробиологических исследований аспиратов или биоптатов, предшествующая антибактериальная терапия ППИ, включая местную антибактериальную терапию; - лабораторное обследование: клинический анализ крови, СОЭ, СРБ, общий белок, креатинин, общий билирубин, АСТ, глюкоза; - рентгеновское обследование области ППИ; - диагностическая пункция области тазобедренного сустава с анализом полученного материала на микроскопию и бактериологическое исследование; - при наличии свища обязательное выполнение фистулографии; - затеки контрастного вещества в мягкие ткани вокруг сустава, являются показанием к выполнению УЗИ тазобедренного сустава и бедра; - дефект костей образующих вертлужную впадину, бедренной кости служат показанием к выполнению СКТ; - смещение вертлужного компонента кнутри от линии Келлера требует выполнения СКТ в сосудистом режиме с целью изучения взаимного расположения конструкций эндопротеза и сосудов таза. Медикаментозная терапия в дооперационном периоде включает по показаниям: - обезболивающие НПВП (кетопрофен, парацетамаол, кеторолак и другие), анальгетики (трамадол и другие); - внутривенные препараты железа для быстрого восполнения запасов железа (железа гидроксида сахарозный комплекс и другие); - при необходимости препараты для терапии сопутствующей патологии; - питательные смеси для коррекции трофологического статуса; - рекомендуется избегать назначения антибактериальной терапии до выполнения операции и взятия образцов биоматериала и удаленных компонентов эндопротеза на бактериальное исследование. б) Оперативное вмешательство как первый этап комплексного лечения перипротезной инфекции ТБС (реэндопротезирования суставов конечностей) Единого стандарта выполнения санирующего этапа двухэтапного ревизионного эндопротезирования не существует, т.к. ход операции во многом зависит от области распространенности инфекционного процесса, общего состояния пациента, состояния окружающих эндопротез мягких тканей и т.д. Обязательным требованиями первого этапа являются: радикальная хирургическая обработка области инфекционного воспаления с иссечением мягких тканей, секвестров кости, пораженных инфекционным процессом. Забор тканевых биоптатов нескольких локализаций с самой высокой плотностью микроорганизмов (граница кости и цемента или кости и протеза) для бактериологического (в количестве ≥5) и для гистопатологического (в количестве ≥3) исследований; удаление эндопротеза и направление удаленных компонентов на бактериологическое исследование; установка цементного спейсера для сохранения функции сустава (артикулирующий спейсер), заполнения «мертвого» пространства на месте удаленного эндопротеза, а также как депо препаратов для локальной антибактериальной терапии Техника санирующих операций: Как правило, доступ осуществлялся через старый послеоперационный рубец (рис 1). 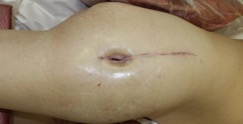 Рис. 1. Внешний вид после операционного рубца. В нижней трети рубца расположен свищевой ход. Предварительно для визуализации всей зоны поражения в свищевой ход или дефект вводился спиртовой раствор бриллиантовой зелени с перекисью водорода (рис. 2). а) 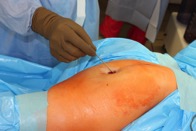 б) б)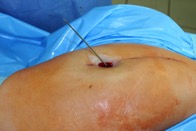 в) 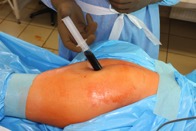 г) г) Рис. 2. Окрашивание свищевого хода раствором бриллиантового зеленого: а) изучение свищевого хода пуговчатым зондом; б) определена глубина, направление свища; в-г) бриллиантовый зеленый введен с помощью шприца. Для лучшего окрашивания свищевого хода выполняют несколько энергичных ротационных движений в суставе (рис. 3).   Рис. 3. Выполнение движений в суставе позволяет лучше окрасить свищевой ход. Визуально оценивают степень выраженности отека, цвет, консистенцию и наличие отслойки мягких тканей (рис. 4). 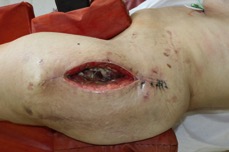 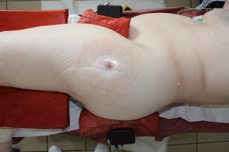 Рис. 4. Внешний вид послеоперационного рубца до ревизии: а) рана зияет, на дне ее бедренная кость, покрытая фибрином, отек подкожной клетчатки; б) отек, гиперемия вокруг свищевого хода. Как правило, доступ выполняют с иссечением старого послеоперационного рубца (рис. 5). а) 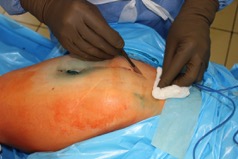 б) б)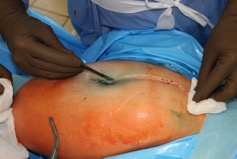 в) 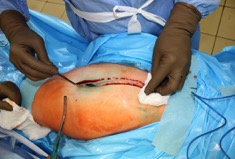 г) г)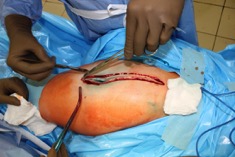 д) д)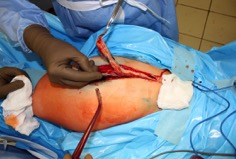 е) е)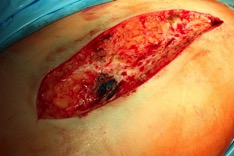 Рис. 5. Выполнение хирургического доступа с иссечением старого операционного рубца и свищевого хода, окрашенного бриллиантовым зеленым (а-д). Внешний вид операционной раны после иссечения рубца, на дне раны продолжение свищевого хода (е). Если в полости сустава обнаруживают жидкость, необходимо оценить ее цвет, запах, консистенцию и объем (рис. 6). 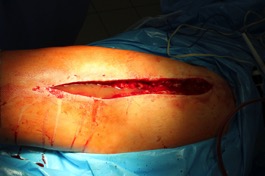 Рис. 6. Операционная рана наполнена гноем после рассечения капсулы сустава. Фрагменты патологически измененных тканей, окружающих эндопропротез (как правило 5 образцов), жидкость из полости сустава, а также компоненты эндопротеза отправляют на микробиологическое исследование (рис.7). а) 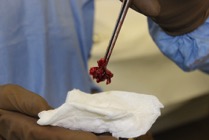 б) б) в) 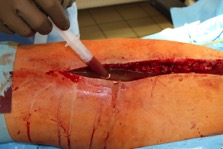 г) г) Рис. 7. Взятие материала для микробилогического исследования: а) тканевой биоптат; б) пробирки с тканевыми биоптатами в питательной среде; в) сбор жидкости из полости сустава; г) удаленный компонент эндопротеза в стерильном контейнере. Нагноившиеся лигатуры иссекают широко в пределах здоровых тканей (рис. 8). 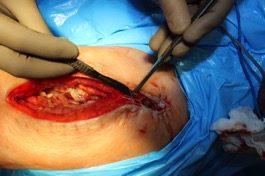 Рис. 8. Иссечение лигатуры по ходу доступа к суставу. В случае проникновения бриллиантового зеленого в под широкую фасцию бедра, выполняют полноценную ревизию сустава на всю глубину раны (рис. 9). а) 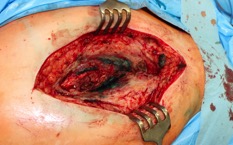 б) б)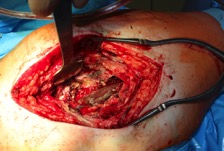 в) 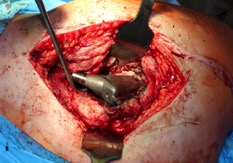 г) г)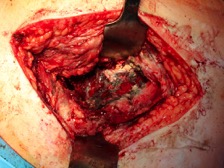 Рис. 9. Бриллиантовый зеленый в полости тазобедренного сустава: а) краситель обнаружен под широкой фасцией бедра; б-в) патологические грануляции окружают бедренный компонент эндопротеза; г) дефект кости, грануляции, окрашенные бриллиантовым зеленым после удаления бедренного компонента эндопротеза. После вывиха головки эндопротеза определяют стабильность бедренного компонента путем приложения компрессионных, тракционных и ротационных усилий на него с разных сторон (рис. 10). а) 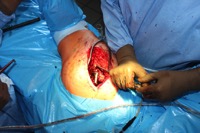 б) б)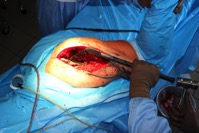 в) 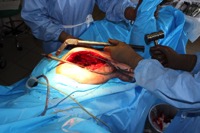 Рис. 10. Определение стабильности бедренного компонента и его удаление. Прочность имплантации вертлужного компонента определяют давлением на край металлического каркаса чашки протеза. При отсутствии подвижности чашки и (или) выделения из-под нее жидкости (раствора красителя, гноя) вертлужный компонент протеза считают стабильным (рис. 11). а) 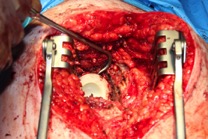 б) б)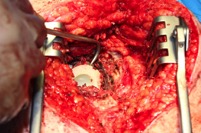 в) 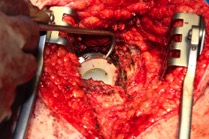 г) г)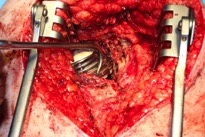 д) 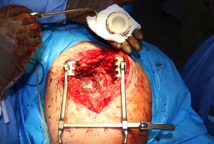 Рис. 11. Определение стабильности вертлужного компонента с помощью однозубого крючка (а). Вертлужный компонент не стабилен, последовательно удален (б-д). Следующим этапом выполняют непосредственно хирургическую обработку тканей, иссечение краев операционной раны с повторной обработкой раны растворами антисептиков (рис. 12). а) 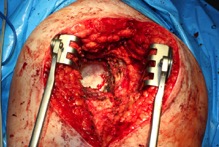 б) б)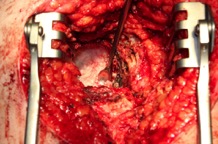 в) 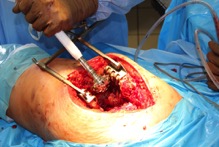 г) г)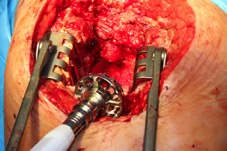 д) 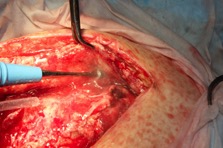 е) е)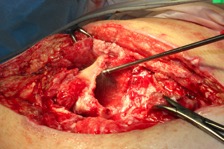 ж)  Рис. 12. Хирургическая обработка раны: а-г) дебридмент вертлужной впадины с помощью косной ложки и фрезы; д-е) некрэктомия мягких тканей и бедренной кости с помощью ультразвукового аппарата (ж). Для заполнения «мертвого» пространства используют блоковидные спейсеры, изготовленные из костного цемента с антибиотиком, или артикулирующие спейсеры, включающие металлический бедренный компонент и вертлужный компонент, изготовленный интраоперационно из костного цемента на основе полиметилметакрилата (рис.13). В качестве бедренного компонента артикулирующего спейсера возможно использовать заранее подобранную новую ножку цементной фиксации или, что чаще, только что удаленный бедренный компонент, подвергнутый стерилизации прямо в ходе операции. Оба компонента артикулирующего спейсера устанавают на костный цемент с добавлением антибиотика и имитируют полноценный искусственный сустава.  Рис. 13 Формы для изготовления спейсера вертлужной впадины. После установки того или иного варианта спейсера (рис.4 а,б) производили ушивание раны и осуществляли дренирование путем активной аспирации. Свободные концы дренажей выводили через отдельные проколы мягких тканей и фиксировали на коже отдельными узловыми швами. Ушитая рана закрывалась асептической повязкой. В ряде случаев, при значительной нестабильности сустава, в послеоперационном периоде накладывали тазобедренную гипсовую иммобилизацию сроком до 3-х мес. (рис.14 а,б). 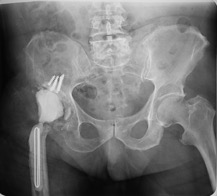 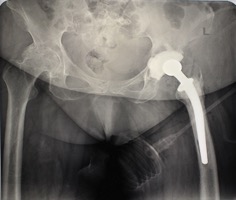 Рис. 14. Рентгенограммы пациентов с а) блоковидным спейсером; б) артикулирующим спейсером Принципиальным хирургическим положением является применение методов дополнительной обработки. Для снижения риска послеоперационного нагноения иссечение гнойного костно-мягкотканного очага завершается обработкой раневой поверхности с применением ультразвуковой обработки, обработкой пульсирующей струей с растворами антисептиков. В основе физических методов воздействия на раневую поверхность присутствуют следующие группы физических факторов: ультразвуковая кавитация, водоструйные технологии, воздействие активного кислорода на раневую поверхность. Последовательное и (или) комплексное применение современной аппаратуры позволяет получить позитивные клинические результаты. Диссектор ультразвуковой серии SONOCA (РЗН 2014/1652) – при обработке раневой поверхности раствором антибиотика, разведённого в 250 мл раствора физиологического раствора, возникает тепловой эффект, что приводит к усилению обменных процессов, увеличению фагоцитарной активности лейкоцитов, стимуляции клеточного и гуморального звеньев иммунитета, проявлению бактерицидного действия. Отмечается также повышение чувствительности микроорганизмов к антибиотикам и антисептикам. Раневая поверхность обрабатывается равномерно в режиме 2,2 Вт/см2 в течение 3-х минут. Аппарат для санации раневой поверхности “Pulsovac Plus” (ФСР 2011/09788) оказывает воздействие на рану пульсирующей струей с растворами антисептиков. Преимущества этого способа: использована концепция пульсирующей струи, возможен выбор наконечников для различных видов тканей, система создает высокое давление; в конусе насадки есть канал для аспирации подаваемой жидкости, что снижает риски повреждения мягких тканей и разбрызгивания подаваемой жидкости, существует регулировка мощности потока. |
