Инфекции в эндопротезировании. двухэтап рев эндопрот при инфекц. Общероссийская общественная организация ассоциация травматологовортопедов россии
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
в) послеоперационный период Цель послеоперационного периода – купирование инфекционного процесса, предупреждение рецидива инфекции, восстановление тонуса мышц, прочности капсульно-связочного аппарата, амлитуды движений в суставе. Активное дренирование полостей послеоперационной раны до уменьшения количества отделяемого до 50 мл./сут.; Регулярные пункции сустава после удаления дренажей; Промывание сустава антисептиками с целью эррадикаци планктонных форм микроорганизмов; Парентеральная антибактериальная терапия с учетом чувствительности микрофлоры; Пероральная антибактериальная терапия на амбулаторном этапе. Второй этап двухэтапного ревизионного эндопротезирования Интервал времени между первым и вторым этапом ревизионного эндопротезирования составляет от 2-х недель до нескольких месяцев. В ранних когортных исследованиях показано, что выполнение второго этапа ревизии менее чем через 3 недели после удаления эндопротеза, сопряжено со значительным количеством неудовлетворительных результатов [Rand JA, Bryan RS. 1983;]. В аналогичных современных исследованиях, выполненных в Европе, установлено, что наилучшие результаты могут быть получены при выполнении второго этапа в срок от 2 до 6 недель после окончания парентеральной антибактериальной терапии, то есть около 3-х месяцев [Segawa H. et al 1999; Brandt CM, Duffy MC, 1999; Westrich GH, Walcott-Sapp S. et al, 2010; ]. Период времени между первым и вторым этапами ревизионного эндопротезирования, используют для выявления некупированной инфекции с помощью клинической оценки и лабораторных тестов (СОЭ, СРБ, лейкоциты). Известно, что после первого этапа ревизии постоянный высокий уровень СРБ, СОЭ не могут быть достоверным маркером перипротезной инфекции. Решение об объеме второго этапа должно быть принято на основании комплексного анализа всех клинических и лабораторных данных. Как было указано ранее, антибактериальная терапия должна быть отменена за две недели до второго этапа ревизии для получения достоверного результата микробиологического исследования микробиологического исследования внутрисуставной жидкости и тканевых биоптатов. Внутрисуставную жидкость исследуют на наличие микрофлоры и клеточный состав. Во время второго этапа ревизионного эндопротезирования возможно применение конструкций как цементной, так и бесцементной фиксации. Выбор эндопротеза делают на основании стандартных критериев: дефицит кости, степень остеопороза. В ходе операции выполняют повторную хирургическую обработку, забирают образцы тканей на микробиологическое и гистологическое исследование. Удаленный спейсер так же направляют на микробиологическое исследование. Антибактериальная терапия при лечении перипротезной инфекции Антибактериальная терапия может быть: этиотропной – препаратами, активными в отношении выделенных возбудителей у конкретного пациента (таб.4) эмпирической – препаратами, которые активны в отношении ведущих возбудителей перипротезной инфекции, спектр и антибактериальная чувствительность которых определяется на основе локального мониторинга, наибольшей активностью обладает комбинация ванкомицин (ЛС-000602 от 11.02.10), линезолид (№: П N014286/01-2002 от 14.08.08) или даптомицин (ЛСР-005067/09 от 26.06.09) в сочетании с цефаперазоном/сульбактамом (П N012160/01 от 08.07.08) или одним их препаратов группы карбапенемов местной – костный цемент с АБ, антисептики системной – парентеральное и пероральное введение АБ Особенности антибактериальной терапии при лечении ППИ: при ревизии и санации гнойного очага начинать антибактериальную терапию следует после взятия образцов клинического материала и удаленных конструкций на бактериологическое исследование, если состояние больного не требует немедленного начала терапии; выбор препарата должен учитывать возбудителя, выделенного их дооперационного аспирата (при его наличии) или необходимо назначение эмпирической антибактериальной терапии необходимо назначение комбинированной терапии для усиления антистафилококкового или антисинегнойного эффекта, активности в отношении микробных биопленок, внутриклеточно расположенных возбудителей; назначение больших доз препаратов (таб.4) на длительное время – 6 недель и более после каждого этапа двухэтапного ревизионного ЭП, включая парентеральное введение антибиотиков в течение 10-14 суток. перед II этапом двухэтапного ревизионного ЭП период отмены АБ должен быть не менее 2 недель для профилактики антибиотико-ассоциированного колита целесообразно назначение пробиотиков антибактериальный препарат должен быть активным в отношении установленного возбудителя инфекции; необходимо учесть со стороны пациента: лекарственную непереносимость в анамнезе, функцию почек и печени, возможность принимать препарат внутрь; продолжительность курса антибактериальной терапии определяется характером инфекционного процесса, возбудителем и выбранной лечебной тактикой; необходимо проводить регулярный мониторинг эффективности и нежелательных реакций на фоне длительных курсов антибактериальной терапии: опрос пациента, клинический осмотр, выполнение лабораторного мониторинга (клинический анализ крови, СОЭ, СРБ, креатинин, АЛТ); начинать антибактериальную терапию при ревизии и санации гнойного очага следует после взятия образцов клинического материала и удаленных конструкций на бактериологическое исследование, если состояние больного не требует немедленного начала терапии; в случае двухэтапного хирургического лечения при проведении реимплантации эндопротеза введение антибиотиков начинают за 30-40 мин. до разреза, согласно принципам профилактики хирургических инфекций. Таблица3 Антибактериальные препараты*, рекомендованные для этиотропной терапии ППИ (№ регистрационных удостоверений см. табл. 4)
Рекомендации составлены на основе собственных данных, включающих результаты мониторинга спектра ведущих возбудителей ортопедической инфекции и их антибиотикочувствительности за период 2007-2012 гг. (Божкова С.А. с соавт., 2013а; Божкова С.А. с соавт. 2013б) Примечания: * – при аллергии на β-лактамные антибиотики; 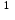 – в комбинации с рифампицином или ко-тримоксазолом или доксициклином или фосфомицином; – в комбинации с рифампицином или ко-тримоксазолом или доксициклином или фосфомицином;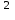 – в комбинации гентамицином. – в комбинации гентамицином.³ - при комбинации ванкомицина с гентамицином происходит усиление нефротоксичности, требуется постоянный мониторинг функции почек Таблица 4 Дозы и регистрационные номера антибактериальных препаратов для лечения перипротезной инфекции у взрослых пациентов с нормальной функцией печени и почек
. ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ И СПОСОБЫ ИХ УСТРАНЕНИЯ Развитие раннего послеоперационного поверхностного или глубокого нагноения у больных с ППИ трудно назвать осложнением после хирургического лечения. Как правило, такой хирургический исход следует расценивать как неэффективное лечение вследствие неадекватной или небрежно осуществленной лечебной тактики, либо вследствие недобросовестного отношения пациента к проводимому лечению (нарушение лечебного режима). Рецидив ППИ обусловлен выраженной дистрофией костной ткани, обширным инфекционным поражением и трофическими изменениями мягких тканей в области сустава, ограниченными ресурсами пластических тканей в непосредственной близости от очага. Однако рецидив может быть следствием небрежного отношения пациента к состоянию собственного здоровья. После проведенного лечения в домашних условиях необходимо исключить: - резкие температурные колебания – переохлаждение (одеваться-обуваться по сезону), перегревание (парные бани, летнее загорание на солнце), - чрезмерную, особенно хроническую, физическую нагрузку, удары, ушибы, вибрацию. После проведенного хирургического лечения больных с ППИ можно направить на бальнео- и климатолечебные курорты – Сочи, Пятигорск, Хмельник, Мироновка, Липецк, Пушкино (Московской области) и другие не ранее чем через 6 месяцев после операции. Спокойный, размеренный образ жизни, умеренные посильные психофизические нагрузки, исключение алкоголя, курения, прогулки на свежем воздухе и здоровая пища – есть образ жизни пациентов с ППИ. ЭФФЕКТИВНОСТЬ ИСПОЛЬЗОВАНИЯ ФЕДЕРАЛЬНЫХ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ По материалам регистра ППИ РНИИТО им. Р.Р. Вредена для хирургического лечения в отделение гнойной хирургии было госпитализировано в 2012г. - 196, в 2013 г. - 264, в 2014 г. - 159 пациентов с ППИ различных типов и активности. Эффективность хирургического лечения больных ППИ оценивают по двум критериям: I. Удовлетворительный исход – сочетание следующих клинических признаков: купирование инфекционного воспаления, заживление раны по типу первичного натяжения, жизнеспособность кожных или мышечных аутотрансплантатов, отсутствие отторжения имплантатов, восстановление или сохранение функции конечности, отсутствие рецидивов хронического остеомиелита на протяжении одного года. II. Неудовлетворительный исход – наличие одного из клинических признаков: раннее поверхностное или глубокое нагноение послеоперационной раны, рецидив ППИ до одного года, отсутствие восстановления функции конечности За период 2012-2014 г.г. в отделении гнойной хирургии проведено комплексное лечение 519 больных ППИ тазобедренного сустава, при этом у 459 пациентов (88,4%) было выполнено друхэтапное ревизионное эндопротезирование. Эффективность санации, удаления эндопротеза и установки спейсера ППИ в области тазобедренного сустава составила 73%. Средний срок госпитализации – 45 койко-дней. Удовлетворительный исход с заживлением раны по типу первичного натяжения наблюдали у 363 больных ППИ. Неудовлетворительный исход с ГИОХВ в области послеоперационной раны отмечен у 156 пациентов. На контрольный осмотр в поликлинику РНИИТО в срок от 1 года до 3 лет явились 352 пациента. Список литературы Божкова С.А., Тихилов Р.М., Краснова М.В. с соавт. Профиль резистентности возбудителей как основа выбора эффективного антибиотика при стафилококковых инфекциях протезированных суставов. КМАХ. 2013а; 15 (2): 115-123; Божкова С.А. Тихилов Р.М., Краснова М.В., Рукина А.Н., Ортопедическая имплант-ассоциированная инфекция: ведущие возбудители, локальная резистентность и рекомендации по антибактериальной терапии Травматология и ортопедия России. 2013б; 4(70): 6-15 Материалы международной согласительной конференции по перипротезной инфекции. Под.ред.: Тихилова Р.М. 2013, СПб: 355 c. Adeli B. The Infected Hip: A Treatment Algorithm. B. Adeli, J. Parvizi. - Semin Arthro 2011 Elsevier Inc.22.- р.100-102 Kurtz SM, Lau E, Watson H, Schmier JK, Parvizi J. Economic Burden of periprostheticjoint infection in the United States. J Arthroplasty. 2008;23:984- 91.[PubMed: 18534466] Tsukayama D.T., Estrada R., Gustilo R.B. infection after total hip arthroplasty a study of the treatment of one hundred and six infections. // J. Bone Jt. Surg. Am.- 1996. - 78: 512 - 523. Darouiche R. Treatment of infections associated with surgical implants. R.O. Darouiche. - N Engl J Med 2004;350:1422-9. Brandt CM, Sistrunk WW, Duffy MC, et al. Staphylococcus aureus prosthetic joint infection treated with debridement and prosthesis retention. Clin Infect Dis 1997; 24:914-9. Rand JA, Bryan RS. Reimplantation for the salvage of an infected total knee arthroplasty. J Bone Joint Surg Am 1983; 65:1081-6. Westrich GH, Walcott-Sapp S, Bornstein LJ, Bostrom MP, Windsor REBrause BD. Modern treatment of infected total knee arthroplasty with a 2-stage reimplantation protocol. J Arthroplasty 2010; 25:1015-21, 1021.e1-2. Segawa H, Tsukayama DT, Kyle RF, Becker DA, Gustilo RB. Infection after total knee arthroplasty. A retrospective study of the treatment of eighty-one infections. J Bone Joint Surg Am 1999; 81:1434-45. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
