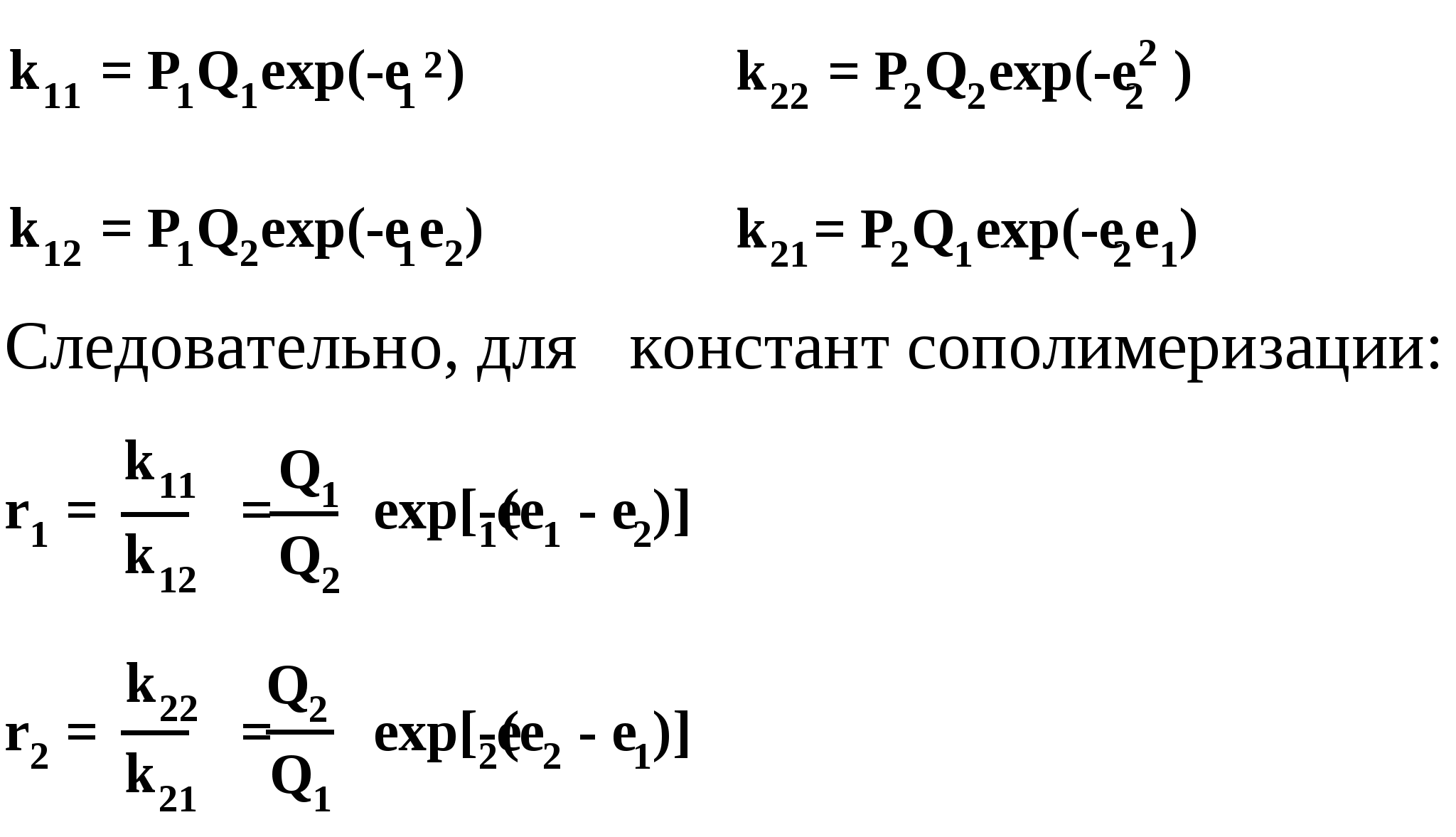Из изложенного выше ясна ключевая роль констант сополимеризации для прогнозирования ее результатов и для управления ходом процесса (выбора температурного режима и добавления в ходе процесса того мономера, который расходуется быстрее). Отсюда – важность определения величин констант сополимеризации.
Современные справочные материалы включают довольно многочисленные данные по величинам констант сополимеризации. Если же возникает необходимость исследовать новую пару мономеров или уже известную, но в ранее не исследованных условиях, величины констант необходимо определять. Существуют экспериментальные методы определения констант сополимеризации и методы их теоретического расчета.
Экспериментальное определение величин констант сополимеризации
Для экспериментального определения констант сополимеризации двух мономеров приготовляют несколько смесей этих мономеров с разным их соотношением – от заметного избытка одного до заметного избытка другого. Каждую смесь подвергают сополимеризации до малых глубин конверсии мономера (напомним, что при сколько-нибудь больших глубинах условие квазистационарности не действует, и уравнение Мейо-Льюиса теряет силу). Разумеется, все смеси сополимеризуют в одних и тех же условиях. Каждый сополимер выделяют из реакционной смеси (например, осаждением) и определяют его состав химическими или физическими методами. Этот состав условно считают дифференциальным (d[A]/d[B]); это не вполне корректно, но не слишком сильно искажает результаты. Полученные результаты обрабатывают; можно привести два варианта обработки:
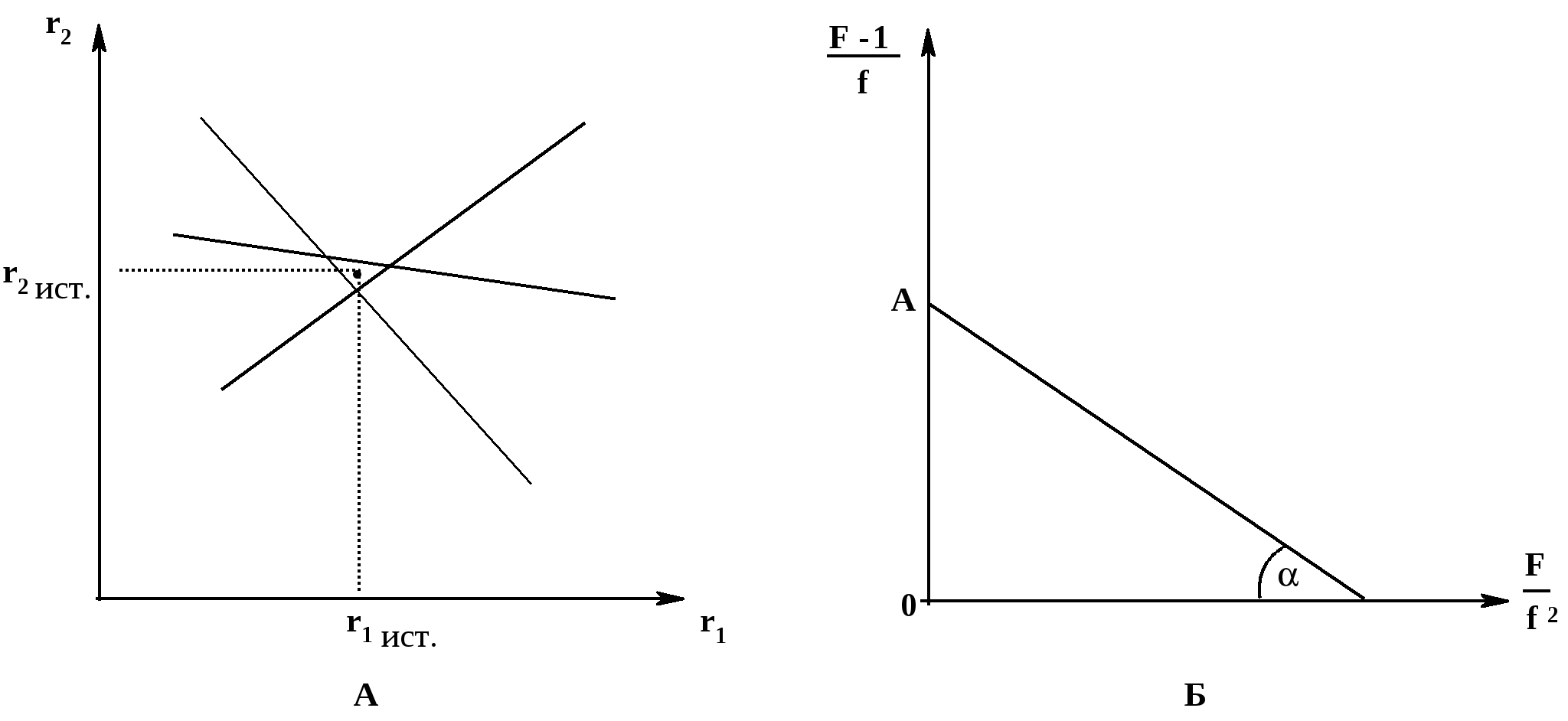
1. Метод Мейо-Льюиса. Для каждой смеси мономеров подставляют в уравнение Мейо-Льюиса соответствующие значения [A]/[B] (заданные) и d[A]/d[B]) (найденные); получаем линейное уравнение с двумя неизвестными – r1 и r2. Исходя их этого уравнения, строят график зависимости одной константы от другой; он является прямой линией. Если эксперимент проведен корректно, прямые для разных смесей мономеров пересекаются в достаточно ограниченной области (рис. 4, А):
Рис. 4. Расчет экспериментально определяемых констант сополимеризации
А. По Мейо-Льюису; Б. По Файнману - Россу
Координаты центра этой области пересечения прямых (r1 ист. и r2 ист.) соответствуют значениям констант r1 и r2 для данной пары мономеров в данных условиях.
2. Метод Файнмана-Росса. Обозначив d[A]/d[B] как F и [A]/[B] как f, и проведя ряд преобразований, приводят уравнение Мейо-Льюиса к виду:
И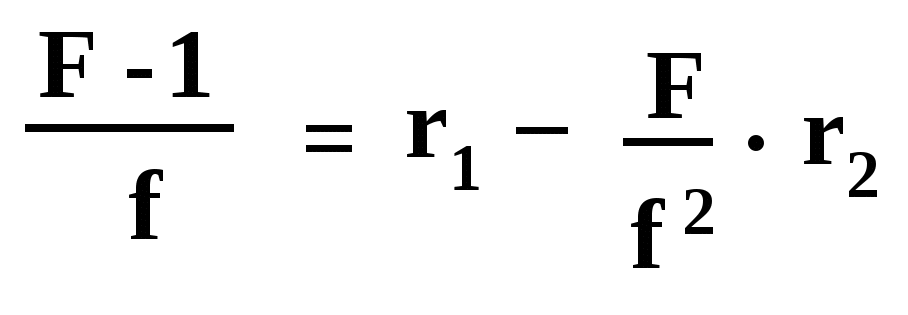
спользуя взятые значения [A] и [B] и найденные значения d[A] и d[B], вычисляют значения F и f для каждой смеси мономеров, а затем строят график в координатах F/f2 – (F-1)/f; он представляет собой прямую (рис. 4, Б). Эта прямая отсекает на оси ординат значение r1 (отрезок 0А); тангенс угла наклона прямой к оси абсцисс (tg) дает значение r2.
Теоретический расчет констант сополимеризации
Как уже упоминалось, константы сополимеризации характеризуют сравнительную реакционную способность мономеров и образующихся в реакции радикалов т.е. они напрямую связаны с их строением. Это делает принципиально возможным априорный расчет величин констант сополимеризации.
Пока не удалось найти точные количественные закономерности, связывающие величины констант сополимеризации со строением участвующих в процессе частиц. Однако удалось найти некоторые корреляционные зависимости, которые в той или иной мере эмпирически позволяют предсказывать величины констант сополимеризации (разумеется, лишь с известной степенью приближения). Среди этих корреляционных зависимостей наиболее известна так называемая Q – e –схема Элфри – Прайса (Alfrey – Price, 1947).
Согласно этой схеме сродство полимерного радикала и мономера (что и определяет легкость протекания любой элементарной реакции роста цепи) обусловлено следующими факторами: 1) фактор Р – величина, характеризующая активность радикала (для радикала A▪ - P1, для радикала
B▪ - Р2); 2) фактор Q – величина, характеризующая активность мономера (для мономера А - Q1, для мономера В - Q2); 3) фактор е – величина, характеризующая полярность мономера и соответствующего ему радикала ( для А и
А▪ - е1, для В и
B▪ - е2). Для упрощения принято, что фактор полярности для мономера и соответствующего ему радикала одинаков. Это, вообще-то, не вполне корректно, но заметно не ухудшает корреляцию. При этом для электроноизбыточных мономеров (например, винильных мономеров, содержащих донорный заместитель Х при С=С – связи, типа бутилвинилового эфира СН2=СН-ОВu) значение фактора е принимается отрицательным, а для электронодефицитных (например, акрилонитрила СН2=СН→CN) – положительным.
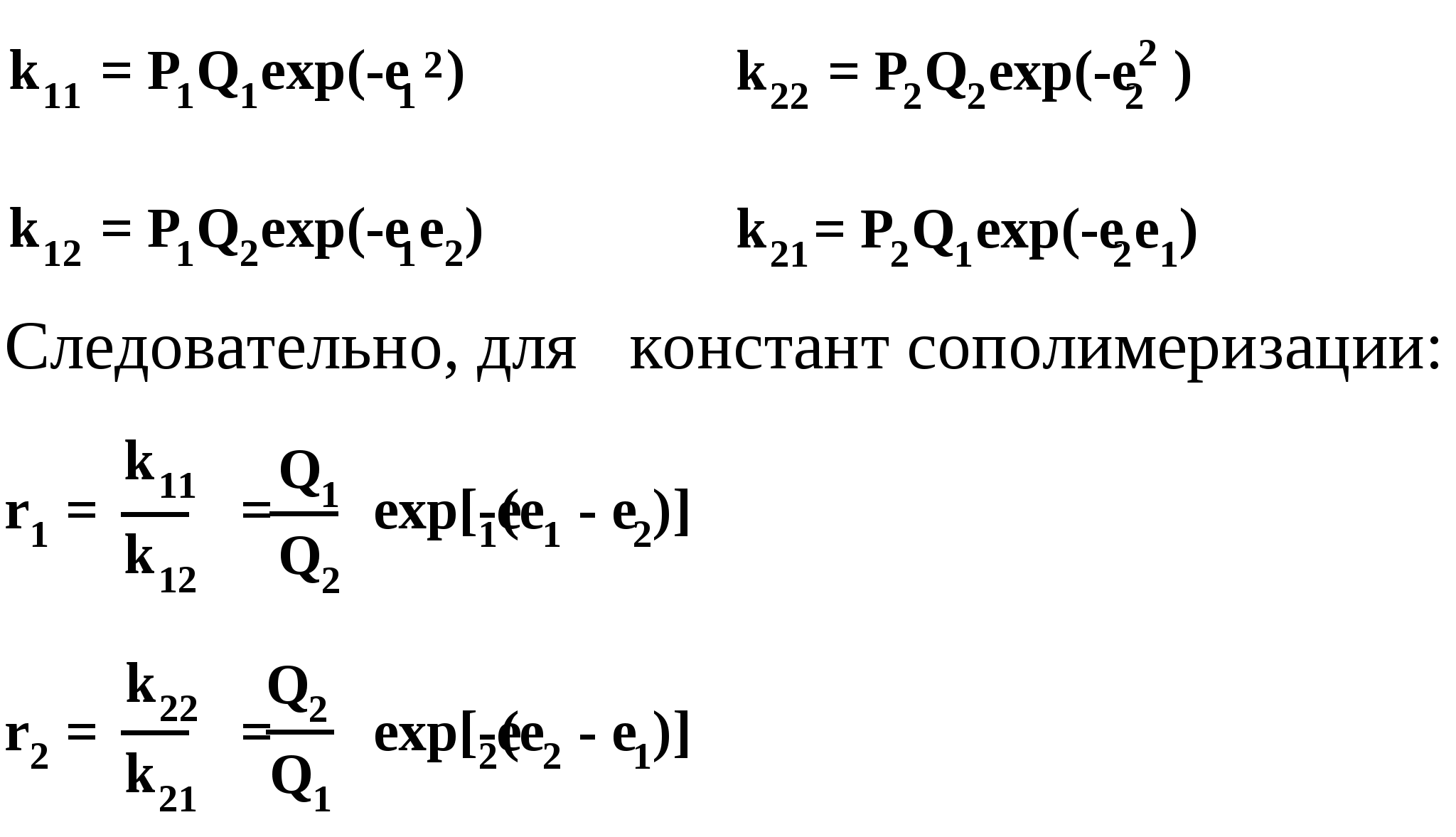
Согласно Элфри – Прайсу константы скорости элементарных реакции роста цепи при радикальной сополимеризации связаны с этими факторами следующим образом:
Таким образом, для расчета констант сополимеризации необходимо знать величины факторов Q и е. При этом здесь важны не абсолютные величины этих факторов, а их соотношение для разных мономеров (приведенные уравнения – корреляционные). Поэтому здесь в качестве «отправной точки» можно выбрать некий «эталонный» мономер, приписать ему некие, в общем-то, произвольные значения факторов Q и е (однако при условии, чтобы порядок и знак этих факторов как-то согласовывались со строением мономера), а далее экспериментально сравнивать другие мономеры с эталонным.
В качестве эталонного мономера был выбран стирол (пожалуй, наиболее «универсальный» мономер); ему были приписаны значения: Q = 1, е = - 0,8. Для определения величин факторов Q и е для какого-либо мономера проводят его сополимеризацию со стиролом и экспериментальноопределяют константы сополимеризации r1 и r2. Найденные значения констант подставляют в приведенные выше уравнения и получают два уравнения с двумя неизвестными Q2 и е2 (т.к. Q1 = 1, е1= - 0,8); решение уравнения дает искомые величины.
Таким способом были экспериментально определены величины факторов Q и е для многих мономеров; выбрав любую пару из этих мономеров, можно рассчитать константы сополимеризации для этой пары (для тех же условий, в которых определялись величины Q и е. Достоверность этих расчетов далеко не стопроцентная, но все же позволяет предсказать порядок величин констант сополимеризации и их соотношение и во многих случаях отнести пару мономеров к одной из четырех упомянутых выше групп.
Анализ приведенных выше уравнений Элфри – Прайса показывает , что если полярность мономеров противоположна (факторы е имеют разные знаки), то обе константы сополимеризации будут меньше единицы, т.е. сополимер будет иметь тенденцию к чередованию. Поэтому если, допустим, стоит задача получить частично чередующийся сополимер двух винильных мономеров, нужно выбрать пару, где один мономер содержит донорный заместитель при связи С=С, а другой – акцепторный. Есть предположение, что такая «донорно-акцепторная» пара мономеров образует комплекс с переносом заряда, что увеличивает скорость сополимеризации и дополнительно способствует чередованию.
Изучение сополимеризации помимо совершенно очевидного прикладного интереса имеет и весьма важное теоретическое значение, т. к. позволяет получить важную информацию о реакционной способности мономеров.
Закономерности сополимеризации трех мономеров в принципе аналогичны описанным выше, но расчеты здесь более громоздкие (например, необходимо учитывать уже не две, а шесть констант сополимеризации).
Рассмотренные здесь закономерности радикальной сополимеризации во многом применимы и к ионной сополимеризации, т.к. формирование цепи сополимера, как и при радикальных процессах, идет на стадии роста по цепному механизму, путем взаимодействия активного центра с мономером.
Резюме
Цепная полимеризация – разновидность реакций, протекающих по цепным механизмам. Она включает три этапа – инициирование, рост кинетической цепи и обрыв кинетической цепи. При этом рост кинетической цепи идет путем присоединения активных центров к молекулам мономеров; растущую цепь называют «живым полимером»
Радикальная полимеризация – вариант цепной полимеризации, в котором активными центрами являются радикалы – частицы с неспаренным электроном. Обычные мономеры – алкены Инициирование – образование радикалов из молекул мономеров – может идти термически, фотохимически, радиационно, но чаще всего – с использованием инициаторов – обычно пероксидов или азосоединений. Рост кинетической цепи протекает с очень высокой скоростью, что позволяет за время порядка 10 сек. сформировать цепь, содержащую тысячи звеньев. Для несимметрично незамещенных производных этилена доминирует соединение звеньев по типу «голова к хвосту». Обрыв цепи происходит при встрече двух радикалов (обычно – «живых полимеров») и протекает большей частью путем рекомбинации и в меньшей степени – путем диспропорционирования. Образующийся при этом «мертвый» полимер содержит осколки инициатора в качестве концевых групп – с обоих концов при рекомбинации и с одного – при диспропорционировании.
Реакции роста цепи во многих случаях сопровождаются реакциями передачи цепи, из которых наиболее важны реакции передачи на посторонние примеси (регуляторы и ингибиторы) и на «мертвый» полимер (образование разветвлений)
Кинетика радикальной полимеризации проста при малых глубинах процесса и может значительно усложняться при бóльших глубинах (гель-эффект).
Результаты радикальной сополимеризации двух или более мономеров определяются константами сополимеризации, которые характеризуют сравнительную реакционную способность мономеров и зависят от строения мономеров и от температуры. Знание этих констант позволяет контролировать и регулировать процесс сополимеризации.
|
 Скачать 0.64 Mb.
Скачать 0.64 Mb.