Определение содержания железа в реальных объектах. Анализ химического реактива нитрат железа (III). Курсовая работа. Определение содержания железа в реальных объектах. Анализ химического реактива нитрат железа (iii)
 Скачать 142.13 Kb. Скачать 142.13 Kb.
|
2.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ2.1 Подготовка к анализуБыл получен образец соли нитрата железа (III) массой 21,3667 г. Навеску соли количественно перенесли в колбу на 1000 мл, разбавили водой до метки и перемешали. 2.2 Проведение анализа2.2.1 Гравиметрический метод определения железа (III)Реагенты и оборудование Азотная кислота HNO₃, концентрированная (ρ=1,40 г/см²) Аммиак NH₃, 10 %-ный раствор Аммоний азотнокислый NH₄NO₃, 10 %-ный горячий раствор Серебро азотнокислое AgNO₃, 10 %-ный раствор Горячая дистиллированная вода 6 стаканов на 400 мл 6 палочек для перемешивания 6 воронок для фильтрования Фильтр «красная лента» 6 колец Стакан на 100 мл Пипетка Мора на 25 мл 3 промывалки Мерный цилиндр 6 тиглей, прокаленных до постоянной массы Эксикатор Сушильный шкаф Муфельная печь Лабораторные весы Выполнение работы Для анализа возьмем 6 аликвот по 25 мл раствора. К исследуемому раствору приливаем 5 мл концентрированной HNO₃ и нагреваем до кипения, затем разбавляем до 150 мл горячей водой и приливаем при непрерывном перемешивании раствор аммиака до появления явного запаха аммиака. Даем осадку собраться на дне стакана и проверяем полноту осаждения гидроксида железа. Для этого осторожно по стенке стакана приливаем 2 мл раствора аммиака: если в месте соприкосновения добавляемого реактива и исследуемого раствора не появляется осадок - осаждение следует считать полным. Фильтрование осадка проводят на фильтре «красная лента». Методом декантации переносим раствор над осадком, сливая его по палочке на фильтр. При помощи промывной жидкости 1 %-ного горячего раствора NН₄NО₃, методом декантации переносим осадок на фильтр, а оставшиеся частицы осадка на стенках стакана и на палочке снимаем кусочком беззольного фильтра, смоченного промывной жидкостью. Кусочки фильтра помещают в воронку. Осадок на фильтре промывают горячим раствором NН₄NО₃, делая пробу на полноту промывания. Для этого отдельную порцию фильтрата подкисляют азотной кислотой и добавляют несколько капель раствора азотнокислого серебра - допустима лишь слабая опалесценция. Воронку с фильтром помещаем в сушильный шкаф, подсушиваем осадок, и помещаем его вместе с влажным фильтром в предварительно доведенный до постоянной массы тигель. Тигель помещаем в муфельную печь, осторожно озоляем фильтр при открытой дверце муфеля, а затем прокаливаем при температуре 800-900°С и доводим тигель с осадком до постоянной массы. Массу Fe(NO₃)₃ находим по формуле 1: 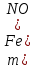 (1) (1)где m – масса, F – гравиметрический коэффициент перерасчета массы Fe₂O₃ и Fe(NO₃)₃ равный 1,7826, V – объем Результаты гравиметрического анализа представлены в таблице 3. Таблица 3. Результаты гравиметрического анализа
QкритMAX = 0,56 Содержание нитрата железа (III) в образце ω = 60,8±0,1% 2.2.2 Дихроматометрический метод определения железа (III)Реагенты и оборудование Раствор K₂Cr₂O₇ - С(⅟₆K₂Cr₂O₇)= 0,05 моль/л Смесь фосфорной и серной кислот Цинк гранулированный Концентрированная соляная кислота Индикатор - дифениламин 6 конических колб на 250 мл 2 стакана на 100 мл Бюретка на 25 мл с ценой деления 0,1 мл Пипетка Мора на 10 мл Мерный цилиндр Плитка электрическая Выполнение работы К аликвоте 10 мл исследуемого раствора необходимо добавить 30 мл воды 2-3 гранулы металлического цинка, 5 мл концентрированной соляной кислоты и прокипятить его в течение 3 мин до исчезновения желтой окраски раствора. Железо (III) полностью восстановится до железа (II). В колбу для титрования вносим 8 мл защитной смеси, 2 капли индикатора дифениламина и титруем по каплям из бюретки раствором дихромата калия до появления сине-фиолетовой окраски. Массу Fe(NO₃)₃ находим по формуле 2: 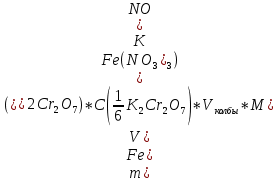 (2) (2)где m – масса, V – объем, C – нормальная концентрация, M – молярная масса Результаты дихроматометрического анализа представлены в таблице 4 Таблица 4. Результаты дихроматометрического анализа
QкритMAX = 0,56 Содержание нитрата железа (III) в образце ω = 56,8±0,3% 2.2.3 Комплексонометрический метод определения железа (III)Реагенты и оборудование Фиксанал ЭДТА дигидрат 0,05 моль Фиксанал MgSO₄·7H₂O 0,05 моль Кислота сульфосалициловая двуводная Кислота соляная разбавленная Бумага индикаторная универсальная Эриохром черный Т (ЭХЧ-Т), смесь с NaCl в соотношении 1:200 Аммиачный буфер pH=10 Плитка электрическая. Весы аналитические. 2 мерные колбы вместимостью 2000 мл Мерная колба вместимостью 100 мл Пипетка вместимостью 10 мл 6 конических колбы вместимостью 250 мл. Бюретка на 25 мл с ценой деления 0,1 мл 2 воронки 2 бойка Подготовка к анализу Получены 2 фиксанала: ЭДТА дигидрат, содержащий 0,05 моль вещества, и MgSO₄·7H₂O, содержащий 0,05 моль вещества. Аккуратно разобьем донышки фиксаналов и количественно перенесем вещества в колбы на 2000 мл, промывая дистиллированной водой. Доводим уровень раствора в колбах до метки дистиллированной водой. Концентрации растворов ЭДТА и сульфата магния равны 0,025 моль/л. Навеску сульфосалициловой кислоты 10 г количественно переносим в колбу на 100 мл, доводим до метки и перемешиваем. Стандартизация раствора ЭДТА Отбираем пипеткой 10 мл 0,05 М раствора сульфата магния и переносим в коническую колбу прибавляем 15 мл аммиачного буфера (pH=10), перемешиваем раствор и прибавляем на кончике ложечки около 0,05 г индикатора ЭХЧ-Т. Раствор перемешиваем и тируем 0,05 н. раствором ЭДТА до перехода красной окраски в синюю. Концентрацию ЭДТА находим по формуле 3: 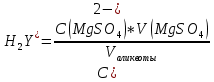 (3) (3)где С - нормальная концентрация, V - объем Результаты стандартизации ЭДТА представлены в таблице 5 Таблица 5. Результаты стандартизации ЭДТА
QкритMAX = 0,64 Концентрация ЭДТА равна 0,0250±0,0004 моль/л Выполнение работы В коническую колбу вместимостью 250 см отбираем пипеткой 10 мл анализируемого раствора,, приливаем 20 мл соляной кислоты, приливаем 100 мл воды, нейтрализуем аммиаком до рН около 2 (по универсальной индикаторной бумаге), нагреваем раствор до 60-70 °С, приливаем 2 мл раствора сульфосалициловой кислоты и титруем железо (III) 0,05 н. раствором ЭДТА (добавляя раствор ЭДТА медленно, тщательно перемешивая) до перехода окраски из темно-красной в желтую. Массу Fe(NO₃)₃ находим по формуле 4: 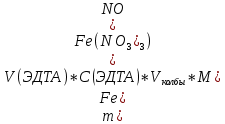 (4) (4)где m – масса, V – объем, C – нормальная концентрация, M – молярная масса Результаты комплексонометрического анализа представлены в таблице 6 Таблица 6. Результаты комплексонометрического анализа
QкритMAX = 0,56 Содержание нитрата железа (III) в образце ω = 59,4±0,2% 2.2.4. Фотометрический метод определения железа (III) с сульфосалициловой кислотойРеагенты и оборудование Кислота сульфосалициловая 2-водная Аммиак водный, разбавленный 1:1. Квасцы железоаммонийные. Кислота серная концентрированная Азотная кислота HNO₃, концентрированная (ρ=1,40 г/см²) Аммиак NH₃, 10 %-ный раствор Аммоний азотнокислый NH₄NO₃, 10 %-ный горячий раствор Серебро азотнокислое AgNO₃, 10 %-ный раствор Горячая дистиллированная вода Фотоэлектроколориметр Весы аналитические. Колбы мерные вместимостью 100 мл (7), 250 мл, 200 мл Пипетка вместимостью 10 мл, на 50 мл. Пипетка вместимостью 10 мл с ценой деления 0,02 мл. Мерный цилиндр Стакан на 100 мл, на 400 мл (2) 2 палочки для перемешивания 2 воронки для фильтрования Фильтр «красная лента» 2 кольца Промывалка 2 тигля, прокаленных до постоянной массы Эксикатор Сушильный шкаф Муфельная печь Подготовка к анализу Для построения калибровочного графика необходимо приготовить стандартный раствор железа с концентрацией 1,5 мг/мл, для этого навеску 3,2400 г железноаммонийных квасцов FeNH₄(SO₄)₂ количественно переносим в колбу на 250 мл, добавляем 100 мл дистиллированной воды, 10 мл концентрированной серной кислоты и нагреваем до полного растворения соли. Полученный раствор содержит 1,5 мг/мл железа (III). Для установления точной концентрации стандартного раствора железа необходимо повести стандартизацию. Стандартизацию проведем гравиметрическим методом, для этого возьмем 2 аликвоты по 50 мл раствора. К исследуемому раствору приливаем 5 мл концентрированной HNO₃ и нагреваем до кипения, затем разбавляем до 150 мл горячей водой и приливаем при непрерывном перемешивании раствор аммиака до появления явного запаха аммиака. Даем осадку собраться на дне стакана и проверяем полноту осаждения гидроксида железа. Для этого осторожно по стенке стакана приливаем 2 мл раствора аммиака: если в месте соприкосновения добавляемого реактива и исследуемого раствора не появляется осадок - осаждение следует считать полным. Фильтрование осадка проводят на фильтре «красная лента». Методом декантации переносим раствор над осадком, сливая его по палочке на фильтр. При помощи промывной жидкости 1 %-ного горячего раствора NН₄NО₃, методом декантации переносим осадок на фильтр, а оставшиеся частицы осадка на стенках стакана и на палочке снимаем кусочком беззольного фильтра, смоченного промывной жидкостью. Кусочки фильтра помещают в воронку. Осадок на фильтре промывают горячим раствором NН₄NО₃, делая пробу на полноту промывания. Для этого отдельную порцию фильтрата подкисляют азотной кислотой и добавляют несколько капель раствора азотнокислого серебра - допустима лишь слабая опалесценция. Воронку с фильтром помещаем в сушильный шкаф, подсушиваем осадок, и помещаем его вместе с влажным фильтром в предварительно доведенный до постоянной массы тигель. Тигель помещаем в муфельную печь, осторожно озоляем фильтр при открытой дверце муфеля, а затем прокаливаем при температуре 800-900°С и доводим тигель с осадком до постоянной массы. Концентрацию Fe³⁺ находим по формуле 5: 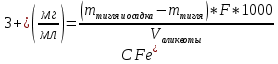 (5) (5)где С – концентрация, F – гравиметрический коэффициент перерасчета массы Fe₂O₃ и Fe равный 0,6994 , V – объем Результаты гравиметрического анализа представлены в таблице 7. Таблица 7. Результаты гравиметрического анализа
Концентрация стандартного раствора железа (III)равна 1,493 мг/мл Для анализа необходим раствор 2-водной сульфосалициловой кислоты с концентрацией 200 мг/мл, для этого навеску 2-водной сульфосалициловой кислоты массой 50 г количественно перенесем в колбу на 200 мл и доведем до метки. Построение градуировочного графика. В мерные колбы вместимостью 100 мл вводят из микробюретки 0,5; 1,0; 2,5; 3,5 и 4,0 мл стандартного раствора железа, разбавляют до 10 мл водой, приливают 10 мл раствора сульфосалициловой кислоты, 15 мл раствора аммиака и доводят до метки водой. Через 20 минут измеряют оптическую плотность раствора на фотоэлектроколориметре, используя светофильтр с максимумом светопропускания при длине волны 430 нм и кювету с толщиной поглощающего свет слоя 20 мм по отношению к одновременно приготовленному "нулевому" раствору, содержащему все реактивы, за исключением стандартного раствора железа. Данные калибровки представлены в таблице 8. Таблица 8. Данные калибровки стандартного раствора железа.
Рисунок 4. Калибровочный график стандартного раствора железа (III).  Выполнение работы Для определения железа в мерную колбу вместимостью 100 см отбирают аликвотную часть раствора 1 мл, приливают 10 мл раствора сульфосалициловой кислоты, 15 мл раствора аммиака и доводят до метки водой. Через 20 мин измеряют оптическую плотность раствора на фотоэлектроколориметре, используя светофильтр с максимумом светопропускания при длине волны 430 нм и кювету с толщиной поглощающего свет слоя 20 мм по отношению к раствору контрольного опыта, который проводят через все стадии анализа одновременно с анализом серии проб. Концентрацию железа находят по градуировочному графику. Массу Fe(NO₃)₃ находим по формуле 6: 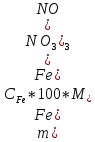 (6) (6)Результаты фотометрического анализа представлены в таблице 9 Таблица 9. Результаты фотометрического анализа
Содержание нитрата железа (III) в образце ω = 60,34% |
