Определение содержания железа в реальных объектах. Анализ химического реактива нитрат железа (III). Курсовая работа. Определение содержания железа в реальных объектах. Анализ химического реактива нитрат железа (iii)
 Скачать 142.13 Kb. Скачать 142.13 Kb.
|
1.2 Инструментальные методы1.2.1 Амперометрическое определение железа (III)Метод амперометрического определения железа основывается на дихроматометрическом титровании, конечная точка титрования фиксируется инструментально. Метод основан на измерении предельного диффузионного тока, проходящего через раствор при фиксированном напряжении между индикаторным электродом и электродом сравнения. При амперометрическом титровании точку эквивалентности определяют по излому кривой ток – объем добавляемого рабочего раствора. Индикаторным электродом в методе амперометрического титрования является платиновый электрод, впаянный в стеклянную трубку, а электродом сравнения является насыщенный каломельный (или хлорсеребряный) электрод. 1.2.2 Кулонометрическое определение железа (III)Кулонометрический метод[8] основан на восстановлении ионов Fе³⁺ электрогенерируемыми ионами Cu⁺: Cu²⁺ + e⁻ → Cu⁺, затем Cu⁺ + Fе³⁺ → Fe²⁺ + Cu²⁺. Генераторный рабочий электрод – платиновая фольга (катод), вспомогательный – серебряная спираль (анод). Расчет результатов анализа проводится по формуле Фарадея. Точность определения железа по предложенному способу в 3 раза выше, чем по другим извесиным методам. Кроме того, благодаря отсутствию подготовительных операций перед анализом. Этот способ является простым и быстрым. 1.3 Физико-химические методы анализа.1.3.1 Фотометрическое определение железа (III)Фотометрический метод определения железа (III) c о-фенантролином[9] Фотометрический метод определения массовой концентрации общего железа основан на взаимодействии ионов Fe (II) с о-фенантролином с образованием красного комплекса с максимумом светопоглощения при λ=510 нм. Восстановление Fe (III) до Fe (II) проводят гидроксиламином. Окраска комплекса не зависит от рН в пределах от 3 до 9 ед. рН и устойчива длительное время. Если массовая концентрация общего железа в анализируемой пробе превышает верхнюю границу, то допускается разбавление пробы таким образом, чтобы концентрация общего железа соответствовала регламентированному в таблице 1 диапазону. Таблица 1. Диапазон концентрации общего железа
Мешающие влияния, обусловленные присутствием в пробе меди, кобальта, хрома, цинка в количествах, превышающих в 10 раз концентрацию железа, органических веществ, нитритов, полифосфатов и др. устраняются специальной подготовкой пробы. Фотометрический метод определения железа (III) c сульфосалициловой кислотой[10] Метод основан на том, что ион железа (III) образует с сульфосалициловой кислотой внутрикомплексные соединения различного цвета в зависимости от величины рН среды. При рН 1,8-2,5 образуется окрашенный в буровато-розовый цвет комплексный катион: Fe3+ + Sal2 FeSal⁺ где Sal²⁻ ион сулфосалициловой кислоты, формула которой представлена на рисунке 3 Рисунок 3. Формула сулфосалициловой кислоты . 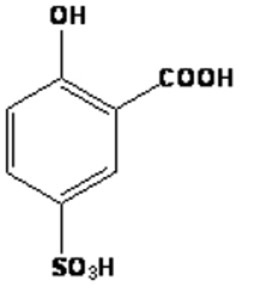 При рН 4-8 образуется комплексный анион бурого цвета: Fe3+ + 2Sal2 Fe(Sal)2, а при рН 8-12 трисульфосалицилат-ион Fe(Sal)33 жёлтого цвета: Fe3+ + 3Sal2 Fe(Sal)33. Чувствительность анализа 2 мкг железа в 50 мл конечного объема при толщине слоя раствора 50 мм. 1.3.2 Колориметрическое определение железа (III)Колориметрическое определение ионов железа (III) с роданид-ионами[11] Колориметрическое определение ионов железа (III) основано на их взаимодействии с ионами CNS⁻, сопровождающемся образованием железо-роданидных комплексов, окрашивающих раствор в кроваво-красный цвет, тем более интенсивный, чем больше ионов Fe(III) содержалось в растворе. К недостаткам этого метода относится то, что в зависимости от содержания ионов CNS⁻ в растворе состав комплексов может быть различным. Эта реакция весьма чувствительна и позволяет определять железо при содержании его в растворе 10⁻⁷ г/мл . Если к раствору, содержащему роданид железа, прибавить немного изоамилового спирта и смесь тщательно взболтать, роданид железа растворится в спирте. Так как изоамиловый спирт с водой не смешивается, окрашенный слой всплывает на поверхность. Ввиду малого количества прибавленного изоамилового спирта концентрация роданида железа в нем значительно выше, чем во всем водном растворе, и поэтому при колориметрировании спиртового раствора чувствительность метода увеличивается. Колориметрическое определение ионов железа (III) с 2,2'-дипиридилом[12] Метод основан на образовании устойчивого, окрашенного в красный цвет, комплексного соединения ионов Fe (II) с 2,2'-дипиридилом после восстановления ионов Fe (III) до Fe (II) аскорбиновой кислотой или гидрохлоридом гидроксиламина. Окраска устойчива в течение длительного времени. Определению мешают ионы серебра, ртути, меди, никеля, кобальта, цинка, висмута, оксалатов, цианидов, фосфатов, молибдена. Метод не применим для соединений кадмия. |
