Определение содержания железа в реальных объектах. Анализ химического реактива нитрат железа (III). Курсовая работа. Определение содержания железа в реальных объектах. Анализ химического реактива нитрат железа (iii)
 Скачать 142.13 Kb. Скачать 142.13 Kb.
|
1. ЛИТЕРАТУРНЫЙ ОБЗОРНа данный момент существует большое количество методов определения железа (III). Все методы можно разделить на три группы: классические (гравиметрия, титриметрия), инструментальные (амперометрия, кулонометрия), физико-химические (фотометрия, колориметрия). 1.1 Классические методы1.1.1 Гравиметрические методы определения железа (III)Гравиметрический метод анализа является одним из важнейших методов количественного химического анализа. Основным достоинством гравиметрического метода, как является его высокая точность (до 0,2%). Однако из-за большой продолжительности гравиметрические определения не могут использоваться для экспрессного (быстрого) определения каких-либо показателей качества сырья или готовой продукции. В то же время гравиметрический метод незаменим при арбитражных анализах и широко применяется при выполнении научно-исследовательских работ для сравнения аналитических данных, полученных разными методами. Наибольшее значение имеет метод осаждения. Сущность данного метода заключается в том, что определяемую составную часть анализируемого вещества выделяют в осадок в виде малорастворимого соединения, которое после соответствующей обработки (отделение от раствора, промывание, высушивание или прокаливание) взвешивают. Первый метод – основан на осаждении железа (III) в виде гидроксида водным раствором аммиака в виде гидроксида железа (осаждаемая форма): Fe³⁺ + 3NH₃ + 3Н₂О → “Fе(ОН)₃” + 3NH₄⁺ Осаждение проводят из горячих растворов горячим раствором осадителя. Нагревание усиливает гидролиз исходного раствора: Fe³⁺ + Н₂О → Fе(ОН)²⁺ + Н⁺ Fе(ОН)²⁺ + Н₂О → Fе(ОН)₂⁺ + Н⁺ При действии аммиака равновесия указанных реакций смещается вправо. Полученный осадок фильтруют, промывают прокаливают 800-900°С и взвешивают: Fе(ОН)₃ → Fе₂O₃ + 3Н₂О По массе осадка Fе₂O₃ рассчитывают, сколько в нем содержится железа. Малая растворимость осаждаемой формы Fе(ОН)₃ (ПР = 6,3 • 10⁻³⁸) приводит к тому, что железо количественно осаждается даже из слабокислых растворов. Недостатком метода является то, что при температуре выше 900⁰С происходит частичное восстановление оксида железа углеродом до Fе₃O₄, поэтому необходимо контролировать температуру и длительность прокаливания. Второй метод[6] предполагает определении трехвалентного железа в виде малорастворимого комплекса с нитрилотриметилфосфорной кислотой (НТФ). Формула НТФ приведена на рисунке 1. Рисунок 1. Формула нитрилотриметилфосфорной кислоты. 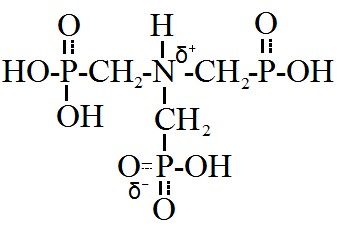 Способ основан на том, что железо даже в сильнокислой среде, где большинство ионов металлов не образует нитрилотриметилфосфонатов, количественно осаждается нитрилотриметилфосфорной кислотой. Осаждение 0,1—10 мг элемента проводят при нагревании. водными растворами НТФ, Полученное соединение имеет строгий стехиометрический состав, что исключает необходимость прокаливания по окисла. Данный метод имеет большую избирательность и точность определения, а также ввиду того, что прокаливание не требуется, сокращается время анализа. 1.1.2 Титриметрические методы определения железа (III)Титриметрический (объёмный) анализ является одним из важнейших видов количественного анализа. Его основными достоинствами являются точность, быстрота исполнения и возможность применения для определения самых разнообразных веществ. Определение содержания вещества в титриметрическом анализе осуществляется в результате проведения реакции точно известного количества одного вещества с неизвестным количеством другого, с последующим расчётом количества определяемого вещества по уравнению реакции. Метод комплексонометрического титрования железа (III)[7] основан на реакции образования слабоокрашенного комплексного соединения трехвалентного железа с этилендиаминтетраацетатом натрия (ЭДТА). ЭДТА образует с ионами железа (III) прочный комплекс состава 1:1, что исключает ступенчатое комплексообразование и упрощает анализ и сопутствующие ему расчеты. Fe³⁺ + H₂Y²⁻ → FeH₂Y⁺ где H₂Y²⁻ - анион этилендиаминтетраацетат, формула которого представлена на рисунке 2. Рисунок 2. Формула этилендиаминтетраацетат-иона. 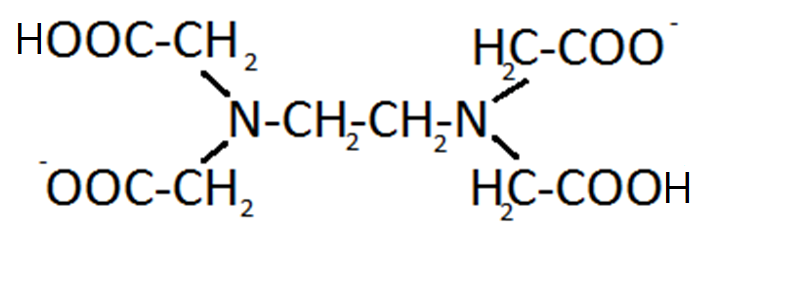 Индикатор метода – сульфосалициловая кислота - образует с ионами железа (III) сильно окрашенный фиолетовый комплекс, который разрушается при добавлении ЭДТА. Полный переход окраски от фиолетовой до желтой свидетельствует о конечной точке титрования. Метод комплексонометрического титрования обладает высокой чувствительностью (до 10-3 моль/л) и точностью (погрешность 0,1-0,3%), быстр и прост в исполнении, имеет достаточно высокую селективность. Методы окислительно-восстановительного титрования для определения железа (III) основаны на восстановлении железа (III) до железа (II), например цинком в солянокислой среде (выделяющийся атомарный водород восстанавливает железо (III) до железа (II)), гидроксиламин и др. Затем железо (II) титруется раствором окислителя (KMnO₄, K₂Cr₂O₇, Ce(NO₃)₄ и др.) Перманганатометрическое определение основано на реакции: 5Fe²⁺ + МnO₄⁻ + 8Н⁺ → 5Fе³⁺ + Мn²⁺ + 4Н₂O n(⅕КМnО₄) = n(Fe) уравнения полуреакций: Fe²⁺ -e⁻ → Fе³⁺, E⁰Fe³⁺/Fe²⁺ = 0,77 В МnO₄⁻ + 8Н⁺ → Мn²⁺, E⁰МnO₄⁻/Мn²⁺ = 1,51 В выделяющееся при этом железо (III) связывают в бесцветный комплекс с фосфорной кислотой, добавляя смесь Рейнгарда-Циммермана. Конечная точка титрования фиксируется появлением неисчезающей слабой малиновой окраски раствора при добавлении одной капли индикатора. Метод обладает рядом достоинств: титрование проводится без постороннего индикатора, высокое значение E⁰МnO₄⁻/Мn²⁺ позволяет определять большое число веществ; перманганат калия доступен и сравнительно недорог. К недостаткам перманганатометрии относятся: невозможность приготовления стандартного раствора титранта по точной навеске, его нестабильность при хранении, необходимость в проведении стандартизации необходимость строгого соблюдения условий проведения титрования, невозможность использования метода в присутствие хлороводородной кислоты Дихроматометрическое определение основано на реакции: 6Fe²⁺ + Cr₂O₇²⁻ + 14Н⁺ → 6Fе³⁺ + 2Cr³⁺ + 7Н₂O n(⅟₆К₂Cr₂O₇) = n(Fe) уравнения полуреакций: Fe²⁺ -e⁻ → Fе³⁺, E⁰Fe³⁺/Fe²⁺ = 0,77 В Cr₂O₇²⁻ + 14Н⁺ → 2Cr³⁺ + 7Н₂O E⁰ Cr₂O₇²⁻/Cr³⁺ = 1,33 В выделяющееся при этом железо (III) связывают в бесцветный комплекс с фосфорной кислотой, добавляя смесь Кнопфа. Конечная точка титрования фиксируется с помощью индикатора дифениламина – возникновение неисчезающей сине-фиолетовой окраски. Недостаткомдихроматного метода является то, что при переходе от Cr₂O₇²⁻ - к Cr³⁺ окраска меняется из оранжевой на зеленую, что затрудняет наблюдение конца титрования. Чтобы уменьшить влияние зеленой окраски, раствор перед титрованием разбавляют. Достоинствами метода являются: К₂Cr₂O₇ - первичный стандарт – стандартный раствор можно приготовить по точной навеске К₂Cr₂O₇ - стабилен при хранении Раствор К₂Cr₂O₇ не требует стандартизации |
