Опухоли. Классификация. патана 12. Опухоль (новообразование, бластома)
 Скачать 1.1 Mb. Скачать 1.1 Mb.
|
Для чего нужна биопсия?Методы визуализации, такие как МРТ, КТ, ПЭТ, УЗИ и другие, позволяют выявить опухоль, ее размеры и форму, распространенность, наличие метастаз, но эти методы не могут предоставить данные о клеточном составе, происхождении и степени злокачественности. Все эти сведения дает биопсия после микроскопического, биохимического и других необходимых видов исследования. В результате консилиум специалистов для определения наиболее эффективной стратегии лечения получает полную характеристику опухоли, прогноз о ее дальнейшем развитии, о ее восприимчивости к тем или иным методам лечения. Также хирургия помогает определиться с объемом оперативного вмешательства (на примере рака груди — удалять всю молочную железу либо только участок). В каких случаях проводится биопсия?Забор материала для последующего исследования необходим в следующих случаях: подтвердить или опровергнуть злокачественность новообразования идентификации рака определение метастаз в лимфоузлах диагностика заболеваний крови (биопсия костного мозга) подозрение на рецидив опухоли подозрение метастаз в органах и костях Взятый при биопсии материал направляется в лабораторию на гистологическое и цитологическое исследование. Доброкачественные и злокачественные опухоли: разновидности, сравнительная характеристика. – см. в номенклатуре, и вот: Доброкачественные опухоли, их свойства: растут экспансивно, раздвигая и сдавливая окружающие ткани; как правило, четко отграничены и могут иметь фиброзную капсулу (псевдокапсулу); в полых и трубчатых органах характеризуются чаще экзофитным типом роста (растут в просвет); почти всегда растут медленно; не дают метастазов; обладают тканевым атипизмом, но не имеют атипии и полиморфизма клеток опухолевой паренхимы. характеризуются митотической активностью опухолевой паренхимы, редко выходящей за пределы соответствующей нормы. Злокачественные опухоли, их свойства: обладают инвазивным (инфильтрирующим) ростом с прорастанием окружающих тканей и их разрушением; в полых и трубчатых органах характеризуются как экзофитным, так и эндофитным типом роста; почти всегда растут быстро; часто дают метастазы; обладают тканевым атипизмом, а также атипизмом и полиморфизмом клеток опухолевой паренхимы (отличиями этих клеток от нормальных аналогов и отличиями между собой по расположению, величине, форме и степени окраски); часто характеризуются повышенной митотической активностью опухолевой паренхимы и наличием зон некроза. ГИСТОГЕНЕЗ ОПУХОЛЕЙ Термин "гистогенез опухолей" означает тканевое происхождение опухоли, что не совсем точно, так как в настоящее время мы можем нередко определять не только тканевое, но и клеточное происхождение неоплазмы, т.е. ее цитогенез. Осо-бенно хорошо изучен цитогенез опухолей кроветворной и лимфоидной ткани — гемобластозов. В основе теории цитогенеза гемобластозов положено учение о стволовых и полустволовых клетках-предшественницах кроветворения. Многие вопросы происхождения солидных опухолей остаются пока еще спорными, поскольку имеется мало данных о клетках-предшественницах многих тканей. Предлагаются гипотетические схемы цитогенеза рака легкого, желудка, молочной железы и др. В теории гисто- и цитогенеза опухолей следует выделить несколько основных аспектов. 1. Трансформации может подвергаться только пролиферирующая соматическая клетка, т.е. поли- или унипотентные клетки-предшественницы . 2. Опухолевая клетка способна повторять в извращенной форме признаки дифференцировки (т.е. фенотип), заложенные в клетке-предшественнице, из которой она возникла. 3. В опухолевых клетках извращение дифференцировки связано с наличием блока дифференцировки. При наличии такого блока дифференцировки на уровне унипотентных клеток-предшественниц опухолевые клетки обладают минимальной стенотипической гетерогенностью. При наличии блока дифференцировки на уровне полипотентных клеток-предшественниц в неоплазме выражена фенотипическая гетерогенность опухолевых клеток и появляются клетки-химеры с множественной дифференцировкой. 4. Дифференцировка опухолевых клеток зависит как от уровня малигнизации клетки-предшественницы, так и от уровня блока дифференцировки. Доброкачественные опухоли развиваются при трансформации унипотентных клеток-предшественниц с низким блоком дифференцировки, поэтому они построены из зрелых клеточных элементов. Злокачественные опухоли характеризуются меньшим уровнем дифференцировки их клеток по сравнению с доброкачественными, что связывается с их развитием из полипотентных клеток-предшественниц и наличием высокого блока дифференцировки. Чем выше уровень малигнизации и уровень блока дифференцировки, тем менее дифференцированна возникающая злокачественная опухоль. В качестве гисто- и цитогенетических маркеров опухолевых клеток могут использоваться ультраструктурная организация опухолевой клетки, а также генные, хромосомные, антигенные и биомолекулярные маркеры, получившие название "опухолевые маркеры". В группу биомолекулярных опухолевых маркеров относят различные молекулы (факторы роста, рецепторы, онкобелки, адгезивные молекулы, интегриновые рецепторы), ферменты, белки промежуточных филаментов, рецепторов и адгезивных молекул. Чем ниже степень дифференцировки, тем выше уровень злокачественности опухоли. Дифференцированные новообразования, как правило, относят к доброкачественным. Основными свойствами опухоли являются автономный и бесконтрольный рост, наличие атипизма, способность к прогрессии и метастазированию. + Автономный рост опухоли. Характеризуется отсутствием контроля за пролиферацией и дифференцировкой клеток со стороны организма-опухоленосителя и выражается в утрате контактного торможения и иммортализации (приобретение бессмертия) опухолевых клеток. Автономность опухоли носит относительный характер, поскольку опухолевая ткань постоянно получает от организма различные питательные вещества, кислород, гормоны, цитокины, приносимые с током крови. Кроме того, она испытывает воздействие иммунной системы и прилежащей неопухолевой ткани. В злокачественных опухолях автономный рост выражен в значительной степени, и они растут быстро, прорастая окружающие нормальные ткани. В доброкачественных опухолях автономный рост выражен слабо. +Атипизм опухоли.В опухолях выделяют 4 вида атипизма: морфологический, биохимический, антигенный и функциональный. Морфологический атипизм выражается в том, что ткань опухоли не повторяет строение аналогичной зрелой ткани, и клетки опухоли могут быть не похожи на зрелые клетки того же происхождения. Морфолоический атипизм представлен двумя вариантами: тканевым и клеточным. Тканевой атипизм выражается в изменении взаимоотношения между паренхимой и стромой опухоли, чаще с преобладанием паренхимы; изменением величины и формы тканевых структур с появлением уродливых тканевых образований различной величины. Клеточный атипизм заключается в появлении полиморфизма клеток как по форме, так и по величине, укрупнению в клетках ядер, имеющих часто изрезанные контуры, увеличении ядерно-цитоплазматического соотношения в пользу ядра, появления крупных ядрышек и внутриядерных включений. В результате патологических митозов в опухолевых клетках обнаруживаются гиперхромные ядра, формируются многоядерные клетки. Злокачественным опухолям присущи оба типа морфологического атипизма. Доброкачественным опухолям свойствен только тканевой атипизм, поскольку они построены из зрелых, дифференцированных клеточных элементов. Биохимический атипизм. Проявляется в метаболических изменениях опухолевой ткани. Все перестройки метаболизма в опухоли направлены на обеспечение ее роста и приспособление к относительному дефициту кислорода, который возникает при быстром росте опухоли. В опухолевых клетках регистрируется усиленный синтез онкобелков, факторов роста и их рецепторов, уменьшение синтеза и содержания гистонов, синтез эмбриональных белков и рецепторов к ним, превращение опухолевых клеток в факультативные анаэробы, снижение содержания цАМФ. Биохимический атипизм может быть изучен с помощью морфологических методов — гистохимических и иммуногистохимических, поэтому его еще называют гистохимическим атипизмом. Антигенный атипизм опухолей проявляется в образовании опухолеспецифических антигенов, онкофетальных антигенов, а также в утрате некоторыми опухолями антигенов гистосовместимости, тканеспецифических антигенов, что приводит к развитию антигенонегативных опухолей и формированию к ним толерантности. Функциональный атипизм. Характеризуется утратой опухолевыми клетками специализированных функций, присущих аналогичным зрелым клеткам, и/или появлением новой функции, не свойственной клеткам данного типа. Например, клетки низкодифференцированного скиррозного рака прекращают продуцировать секрет и начинают усиленно синтезировать коллаген стромы опухоли. Прогрессия опухолей. В ходе своего развития многие новообразования становятся все более агрессивными и увеличивают потенциал злокачественности. В ряде случаев, например при развитии рака толстой кишки, используя серийные биоптаты, можно проследить ход прогрессии от предопухолевых состояний до доброкачественных и, наконец, злокачественных новообразований. Поэтому под прогрессией понимают изменение совокупности признаков опухоли (генотипа, кариотипа и фенотипа опухолевых клеток, включающего различные черты их морфологической, биохимической или иной дифференцировки) в направлении все большего усиления злокачественности. Увеличение злокачественности связано с последовательным появлением клеточных субпопуляций, имеющих гено- и фенотипические отличия от своих предшественников, которые представлены такими свойствами и признаками, как инвазивность, изменение темпа роста, способность к метастазированию, появление нового кариотипа, другой чувствительности к гормонам и противоопухолевым препаратам. Поэтому, несмотря на то, что первоначально большинство злокачественных новообразований имеет моноклональное происхождение, ко времени их клинического обнаружения клетки, составляющие их паренхиму, отличаются выраженной гетерогенностью в гено- и фенотипическом отношении. +На молекулярном уровне опухолевая прогрессия и связанная с ней гетерогенность являются результатом множественных мутаций, накапливающихся в разных клетках. Последние дают начало новым субклонам с новыми признаками. Считают, что трансформированные клетки становятся генетически более нестабильными, т.е. в высокой степени подвержены спонтанным мутациям в ходе распространения субклонов. Кроме того, мутации определенных контрольных генов, например, FCC, гена наследственного рака толстой кишки, могут предрасполагать к выраженной генетической нестабильности. Все эти механизмы приводят к формированию субклонов, подвергающихся иммунному и неиммунному отбору. Опухоли построены из паренхимы и стромы. Паренхима опухоли— это собственно опухолевые клетки, образовавшиеся в результате злокачественной трансформации клетки-предшественницы и ее клональной пролиферации.Структурные изменения затрагивают все компоненты опухолевой клетки — ядро, цитоплазму, мембраны, органеллы и цитоскелет. Ядра опухолевых клеток. Как правило, ядра опухолевых клеток увеличены, полиморфны, их контуры изрезаны, структура изменена. Ядро имеет неупорядоченно расположенный хроматин с конденсацией его в виде глыбок под кариолеммой. Размеры ядра увеличиваются за счет нарушения процессов эндоредуплекации ДНК, полиплоидии, эндомитозов, увеличения хромосом в ряде новообразований. В ядрах могут обнаруживаться разнообразные включения: вирусные частицы, внутриядерные тельца, тубулярные структуры, пузырьки, выросты, карманы ядерной мембраны. Наблюдаются также изменения ядрышек— увеличение их размеров, количества, появление «персистирующих» ядрышек, не исчезающих во время митозов. Ядерная мембрана опухолевой клетки бедна ядерными порами, что затрудняет транспортные связи между ядром и цитоплазмой. Цитоплазма, органеллы и цитоплазматическая мембрана опухолевых клеток. Поверхность опухолевых клеток отличается увеличенной складчатостью, появлением микровыростов, пузырьков, а в ряде опухолей микроворсинок различной конфигурации и плотности. Полагают, что в области микроворсинок концентрируются рецепторы, способные воспринимать канцерогенные агенты. Эндоплазматическая сеть в опухолевых клетках может быть развита в разной степени, что отражает белок-секретирующую функцию. Усиление анаэробного гликолиза сопровождается уменьшением в опухолевых клетках количества митохондрий с нарушением ориентации их крист. В то же время имеется небольшое количество типов опухолей с высоким содержанием митохондрий в цитоплазме (онкоцитомы, почечно-клеточный рак). Строма опухоли, так же, как и строма нормальной ткани, в основном выполняет трофическую, модулирующую и опорную функции и состоит из волокон и клеток (нормальных фибробластов, лимфоцитов и пр.). Таким образом, в опухолях удивительным образом соседствуют и взаимодействуют опухолевые и нормальные клетки. В зависимости от развитости стромы опухоли подразделяют на органоидные и гистиоидные. В органоидных опухолях имеются паренхима и развитая строма. Примером органоидных опухолей могут служить различные опухоли из эпителия. При этом степень развитости стромы может также варьировать от узких редких соединительнотканных прослоек и сосудов капиллярного типа в медуллярном раке до мощных полей фиброзной ткани, в которых цепочки опухолевых бывают едва различимыми (в фиброзном раке, или скирре). В гистиоидных опухолях доминирует паренхима, строма практически отсутствует, так как представлена лишь тонкостенными сосудами капиллярного типа, необходимыми для питания. По гистиоидному типу построены опухоли из собственной соединительной ткани и некоторые другие неоплазмы. В опухолях соединительной ткани стромой принято называть также экстрацеллюлярный матрикс с коллагеновыми волокнами. В зависимости от степени дифференцировки опухоли различают три вида ее роста: экспансивный, аппозиционный, инфильтрирующий (инвазивный). При экспансивном росте опухоль растет «сама из себя», отодвигая и раздвигая окружающие ткани. Паренхиматозные элементы окружающей опухоль ткани атрофируются, развивается коллапс стромы и опухоль окружается как бы капсулой (псевдокапсула). Экспансивный рост опухоли медленный, он характерен для зрелых, доброкачественных опухолей. Однако некоторые злокачественные опухоли (рак почки, рак щитовидной железы, фибросаркома и др.) также могут долгое время расти экспансивно. Аппозиционный рост опухоли происходит за счет неопластической трансформации нормальных клеток, окружающих опухоль, в опухолевые, что наблюдается в опухолевом поле. При инфильтрирующем (инвазивном) росте клетки опухоли врастают в окружающие ткани и разрушают их (деструирующий рост). Инвазия обычно происходит в направлении наименьшего сопротивления по межтканевым щелям, по ходу нервных волокон, кровеносных и лимфатических сосудов. Комплексы клеток опухоли разрушают стенки сосудов, проникают в ток крови и лимфы, врастают в рыхлую соединительную ткань. Если на пути инвазии опухоли встречается капсула органа или другие плотные ткани, то опухолевые клетки вначале распространяются по их поверхности, а затем, прорастая их, проникают вглубь органа. Границы опухоли при инфильтрирующем ее росте четко не определяются. Инфильтрирующий рост опухоли быстрый, он характерен для незрелых, злокачественных опухолей. По отношению к просвету полого органа рост опухоли может быть эндофитным или экзофитным. Эндофитный рост— инфильтрирующий рост опухоли в толщу стенки полого органа, а также наружу по отношению к его внешней поверхности. При этом опухоль со стороны слизистой оболочки (например, желудка, мочевого пузыря, бронха, кишки) может быть почти незаметна, а на разрезе стенки видно, что она проросла опухолью. Иногда большая часть опухоли находится снаружи в виде узла разной величины (экзоорганный рост). Экзофитный рост— рост опухоли в просвет полого органа. Опухоль при этом может соединяться со стенкой как тонкой ножкой (наиболее характерно для доброкачественных опухолей), так и располагаться на широком основании (более характерно для злокачественных опухолей). В зависимости от числа очагов возникновения опухоли говорят об уницентрическом(один очаг) и мультицентрическом (множественные очаги) росте. Отдельно выделяют так называемые, местнодеструирующие опухоли, для которых характерен инфильтрирующий тип роста и склонность к рецидивам, при этом они никогда (или крайне редко) не метастазируют. Из доброкачественных опухолей к ним относят абдоминальный фиброматоз — опухоль, локализующаяся в передней брюшной стенке, состоящая из зрелых фибробластов, расположенных между коллагеновыми волокнами. А среди злокачественных опухолей — базальноклеточный рак, ранее называвшийся базалиомой.  Рак (карцинома) – злокачественная опухоль из эпителиальной ткани. Основная классификация раков основана на гистологической картине, которую копирует паренхима опухоли. Различают следующие раки из покровного эпителия: —плоскоклеточный ороговевающий рак; —плоскоклеточный неороговевающий рак; —базальноклеточный рак; —недифференцированный рак (мелкоклеточный, полиморфноклеточный и др.) —переходноклеточный рак. Кроме того, встречаются смешанные формы рака, состоящие из двух видов эпителия (плоского и цилиндрического), их называют диморфные раки. Классификация раков из железистого эпителия: —аденокарцинома; —солидный рак; —слизистый (коллоидный) рак (его разновидность — перстневидноклеточный рак). Дополнительная классификация раков основана на соотношении паренхиматозного и стромального компонентов опухоли, в связи с чем различают: —медуллярный (мозговидный) рак, который характеризуется преобладанием паренхимы над стромой. Опухоль мягкая, бело-розового цвета, напоминает ткань головного мозга; —простой, или вульгарный рак, который содержит примерно равное количество паренхимы и стромы; —скирр, или фиброзный рак, который отличается явным преобладанием стромы над паренхимой. 2. Важнейшие клинико-патологические проявления опухолевого роста. Характеристика опухолевого процесса. Местное воздействие опухоли. Нарушение гомеостаза организма. Вторичные изменения в опухоли. Метастазы и системные неметастатические воздействия. Раковая кахексия, паранеопластические синдромы. Далеко не всегда, особенно на ранних стадиях развития, опухоль проявляет себя клинически. По мере роста опухоли появляется определенная симптоматика, которую можно разделить на несколько групп. 1. Местное воздействие первичного опухолевого узла: А. Сдавление опухолью окружающих тканей, сосудов и соседних органов с нарушением их функции, например, нарушение оттока секрета желез, нарушения крово- и лимфообращения. Б. При экзофитном типе роста опухоли в полом органе — стеноз (сужение) и обструкция (закрытие) просвета с нарушением продвижения содержимого; В. При инвазивном типе роста — деструктивные изменения тканей, которые могут привести к развитию кровотечения (врастание в стенку и аррозия сосудов), перфорации полого органа, формирование свищевых ходов и т.д. 2. Нарушение гемостаза: А. Повышение свертываемости крови (из-за неустойчивого кровотока и повреждения эндотелиальной выстилки). Характерный синдром — илеофеморальный тромбоз. Б. Риск развития тромбоэмболий. В. Развитие хронического ДВС-синдрома (особенно в терминальной стадии развития онкологического заболевания) с тенденцией к спонтанным кровоизлияниям вследствие истощения компонентов коагуляции. 3. Метастазирование. 4. Системные неметастатические воздействия (обменные, эндокринные и иммунные нарушения): А. Железодефицитная анемия. Б. Анорексия (отсутствие аппетита и частично связанная с этим потеря массы тела) и раковая кахексия. Раковая кахексияпредставляет собой снижение массы тела, возникающее при значительном уменьшении жировых депо и ферментном расщеплении мышечных белков. При кахексии отмечается резкое истощение больных. Их кожа становится сухой и дряблой. Жировые депо практически отсутствуют. Мышцы уменьшены в объеме, дряблые, атрофичные, буроватого цвета (бурая атрофия скелетных мышц). Внутренние органы, в частности сердце, заметно уменьшены в размере и массе. Уменьшение сердца сопровождается извитостью коронарных артерий, сохраняющих естественную длину. В кардиомиоцитах накапливается липофусцин (бурая атрофия миокарда). Бурая атрофия также характерна для печени. Отмечаются расстройства пигментного обмена: кроме накопления липофусцина в скелетных мышцах, кардиомиоцитах, гепатоцитах, слабо выраженный меланоз кожи, приобретающей сероватый оттенок, ярко оранжевая окраска остатков жировой ткани жировых депо (из-за конденсации липохромов). В. Лихорадка. Г. Паранеопластические синдромы Паранеопластический синдром(греч. «para» — около + неоплазма) — общее название синдромов, обусловленных опосредованным (гуморальным и др.) влиянием опухоли на обменно-эндокринные процессы, механизмы иммунитета и функциональную активность других регуляторных систем организма. К паранеопластическим синдромам относят: — гиперкальциемию из-за остеолиза, вызванного метастатическим, реже первичным поражением костей, например при миеломе, и выработкой какой-либо некостной опухолью гуморальных субстанций, приводящих к поступлению кальция в кровь (например, паратгормона при раке легкого). — эндокринопатии. Встречается синдром Иценко-Кушинга (при опухолях передней доли гипофиза, раке легкого, толстой кишки, эндометрия), гиперкальциемия и остеопороз при опухолях паращитовидных желез, раке легкого. Гиперпродукция гастрина при некоторых опухолях поджелудочной железы (гастриномах) приводит к развитию синдрома Золлингера-Эллисона (гипертрофия и множественные эрозии и язвы слизистой оболочки желудка и двенадцатиперстной кишки с развитием желудочно-кишечных кровотечений). — иммунопатологические процессы с иммунокомплексными, антительными и цитотоксическими механизмами развития, приводящие к развитию васкулитов, нейропатий, миопатий и дерматопатий (дерматомиозит). Иногда к паранеопластическим синдромам относят анемию, гиперкоагуляцию, кахексию, лихорадку. Если их учитывать, то паранеопластические синдромы встречаются более, чем у половины больных со злокачественными опухолями. Паранеопластические синдромы часто бывают первыми клиническими симптомами опухоли и поэтому имеют важное диагностическое значение. Вторичные изменения в опухолях представлены очагами некроза и кровоизлияний, воспалением, ослизнением, склерозом, отложением солей кальция (петрификация), разрастанием костных структур (оссификация), формированием кист. Иногда эти изменения происходят в связи с применением лучевой терапии и химиотерапии и являются признаком терапевтического патоморфоза, поэтому при направлении биоптата или удаленной опухоли в патологоанатомическое отделение обязательно указывают проводимое лечение. 3. Факторы риска опухолевого роста. Старение человека. Влияние географических зон, факторов окружающей среды. Наследственность: наследственные опухолевые синдромы, семейные формы неоплазии, синдромы нарушенной репарации ДНК. Предопухолевые (предраковые) состояния и изменения, их сущность, морфология Выделяют 4 группы важнейших факторов риска, способствующих возникновению как доброкачественных, так и злокачественных новообразований. 1. Старение. Увеличение числа опухолей с возрастом связывают с накоплением в клетках мутаций, возрастной депрессией репарации ДНК и физиологическим возрастным иммунодефицитным синдромом. 2. Влияние географических зон и факторов окружающей среды (экологических).Заболеваемость и смертность в различных странах от злокачественных опухолей неодинакова: например, от рака желудка в Японии до внедрения специальных мер профилактики и ранней диагностики, погибало в 7-8 раз больше больных, чем в США. Из факторов окружающей среды следует назвать солнечную радиацию, экологические особенности, определенный образ жизни людей (курение, алкоголизм, особенности питания и ожирение, большое число половых партнеров, особенно при раннем начале половой жизни). 3. Наследственность. От 5 до 10% злокачественных опухолей человека связаны с наследственной предрасположенностью. Наследственные формы злокачественных новообразований разделяют на 3 группы:1) наследственные опухолевые синдромы; 2) семейные формы опухолей; 3) аутосомно-рецессивные синдромы нарушенной репарации ДНК. Наследственные опухолевые синдромы. К этой группе относят новообразования, при которых наследование единственного мутантного гена значительно повышает риск их развития. Такая предрасположенность относится к аутосомно-доминантному типу наследования. Самый частый пример из этой группы — ретинобластома (злокачественная нейроэпителиома сетчатки глаза), сочетающаяся у детей с полипозом толстой кишки. Семейные формы опухолей. Многие распространенные типы злокачественных опухолей, которые встречаются спорадически, наблюдаются также и в семейных формах: рак толстой кишки, молочной железы, яичников, опухоли головного мозга. Общими признаками семейной формы опухолей являются возникновение в раннем возрасте, появление минимум у двух ближайших родственников, частое формирование двусторонних или множественных поражений. Аутосомные рецессивные синдромы нарушенной репарации ДНК. Речь идет о нестабильности структуры ДНК или хромосом. В группу этих синдромов входит пигментная ксеродерма (пигментация, гиперкератоз, отек и другие изменения кожи при солнечном облучении), анемия Фанкони, характеризующаяся гипоплазией костного мозга, низким содержанием клеток крови, многими аномалиями развития. 4. Хронические пролиферативные изменения. Фоном для малигнизации (озлокачествления) может служить хроническое воспаление, которое часто сопровождается очаговой гиперплазией, метаплазией и дисплазией эпителия (данные понятия частично рассматривались в главе, посвященной процессам адаптации, компенсаторно-приспособительным процессами и также будут рассмотрены ниже при изучении морфогенеза опухоли). Предопухолевые состояния. Любой опухоли предшествуют хронические или патологические процессы, при которых клетка достигает выраженной степени дисплазии (неправильное развитие тканей, органов или частей тела). Предраковыми заболеваниями считаются: хронический гастрит, хроническая эрозия шейки матки, хронический бронхит, сопровождающийся метаплазией эпителия бронхов. 4. Канцерогенные агенты и их взаимодействие с клетками. Химический канцерогенез. Этапы, механизмы. Важнейшие группы химических канцерогенов. Радиационный канцерогенез. Вирусный канцерогенез. Механизмы, клинико-морфологические проявления. Канцерогенами называются химические вещества, воздействие которых достоверно увеличивает частоту возникновения опухолей или сокращает период их развития у человека или животных. Различные этиологические факторы, способные вызвать развитие опухолей, называются канцерогенными факторами, или канцерогенами. Выделяют три основные группы канцерогенных агентов: химические, физические (радиационные) и вирусные Процесс развития опухолей под влиянием канцерогенных факторов носит название канцерогенеза. Среди причин развития опухолей человека и животных называются различные канцерогенные агенты, что легло в основу построения множества теорий канцерогенеза. Основными являются теория химических канцерогенов, физических канцерогенов, вирусно-генетическая и полиэтиологическая теории. Канцерогенные агенты подразделяются на две большие группы: генотоксические и эпигенетические в зависимости от их способности взаимодействовать с ДНК. К генотоксическим канцерогенам относятся полициклические ароматические углеводороды, ароматические амины, нитрозосоединения и др. Часть генотоксических канцерогенов может напрямую взаимодействовать с ДНК, поэтому они называются прямыми. Другие же должны претерпеть химические превращения в клетках, в результате которых они становятся активными, приобретают электрофильность, могут концентрироваться в ядрах клеток и взаимодействовать с ДНК. Эти генотоксические канцерогены называются непрямыми. Активация непрямых генотоксических канцерогенов происходит с участием ряда ферментных систем клетки, таких как монооксигеназная ферментная система, основным действующим компонентом которой являются цитохром Р-450-гемопротеид, эпоксидгидратазы, а также трансферазы, катализирующие реакции конъюгации канцерогенных веществ. Активированные метаболиты реагируют с различными участками ДНК. вызывая алкилирование ее оснований — аденина, гуанина, цитидииа и тимидина. Образование 06-алкилгуанина может приводить к точечным мутациям в геноме клетки. Названные ферментные системы обнаружены в клетках печени, бронхиального, желудочного, кишечного и почечного эпителия и других клетках. Эпигенетические канцерогены представлены хлорорганическими соединениями, иммунодепрессантами и др. Они не дают положи тельных результатов в тестах на мутагенность, однако их введение вызывает развитие опухолей. Происхождение химических канцерогенов может быть экзо- и эндогенным . Известными эндогенными канцерогенами считаются холестерин, желчные кислоты, аминокислота, триптофан, некоторые стероидные гормоны, пероксиды липидов. Накоплению эндогенных канцерогенов в организме могут способствовать некоторые заболевания, а также хронические гипоксические состояния. Химический канцерогенез имеет многоступенчатый характер и протекает в несколько стадий: инициации, промоции и прогрессии опухоли. Каждая из стадий требует специальных этиологических факторов и отличается морфологическими проявлениями. В стадию инициации происходит взаимодействие генотоксического канцерогена с геномом клетки, что вызывает его перестройку. Однако для злокачественной трансформации этого бывает недостаточно. Последняя обеспечивается действием еще одного повреждающего агента, вызывающего дополнительные перестройки в геноме. Клетка малигнизируется, начинает бесконтрольно делиться. Вещество, определяющее начало стадии промоции, называется промотором. В качестве промоторов нередко применяются эпигенетические канцерогены, а также вещества, не являющиеся сами по себе канцерогенами. Эффект химических канцерогенов зависит от длительности введения и дозы, хотя нет той пороговой минимальной дозы, при которой канцерогенный агент может считаться безопасным. Кроме того, эффект от действия различных химических канцерогенов может суммироваться  Радиационный канцерогенез.Канцерогенное действие ионизирующего излучения обнаружено в 1902 г., т.е. вскоре после открытия рентгеновских лучен и естественной радиоактивности. Радиацией можно индуцировать опухоли практически всех органов, чаше всего кожи и костей, лейкозы, а также железистой ткани. Частота и виды злокачественных новообразований, индуцированных ионизирующими излучениями, зависят от проникающей способности излучения, характера воздействия (внешнее или внутреннее), органотропности радионуклидов и т.д. Вирусный канцерогенез.Вирусы, вызывающие опухоли у животных, подразделяют на ДНК-содержашие (например, вирус обезьяны SV40) и РНК-содержащие, или ретровирусы (например, вирус саркомы Рауса). Этиологическая роль вирусов в возникновении опухолей человека весьма вероятна в случае лимфомы Беркитта, рака носоглотки (ДНК-содер-жаший вирус Эпштейна—Барр), рака шейки матки (вирус папилломы), а также Т-клеточного лейкоза взрослых (ретровирус HTLV-1). В отношении некоторых других опухолей человека роль вирусов только предполагается. 5. Молекулярные основы канцерогенеза. Этиология и патогенез опухолей. Клеточные онкогены, белковые продукты онкогенов. Протоонкогены: номенклатура, характеристика, определение в опухолях человека. Роль в онкогенезе факторов роста, рецепторов факторов роста, ядерных регуляторных белков, белков, участвующих в трансдукции сигналов. Механизмы активации онкогенов. Точковые мутации. Транслокации хромосом. Амплификация генов. Гены – супрессоры рака. Гены – регуляторы апоптоза. У млекопитающих обнаружили участок ДНК, гомологичный вирусным онкогенам. В активном состоянии такие участки получили название клеточных онкогенов, в неактивном — протоонкогенов. Протоонкогены — это нормальные гены клеток. В зрелых тканях они, как правило, неактивны. Активация протоонкогенов и превращение их в клеточные онкогены происходит при опухолевом росте, а также в процессе эмбриогенеза. Некоторые из клеточных онкогенов активируются также при пролиферации Дифференцировке клеток в очагах репаративной регенерации. Клеточные онкогены кодируют синтез белков, которые называются онкобелками, или онкопротеинами. Следует отметить, что все известные в настоящее время онкобелки принимают участие в передаче митогенетических сигналов от клеточной мембраны до ядра к определенным генам клеток. Это значит, что большинство факторов роста и других цитокинов в той или иной степени могут взаимодействовать с онкобелками. По функциональной активности и структурному сходству с элементами сигнальной митогенетической цепочки все онко-белки могут быть подразделены на следующие группы: - онкобелки — гомологи факторов роста (c-sis, int-r, k-fgt и др.); - онкобелки — гомологи рецепторов к факторам роста (с-еrbВ, c-erbA и др.); - онкобелки, связанные с работой рецепторов, — аналоги G-белка (c-ras) и протеинкиназные белки (c-src, c-fps, c-fes, c-abl, c-met); - онкобелки, передающие ростовые сигналы на ДНК (c-fos, c-jun, c-myc и др.). Для того чтобы стимулировать пролиферацию клеток, протоонкогены должны превратиться в клеточные онкогены. Известны четыре основных механизма активации протоонкогенов: - инсерционная активация — активация под действием встроенных в геном генов (вирусных); - активация при транслокации участка хромосомы с встроенным в него протоонкогеном; - активация путем амплификации (умножении копий) протоонкогена; - активация при точечных мутациях протоонкогенов Классификация протоонкогенов, подвергающихся влиянию вирусных промоторов, основана на следующих критериях; сходстве (гомологии) первичной структуры клеточных и вирусных генов, ферментативных свойствах продуктов протоонкогенов и антигенном родстве опухолевых белков с другими клеточными белками. В соответствии с этим выделяют следующие группы протоонкогенов. Протоонкогены, кодирующие протеинкиназы. Представлены протоонкогенами, гомологичными по первичной структуре онкогенам, белковые продукты которых обладают или могут обладать протеинкиназной активностью и локализуются в основном на мембранах трансформированных клеток. • Тирозинспецифические фосфопротеинкиназы нерецепторного типа представлены протоонкогенами семейства src (yes, ras, sea и др.), а также рядом других генов (fes, abl, kit и др.). • Рецепторы фактора роста — протоонкогены, белки которых представляют собой гомологи рецепторов факторов роста (например, erbB). • Нетирозиновые фосфопротеинкиназы — белки протоонкогенов, неспособных фосфорилиро-вать субстраты по тирозину. Например, продукты генов mos и га/являются серии1/треонин киназами. Ядерные протоонкогены — представлены генами, кодирующими белки, локализованные в ядре. • Регуляторы транскрипции — протоонкогены, белки которых специфично взаимодействуют с регуляторными элементами клеточного генома (например, fos). • ДНК-связывающие белки — протоонкогены, кодирующие белки, способные связываться с ДНК (например, гены семейства mys и др.). • ГТФ-связывающие белки представлены протоонкогеном ras, продукты которого связывают ГТФ — непосредственный предшественник гуаниловой кислоты в синтезе РНК (гуаниловая кислота является одним из основных компонентов РНК). Протоонкогены, кодирующие факторы роста, представлены генами, продукты которых служат факторами роста. Например, ген sis кодирует синтез фактора роста тромбоцитов. Вставочные (инсерционные) протоонкогены представлены генами (например, int-lu др.), в месте локализации которых происходит встраивание онкогенных ретровирусов. Протоонкогены транслокации — участки (локусы) клеточного генома (ber и др.), способные вовлекаться в процесс транслокации (перемещения) генов. 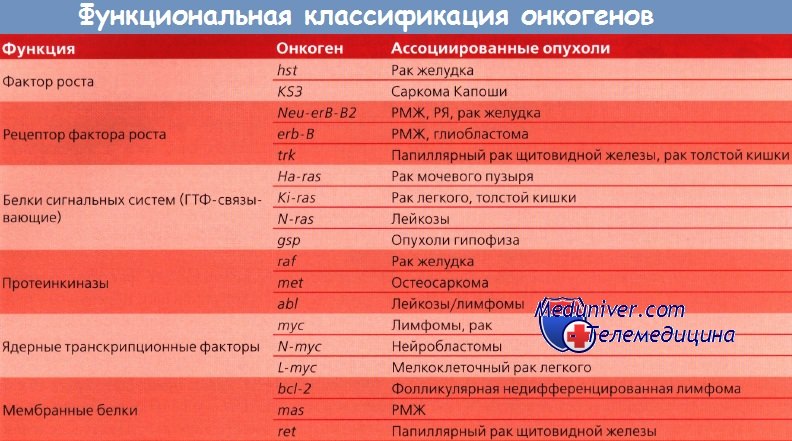 Механизмы активации протоонкогенов Процесс превращения нормальных протоонкогенов в онкогены называется активацией или экспрессией онкогенов, непосредственно вызывающих опухолевый рост. Известны три основных мехаиизма активации прдтоонкогвмов: а) мутации в структуре протоонкогена или депеции (утеря генетического материала); б) амплификация протоонкогена (увеличение количества копий гена); в) перестройка генома в результате перемещения (транспокации) участков хромосом. Мутации. Один из возможных путей активации протоонкогена – точечная мутация в его структуре под воздействием различных факторов (канцерогенов). Поскольку они вызывают перестройку структуры ДНК, то их называют генотоксическими канцерогенами. Изменение структуру гена ведет к продук- ции функционально измененного белка, который, включаясь в процесс вместо нормального, может блокировать или извращать реакцию или передачу сигнала. Депеция характеризуется потерей генетического материала. При утрате антионкогенов, или генов-супрессоров, теряется контроль над процессами опухолевой трансформации. Амплификация. Этот механизм активации как отдельных, так и нескольких протоонкогенов и характеризуется увеличением числа их копий, в клетке появляется значительное количество структурно неизмененных сигнальных белков протоонкобелков. Такая «суперэкспрессия»(«оверэкспрессия») имитирует получение внешних сигналов, усиливающих митотическую активность - так называемых митогенных сигналов, которые постоянно поддерживают клетку в состоянии пролиферации. Это приводит к появлению клеток, реагирующий не на внешние, а лишь на свои внутренние ложные сигналы, что может привести к ее опухолевой трансформации. Транслокация. Онкогены могут активироваться при перенесении по контроль другого гена - сильного промотора. Промотор – это ген, который контролирует начало репликации одного определённого гена. Перенос, или транслокация, происходит при перемещении участков одной хромосомы на другую без потери генетической информации - реципрокная транслокация— взаимный, равноценный обмен фрагментами генома. При этом онкоген может переноситься на активные участки генома. В результате этих событий протоонкогены., локализованные в зоне обмена участков генома могут претерпевать различные изменения своей структуры с последующим нарушением нормальной регуляции функции. Разновидностью перестройки хромосом, является инсерционная активация протоонкогенов, или «вставочный канцерогенез», когда какой-либо ген может встраиваться в геном клетки и усиливать активность близлежащих протоонкогенов. Инсерционные гены называют еще гены-энхансеры. Их носителями являются РНК-содержащие ретровирусы, в то время как ДНК-вирусы способны вызывать клеточную трансформацию преимущественно посредством блокады генов-супрессоров. Протоонкогены находятся под жестким контролем генов-супрессоров, или антионкогенов. Мутации протоонкогенов, выводящие их из-под воздействия генов-супрессоров, способствуют автономности их функционирования и вызывают постоянную, «не выключающуюся» активность и клетка теряет способность выходить из митотического цикла.   6. Молекулярные основы многоступенчатого канцерогенеза. Стадии канцерогенеза. Изменения кариотипа в опухолях (транслокации, делеции, амплификации генов, укорочение теломер, изменение плоидности ДНК). |
