основы электрохимии. Основы электрохимии и коррозии металлов Электродные потенциалы металлов и эдс гальванических элементов
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
Коррозия металлов.Коррозией металлов (лат. сorrosio - разъедание) называется самопроизвольный процесс разрушения металлов под действием окружающей среды. Коррозия обусловлена протеканием химических или электрохимических реакций и является следствием термодинамической неустойчивости металлов в свободном состоянии. Обычно металлы получают из соответствующих руд, затрачивая энергию при осуществлении процесса восстановления (доменный процесс, электролиз и т.д.): В окружающей среде металлы самопроизвольно переходят в более устойчивое окисленное состояние, образуя оксиды, сульфиды, гидроксиды и другие соединения. Процесс окисления связан с уменьшением изобарно-изотермичесного потенциала: Только некоторые металлы, встречающиеся в природе в свободном состоянии, например, Au, Pt, Ag, практически не подвергаются коррозии в условиях эксплуатации, близких к природным.
Коррозионные процессы, имеющие место в реальных условиях эксплуатации, можно классифицировать:
Жидкостная коррозия в свою очередь может быть пресноводной, морской, коррозией в химических агрессивных средах (растворы кислот, солей, щелочей и т.д.).
В свою очередь, общая коррозия подразделяется на равномерную и неравномерную.(pиc.11.2.)  Рис. 11.2. Общая коррозия металлов: а) равномерная; б) неравномерная Местная коррозия может развиваться пятнами, диаметр которых (d) больше глубины (Н), язвами (d>Н), точками (питтинговая коррозия, при которой d<Н). Кроме того, местная коррозия может протекать по границам зерен кристаллов - межкристаллитная коррозия, затрагивать лишь отдельные компоненты сплавов-структурно-избирательная коррозия и др.(рис.11.3.).    Рис. 1 Местная коррозия: а) коррозия пятнами; б) язввенная коррозия; в) питтинговая коррозия (точками); г) межкристаллитная коррозия; д) избирательная коррозия; В особую группу следует выделить случаи коррозии металлов, вызываемые совместным действием окружающей среды и механических напряжений. К таким видам коррозионно-механических повреждений относятся:
Приводя классификацию коррозионных процессов, нельзя не отметить еще один вид коррозии - микробиологическую коррозию. Это особый вид коррозии, связанный с жизнедеятельностью микроорганизмов во влажной среде при умеренных температурах и в присутствии кислорода (аэробные условия) или в его отсутствие (анаэробные условия). Наибольшую опасность для нефтяной и газовой промышленности представляет биокоррозия, вызываемая деятельностью сульфатовосстанавливающих бактерий (СВБ). При благоприятных условиях СВБ могут продуцировать значительные количества сероводорода из сульфатов, резко интенсифицируя коррозионное разрушение металла. Восстановление сульфатов до сероводорода под действием бактерий можно представить следующей схемой:
Характерной особенностью коррозионного процесса, протекающего по химическому механизму, является непосредственный переход электронов с атомов металла (восстановителя) на атомы.или молекулы окислителя, входящие в состав среды. Такой механизм коррозии характерен для разрушения металлов в непроводящей электрический ток среде, например, в безводных органических растворителях, жидком броме, расплавленной сере и т.д. Примером химической коррозии в жидких неэлектролитах может быть разрушение алюминия жидким бромом: По химическому механизму протекает и газовая коррозия коррозия металлов при контакте с сухими газами, например, окисление металла кислородом при высокой температуре. Этому виду коррозии подвержены двигатели внутреннего сгорания, оборудование печей, сопла реактивных двигателей, лопатки газовых турбин. Продуктами газовой коррозии обычно являются оксиды металлов, однако, в зависимости от среды, могут образовываться и другие продукты, например, сульфиды. Так, при высокотемпературном окислении железоуглеродистых сталей образуются.разнообразные оксиды (Fe3O4 - магнетит, Fe2O3 - гематит, FeO - вюстит), входящие в состав окалины и происходит обезуглероживание металла. Последний процесс связан с уменьшением концентрации карбида железа (Fe3С) и уменьшением вследствие этого твердости в износостойкости самого металла. Если образующаяся при газовой коррозии пленка продуктов коррозии характеризуется хорошим сцеплением с поверхностью металла, сплошностью, близким и металлу коэффициентом теплового расширения, то она может обладать защитными свойствами и приводить к замедлению коррозионного процесса. 11.2.3. Электрохимическая коррозия.Коррозионное разрушение металлов, протекающее по электрохимическому механизму, является наиболее распространенным видом разрушения металлов. Электрохимическая коррозия - процесс разрушения металла в среде электролита, включающий анодное растворение металла и катодное восстановление какого-либо окислителя. Электрохимические процессы отличаются от химических тем, что окислительная и восстановительная стадии превращения осуществляются не в едином акте, а протекают раздельно с участием металлической поверхности, принимающей или отдающей электроны реагирующим частицам. Окислительный и восстановительный компоненты непосредственно не встречаются, но каждый из них должен встретиться с металлом (электродом). Окислительная и восстановительная стадии электрохимической коррозии представляют собой два взаимосвязанных процесса. Их скорость зависит как от обычных кинетических параметров (концентрации и температуры), так и от величины заряда металлической поверхности, т.е. от потенциала. Скорость анодной (окислительной) реакции с ростом потенциала увеличивается, а скорость катодной (восстановительной) реакции - уменьшается. Таким образом, коррозия металлов, протекающая по электрохимическому механизму, имеет следующие особенности:
Исторически электрохимическую коррозию называют гальванической коррозией, т.е. и при работе соответствующих гальванических элементов и при коррозионном разрушении металла имеют место идентичные процессы. На рис 20 показаны три отличающихся друг от друга железо-цинковых гальванических элемента. Приведенный на рис. 11.3.а гальванический элемент состоит из железной и цинковой пластин, погруженных в раствор соляной кислоты и соединенных друг с другом с помощью внешней цепи. 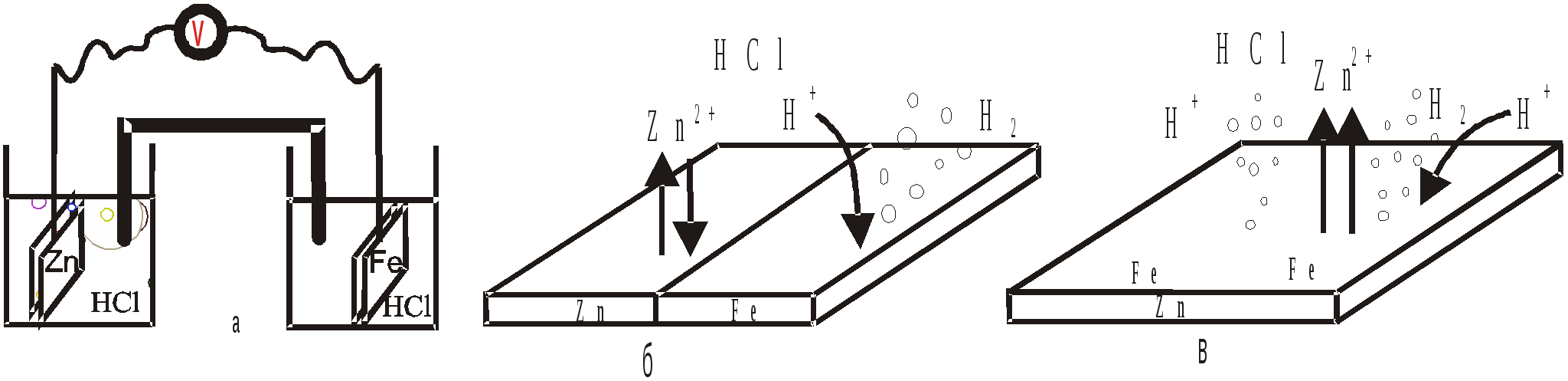 Рис. 11.3. Виды железо - цинковых гальванических элементов. а) макрогальванический элемент, б) короткозамкнутый макрогальванический элемент, в) микрогальванический элемент. На рис.11.3.б показан короткозамкнутый макрогальванический элемент, состоящий из контактирующих друг с другом железной и цинковой пластин, находящихся в растворе электролита. Изображенная на рис.11.3.в. цинковая пластинка с микровключениями железа, находящаяся в растворе соляной кислоты, может тоже рассматриваться в качестве гальванического элемента (микрогальванического элемента). В каждом из приведенных гальваническом элементе цинк является анодом, а катодом служит железо. В любом из приведенных гальванических элементов протекают пространственно-разделенные окислительно-восстановительные процессы: на аноде (цинк): на катоде (железо): Электроны, перетекающие с анода на катод, обусловливают возникновение электрического тока. |
