основы электрохимии. Основы электрохимии и коррозии металлов Электродные потенциалы металлов и эдс гальванических элементов
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
|
Пример 3. Электролиз раствора сульфата калия K2SO4. В водном растворе сульфата калия содержатся ионы K+, K2SO4 → K+ + H2О H+ + OH–. Так как ионы K+ разряжаются труднее, чем ионы Н+, а ионы На катоде: 2H2О + 2e = Н2 + 2ОН–. На аноде: 2H2О – 4e = O2 + 4H+. Суммарное уравнение процесса будет иметь вид: 2H2О В то же время, вследствие разряда водородных и гидроксильных ионов воды и непрерывного перемещения ионов K+ к катоду, а ионов Пример 4. Электролиз раствора сульфата меди с растворимым (активным) медным анодом. Особым образом протекает электролиз с растворимыми электродами. В этом случае анод изготовлен из того же металла, соль которого находится в растворе. При этом никакие ионы из раствора у анода не разряжаются, а происходит окисление материала самого анода, т.е. сам анод постепенно растворяется, посылая в раствор ионы и отдавая электроны источнику тока. Cu0 – 2e → Cu2+. Образующиеся на аноде катионы меди перемещаются в растворе соли к катоду. Процесс восстановления сводится к выделению меди на катоде: Cu2+ + 2e → Cu0. Количество соли CuSO4 в растворе остается неизменным. Таким образом, при осуществлении процесса электролиза с растворимыми электродами имеет место перенос материала электрода (в нашем случае меди) с анода на катод. Количественные соотношения при электролизе Количественные расчеты процессов электролиза осуществляются на основании законов М. Фарадея. Первый закон Фарадея. Масса вещества, выделяющегося на электроде при электролизе, пропорциональна количеству прошедшего через раствор электричества. m = k · Q, где m – масса восстановленного или окисленного вещества (г); k – коэффициент пропорциональности (электрохимический эквивалент) (г/Кл); Q – количество электричества, прошедшего через электролит (Кл). Напомним, что кулон (Кл) – количество электричества, проходящее по проводнику при силе тока 1 ампер (А) за время 1 с. Количество электричества Q рассчитывается как произведение силы тока I в амперах на время t в секундах. Q = I · t. Электрохимический эквивалент (k) представляет собой массу вещества, которая восстанавливается на катоде или окисляется на аноде при прохождении через раствор 1 Кл электричества. Величину электрохимического эквивалента можно рассчитать по формуле: k  , , где Mэкв. – молярная масса эквивалента этого вещества (г/моль); F – постоянная Фарадея. Постоянная Фарадея представляет собой количество электричества, необходимое для выделения из раствора 1 моль эквивалентов вещества (F = 96500 Кл/моль). Это количество электричества равно заряду 1 моль (6,02 ∙ 10 23) электронов. Молярная масса эквивалента для элемента, в свою очередь, может быть найдена как частное от деления молярной массы элемента на его валентность: Mэкв =  . .Например, молярные массы эквивалентов для серебра, меди и алюминия будут, соответственно, равны: Mэкв (Ag) = 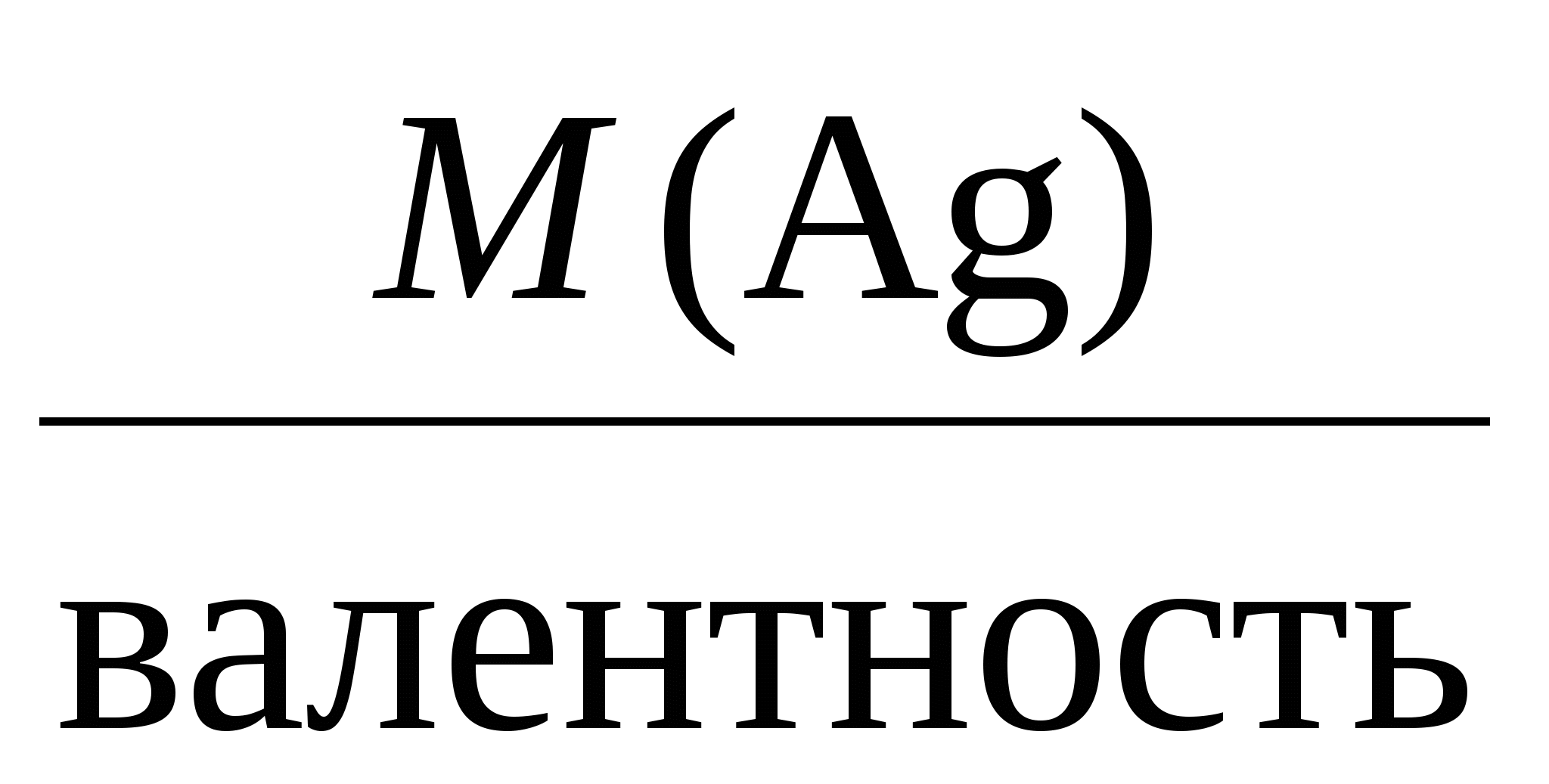 = = 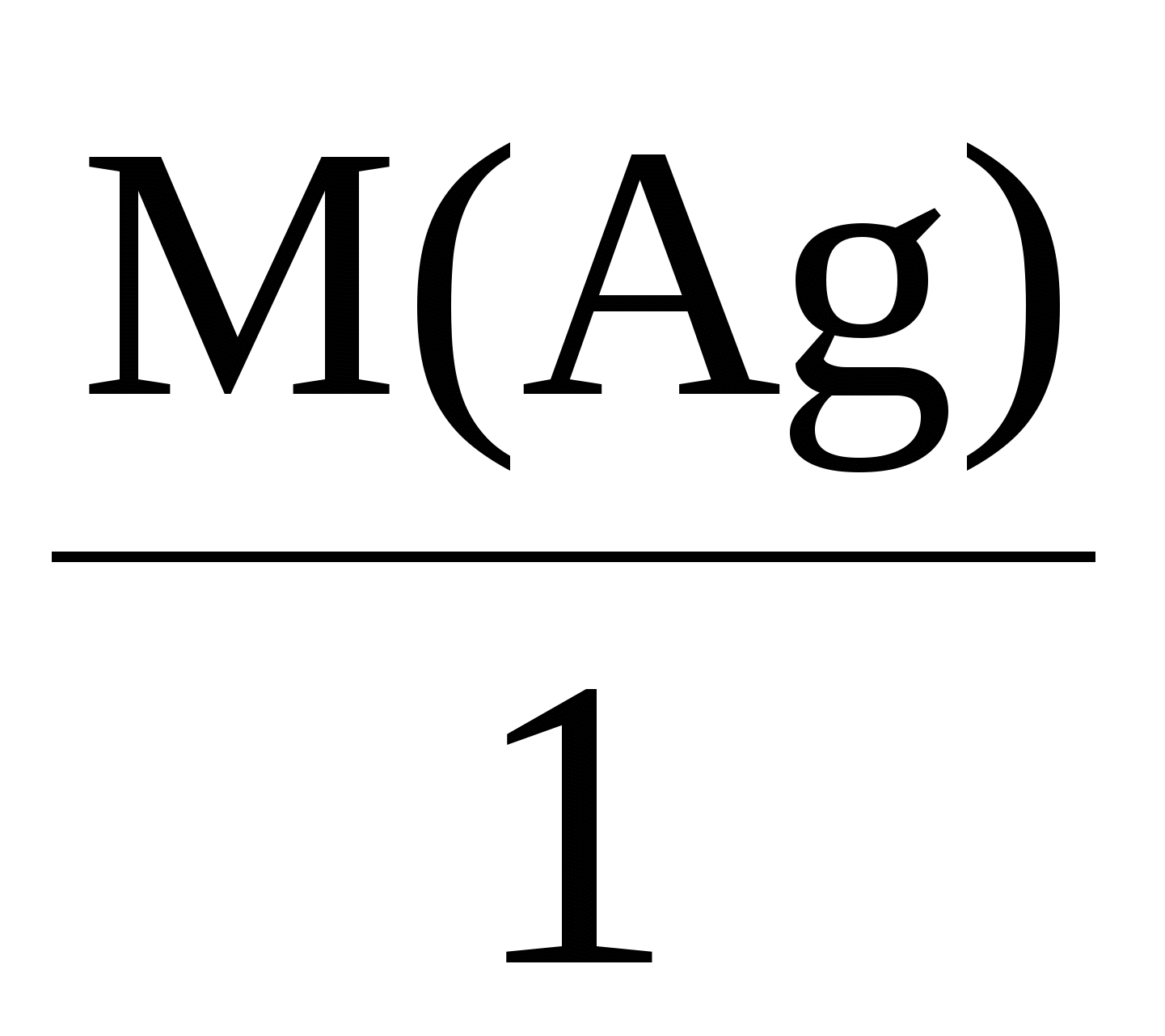 = = Mэкв (Ag) = 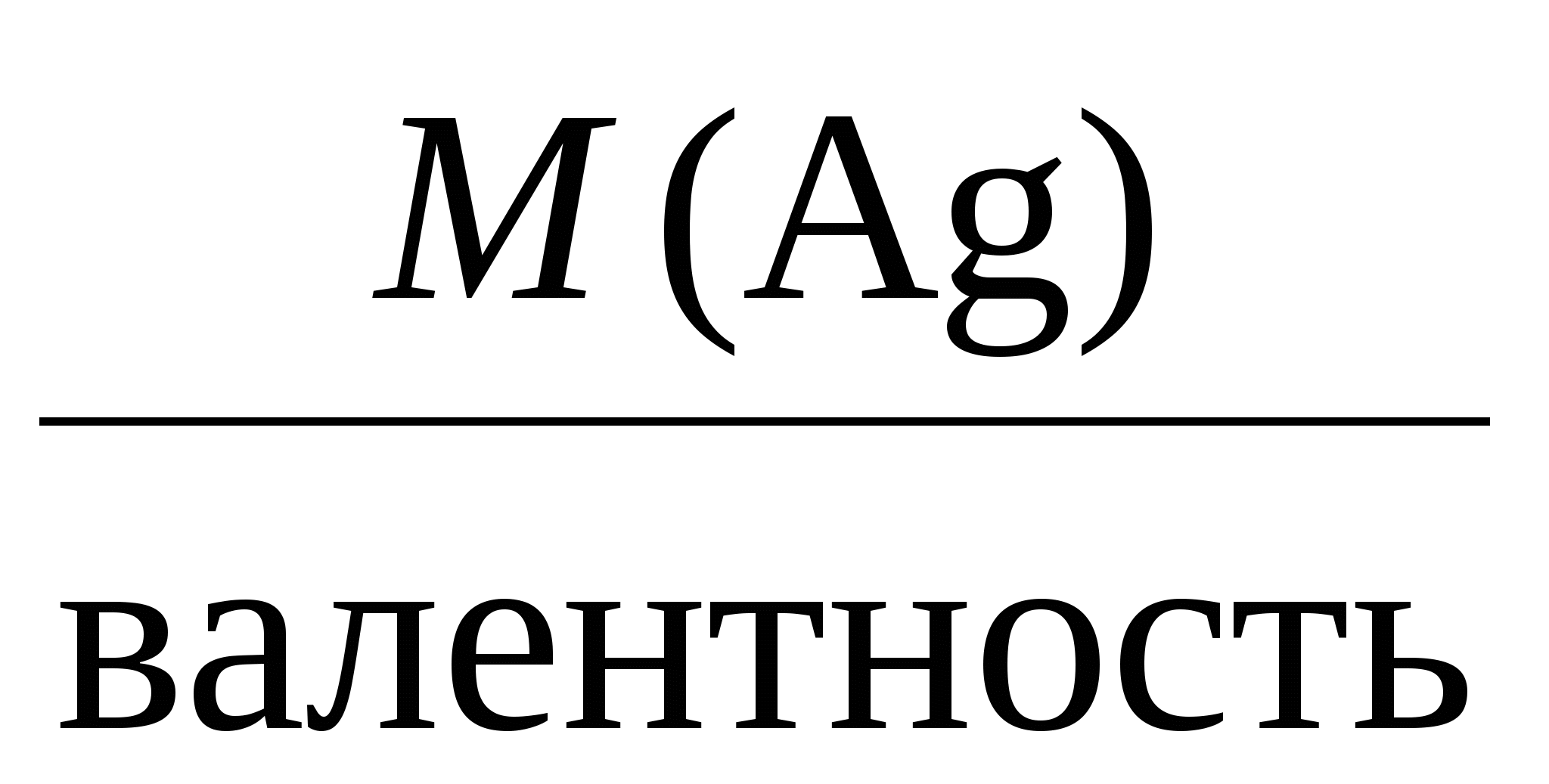 = = 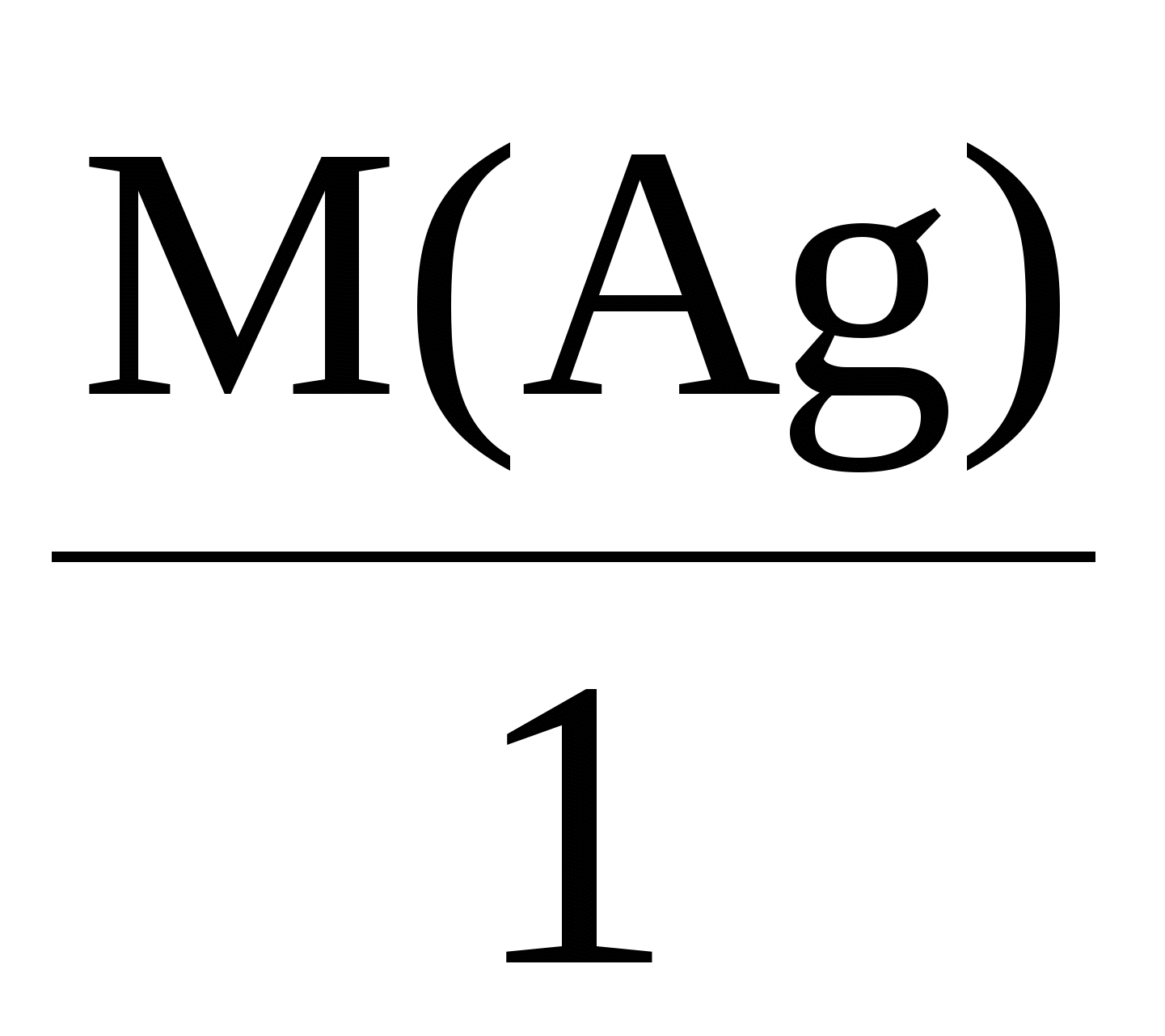 = = Mэкв (Cu) = 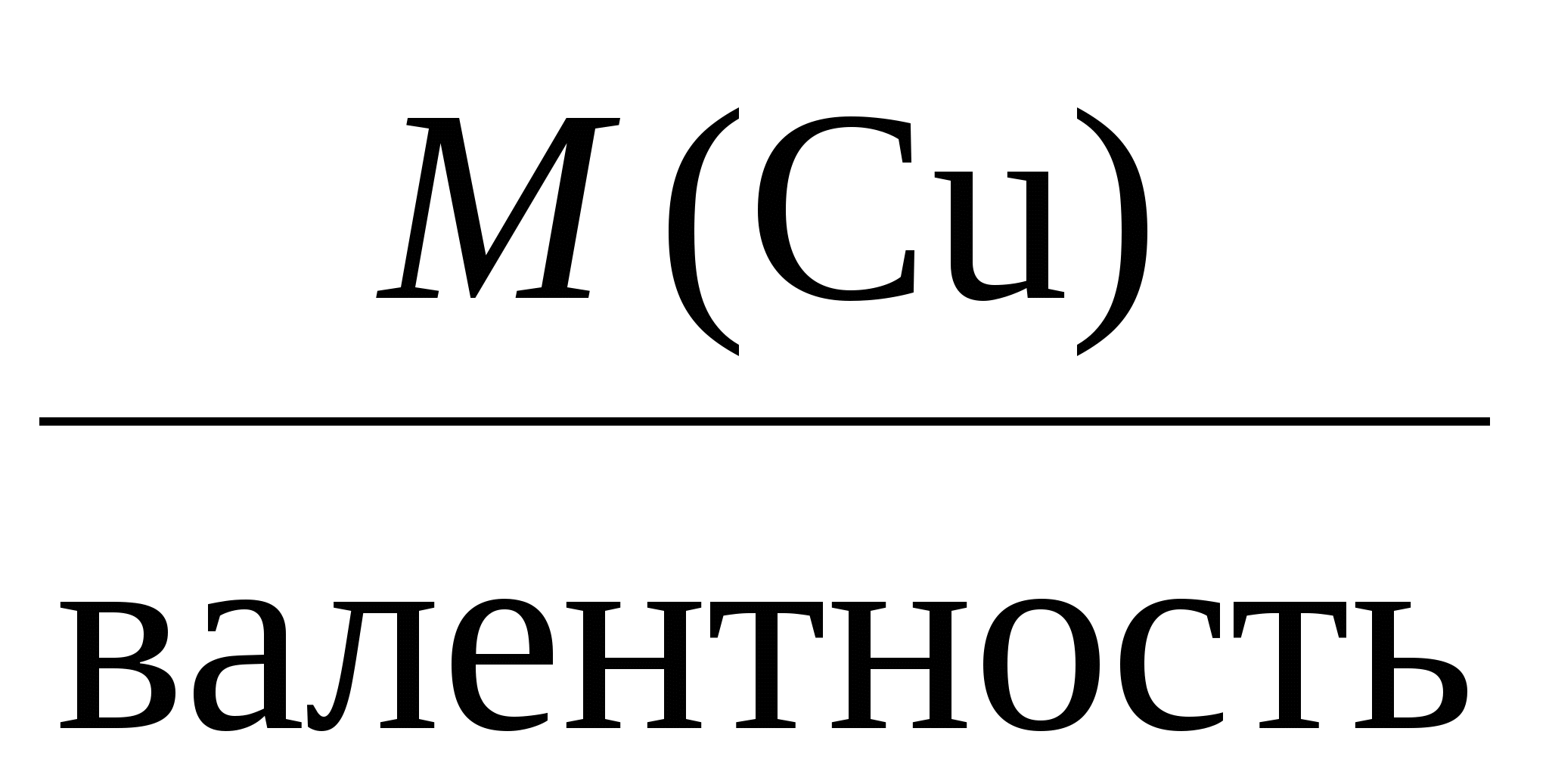 = = 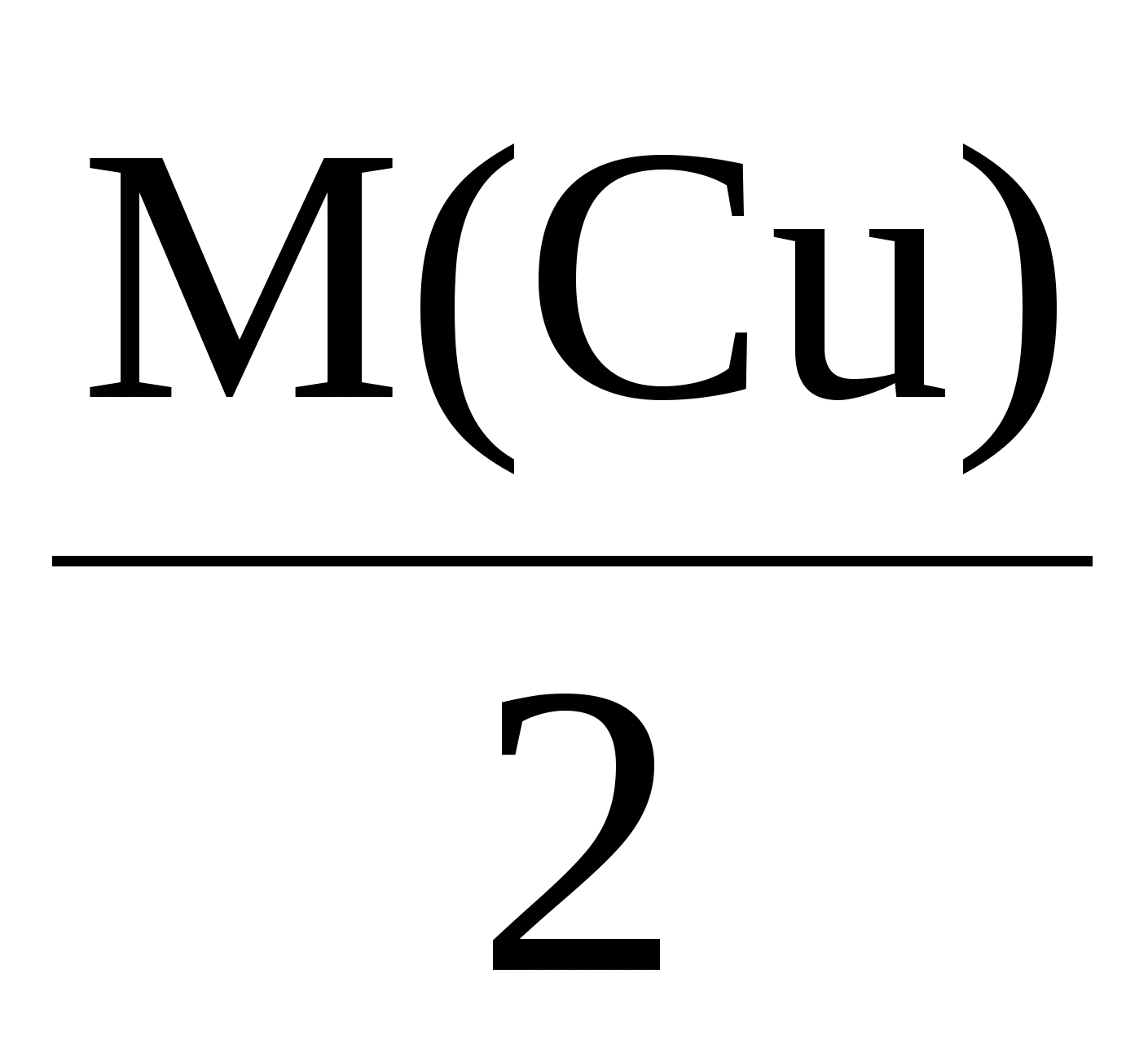 = = Mэкв (Al) = 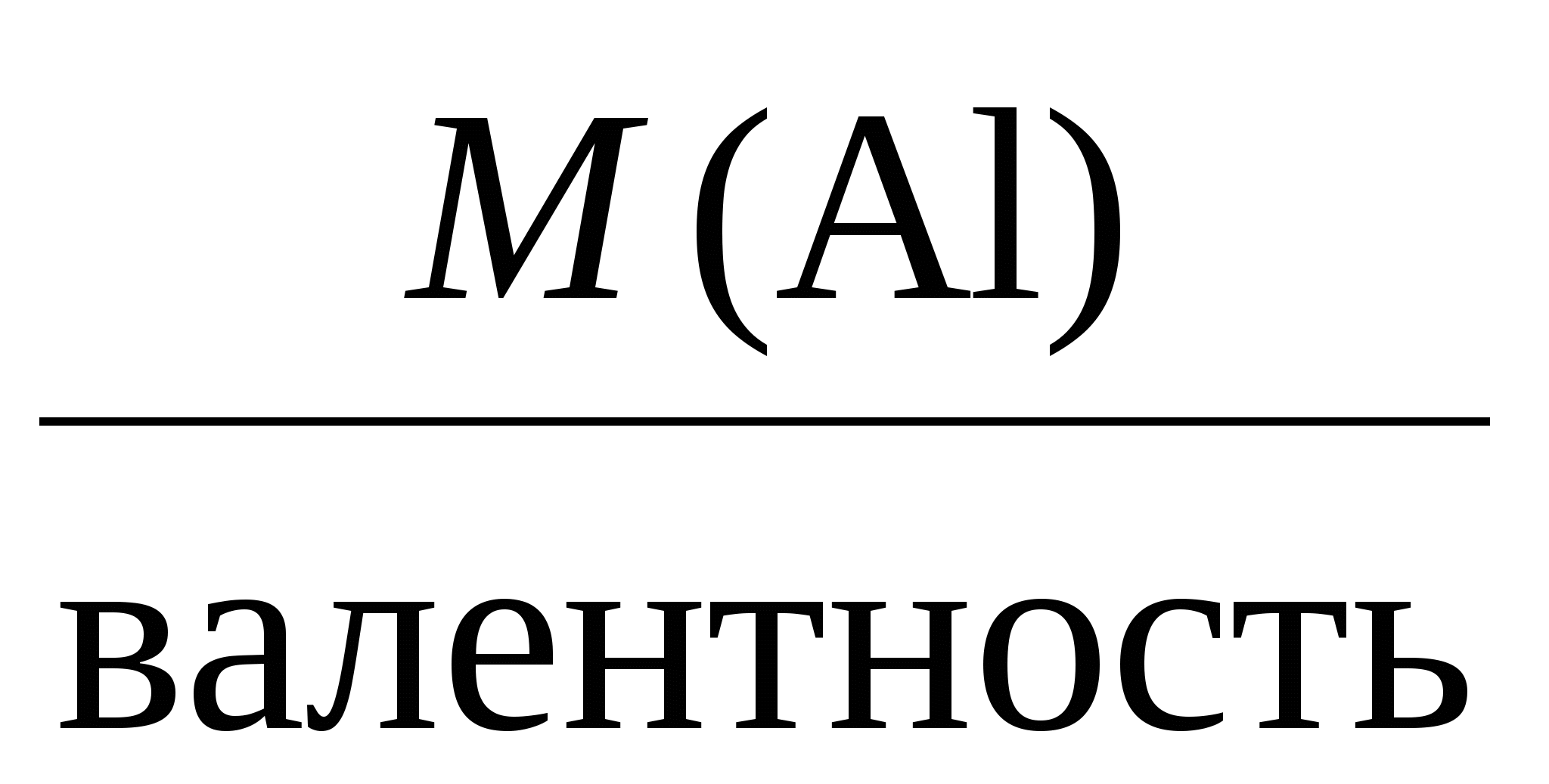 = = 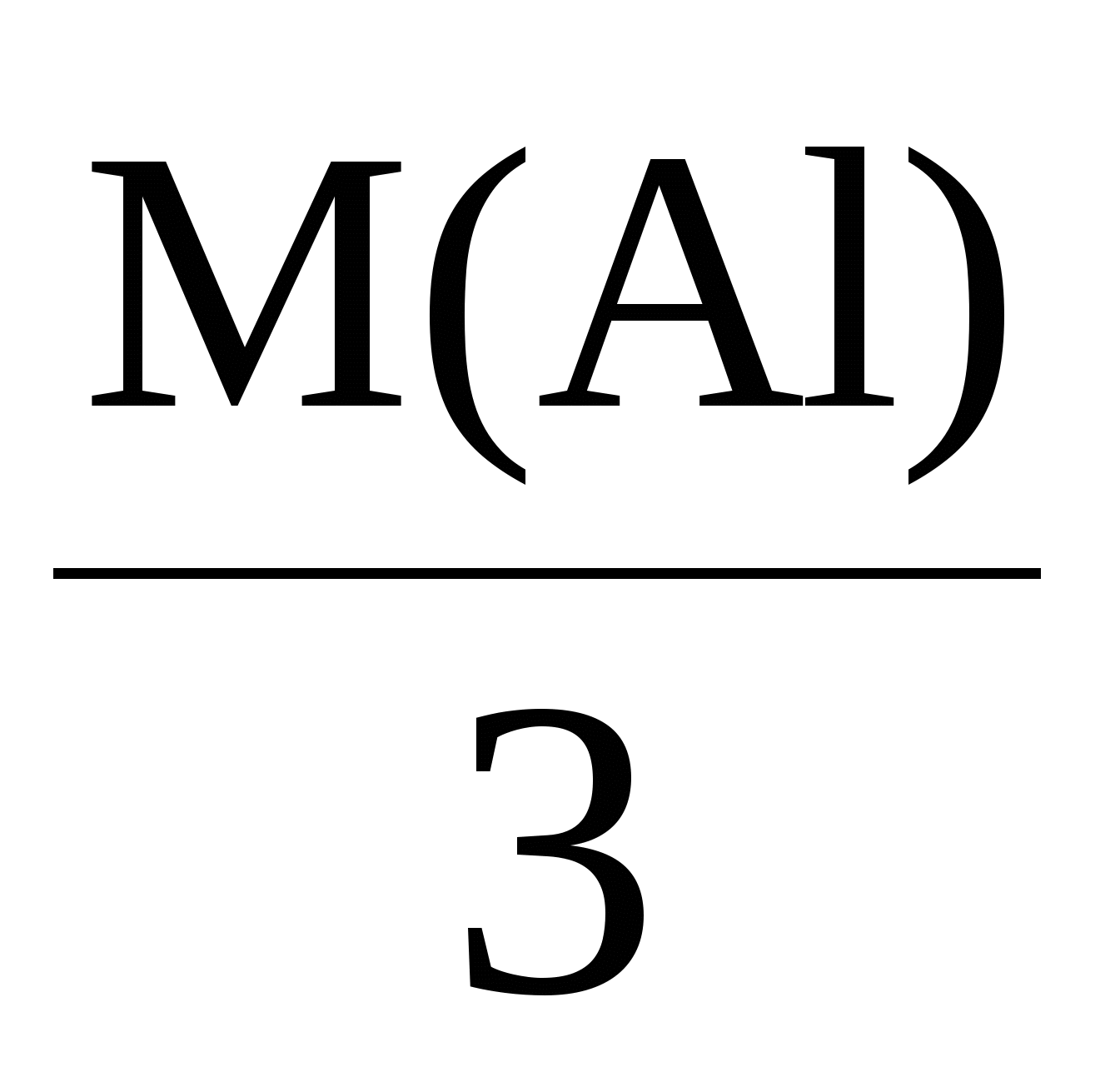 = = При пропускании 96500 Кл электричества на катоде выделится, соответственно, 108 г серебра, 32 г меди или 9 г алюминия. Таким образом, при количественных расчетах процесса электролиза можно пользоваться следующими формулами: m = k · Q = k ∙ I · τ, m = 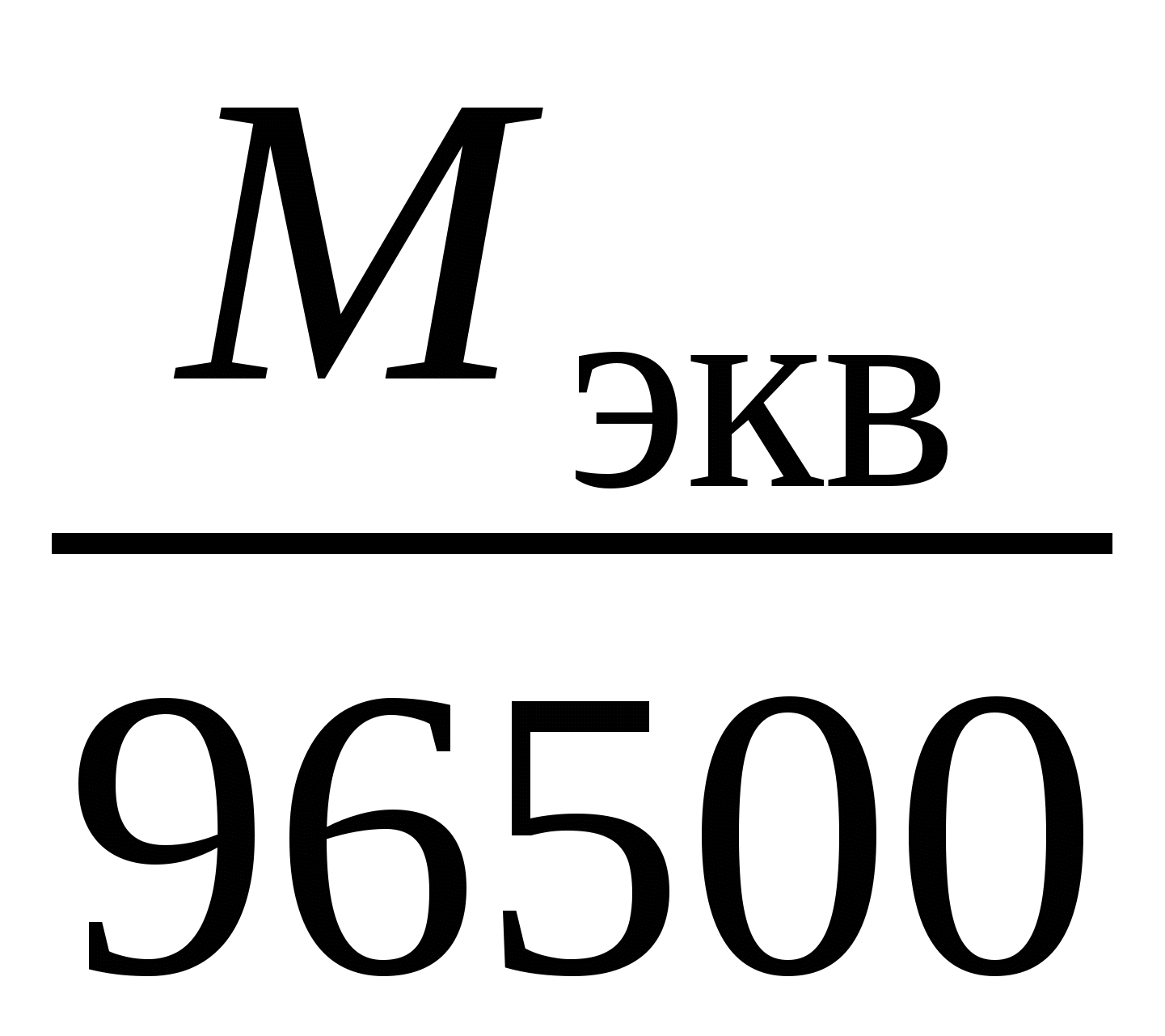 I· τ. I· τ.Второй закон Фарадея. Массы окисляющихся и восстанавливающихся на электродах веществ, при пропускании через раствор одного и того же количества электричества, пропорциональны молярным массам их эквивалентов. 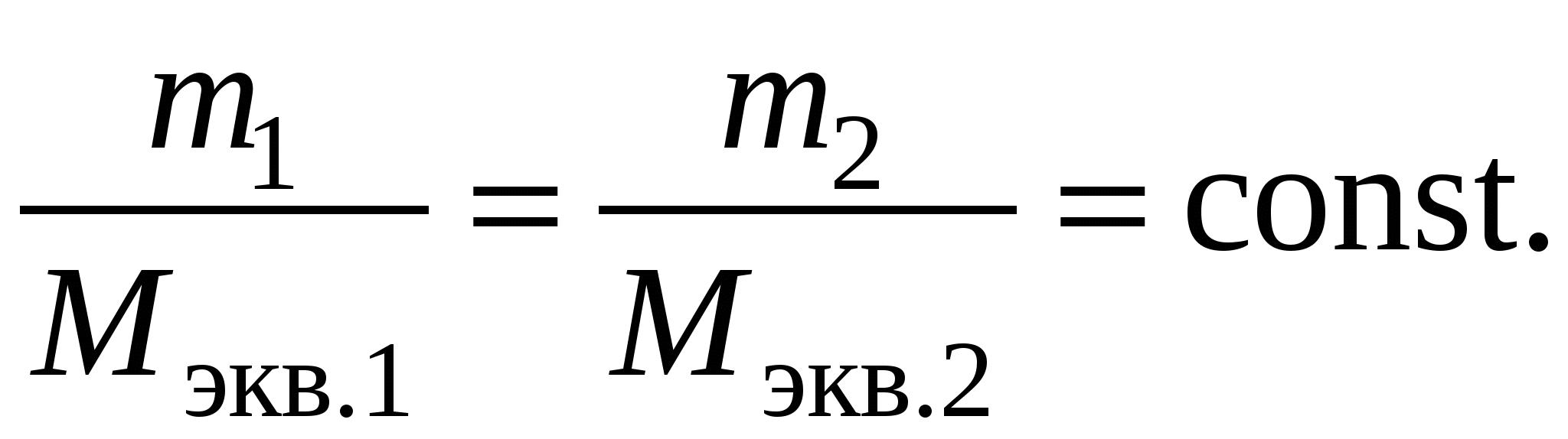 Полезно иметь в виду, что если для разряда одного однозарядного иона (например, Na+, Cl–) требуется 1 электрон, то для выделения из раствора электролита 1 моль таких же ионов, требуется число электронов, равное числу Авогадро – 6,02·1023 (1 моль электронов). Это количество электронов как раз и имеет общий заряд, равный 96500 Кл. Соответственно, для разряда 1 моль двухзарядных ионов, потребуется 2 моль электронов, или количество электричества, равное 2 · 96500 Кл и т.д. Используя вышеприведенные формулы, можно производить ряд расчетов, связанных с процессом электролиза, например: вычислять количества веществ, выделяемых или разлагаемых определенным количеством электричества; находить силу тока по количеству выделившегося вещества и времени, затраченному на его выделение; устанавливать, сколько времени потребуется для выделения определенного количества вещества при заданной силе тока. Практическое применение электролиза Электрохимические процессы широко применяются в различных областях современной техники и технологии. С использованием элект-ролиза в промышленных масштабах получают хлор и фтор, щело- чи, хлораты и перхлораты, химически чистые водород и кислород и т.д. В цветной металлургии электролиз используется для извлечения металлов из руд. Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и другие металлы. Для очистки металлов используют электрохимическое рафинирование. Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов в электролизер. При пропускании тока металл, подлежащий очистке, подвергается анодному растворению, т.е. переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде, благодаря чему образуется осадок чистого металла. Примеси, находящиеся в аноде, либо остаются нерастворимыми (выпадают в виде анодного шлама), либо переходят в раствор электролита и удаляются. Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Особо необходимо отметить значение гальванических покрытий в высоких технологиях (HiTec) таких, как микроструктурная техника, электроника и другие. Гальванотехника подразделяется на гальваностегию и гальванопластику. Гальваностегия (от греч. покрывать) – это электроосаждение на поверхность металла другого металла, который прочно связывается с покрываемым металлом (или специально обработанным неметаллическим предметом), служащим катодом электролизера. Покрытие изделий цинком, кадмием, никелем, хромом, золотом и другими металлами придает изделиям не только красивый внешний вид, но и предохраняет металл от коррозионного разрушения. Гальванопластика – получение путем электролиза точных, легко отделяемых металлических копий (матриц) с различных как неметаллических, так и металлических рельефных предметов. С помощью гальванопластики изготовляют бюсты, статуи и т. д. Кроме того, с помощью электролиза: получают защитные и декоративные оксидные пленки на поверхности металлов (анодирование), осуществляют электрохимическую размерную обработку металла (электрохимическое фрезерование), проводят обработку поверхности металлического изделия (электрохимическое полирование), осуществляют электрохимическое окрашивание металлов, проводят электрохимическую заточку режущих инструментов (например, хирургических ножей, бритв и т. д.), наносят металлические покрытия на изношенные металлические покрытия для ремонтных целей, наносят эмалевые покрытия порошково-электростатическим методом. 12.1. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Что такое электролиз? 2. Какие процессы имеют место при электролизе? 3. Как устроен электролизер? 4. Какой заряд имеют при электролизе а) анод, б) катод? 5. К какому электроду движутся при электролизе катионы? 6. Как заряжен электрод, к которому движутся при электролизе анионы? 7. Какой процесс протекает при электролизе: а) на аноде, б) на катоде? 8. Какие виды анодов используют при электролизе? 9. Какой процесс протекает при электролизе на растворимом аноде? 10. Из каких материалов изготавливают инертные (нерастворимые) аноды? 11. Какова последовательность разряда ионов при электролизе на аноде? 12. Какова очередность восстановления катионов при электролизе на катоде? 13. На основании какого закона устанавливается зависимость массы вещества, образовавшегося при электролизе, от времени, силы тока и природы электролита? 14. Приведите формулировку I закона Фарадея. 15. Приведите формулировку II закона Фарадея. 16. Какое значение имеет постоянная Фарадея? 17. Что такое электрохимический эквивалент? Какую размерность он имеет? 18. Как рассчитывается электрохимический эквивалент для металлов? 19. Как можно рассчитать значение молярной массы эквивалента металла? 20. Что такое выход по току? 21. Назовите области применения электролиза. 12.2. Примеры решения типовых задач по теме Пример 1. Сколько граммов меди выделится на катоде при пропускании через раствор сульфата меди (II) СuSO4 тока силой 5 ампер в течение 10 минут? Решение. Определим количество протекшего через раствор электричества: Q = I ∙ t, где I – сила тока в амперах; t – время в секундах. Q = 5A ∙ 600 с = 3000 А ∙ с = 3000 кулон. Молярная масса эквивалента меди (молярная масса 64) равняется 64:2 = 32 г/моль. Следовательно, 96500 кулон выделяют 32 г меди. Искомое количество меди: m = (32 ∙ 3000) / 96500 0,99 г. Пример 2. Сколько времени нужно пропускать через раствор кислоты ток силой 10 ампер, чтобы получить 5,6 л водорода (при н.у.)? Решение. Молярная масса эквивалента водорода равна: Mэкв (H) = 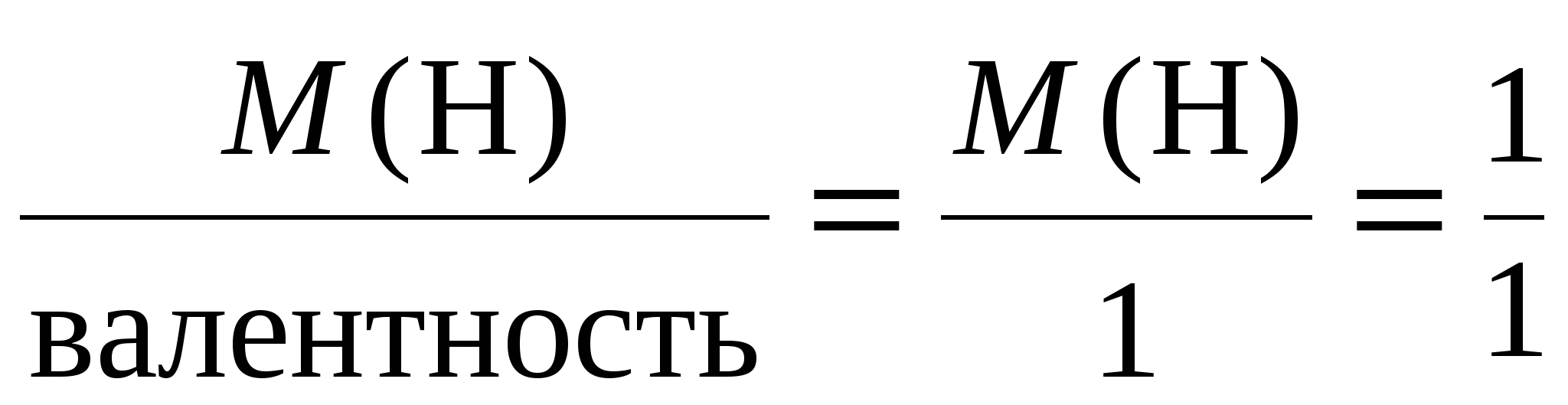 = 1 г/моль. = 1 г/моль.Молярная масса водорода M(H2) = 2 г/моль. Один моль молекул водорода имеет массу 2 г и занимает при н.у. объем 22,4 л. Осюда следует, что 1 моль эквивалентов водорода, имеющий массу 1 г, занимает при н. у. объем 11,2 л. Для выделения из раствора 1 моль эквивалентов необходим 1 Фарадей электричества (96500 Кл). Находим количество электричества, которое должно пройти через раствор, чтобы из него выделилось 5,6 л водорода. Искомое количество электричества: 11,2 л − 96500 Кл, 5,6 л − Q, Q = (96500 ∙ 5,6) / 11,2 = 48250 кулонов. Определим время прохождения тока: t = Q / I = 48250/10 = 4825 с = 1 ч 20 мин 25 с. Пример 3. При пропускании тока через раствор нитрата серебра на катоде выделилось за 10 мин. 1 г серебра. Определите силу тока. Решение. Масса 1 моль эквивалентов серебра равна 108 г. Для выделения 1 г серебра через раствор должно пройти 96500 : 108 894 кулона. Отсюда сила тока: I = 894 / (10 ∙ 60) 1,5A. Пример 4. Найти молярную массу эквивалента олова, если при токе 2,5 ампера из раствора хлорида олова (II) SnCl2 за 30 мин. выделяется олово массой 2,77 г. Решение. Количество электричества, прошедшее через раствор за 30 мин. будет равно: Q = 2,5 ∙ 30 ∙ 60 = 4500 кулонов. Так как для выделения 1 моль эквивалентов требуется количество электричества 96500 кулонов, то молярная масса эквивалента олова: Мэкв. (Sn) = (2,77 ∙ 96500) / 4500 = 59,4 г/моль. 12.2. ЗАДАЧИ И УПРАЖНЕНИЯ 1. Укажите номер, под которым приведена формула вещества выделяющегося на катоде при электролизе водного раствора хлорида натрия? 1) Na, 2) H2, 3) Cl2, 4) О2. 2. Под каким номером указан процесс, протекающий на катоде при электролизе водного раствора сульфата натрия? 1) 2H2О – 4e O2 + 4H+, 3) Na+ + 2e Na0, 2) 2H2О + 2e H2 + 2OH–, 4) 2H+ + 2e 3. С каким полюсом батареи (положительным или отрицательным) должен быть соединен стальной предмет при его никелировании? Укажите номер правильного ответа: 1) с отрицательным, 2) с положительным. 4. Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, для которых нельзя осуществить процесс электролиза расплава: 1) NaOH, 2) Al2O3, 4) CaCO3, 8) KCl, 16) AgNO3. 5. Водный раствор, содержащий смесь нитратов меди, свинца, серебра, калия, цинка и лития с одинаковыми концентрациями, подвергли электролизу. Укажите значение молярной массы вещества, которое будет восстанавливаться на катоде в первую очередь. 6. Под каким номером приведена последовательность, в соответствии с которой на катоде будут выделяться металлы при электролизе их водных растворов, содержащих ионы Zn2+, Ag+, Cu2+ одинаковой концентрации? 1) Cu Ag Zn, 2) Cu Zn Ag, 3) Zn Cu Ag, 4) Ag Zn Cu, 5) Ag Cu Zn. 7. Укажите номер или сумму условных номеров, под которыми расположены названия веществ, при электролизе водных растворов которых на катоде выделяется только металл. хлорид бария, 2) хлорид меди (II), 4) иодид калия, 8) нитрат серебра, 16) сульфид натрия. 8. Укажите номер или сумму условных номеров, под которыми расположены названия веществ, при электролизе водных растворов которых на катоде выделяется только водород. 1) хлорид калия, 2) хлорид никеля (II), 4) бромид кальция, 8) нитрат серебра, 16) иодид натрия. 9. Укажите номер или сумму условных номеров, под которыми расположены названия веществ, при электролизе водных растворов которых на катоде выделяются и водород, и металл: 1) хлорид хрома (III), 2) сульфат меди (II), 4) иодид калия, 8) нитрат серебра, 16) сульфат цинка. 10. Укажите номер или сумму условных номеров, под которыми расположены названия веществ, при электролизе водных растворов которых на аноде выделяется кислород: 1) фторид серебра, 2) хлорид меди (II), 4) иодид калия, 8) нитрат серебра, 16) гидроксид натрия. 11. Укажите номер или сумму условных номеров, под которыми расположены названия веществ, при электролизе водных растворов которых их массовая доля в растворе уменьшается: 1) нитрат серебра, 2) хлорид меди (II), 4) сульфат калия, 8) нитрат натрия, 16) фторид калия. 12. Укажите номер, под которым приведено название самого сильного окислителя: 1) фтор, 2) кислород, 3) концентрированная серная кислота, 4) электрический ток на аноде при электролиз, 5) электрический ток на катоде при электролизе? 13. Под каким номером указаны формулы веществ, выделяющихся на электродах при электролизе водного раствора нитрата серебра? 1) Ag и NO2, 2) H2 и O2, 3) H2 и NO2, 4) Ag и O2. 14. Под каким номером указана формула вещества, образующегося в растворе после окончания процесса электролиза раствора хлорида натрия? 1) Na, 2) H2, 3) Cl2, 4) NaOH, 5) NaClO3. 15. Под каким номером указана окраска индикатора метилоранж, которую он будет иметь в растворе у катода, при электролизе водного раствора иодида калия? 1) желтая, 2) оранжевая, 3) красная, 4) синяя. 16. Укажите номер или сумму условных номеров, под которыми расположены названия веществ, продукты электролиза которых одинаковы как для растворов, так и для расплавов: 1) фторид серебра, 2) хлорид меди (II), 4) иодид калия, 8) хлорид ртути (II), 16) гидроксид натрия. 17. Укажите номер или сумму условных номеров, под которыми расположены названия веществ, при электролизе водных растворов которых в окислительно-восстановительных процессах на электродах участвует вода: 1) фторид серебра, 2) бромид меди (II), 4) иодид калия, 8) хлорид ртути (II, 16) сульфат натрия. 18. Укажите номер или сумму условных номеров, под которыми расположены названия веществ, при электролизе водных растворов которых можно получить щелочь: 1) хлорид магния, 2) бромид бария, 4) иодид калия, 8) хлорид ртути (II), 16) сульфат натрия. 19. При электролизе водного раствора сульфата меди (II) с медным анодом масса катода увеличилась на 320 г. Какое количество вещества ионов меди (в молях) перешло в раствор? 20. Укажите номер или сумму условных номеров, под которыми расположены формулы солей, при электролизе водных растворов которых не происходит выделение металла: 1) ZnSO4, 2) NaNO3, 4) ZnCl2, 8) Hg(NO3)2, 16) RbCl. 21. Через электролизеры с водными растворами нитрата ртути (II) и нитрата серебра пропустили одинаковое количество электричества. При этом выделилась ртуть массой 402 г. Чему равна масса, в граммах, выделившегося серебра? 22. Вычислите объем хлора в литрах (н.у.), который можно получить при электролизе расплава хлорида натрия массой 585 г считая, что хлорид натрия израсходован полностью. 23. При электролизе раствора сульфата меди с медными электродами масса катода увеличилась на 40 г. Какое количество электричества (в кулонах) было пропущено через раствор? 24. Гидроксид калия какой массы (в граммах) образуется при пропускании через раствор калийной соли 48250 кулонов электричества? 25. Кадмий какой массы выделился на катоде, если через раствор сульфата кадмия пропустили ток силой 3,35 А в течение одного часа? Ответ округлите до целого числа и дайте в граммах. 26. Серебро какой массы выделилось на катоде, если через раствор нитрата серебра пропустили электрический ток силой 0,67 А в течение 20 часов? Ответ округлите до целого числа и дайте в граммах. 27. При электролизе раствора хлорида щелочного металла образовалась щелочь массой 3,06 г и хлор объемом 336 мл (н.у.). Определите значение относительной атомной массы щелочного металла. |
