основы электрохимии. Основы электрохимии и коррозии металлов Электродные потенциалы металлов и эдс гальванических элементов
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
11.2.3. Причины электрохимической гетерогенности поверхности металлов.В силу неоднородности реальных металлических материалов или состава контактирующих с ними электролитов, на металлах возникают участки, характеризующиеся различной величиной электродного потенциала. Участки, характеризующиеся более отрицательным значением потенциала, будут являться анодами, а более положительным - катодами возникающего при этом гальванического элемента. Основными причинами, вызывающими электрохимическую гетерогенность (неоднородность) поверхности металла могут быть:
11.2.4. Электродные процессы при коррозии металлов.При коррозионном разрушении металла по электрохимическому механизму в коррозионном гальваническом элементе имеет место протекание двух пространственно разделенных, но взаимосвязанных процессов, схема которых представлена на рис. 11.4. Анодный процесс окисления металла, который собственно и вызывает его разрушение, обусловлен переходом металла в раствор при его ионизации: анодный процесс при коррозии металлов - Избыток электронов с анода перетекает на катод, где связывается соответствующими окислителями, в качестве которых чаще всего выступают ионы водорода или растворенный в электролите кислород. Если электроны, образующиеся на аноде, связываются на катоде ионами водорода, то говорят о протекании коррозионного процесса с водородной деполяризацией. Такие процессы обычно имеют место при коррозии в кислых средах: катодный процесс ( водородная деполяризация) - 2Н+ + 2е- Н20 Если электроны, образующиеся на аноде, связываются на катоде растворенными в электролите молекулами кислорода, то говорят о протекании коррозионного процесса с кислородной деполяризацией. Катодный процесс (кислородная деполяризация) в зависимости от реакции среды может быть представлен следующими схемами: а) в нейтральных или щелочных средах - 2Н2О + О2 + 4е- 4ОН- б) в кислых средах - О20 + 4Н+ 2Н2О 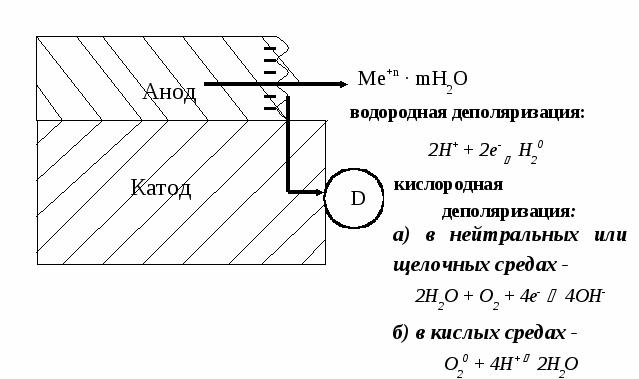 Рис. 2. Схема электродных процессов, протекающих при электрохимической коррозии. Для эффективной работы коррозионного гальванического элемента, как минимум, необходимо удаление ионов металла из анодного приэлектродного пространства и связывание на катоде образующихся при анодном растворении металла электронов. Любой фактор, вызывающий затруднение протекания катодного или анодного процесса, приводит к поляризации электродов гальванического элемента. При этом потенциал анода становится менее отрицательным, потенциал катода менее положительным, т.е. потенциалы анодных и катодных участков выравниваются, а Э.Д.С. гальванического элемента уменьшается. 11.2.5. Роль поляризации и деполяризации при коррозии металлов. Поляризация вызывается отставанием электродных процессов от процесса передвижения электронов в металле от анода к катоду. Если анодный процесс перехода ионов металла в раствор отстает от перетока электронов от анода к катоду, то это приводит к уменьшению отрицательного заряда на поверхности металла (анодная поляризация). Анодная поляризация при коррозии металла может быть вызвана:
Пассивность в определенных условиях наблюдается у титана, алюминия, хрома, молибдена, магния, никеля, кобальта, железа и некоторых других металлов. Пассивность металлов зависит как от внутренних факторов (состав, структура, состояние поверхности), так и от внешних факторов (состав и концентрация электролита, температура, движение раствора, наложение внешнего тока и т.д.). Ввещества, способствующие переходу металла в пассивное состояние, называются пассиваторами. К пассиваторам относятся такие окислители, как HNO3, NaNO3, NaNO2, K2CrO7, O2 и др. Пассивное состояние может сохраняться и после изменения внешних условий, вызвавших пассивацию. Депассивирующими факторами при коррозии металлов, нарушающими пассивное состояние металла, являются: действие некоторых восстановителей, например H2, Na2SO3 и др. некоторых ионов, например, CI-, Br-, I-, Катодная поляризация при коррозии металлов может быть вызвана:
Поляризация тормозит коррозионные процессы, и если бы этот процесс не имел бы места в реальных условиях, многие металлы потеряли бы свое техническое значение. Любые процессы, уменьшающие явление поляризации, называются процессами деполяризации, а вещества ее вызывающие-деполяризаторами. Деполяризация ускоряет коррозионные процессы. В зависимости от среды различают процессы коррозии, протекающие: а) с водородной деполяризацией, б) с кислородной деполяризацией. Наиболее распространена коррозия с кислородной деполяризацией, которая имеет место в нейтральных, щелочных и слабокислых средах. Примером коррозии с кислородной деполяризацией может служить коррозия углеродистой стали в атмосферных условиях. В этом случае на поверхности металла находится пленка влаги, образованная за счет атмосферных осадков или конденсации паров из воздуха. Установлено, что для протекания коррозии по электрохимическому механизму достаточно слоя электролита толщиной всего 40-50 молекул. В воде растворяются O2, CO2, SO2, соли и др., что повышает электропроводность электролита. Сталь содержит в своем составе зерна карбида железа (Fe3C), выполняющие функцию микрокатодов (рис.22). На анодных участках (железо) происходит процесс окисления, при этом железо переходит в виде ионов в раствор: На катодных участках (Fe3C) - восстановление деполяризатора - растворенного кислорода: Так протекает реакция ионизации кислорода в нейтральных или щелочных средах. В кислых средах кислородная деполяризация протекает по уравнению: При коррозии имеют место вторичные процессы, при которых ионы железа с ионами гидроксила образуют гидроксид железа (П), который далее окисляется кислородом до гидроксида железа (III): Частично теряя воду, этот гидроксид образует ржавчину переменного состава: 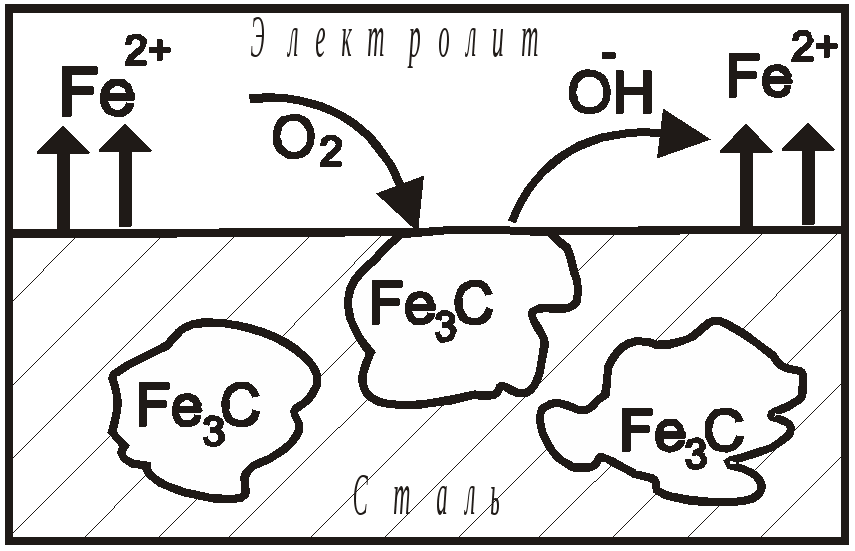 Рис. 3. Схема коррозии стали с кислородной деполяризацией в нейтральной среде. Катодный процесс коррозии с кислородной деполяризацией состоит из нескольких стадий:
Обычно наиболее замедленной стадией является диффузия кислорода к поверхности металла, поэтому аэрация сильно сказывается на скорости коррозии. Однако, при больших скоростях подвода кислорода к корродирующей поверхности наиболее медленной стадией становится ионизация кислорода и в этом случае большое значение имеет перенапряжение ионизации кислорода. Скорость коррозионного процесса определяется скоростью наиболее заторможенной стадии, поэтому эта стадия называется лимитирующей стадией или контролирующим фактором. Коррозия с водородной деполяризацией протекает в кислых средах и роль деполяризатора в этом случае выполняют ионы водорода Н+. Например, при коррозии железа в кислых средах на анодных участках происходит окисление железа: а на катодных - восстановление ионов водорода: Контролирующим фактором процесса коррозии с водородной деполяризацией обычно является восстановление ионов водорода Н+.. В этом случае большое значение имеет перенапряжение выделения водорода на катоде; чем оно больше, тем медленнее протекает процесс деполяризации, а, значит, и коррозионный процесс в целом. Так, учитывая небольшие величины перенапряжения выделения водорода на меди (0,23В) и на железе (-0,08В), по сравнению с цинком (0,7В), становится понятным резкое возрастание скорости растворения в разбавленных кислотах технического цинка с примесями данных металлов, по сравнению со скоростью растворения чистого цинка. Таким образом, перенапряжение выделения водорода является фактором, тормозящим разрушение металла. |
