основы электрохимии. Основы электрохимии и коррозии металлов Электродные потенциалы металлов и эдс гальванических элементов
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
|
Глава 12 Электролиз Электролизом называется совокупность процессов, сопровождающих прохождение электрического тока через растворы или расплавы электролитов. При электролизе имеет место превращение электрической энергии в химическую энергию, сопровождающееся разложением растворенного или расплавленного вещества или воды. Для проведения электролиза применяют специальные устройства электролизеры (рис. 12.1).      3 2 4 3 1   Катод Анод        Р 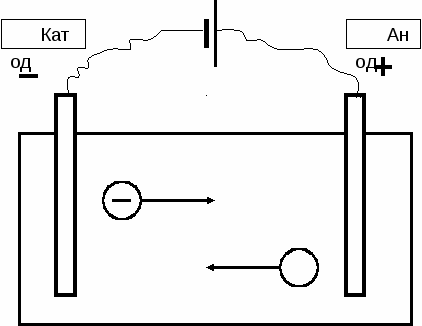 ис. 12.1. Схема электролизера: ис. 12.1. Схема электролизера:1 – электролитическая ячейка, 2 – раствор (расплав) электролита, 3 – электро- ды, 4 – источник тока Электролизеры состоят из электролитической ячейки (в промышленности – электролизной ванны), содержащей раствор или расплав электролита, погруженных в нее электродов и источника тока. Электрод, подключенный к положительному полюсу источника тока, называется анодом, а к отрицательному полюсу – катодом. При осуществлении электролиза протекают следующие процессы: направленное движение ионов электролита к электродам. Положительно заряженные ионы перемещаются к катоду (отсюда название этих ионов – катионы Мn+), а отрицательно заряженные – к аноду (отсюда название таких ионов – анионы Аnn–). окислительно-восстановительные процессы на электродах. При достижении соответствующего электрода, ионы разряжаются (отдают или принимают электроны). При электролизе, как при любой электрохимической реакции, на аноде протекает процесс окисления, т.е. процесс отдачи электронов, а на катоде – процесс восстановления, т.е. процесс присоединения электронов образовавшиеся на электродах вещества (ионы или нейтральные молекулы) могут покидать поверхность электродов, кроме того, они могут вступать во вторичные взаимодействия. Характер процессов окисления на аноде и восстановления на катоде зависит от условий электролиза. При этом соблюдается строгая очередность разряда ионов. На аноде, в первую очередь, должны окисляться наиболее сильные восстановители – вещества, имеющие наиболее отрицательное значение электродных (окислительно – восстановительных) потенциалов. В зависимости от условий электролиза, на аноде принципиально возможны следующие окислительные процессы: – окисление анионов кислотных остатков 2Сl– - 2e = Cl2 процесс 1 – окисление анионов гидроксила 4ОН- – 4e = 2O2 + 2H2O процесс 2 – окисление молекул воды 2H2О – 4e = O2 + 4H+ процесс 3 – окисление материала анода Me0 – ne = Me+n процесс 4. На катоде, в первую очередь, восстанавливаются наиболее сильные окислители, имеющие наибольшие положительные значения электродных (окислительно-восстановительных) потенциалов. При этом на катоде, в зависимости от условий, принципиально возможны следующие восстановительные процессы: – восстановление катионов металла Me+n + ne = Me0 процесс 5 – восстановление ионов водорода 2H+ + 2e = Н2 процесс 6 – восстановление молекул воды 2H2O + 2e = Н2 + 2ОН– процесс 7. Различают электролиз, протекающий с участием активных и инертных электродов. Электрод (анод), материал которого может окисляться в процессе электролиза, называется активным (растворимым) электродом. Примером активных электродов могут служить медный электрод, используемый при электролизе водного раствора сульфата меди, цинковый, серебряный и другие электроды. В результате процесса электролиза материал электрода растворяется. Не окисляющийся в процессе электролиза и служащий только для подвода электрического тока электрод называется инертным. Инертные электроды изготавливают из графита, угля, золота, платиновых металлов, нержавеющей стали и некоторых других материалов. Рассматривая процессы восстановления катионов на катоде при электролизе, следует иметь в виду следующие аспекты. При восстановлении катионов на катоде и их переводе в нейтральные атомы требуется различное напряжение электрического тока. Одни ионы легче теряют свои заряды, другие труднее. Степень легкости, с которой разряжаются (присоединяют электроны) ионы металлов, определяется положением металлов в ряду стандартных электродных потенциалов. Чем левее стоит металл в этом ряду и чем меньше величина его электродного потенциала, тем труднее, при прочих равных условиях, разряжаются его ионы. Таким образом, легче всего разряжаются ионы наименее активных металлов, например, Аu3+, Ag+, Cu2+; труднее всего восстанавливаются ионы наиболее активных металлов, например, – Li+, Rb+, K+. Если в растворе одновременно находятся ионы нескольких металлов, то в первую очередь разряжаются ионы того металла, величина электродного потенциала которого больше. Например, из раствора, содержащего одновременно ионы Zn2+ и Cu2+, в первую очередь выделяется металлическая медь, которая менее активна и имеет большее значение стандартного электродного потенциала (см. ряд стандартных электродных потенциалов). E0(Cu+2/Cu0) = + 0,34 B, E0(Zn+2/Zn0) = – 0,76 B. В то же время, следует учитывать, что величина потенциала металла зависит и от концентрации его ионов в растворе. Увеличение концентрации ионов металла в растворе способствует возрастанию значения потенциала соответствующего электрода, что облегчает разряд соответствующих ионов, а уменьшение концентрации – затрудняет. Поэтому, при электролизе раствора, содержащего ионы нескольких металлов с различной концентрацией может случиться, что выделение более активного металла будет происходить раньше, чем выделение менее активного (если концентрация ионов первого металла значительна, а второго – очень мала). В водных растворах солей, кроме ионов соли, всегда имеются еще и ионы, образующиеся при диссоциации воды (Н+ и ОН–). Ионы водорода могли бы разряжаться легче, чем ионы металлов, имеющих меньшее значение величины электродного потенциала и расположенных в ряду стандартных электродных потенциалов левее водорода. Однако, ввиду ничтожной концентрации водородных ионов при электролизе водных растворов всех солей (за исключением растворов солей наиболее активных металлов) на катоде возможно выделение либо только металла, либо металла совместно с водородом. Кроме того, катодный процесс выделения водорода на электродах, в зависимости от материала электрода, может характеризоваться значительной поляризацией (перенапряжением), что также облегчает выделение более активных, чем водород металлов. И лишь при электролизе солей наиболее активных металлов (до алюминия включительно) – разряжаются только ионы водорода, и на электроде выделяется газообразный водород. При этом ионы таких наиболее активных металлов не восстанавливаются и остаются в растворе. Рассматривая процессы окисления анионов на аноде при электролизе, также следует обращать внимание на ряд моментов. При электролизе водных растворов солей у анода могут разряжаться или анионы кислотных остатков или гидроксильные ионы, образующиеся при диссоциации воды. Если ионы кислотных остатков не содержат кислород (Cl–, Br–, S2–, CN– и др.), то обычно разряжаются именно эти ионы, а не гидроксильные ионы, которые теряют свой заряд значительно труднее. Так, например, при электролизе водных растворов хлоридов и сульфидов у анода выделяются соответственно Cl2, S. Если электролизу подвергается соль кислородсодержащей кислоты или сама кислородсодержащая кислота, то на аноде разряжаются не анионы кислотных остатков кислородсодержащих кислот, а гидроксильные ионы из воды. При этом, образующиеся при разряде гидроксильных ионов нейтральные группы ОН0, тотчас же разлагаются с образованием кислорода и воды: 4OH– – 4e 4OH0 и далее: 4OH0 O2 + 2H2O. В результате, при электролизе растворов кислородсодержащих солей или самих кислородсодержащих кислот на аноде выделяется кислород. Поскольку концентрация гидроксильных ионов в водных растворах кислот и солей очень мала, то, фактически, происходит окисление молекул воды: 2H2О – 4e = O2 + 4H+ процесс 3. Таким образом, при электролизе принципиально возможно протекание на электродах различных анодных (процессы 1– 4) и катодных (процессы 5–7) процессов. Вероятность каждого из них зависит от целого ряда факторов (температуры, концентрации раствора, рН среды, силы тока, материала электродов и др.). Поэтому, для определения продуктов электролиза водных растворов электролитов следует пользоваться следующими практическими правилами. Процессы восстановления на катоде. Не зависят от материала катода, а зависят от положения металла в ряду стандартных электродных потенциалов. В первую очередь восстанавливаются катионы малоактивных металлов, расположенных в ряду стандартных электродных потенциалов после водорода Н2, (например, Au3+, Ag+, Hg2+, Cu2+) Me+n + ne = Me0 процесс 5. Катионы металлов средней активности, стоящие в ряду стандартных электродных потенциалов между Аl и Н2, восстанавливаются совместно с катионами водорода (из молекул Н2О). При этом на катоде одновременно протекают два процесса: а) процесс восстановления ионов металла средней активности: Me+n + ne = Me0 процесс 5 б) процесс восстановления ионов водорода из воды: 2H2О + 2e = Н2 + 2ОН– процесс 7. Катионы активных металлов от Li до А1 (включительно) при электролизе водных растворов не восстанавливаются. На катоде в этом случае восстанавливаются только ионы водорода из воды и выделяется водород: 2H2О + 2e = Н2 + 2ОН– процесс 7. При электролизе растворов сильных кислот, характеризующихся высокими концентрациями ионов водорода, на катоде восстанавливаются ионы водорода Н+: 2H+ + 2e = Н20 процесс 6. Процессы окисления на аноде Зависят от материала анода. Если анод нерастворимый (инертный), то в первую очередь на нем окисляются анионы бескислородных кислот (за исключением ионо фтора F–) 2Сl– – 2e = Cl2 процесс 1. Анионы кислородсодержащих кислот (оксокислот), например, SO42–, NO3–, СО32–, РO43–, а также фторид ион (F–), не окисляются при электролизе водных растворов. При этом на аноде идет процесс окисления молекул Н2О: 2H2О – 4e = O2 + 4H+ процесс 3. При электролизе растворов щелочей на аноде окисляются ионы ОН– и, в результате, выделяется кислород : 4ОН– – 4e = 2O2 + 2H2O процесс 2. При наличии в растворе различных анионов, они окисляются в порядке возрастания величины их окислительно-восстанови-тельного потенциала: - сначала окисляются анионы бескислородных кислот; - затем окисляются молекулы Н2О (в щелочной среде – ионы ОН–); - анионы кислородсодержащих кислот (оксокислот) и ионы фтора F– остаются в растворе без изменения. Если проводится электролиз с активным электродом (растворимым анодом), то на нем протекает процесс окисления материала анода: Me0 – ne = Me+n процесс 4. Рассмотрим несколько примеров процессов электролиза Пример 1. Электролиз раствора хлорида никеля (II) NiCl2 с инертными электродами. Раствор содержит ионы Ni2+ и Cl–, образующиеся в результате процесса диссоциации соли: NiCl2 → Ni2+ + 2Cl. Кроме того, в растворе в ничтожной концентрации содержатся ионы Н+ и ОН –, образующиеся при диссоциации молекул воды: H2О H+ + OH–. При пропускании тока катионы Ni2+ и H+ перемещаются к катоду (отрицательно заряженному электроду). На катоде протекает процесс восстановления. Принимая от катода по два электрона, ионы Ni2+ превращаются в нейтральные атомы, выделяющиеся из раствора. Катод постепенно покрывается никелем: Ni+ + 2e → Ni0. Одновременно анионы Cl– и OH– движутся к аноду (положительно заряженному электроду). На аноде протекает процесс окисления. Так как в первую очередь разряжаются анионы бескислородных кислот, то ионы хлора, достигая анода, отдают ему электроны и превращаются в атомы хлора. В дальнейшем эти атомы, соединяясь попарно, образуют молекулы хлора, покидающие поверхность электрода. У анода выделяется хлор: 2Cl- – 2e → Складывая уравнения процессов, протекающих на катоде и на аноде с учетом отданных и принятых электронов, получим краткое ионно-молекулярное уравнение процесса электролиза: Ni+ + 2Cl- Молекулярное уравнение процесса электролиза водного раствора хлорида никеля (II) будет иметь вид: NiCl2 Пример 2. Электролиз раствора йодида калия KI. Йодид калия в результате процесса диссоциации находится в растворе в виде ионов К + и I– KI → K+ + I–. Кроме того, в растворе в растворе содержатся ионы Н+ и ОН–, образующиеся при диссоциации воды: H2О H+ + OH–. При пропускании электрического тока ионы К+ и H+ передвигаются к катоду, а ионы I- и OH- – к аноду. Так как калий стоит в ряду напряжений гораздо левее водорода и имеет меньшее значение электродного потенциала, то у катода разряжаются не ионы калия, а катионы водорода из воды. Образующиеся при этом атомы водорода соединяются в молекулы Н2, и, таким образом, у катода выделяется водород: 2H2О + 2e = Н2 + 2ОН– . По мере разряда ионов водорода диссоциируют все новые молекулы воды, вследствие чего у катода накапливаются гидроксильные ионы (освобождающиеся из молекулы воды), а также ионы К+, непрерывно перемещающиеся к катоду. В пространстве у катода образуется раствор КОН и среда становится щелочной. Одновременно к положительно заряженному аноду перемещаются анионы иода и гидроксила. В первую очередь у анода происходит выделение йода, так как ионы I– разряжаются легче, чем гидроксильные ионы из воды: 2I– – 2e = I2. Складывая уравнения процессов, протекающих на аноде и на катоде, получим краткое ионно-молекулярное уравнение процесса электролиза: 2H2О + 2I- Полное ионно-молекулярное уравнение процесса электролиза получим добавляя в левую и правую части краткого уравнения недостающие ионы (ионы калия К+): 2H2О+ 2K+ + 2I– Молекулярное уравнение процесса электролиза водного раствора иодида калия будет иметь вид: 2H2О + 2KI |
