основы электрохимии. Основы электрохимии и коррозии металлов Электродные потенциалы металлов и эдс гальванических элементов
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
Защита металлов от коррозии.Учитывая особую остроту проблемы борьбы о коррозией, антикоррозионные мероприятия следует проводить начиная со стадии проектирования соответствующего оборудования и далее применять различные методы на стадиях изготовления и, что особенно важно, при его эксплуатации. В зависимости от используемого материала, назначения, условий эксплуатации, требований по надежности, технических возможностей и экономичности в настоящее время применяют различные методы борьба с коррозией. Важнейшие среди них:
Рациональное конструирование, правильный выбор конструкционных материалов, их сочетания в различных изделиях, формы конструкций - имеют важное значение в борьбе с коррозией. Конструктор должен предусмотреть рациональные формы частей конструкции, обеспечивающие отсутствие щелей и зазоров, а также мест скопления влаги, которая способствует развитию коррозии. Необходимо избегать контакта разнородных металлов в среде электролита, особенно при малой площади анодных участков. Для изготовления всевозможных конструкций в настоящее время широко используются самые разнообразные металлические и неметаллические материалы. Среди металлических коррозионно-стойких конструкционных материалов следует выделить легированные стали, которые подразделяют на 3 группы:
Нержавеющей сталью называют сталь, обладающую высокой стойкостью в коррозионных средах. Наиболее распространенными представителями этой группы являются хромистые (13-З0% Сr), хромо-никелевые (до 10-12% Ni), хромоникельмолибденовые и др. Их стойкость объясняется пассивацией поверхности металла в условиях эксплуатации. Жаростойкие стали обладают способностью противостоять коррозионному разрушению под действием воздуха в других газов при высоких температурах. К жаростойким относятся сплавы, содержащие алюминий, хром, кремний. Эти сплавы не образуют окалины при высоких температурах. Их стойкость связана с образованием защитных пленок, состоящих из оксидов легирующих элементов. Эти стали применяют для изготовления различных деталей нагревательных устройств и энергетических установок. Жаропрочные стали, способные выдерживать механические нагрузки при высоких температурах, обязаны своими свойствами таким легирующим добавкам, как хром, кремний, молибден, никель. Повышенной коррозионной стойкостью обладает и ряд цветных металлов и сплавов на их основе. Среди них следует выделить обладающий уникальным комплексом ценных свойств титан, практически не подвергающийся коррозии в морской воде, стойкий в атмосферных условиях и растворах кислот - окислителей. Заслуживает особого внимания впервые разработанный в нашей стране сплав титана с добавкой палладия (до 0,5%). Добавка палладия; облегчая катодное выделение водорода, несколько сдвигает потенциал корродируещего металла в положительную сторону. Этого оказывается достаточно, чтобы сплав самопроизвольно переходил в пассивное состояние даже в растворах неокисляющих кислот и обладал в них очень высокой коррозионной стойкостью. Все более широкое использование в нефтяной промышленности находят сплавы на основе алюминия и медные сплавы. Среди неметаллических конструкционных материалов можно выделить целый ряд неорганических силикатных материалов: цементы и бетоны, кварцевое отекло, ситаллы и шлакоситаллы, базальтовое или диабазовое каменное литье, различные керамические материалы. Все большее распространение получают органические полимерные материалы, имеющие низкую плотность, устойчивость к атмосферным условиям, растворам солей, кислот и щелочей. Они могут быть оптически и радиопрозрачными, обладают хорошими теплоизоляционными и диэлектрическими свойствами. В качестве конструкционных материалов используются простые (ненаполненные) и сложные (композиционные) пластические массы. Перспективными конструкционными материалами являются материалы на основе графита, например, углепластики. В целях предупреждения коррозии металлов значительное распространение получили различные защитные покрытия, которые могут наноситься на защищаемую поверхность физическим, химическим или электрохимическим путем. Защитное покрытие, изолирующее поверхность металла от агрессивной среды, должно быть сплошным, малопроницаемым, иметь высокую прочность сцепления с металлом (адгезию) и близкое к металлу значение коэффициента теплового расширения. Покрытия используют также для предупреждения износа деталей, восстановления их размеров и для защитно-декоративной отделки. Все защитные покрытия подразделяются на:
Металлические покрытия используются для защиты легкокорродирующего металла тонким сплошным слоем другого металла или сплава, более стойкого в данных условиях эксплуатации, а также в целях повышения твердости, электропроводности, придания им красивого внешнего вида. С этой целью используют хром, никель, цинк, олово, алюминий, кадмий. Это пассивные металлы благодаря наличию оксидной пленкина их поверхности. В качестве металлических защитных покрытий используются также малоактивные медь, серебро, золото. Обычно металлические покрытия наносятся электрохимическим осаждением (гальванический метод), термомеханическим методом (плакирование), распылением (металлизация), диффузионным методом и погружением в расплавленный металл (горячий метод). Хорошими защитными свойствами обладают металлические покрытия, наносимые при химическом восстановлении соединений соответствующих металлов. Так, например, метод химического никелирования, являясь простым и высокопроизводительным, позволяет получать равномерные по толщине защитные слои на деталях самой сложной конфигурации, что выгодно отличает его от гальванического метода. О масштабах применения металлических покрытий говорит тот факт, что около 50% производимого в мире кадмия, 25% олова и 15% никеля расходуются именно на эти цели. По характеру защитного действия металлические покрытия подразделяются на катодные и анодные. Катодные металлические покрытия - это покрытия, при которых покрывающий металл имеет более положительный электродный потенциал, чем металл защищаемого изделия, например, сталь,покрытая оловом или медью. Анодные металлические покрытия - это покрытия менее активного металла более активным, то есть имеющим меньшую величину электродного потенциала в данной среде. Пока защитный слой покрывающего металла не нарушен, принципиального различия между этими двумя видами покрытия нет. При нарушении целостности катодного покрытия оно перестает защищать изделие от коррозии, более того, присутствие такого металла на поверхности изделия усиливает его коррозию. На рис. 11.5.а показан процесс коррозии лужёного (покрытого оловом) железа в кислой среде.  Рис. 4. Металлические защитные покрытия на железе: а) катодное покрытие; б) анодное покрытие При нарушении целостности такого покрытия усиленно протекает растворение железа (анодный процесс), а выделение водорода (катодный процесс) происходит на олове. Анодное покрытие, например цинк на железе рис.11.5.б при нарушении его целостности будет само подвергаться коррозии и, разрушаясь, будет защищать основной металл. В этом случае на железе протекает катодный процесс восстановления водорода, котрый не приводит к разрушению железа. Следовательно, требование сплошности анодного покрытия не является обязательным, тогда как катодное покрытие должно быть сплошным и непроницаемом для агрессивной среды. Среди неметаллических защитных покрытий следует отметить: лаки, краски, эмали, пластичные смазки, полимерные материалы, резины и каучуки, битумы, утлеграфитовые материалы, цементы. Следует заметить, что нанесение лакокрасочных покрытий является одним из самых распространенных и дешевых методов защиты металлов от коррозии. В настоящее время более 60% металлофонда страны защищается этим методом. Химические защитные покрытия создаются путем химической обработки поверхности металла. Наиболее часто используется оксидирование - создание на поверхности металла слоя оксида, что достигается химическим или электрохимическим путем. Примером химического оксидирования служит “воронение” стальных изделий. Оно осуществляется путем кипячения в течение 20-60 минут очищенных и обезжиренных изделий в растворе NaOH, NaNO3, NaNO2. В результате изделие приобретает черный цвет (Fe3O4) и повышенную коррозионную стойкость. Примером электрохимического оксидирования является - анодирование алюминия. Изделие погружается в раствор серной кислоты и подключают к положительному полюсу источника тока. При оксидировании образуется пленка оксида (AI2O3), которая может быть далее усилена наполнением маслами, парафином, растворами хроматов и бихроматов. При фосфатировании - обработке поверхности стали растворами ортофосфорной кислоты и гидрофосфатов марганца или цинка (например, ZnHPO4+H3PO4), образуются прочно сцепленные с поверхностью слои нерастворимых гидрофосфатов и фосфатов железа, выполняющие защитные функции и являющиеся хорошей основой для последующего нанесения лакокрасочных материалов. Обработка среды с целью снижения ее коррозионной агрессивности направлена на снижение концентрации веществ, вызывающих или ускоряющих коррозионный процесс, а также связана с применением специальных веществ - ингибиторов коррозии, добавление которых в ничтожно малых количествах (десятые доли процента) приводит к существенному уменьшению скорости коррозии. При электрохимической коррозии обработка коррозионной среды сводится и удалению деполяризаторов O2 и Н+. Удаление кислорода из водной среды может быть обеспечено пропусканием ее через фильтры, наполненные металлической стружкой, связывающей растворенный кислород, а также обработкой некоторыми реагентами: а) сульфитами б) гидразином Снижение концентрации ионов водорода достигается нейтрализацией среды щелочами, содой, известью. Раствор соды (карбоната натрия) используется для регулирования рН среды, так как в водных растворах протекает гидролиз этого вещества и среда приобретает явно выраженный щелочной характер: Na2CO3 + H2O NaHCO3 + H2O pH > 7 Для удаления солей могут быть использованы методы дистилляции, ионного обмена и обратного осмоса. Существенное влияние на скорость коррозии оказывает удаление кислых газов (CO2, H2S), которое может быть достигнуто путем нейтрализации щелочными компонентами, связывания в нерастворимые соединения или другими методами. Особенно эффективным следует считать использование ингибиторов коррозии. В последние годы ингибиторы коррозии не только стали самостоятельным способом защиты металлов от коррозии, но и существенно изменили составы таких средств защиты, как краски, масла, смазки, полимерные покрытия, охлаждающие жидкости в т.д. Имеется ряд технологических сред, которые вообще невозможно использовать без ингибиторов коррозии, например жидкости, используемые для охлаждения теплообменной аппаратуры, аэрированные буровые растворы и др. Добыча нефти и газа, их переработка, длительное хранение техники, применение сильных окислителей в ракетной технике и т.д. невозможны без применения ингибиторов коррозии. В настоящее время известны сотни различных ингибиторов в ингибирующих композиций, действие которых сильно зависит от состава среды и условий эксплуатации. В качестве ингибиторов применяются как неорганические соединения, например, фосфаты, силикаты, хроматы, нитриты, так и различные органические соединения. По химической природе органические ингибиторы коррозии подразделяются на:
По механизму действия различают:
К анодным ингибиторам относятся вещества, обладающие окислительными свойствами (хроматы, дихроматы, нитриты и др.). Они образуют на анодной поверхности металла тонкие оксидные слои, тормозящие анодные процессы перехода металла в раствор и сокращающие площадь анодной поверхности. К катодным ингибиторам коррозии относятся вещества, способные тормозить отдельные стадии катодного процесса. Например, в процессах, идущих с кислородной деполяризацией, ингибирующее действие будут оказывать соединения цинка (ZnCl2, ZnSO4) и соединения кальция Са(HСO3)2. При реакции с ионами гидроксила, образующимися в прикатодном пространстве: они образуют нерастворимые соединения, осаждающиеся на стенках защищаемой конструкции и блокирующие катодные участки: Ca2+ + 2HCO3- + 2 OH- = CaCO3 + 2H2O Имеются катодные ингибиторы, действие которых заключается в повышении перенапряжения водорода на катоде (AS2O3 , Bi2(SO4) и др.) Ингибиторы коррозии экранирующего действия, адсорбируясь на металле, образуют адсорбционннй слой, защитную пленку из нерастворимых продуктов и тормозят скорости анодного и катодного процессов примерно в одинаковой степени. Заметное экранирующее действие оказывают многие эффективные органические ингибиторы коррозии, обладающие свойствами поверхностно-активных веществ (ПАВ). Их молекулы состоят из гидрофильной полярной части, обеспечивающей растворимость в воде, и гидрофобной неполярной части, представленной обычно длинным углеводородным радикалом, обеспечивающим растворимость в углеводородной среде. При адсорбции ПАВ на поверхности металла происходит ориентация молекулы полярной частью к поверхности металла, а неполярной частью в окружающую среду рис. 11.6. 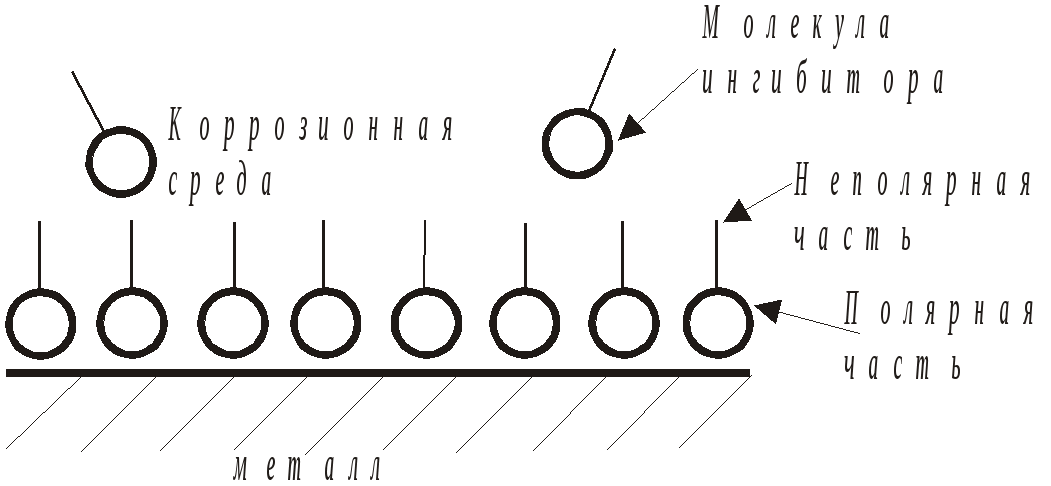 Рис. 5. Структура защитного слоя органического ингибитора (ПАВ) на поверхности металла Такие ингибиторы коррозии значительно снижают поверхностное натяжение и обладают водовытесняющей способностью. Они изменяют характер смачивания поверхности металла и делают его гидрофобным. Кроме того, многие органические ингибиторы коррозии обладают бактерицидным действием и тормозят биокоррозию. Одним из наиболее эффективных способов защиты металлов от коррозии является электрохимическая защита. Используя ее, можно предупредить разрушение трубопроводов, корпусов судов буровых платформ, резервуаров, реакционных аппаратов и др. Сущность электрохимической защиты заключается в наложении внешнего тока, поляризующего катодные участки локальных элементов на поверхности металла до потенциала неполяризованных анодных участков. Поверхность защищаемого изделия становится эквипотенциальной (потенциалы катодных и анодных участков равны) и катодной по отношению к специально присоединенному для обеспечения поляризации аноду. При этом разрушаться будет присоединенный анод, а на защищаемом изделии будут протекать не вызывающие убыли массы и разрушения металла катодные процессы. Электрохимическая защита подразделяется на гальваническую (протекторную) и анодную. При гальваническую защите, (рис. 11.7.) к защищаемому объекту присоединяют специальный анод - протектор “жертвенный анод” с более отрицательной величиной электродного потенциала. 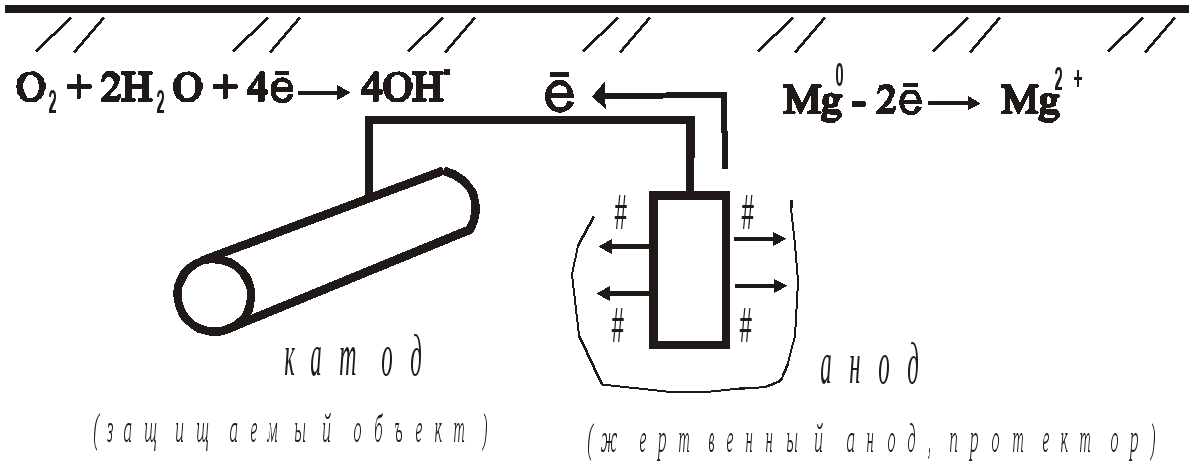 Рис. 6. Гальваническая защита с использованием магниевого анода. Для изготовления протекторов используются активные металлы - магний, алюминий, цинк и их сплавы, имеющие малое значение электродного потенциала и малую анодную поляризуемость. В искусственно созданном макрогальваническом элементе анодом является протектор (магний), который разрушается: а катодом - защищаемый объект: Катодная защита осуществляется путем поляризации защищаемого объекта постоянным током от внешнего источника. Установка катодной защиты (рис.11.8.) состоит из станции катодной защиты, являющейся источником постоянного тока, анодного заземления и соединительных проводов. К защищаемому сооружению подключают отрицательный полюс источника тока, а к анодному заземлению - положительный.   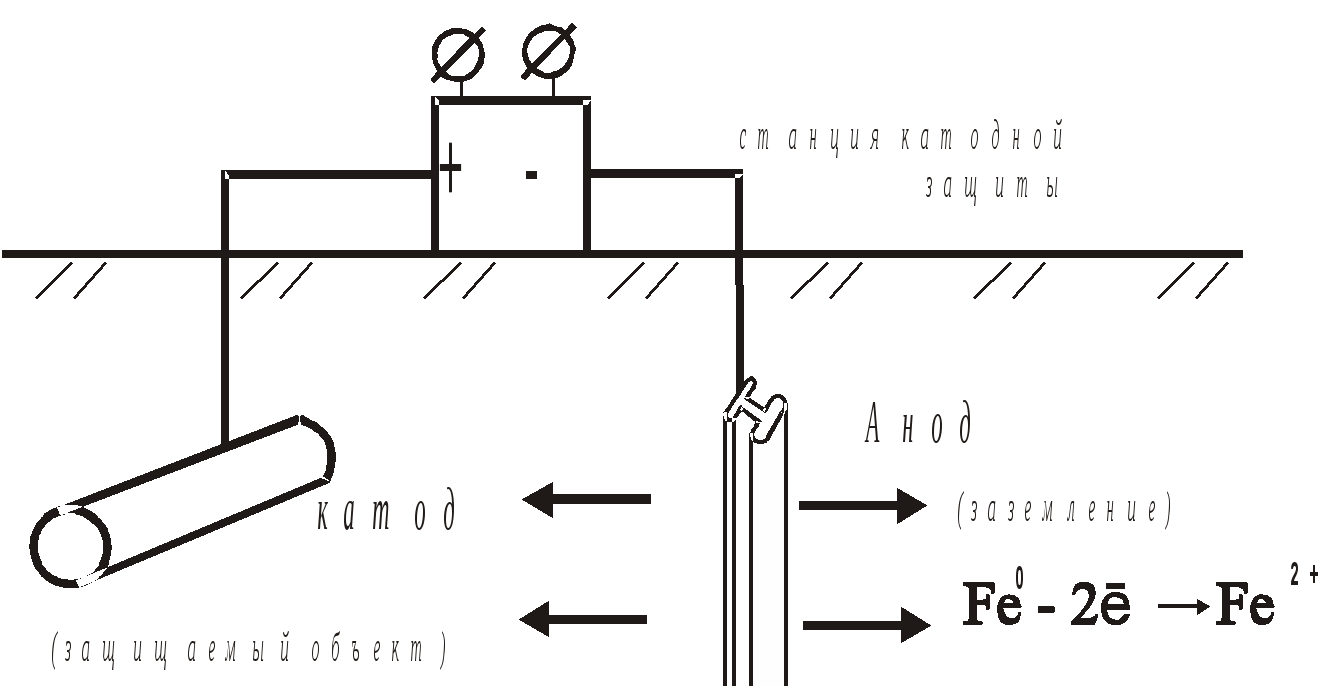  Р    ис. 7. Катодная защита металлов от коррозии. ис. 7. Катодная защита металлов от коррозии.В качестве анодных заземлителей используют лом черных металлов (разрушающиеся заземлители) или специальные аноды из нержавеющей стали, графита, сплавов железа с кремнием и некоторых других материалов (неразрушающиеся заземлители). В случае использования неразрушающихся заземлителей протекание анодного процесса будет приводить к выделению кислорода: Кроме того, при осуществлении электрохимической защиты за счет протекания на защищаемом объекте катодной реакции восстановления: происходит подщелчивание прикатодного пространства, что приводит к образованию на поверхности металла катодных осадков, обладающих защитными свойствами. Состоящие в основном из гидроксида магния и карбонатов кальция или магния они создают защитный барьер, затрудняющий доступ деполяризатора и уменьшающий плотность требуемого защитного тока. В качестве основного критерия электрохимической защиты используется так называемый защитный потенциал, то есть потенциал, который необходимо достигнуть при катодной поляризации. Представляя собой величину потенциала анодных участков неполяризированного микрогальванического элемента и найденный для стали эмпирическим путем, он составляет – 0,85 В по отношению к насыщенному медно-сульфатному электроду (-0,53 В по стандартному водородному электроду). В тех местах, где возможна биологическая коррозия в результате воздействия сульфатовосстанавливающих бактерий, минимальное значение защитного потенциала должно составлять – 0,95 В. 11.1. Вопросы для самоконтроля 1. Что такое металлическая связь? 2. Какими особенностями физических свойств обладают металлы? 3. Дайте определение понятию «электродный потенциал металла»? 4. Как устроен водородный электрод? 5. Какие условия называют стандартными? 6. Что такое стандартный водородный электрод? 7. Дайте определение понятию « стандартный электродный потенциал металла»? 8. Какие электроды сравнения находят наибольшее применение? 9. Что такое « обратимый электрод»? 10. Чем отличается необратимый электрод от обратимого? 11. Какие виды электродов сравнения известны? 12. К какому виду электродов сравнения относится хлорсеребряный электрод? 13. К какому виду электродов сравнения относится медносульфатный электрод? 14. К какому виду электродов сравнения относится водородный электрод? 15. Как рассчитывается потенциал обратимого электрода, находящегося при условиях, отличающихся от стандартных? 16. От каких факторов зависит потенциал электрода? 17. Что такое гальванический элемент? 18. Какой электрод является в гальваническом элементе анодом? 19. Какой электрод является в гальваническом элементе катодом? 20. Как рассчитывается ЭДС гальванического элемента? 21. Какие процессы протекают на электродах при работе гальванического элемента? 22. Что такое поляризация электродов при работе гальванического элемента? 23. Как меняется потенциал анода при поляризации? 24. Какие виды гальванических элементов известны? 25. Что такое концентрационный гальванический элемент? 26. Что такое коррозия металлов? 27. По каким признакам можно классифицировать все коррозионные процессы? 28. Как различаются коррозионные процессы по механизму? 29. Какие факторы могут вызвать электрохимическую гетерогенность? 30. Какой анодный процесс имеет место при коррозии металлов? 31. Какие процессы могут протекать на катодных участках корродирующей конструкции в зависимости от реакции среды? 32. Что такое поляризация электродов? 33. Какие виды поляризации известны? 34. Что такое процесс деполяризации? 35. Почему в аэрированной воде происходит усиление коррозии железа? 36. Почему ускоряют коррозию: а) сероводород, б) морская вода? 37. Какие методы защиты металлов от коррозии известны? 38. В чем заключается сущность гальванической (протекторной) защиты металлов от коррозии? 39. В чем сущность катодной защиты металлов? 11.2. Вопросы и упражнения для самостоятельного решения. 1. Пластинку из кадмия погрузили в водный раствор соли. Укажите номер или сумму условных номеров, под которыми расположены формулы солей, после нахождения в растворах которых масса кадмиевой пластинки увеличится: 1) MgCl2, 2) Hg(NO3)2, 4) CuSO4, 8) AgNO3, 16) CaCl2. 2. Укажите номер или сумму условных номеров, под которыми расположены химические знаки металлов, реагирующих при нормальных условиях с водой: 1) Cr, 2) Rb, 4) Ca, 8) Ni, 16) Fe. 3. Чему равен потенциал цинкового электрода при разбавлении 1 молярного раствора соли цинка в 1000 раз? 4. Чему равен потенциал водородного электрода при рН = I? 5. Чему равен потенциал водородного электрода при рН = 7? 6. Чему равен потенциал стандартного серебряного электрода по отношению к насыщенному каломельному электроду? 7. Чему равен потенциал стандартного серебряного электрода по отношению к насыщенному медно-сульфатному электроду? 8. Чему равен потенциал стандартного серебряного электрода по отношению к хлорсеребряному электроду? 9. Составьте схемы гальванических элементов, в которых протекают реакции: а) 2Ag+ + Cu 0 → Ag 0 + Cu+2, б) Cd 0 + CuSO4 → CdSO4 + Cu. 10. Определите ЭДС для следующих гальванических элементов: а) Zn /ZnS04 // CdS04 / Сd, б) Рb/ Рb(NOз)2) // AgN03/ Ag. 11. Рассчитайте ЭДС следующего гальванического элемента: Zn/ZnCI2 // AgNО3/ Ag. Какой из электродов является анодом, а какой – катодом? 12. Чему равна величина ЭДС (в миливольтах) гальванического элемента, составленного из стандартного цинкового и стандартного медного электродов? 13. Чему равна величина ЭДС (в миливольтах) гальванического элемента, составленного из стандартного медного и стандартного серебряного электродов? 14. Чему равно значение молярной массы металла, который в гальваническом элементе, составленном из стандартного медного и стандартного ртутного электродов, является анодом? 15. Чему равно значение молярной массы металла, на котором в гальваническом элементе, составленном из стандартного серебряного и стандартного ртутного электродов, протекает процесс восстановления? 16. Чему равна сумма коэффициентов в уравнении реакции, протекающей при алюминотермическом восстановлении ванадия из его высшего оксида? 17. Под каким номером приведены формулы веществ, входящих в состав термитной смеси, используемой при сварке металлов: 1) Fe2O3 и Al2O3, 2) Fe2O3 и Al, 3) Fe и Al2O3, 4) Fe и Al. 18. Укажите номер или сумму условных номеров, под которыми расположены группы формул веществ, каждое из которых реагирует с раствором нитрата серебра: 1) Au, Fe, K2SiO3, 2) HNO3, Zn, BaSO4, 4) HBr, KOH, K2CO3, 8) NaOH, Cu, Zn. |
