Экзамен перечень 77. Основные исторические этапы развития микробиологии, вклад отечественных и зарубежных ученых. Разделы микробиологии
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
|
Механизмы резистентности бактерий к антимикробным препаратам. Резистентность микроорганизмов к антибиотикам может быть природной и приобретённой. Истинная природная устойчивость характеризуется отсутствием у микроорганизмов мишени действия антибиотика или недоступности мишени вследствие первично низкой проницаемости или ферментативной инактивации. При наличии у бактерий природной устойчивости антибиотики клинически неэффективны. Природная резистентность является постоянным видовым признаком микроорганизмов и легко прогнозируется. Под приобретённой устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Возможны ситуации, когда большая часть микробной популяции проявляет приобретённую устойчивость. Появление у бактерий приобретённой резистентности не обязательно сопровождается снижением клинической эффективности антибиотика. Формирование резистентности во всех случаях обусловлено генетически: приобретением новой генетической информации или изменением уровня экспрессии собственных генов. Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам: Модификация мишени действия. Инактивация антибиотика. Активное выведение антибиотика из микробной клетки (эффлюкс). Нарушение проницаемости внешних структур микробной клетки. Формирование метаболического «шунта». Влияние химических факторов среды на микробы и их источники. Дезинфекция, метод, назначение. Контроль эффективности. Химические вещества могут оказывать различное действие на микроорганизмы: служить источниками питания; не оказывать какого-либо влияния; стимулировать или подавлять рост. Химические вещества, уничтожающие микроорганизмы в окружающей среде, называются дезинфицирующими. Антимикробные химические вещества могут обладать бактерицидным, вирулицидным, фунгицидным действием и т.д. Химические вещества, используемые для дезинфекции, относятся к различным группам, среди которых наиболее широко представлены вещества, относящиеся к хлор-, йод- и бромсодержащим соединениям и окислителям. Антимикробным действием обладают также кислоты и их соли (оксолиновая, салициловая, борная); щелочи (аммиак и его соли). Дезинфекция — процедура, предусматривающая обработку загрязненного микробами предмета с целью их уничтожения до такой степени, чтобы они не смогли вызвать инфекцию при использовании данного предмета. Как правило, при дезинфекции погибает большая часть микробов (в том числе все патогенные), однако споры и некоторые резистентные вирусы могут остаться в жизнеспособном состоянии. Дезинсекция — один из видов обеззараживания, представляющий собой уничтожение заражённых насекомых с помощью специальных химических средств, путем воздействия горячей воды с паром или с помощью биологических средств (микробов). Под дезинсекцией также понимается процедура уничтожения любых насекомых, чьё соседство с человеком считается нежелательным: клопов, тараканов, муравьев, комаров, тлей, идр. Дератизация — это комплекс мер по борьбе с грызунами (мышами, крысами). Грызуны портят сырье, готовую продукцию, а также являются источниками и переносчиками инфекционных заболеваний человека (туляремии, лептоспироза, паратифа, инфекционного гепатита и др.). Контроль качества дезинфекции, предстерилизационной очистки, стерилизации изделий медицинского назначения осуществляется специалистами Роспотребнадзора. Самоконтроль качества дезинфекции, предстерилизационной очистки и стерилизации проводит персонал лечебно-профилактических учреждений в рамках производственного контроля. Контроль качества дезинфекции осуществляется методом смывов, которые берут с поверхности изделий медицинского назначения до проведения дезинфекции и после неё. У изделий, имеющих функциональные каналы, рабочий конец изделия опускают в пробирку со стерильной водопроводной водой или нейтрализатором и с помощью стерильного шприца или пипетки промывают канал этим раствором. Контролю подлежит 1% от одновременно обработанных изделий, но не менее 3-5 единиц. О качественно проведенной дезинфекции говорит отсутствие роста санитарно-показательной микрофлоры (БГКП, синегнойной палочки, золотистого стафилококка). Контроль качества предстерилизационной очистки проводят путем простановки проб на наличие остаточных количеств крови (амидопириновая и азопирамовая проба), остаточных количеств щелочных компонентов моющих средств(фенолфталеиновая проба). Контролю подлежат 1% от партии, но не менее 3 единиц инструментов. В случае появления положительных проб всю партию подвергают повторной очистке до появления отрицательных результатов проб. Результаты контроля отражают в журнале учета качества предстерилизационной очистки. Эффективность стерилизации оценивают на основании результатов бактериологических исследований, проводимых с применением биологических индикаторов а также при контроле стерильности мединструментов. Контроль стерильности изделий медицинского назначения проводят методом посевов в бактериологических лабораториях. Контролю подлежит не менее 1% от одновременно простерилизованных изделий, но не менее двух изделий одного наименования. Работу стерилизаторов контролируют физическим, химическим, бактериологическим методами. Физический метод: контролируется температурный режим (при помощи максимального термометра) и давление в камере парового стерилизатора (при помощи мановакуумметра). Максимальные термометры закладываются в контрольные точки стерилизационной камеры, количество которых зависит от объема камеры. Бактериологический метод: контролируется эффективность воздействия на споры тест культуры в биотесте. В качестве биологических индикаторов для паровых стерилизаторов используется биотест со спорами тест-культуры Bacillus stearotermophilus (для паровых стерилизаторов), Bacillus licheniphormis (для воздушных стерилизаторов) Химический метод: контролируется температура в стерилизационной камере при помощи химических индикаторов. 3. В клинику поступил больной с предварительным диагнозом сибирской язвы, кожная форма (?). В отделяемом карбункула микроскопическим методом обнаружены грамположительные палочки, расположенные единично, попарно или короткими цепочками, напоминающими бамбуковую трость. На чашке с МПА при посеве отделяемого карбункула выросли колонии, край которых напоминает львиную голову. Для подтверждения диагноза была поставлена биологическая проба. Ее результаты: в мазке отпе-чатке органа белой мыши на красном фоне видны крупные, расположенные цепочкой палочки, окруженные бесцветной капсулой, общей для всей цепочки (окраска фуксином). Подтверждается ли диагноз сибирской язвы? Если да, то каким методом и почему? От какого микроба-двойника следует отличать возбудителя сибирской язвы? Да, подтверждается, т. к. в отделяемом карбункула бактериоскопическим методом обнаружены грамположительные палочки, расположенные единично, попарно или короткими цепочками, напоминающими бамбуковую трость. На чашке с МПА при посеве отделяемого карбункула (бактериологический метод) выросли колонии, край которых напоминает «львиную голову». результаты биопробы: в мазке-отпечатке органа белой мыши на красном фоне видны крупные, расположенные цепочкой палочки, окруженные бесцветной капсулой, общей для всей цепочки (окраска фуксином). Все эти признаки являются характерными для сибиреязвенной бациллы. Выявление сибиреязвенной палочки возможно только после выделения чистой культуры возбудиткля и биопробы. Экспресс-методы дифференциации Вас. anthracis и почвенных спорообразующих бактерий. Для дифференциации необходимо сделать посевы на МПБ с кровью, МПЖ и исследовать культуру микроорганизма на подвижность.Для дифференциальной диагностики возбудителя сибирской язвы и сходных с ним почвенных аэробных бацилл рекомендуется использовать следующие тесты: феномен «жемчужное ожерелье» (с/я п-ка образует его), чувствительность к сибиреязвенному бактериофагу (чувсвительна), свертываемость желтка куриного яйца, гемолитическую активность (слабая у с/я п-ки), феномен капсулообразования (Образует, в отличие от других бацилл капсулу). Генетика бактерий. Строение генома бактерий. Понятие о генотипе и фенотипе. Виды изменчивости. Бактериальный геном состоит из генетических элементов, способных к самостоятельной репликации, т. е. репликонов. Репликонами являются бактериальная хромосома и плазмиды. Наследственная инф-ция хранится у бактерий в форме послед-ти нуклеотидов ДНК, которые опр-т послед-ть АК в белке. Каждому белку соответствует свой ген, т. е. дискретный участок на ДНК, отличающийся числом и специфичностью послед-ти нуклеотидов. Бактериальная хромосома представлена одной двухцепочечной мол. ДНК кольцевой формы. БХ формирует компактный нуклеоид бактериальной кл, им. гаплоидный набор генов. Она кодирует жизненно важные для бактер. кл. функции. Плазмиды бактерий - двухцепочечные молекулы ДНК. Они кодируют не основные для жизнед-ти бактер.кл. функции, но придающие бактерии преимущества при попадании в неблагоприятные условия существования. В состав БГ, как в бакт.хромосому, в плазмиды, входят подвижные генетические элементы: вставочные послед-ти и транспозоны. Вставочные (инсерционные) посл-ти IS-элементы - это участки ДНК, способные как целое перемещаться из одного участка репликона в др, а также между репликонами. Они содержат лишь те гены, которые необходимы для их собственного перемещения - транспозиции: ген, кодирующий фермент транспозазу, обеспечивающую процесс исключения IS-элемента из ДНК и его интеграцию в новый локус, и ген, детерминирующий синтез репрессора, который регулирует весь процесс перемещения. Отличительной особенностью IS-элементов является наличие на концах вставочной посл-ти инвертированных повторов. Эти инвертированные повторы узнает фермент транспозазу. Перемещение ПГЭ принято называть репликативной или незаконной рекомбинацией. Однако в отличие от бакт.хр-мы и плазмид подвижные генетич. элементы не являются самост-ми репликонами, т.к. их репликация -составной элемент репликации ДНК репликона, в составе которого они находятся. Перемещаясь по репликону или между репликонами, подвижные генетические элементы вызывают: 1. Инактивацию генов тех участков ДНК, куда они, переместившись, встраиваются. 2. Образование повреждений генетического материала. 3. Слияние репликонов, т. е. встраивание плазмиды в хромосому. 4. Распространение генов в популяции бактерий, что может приводить к изменению биологических свойств популяции, смене возбудителей инфекционных заболеваний, а также способствует эволюционным процессам среди микробов. Св-ва м/о опр-ся их генотипом, т.е. сов-тью генов данной особи. Фенотип - результат взаимодействия между генотипом и окр.средой, т. е. проявление генотипа в конкретных условиях обитания. Фенотип м/о хотя и зависит от окр.среды, но контролируется генотипом.. В основе изменчивости лежит либо изменение реакции генотипа на факторы окр.среды, либо изменение самого генотипа в рез. мутации генов или их рекомбинации. В связи с этим фенотипическую изменчивость подразделяют на наследственную и ненаследственную. Ненаследственная (средовая, модификационная) изменчивость обусловлена влиянием внутри- и внеклеточных факторов на проявление генотипа. При устранении фактора, вызвавшего модификацию, данные изменения исчезают. Наследственная (генотипическая) изменчивость - мутационная изменчивость. Основу мутации составляют изменения последовательности нуклеотидов в ДНК, полная или частичная их утрата. Насл.изм-ть, связанная с рекомбинациями, называется рекомбинационной изменчивостью. Понятие о плазмидах, их виды, функции, свойства, определение, значение. Механизмы передачи генетического материала у бактерий. Плазмиды — внехромосомные мобильные генетические структуры бактерий, представляющие собой замкнутые кольца двунитчатой ДНК. По размерам составляют 0,1—5 % ДНК хромосомы. Плазмиды способны автономно копироваться (реплицироваться) и существовать в цитоплазме клетки, поэтому в клетке может быть несколько копий плазмид. Плазмиды могут включаться (интегрировать) в хромосому и реплицироваться вместе с ней. Различают трансмиссивные и нетрансмиссивные плазмиды. Трансмиссивные (конъюгативные) плазмиды могут передаваться из одной бактерии в другую. Среди фенотипических признаков, сообщаемых бактериальной клетке плазмидами, можно выделить следующие: 1) устойчивость к антибиотикам; 2) образование колицинов; 3) продукция факторов патогенности; 4) расщепление сложных органических веществ; Термин «плазмиды» впервые введен для обозначения полового фактора бактерий. Плазмиды несут гены, не обязательные для клетки-хозяина, придают бактериям дополнительные свойства, которые в определенных условиях окружающей среды обеспечивают их временные преимущества по сравнению с бесплазмидными бактериями. Некоторые плазмиды находятся под строгим контролем. Это означает, что их репликация сопряжена с репликацией хромосомы так, что в каждой бактериальной клетке присутствует одна или, по крайней мере, несколько копий плазмид. Число копий плазмид, находящихся под слабым контролем, может достигать от 10 до 200 на бактериальную клетку. Для характеристики плазмидных репликонов их принято разбивать на группы совместимости. Несовместимость плазмид связана с неспособностью двух плазмид стабильно сохраняться в одной и той же бактериальной клетке. Некоторые плазмиды могут обратимо встраиваться в бактериальную хромосому и функционировать в виде единого репликона. Такие плазмиды называются интегративными или эписомами. У бактерий различных видов обнаружены R-плазмиды, несущие гены, ответственные за множественную устойчивость к лекарственным препаратам — антибиотикам, сульфаниламидам и др., F-плазмиды, или половой фактор бактерий, определяющий их способность к конъюгации и образованию половых пилей, Ent-плазмиды, детерминирующие продукцию энтеротоксина. Плазмиды подвержены рекомбинациям, мутациям, могут быть элиминированы (удалены) из бактерий, что, однако, не влияет на их основные свойства. Плазмиды являются удобной моделью для экспериментов по искусственной реконструкции генетического материала, широко используются в генетической инженерии для получения рекомбинантных штаммов Передача генетического материала (хромосомных генов) от одних бактерий к другим происходит путем: трансформации, трансдукции и конъюгации, Рекомбинации – это обмен генетическим материалом между двумя особями с появлением рекомбинантных особей с измененным генотипом. Конъюгация – обмен генетической информацией при непосредственном контакте донора и реципиента. Позднее было показано, что донорами генетического материала являлись клетки, несущие F-плазмиду (половой фактор). Бактериальные клетки, не имеющие F-плазмиды, не способны быть генетическими донорами.. Этапы конъюгации: Первым этапом конъюгации является прикрепление клетки-донора к реципиентной клетке с помощью половых ворсинок (sex pili). Затем между обеими клетками образуется конъюгационный мостик, через который из клетки-донора в клетку-реципиент могут передаваться F-фактор и другие плазмиды, находящиеся в цитоплазме бактерии-донора в автономном состоянии. Для переноса бактериальной хромосомы необходим разрыв одной из цепей ДНК, который происходит в месте включения F-плазмиды при участии эндонуклеазы. Проксимальный конец ДНК через конъюгационный мостик проникает в клетку-реципиент и сразу же достраивается до двунитевой структуры. Оставшаяся в клетке донора нить ДНК является матрицей для синтеза второй нити. Следовательно, при конъюгации передается только одна нить ДНК-донора, а вторая, оставшаяся комплементарная, цепь достраивается в реципиентной клетке. Слияние протопластов – механизм обмена генетической информацией при непосредственном контакте участков цитоплазматической мембраны у бактерий, лишенных клеточной стенки. Трансдукция — передача ДНК от бактерии-донора к бактерии-реципиенту при участии бактериофага. Различают неспецифическую (общую) трансдукцию, при которой возможен перенос любого фрагмента ДНК донора, и специфическую — перенос определенного фрагмента ДНК донора только в определенные участки ДНК реципиента. Неспецифическая трансдукция обусловлена включением ДНК донора в головку фага дополнительно к геному фага или вместо генома фага (дефектные фаги). Специфическая трансдукция обусловлена замещением некоторых генов фага генами хромосомы клетки-донора. Фаговая ДНК, несущая фрагменты хромосомы клетки-донора, включается в строго определенные участки хромосомы клетки-реципиента. Таким образом, привносятся новые гены и ДНК фага в виде профага репродуцируется вместе с хромосомой, т.е. этот процесс сопровождается лизогенией. Если фрагмент ДНК, переносимый фагом, не вступает в рекомбинацию с хромосомой реципиента и не реплицируется, но с него считывается информация о синтезе соответствующего продукта, такая трансдукция называется абортивной. Трансформация - непосредственная передача генетического материала (фрагмента ДНК) донора реципиентной клетке. В 1944 г. О. Эвери, К. Мак-Леод и К. Мак-Карти установили, что активным началом, содержащимся в экстракте убитых пневмококков, является ДНК, которая определяет его генетические свойства и является носителем генетической информации. Феномен трансформации воспроизводится в опытах с разными патогенными и непатогенными бактериями: стрептококками, менингококками и др. С донорной ДНК в реципиентную клетку обычно передается только один ген. Это связано с протяженностью трансформирующего фрагмента ДНК, который может проникнуть в реципиентную клетку. Обычно он не превышает 1/100 длины бактериальной хромосомы, т.е. включает один или несколько сцепленных генов. Эффективно трансформация происходит в опытах с бактериями одного и того же вида, имеющих разный генотип. Процесс трансформации бактерий можно подразделить на несколько фаз: адсорбция ДНК-донора на клетке-реципиенте; проникновение ДНК внутрь клетки-реципиента; соединение ДНК с гомологичным участком хромосомы реципиента с последующей рекомбинацией. После проникновения внутрь клетки трансформирующая ДНК деспирализуется. Затем происходит физическое включение любой из двух нитей ДНК донора в геном реципиента. Эффективность спаривания трансформирующей ДНК с соответствующим участком хромосомы реципиента зависит от степени гомологичности ДНК донора и реципиента. Чем выше гомологичность, тем эффективнее спаривание, что определяет конечный результат трансформации, т.е. количество формирующихся рекомбинантов (трансформантов). Отсюда ясно, почему межвидовая трансформация происходит гораздо реже, чем внутривидовая Внехромосомные факторы наследственности. Плазмиды – дополнительный внехромосомный генетический материал. Представляет собой кольцевую, двунитевую молекулу ДНК, гены которой кодируют дополнительные свойства, придавая селективные преимущества клеткам. Плазмиды способны к автономной репликации, т. е. независимо от хромосомы или под слабым ее контролем. За счет автономной репликации плазмиды могут давать явление амплификации: одна и та же плазмида может находиться в нескольких копиях, тем самым усиливая проявление данного признака. Многие плазмиды имеют в своем составе гены трансмиссивности и способны передаваться от одной клетки к другой при конъюгации (обмене генетической информацией). Такие плазмиды называются трансмиссивными или конъюгативными. В зависимости от свойств признаков, которые кодируют плазмиды, различают: 1) R-плазмиды. Известно большое количество R-плазмид, определяющих устойчивость бактерий-хозяев к разнообразным лекарственным препаратам. Передача R-плазмид от одних бактерий к другим привела к их широкому распространению среди патогенных и условно-патогенных бактерий, что чрезвычайно осложнило химиотерапию вызываемых ими заболеваний. 2) F-плазмиды. Представляет собой циркулярно замкнутую нить ДНК. Она контролирует синтез половых ворсинок (sex или F-pili), которые способствуют эффективному спариванию бактерий-доноров с реципиентными клетками при конъюгации. 3) Col-плазмиды. Кодируют синтез бактериоцинов. Это бактерицидные вещества, действующие на близкородственные бактерии; Бактериоцины обнаружены у кишечных бактерий (колицины), бактерий чумы (пестицины), холерных вибрионов (вибриоцины), стафилококков (стафилоцины). 4) Плазмиды патогенности: Tox-плазмиды. Кодируют выработку экзотоксинов; Hly-плазмиды. Кодирует синтез гемолизинов Плазмиды биодеградации. Кодируют ферменты деградации (утилизации) природных (мочевина, углеводы) и неприродных (толуол, камфора, нафталин) соединений, необходимых для использования в качестве источников углерода или энергии, что обеспечивает им селективные преимущества перед другими бактериями данного вида. Патогенным бактериям подобные плазмиды придают преимущества перед представителями аутомикрофлоры. Криптические (скрытые) плазмиды не содержат генов, которые можно было бы обнаружить по их фенотипическому проявлению. Потеря клеткой плазмиды не приводит к ее гибели. В одной и той же клетке могут находиться разные плазмиды Фенотипическая изменчивость, сущность, формы, практическое значение. Роль экологии. Генотипы и фенотипы микроорганизмов. Модификационная (фенотипическая) изменчивость — изменения в организме, связанные с изменением фенотипа вследствие влияния окружающей среды и носящие, в большинстве случаев, адаптивный характер. Генотип при этом не изменяется. В целом современное понятие «адаптивные модификации» соответствует понятию «определенной изменчивости», которое ввел в науку Чарльз Дарвин. Термин «модификации» используют для обозначения фенотипических изменений микроорганизма, которые не предполагают изменений в генетическом аппарате клетки. Модификации возникают под воздействием различных факторов внешней среды и обычно наблюдаются при росте и размножении микроба на питательных средах. Эти изменения не наследуются и утрачиваются с прекращением действия вызвавшего их фактора. Модификации могут касаться многих свойств микроорганизма. Морфологические модификации. В зависимости от состава и качества питательной среды, температуры и времени выращивания у бактерий могут изменяться форма, размеры клеток, способность образовывать капсулы и споры. Молодые клетки, только что помещенные в питательную среду, меньше, чем более старые. При старении культуры бактерий возникает полиморфизм клеток, в них появляются гранулы. При добавлении к среде пенициллина клетки удлиняются, иногда очень значительно. Образование спор у бактерий зависит от характера среды (плотная или жидкая), ее состава, температуры выращивания. При добавлении к среде 0,1% пептона 100% спор возникают через 48 ч, а при добавлений 2% его наблюдаются только вегетативные формы. Культуральные модификации. Многие бактерии и грибы при росте на различных питательных средах и при разных температурах изменяют интенсивность образования пигмента. Так, чудесная палочка при комнатной температуре образует ярко-красный пигмент на питательных средах, а при 37°С он отсутствует. У бактерий наблюдаются также изменения типа колоний, которые они образуют при росте на плотных питательных средах. Одни колонии гладкие, округлой формы, с ровными краями, блестящие, однородные, небольших размеров. Это S-формы колоний (от smooth — гладкий). Другие — шероховатые, тусклые, часто непрозрачные, с неровными краями, неправильных очертаний, сухие. Это R-формы колоний (от rooth — шероховатый). Гладкие S-формы могут переходить в шероховатые R-формы и обратно. Существуют и другие переходные формы колоний: слизистые (М-формы), карликовые (G-формы). Образование различных форм колоний у одного и того же вида бактерий называется диссоциациец (расщепление). Диссоциацию колоний можно получить при изменении состава питательной среды, под действием дезинфицирующих веществ, некоторых солей и т. д. Модификации физиологических и биохимических свойств. Известно, что устойчивость к физическим и химическим агентам зависит от возраста культуры. Например, молодые клетки более чувствительны к дезинфицирующим веществам, чем старые. Типичные физиологические свойства данного вида выявляются у культур бактерий, которые находятся в стационарной фазе роста. Одним из наиболее ярких примеров изменения биохимических свойств микробов является образование ими адаптивных ферментов. Обычно культура бактерий, размножаясь на питательных средах, вырабатывает определенные ферменты, позволяющие ей усваивать питательные вещества. Каждый вид бактерий характеризуется выработкой набора ферментов, предопределенного их генотипом. Но «работают» обычно не все гены, определяющие этот набор. Выработка отдельных ферментов из всего набора обусловливается наличием определенных питательных веществ в среде. Если вещество находится в питательной среде, то появляется и фермент. При отсутствии этого вещества прекращается выработка фермента. Такие адаптивные ферменты позволяют бактериям приспособиться, адаптироваться, к определенным условиям внешней среды. Следовательно, фенотипическая изменчивость зависит от условий среды, в которых существует данный вид микроорганизмов. Приспосабливаясь к конкретным жизненным условиям, микроб реализует ту информацию, которая имеется в геноме клетки. Это позволяет ему расти и размножаться на различных питательных средах. Однако широта изменений микробов имеет определенные пределы. Вариабельность различных свойств микроорганизмов возможна в основном лишь в пределах границ, характерных для каждого вида. Возникновение новых свойств и наследование их возможны лишь тогда, когда произойдут изменения в геноме клетки, затрагивающие информацию, заложенную в ДНК, микроорганизма. Такая изменчивость носит название генотипической. Генотипическая изменчивость. Трансформационная изменчивость, значение для диагностики и профилактики инфекционных заболеваний. Роль экологии. Генотипическая изменчивость - изменчивость, которая появляется в связи с изменением генетического материала, называется наследственной или генотипической. Одним из результатов наследственной изменчивости является образование новых вариантов организмов (новых генотипов), обеспечивающее разнообразие жизни, ее продолжение и эволюционное развитие. Генотипическая изменчивость широко представлена в природе. Иногда это очень крупные изменения, проявляющиеся, например, в признаках махровости у цветков, коротконогости у животных (у овец, кур), но чаще это мелкие, едва заметные отклонения от нормы. Изменение генотипа приводит, как правило, к изменению фенотипа. В основе генотипической изменчивости обычно лежат новые комбинации аллелей, образующиеся в процессе мейоза, при оплодотворении или мутации. Поэтому наследственную (генотипическую) изменчивость подразделяют на два вида: комбинативную (лат. combinatio — объединение) и мутационную. В обоих случаях нарушаются структура гена и структура хромосом, т.е. изменяется последовательность нуклеотидов в ДНК, число хромосом, а также происходит расщепление аллельных пар генов; иными словами, меняется генотип. Все это и приводит к появлению новых наследуемых признаков. Комбинативная изменчивость представляет собой результат перераспределения наследственного материала родителей среди их потомства. Перекомбинация, или рекомбинация, генов и хромосом обычно происходит при мейозе (в процессе кроссинговера, при расхождении гомологичных хромосом) и при оплодотворении. Комбинативная наследственная изменчивость является универсальным свойством всех организмов — от бактерий до высших растений и животных. Наблюдается она и у вирусов. Этот вид наследственной изменчивости имеет важное значение при эволюционных преобразованиях. Мутационная изменчивость является результатом мутаций. Мутации — это внезапные изменения наследуемого генетического материала, приводящие к появлению новых признаков организма, способных передаваться последующему потомству. Мутации могут быть естественными и искусственно вызванными. В природе они могут возникать неожиданно (спонтанно), но чаще под влиянием мутагенов (мутация греч. henes — рождающий, рожденный), т.е. факторов, порождающих мутации. Естественные мутации могут затрагивать разнообразные стороны строения и функций организма. Например, у дрозофилы описаны мутационные изменения формы крыльев, окраска тела, глаз, а также многих физиологических признаков (продолжительность жизни, плодовитость, устойчивость к повреждающим факторам и пр.). Большинство мутаций нейтральны, однако бывают мутации, вредные для организма, некоторые (летальные) даже вызывают его гибель. Очень редко возникают полезные для организма мутации, которые улучшают какие-то свойства особи, но именно они, закрепленные в потомстве, дают ей некоторые преимущества в естественном отборе перед другими. Генотипическая изменчивость присуща всем живым организмам. Она является основным источником генетического разнообразия особей внутри вида, чем обусловливает эволюцию видов в природе и отбор лучших форм в селекции. Трансформация — процесс поглощения клеткой организма свободной молекулы ДНК из среды и встраивания её в геном, что приводит к появлению у такой клетки новых для неё наследуемых признаков, характерных для организма-донора ДНК.(трансформационная изменчивость). Иногда под трансформацией понимают любые процессы горизонтального переноса генов, в том числе трансдукцию,конъюгацию и т. д. В любой популяции лишь часть бактерий способна к поглощению из среды молекул ДНК. Состояние клеток, при котором это возможно, называют состоянием компетентности. Обычно максимальное число компетентных клеток наблюдается в конце фазы логарифмического роста. В состоянии компетентности бактерии вырабатывают особый низкомолекулярный белок (фактор компетентности), активизирующий синтез аутолизина, эндонуклеазы I и ДНК-связывающего белка. Аутолизин частично разрушает клеточную стенку, что позволяет ДНК пройти через неё, а также снижает устойчивость бактерий к осмотическому шоку. В состоянии компетентности также снижается общая интенсивность метаболизма. Возможно искусственное приведение клеток в состояние компетентности. Для этого применяют среды с высоким содержанием ионов кальция, цезия, рубидия, электропорацию или заменяют клетки реципиента протопластами без клеточных стенок. Эффективность трансформации определяется количеством колоний, выросших на чашке Петри после добавления к клеткам 1 мкг суперскрученной плазмидной ДНК и рассева клеток на питательную среду. Современные методы позволяют добиваться эффективности 106—109. Поглощаемая ДНК должна быть двухнитевой (эффективность трансформации однонитевой ДНК на порядки ниже, однако несколько возрастает в кислой среде), её длина — не менее 450 пар оснований. Оптимальный pH для прохождения процесса — около 7. Для некоторых бактерий (Neisseria gonorrhoeae, Hemophilus) поглощаемая ДНК должна содержать определённые последовательности. ДНК необратимо адсорбируются на ДНК-связывающем белке, после чего одна из нитей разрезается эндонуклеазой на фрагменты длиной 2—4 тыс. пар оснований и проникает в клетку, вторая полностью разрушается. В случае, если эти фрагменты имеют высокую степень гомологии с какими-либо участками бактериальной хромосомы, возможна замена этих участков на них. Поэтому эффективность трансформации зависит от эволюционного расстояния между донором и реципиентом. Общее время процесса не превышает нескольких минут. Впоследствии, при делении, в одну дочернюю клетку попадает ДНК, построенная на основе исходной нити ДНК, в другую — на основе нити с включённым чужеродным фрагментом (выщепление). Полимеразная цепная реакция (ПЦР). Сущность. Полимеразная цепная реакция (ПЦР) - метод амплификации (размножения) ДНК in vitro, с помощью которого в течение нескольких часов можно выявить и размножить интересующий фрагмент ДНК размером от 80 до 3000 пар нуклеотидов (пн). Исходные компоненты ПЦР: 1. ДНК-матрица (тотальная ДНК); 2. Праймеры (однонитевые синтетические фрагменты ДНК размером 20-30 нуклеотидов), строго комплементарные правой и левой границам интересующего фрагмента ДНК). 3. Нуклеотиды, являющиеся материалом для синтеза новых комплементарных цепей ДНК); 4. Фермент - ДНК-полимераза, катализирующий удлинение цепей праймеров путем последовательного присоединения нуклеотидов к растущей цепи синтезируемой ДНК. ПЦР–анализ включает 30 циклов амплификации. Каждый цикл состоит из трех стадий: 1. Денатурация ДНК (расплетение двойной спирали, разрыв водородных связей между комплементарными нуклеотидами). Проходит при температуре 93-95оС в течение 1 мин. 2. Отжиг (присоединение) праймеров (50-60оС, 1 мин). 3. Синтез ДНК - достраивание одноцепочечных участков ДНК по принципу комплементарности (72оС, 1 мин). К концу ПЦР происходит накопление нужного участка ДНК до 2n фрагментов, где n-число циклов амплификации. Этого количества достаточно для точной детекции этого фрагмента методом электрофореза. 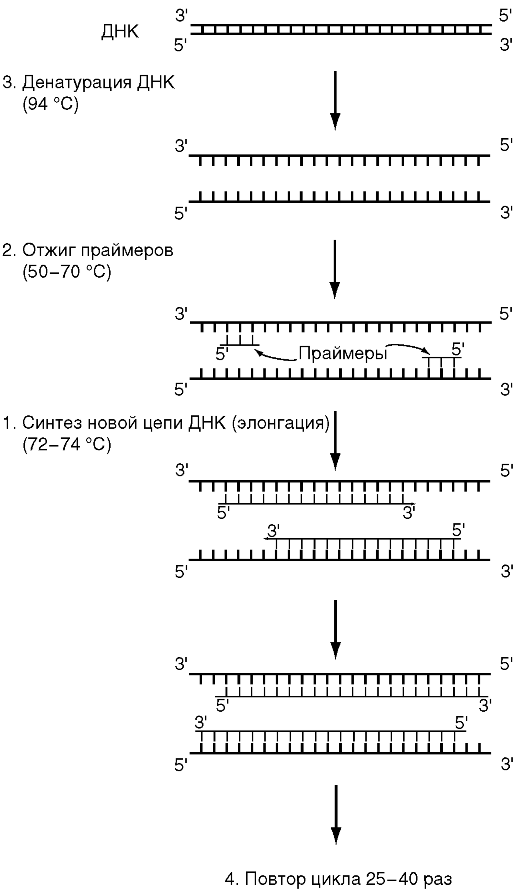 Нормальная микрофлора человека, ее значение для жизнедеятельности организма и его здоровья. Способы восстановления микрофлоры. Организм человека заселен (колонизирован) более чем 500 видов микроорганизмов, составляющих нормальную микрофлору человека, находящихся в состоянии равновесия (эубиоза) друг с другом и организмом человека. Микрофлора представляет собой стабильное сообщество микроорганизмов, т.е. микробиоценоз. Она колонизирует поверхность тела и полости, сообщающиеся с окружающей средой. Место обитания сообщества микроорганизмов называется биотопом. В норме микроорганизмы отсутствуют в легких и матке. Различают нормальную микрофлору кожи, слизистых оболочек рта, верхних дыхательных путей, пищев¬рительного тракта и мочеполовой системы. Среди нормальной микрофлоры выделяют резидентную и транзиторную микрофлору. Резидентная (постоянная) облигатная микрофлора представлена микроорганизмами, постоянно присутствующими в организме. Транзиторная (непостоянная) микрофлора не способна к длительному существованию в организме. Микрофлора кожи имеет большое значение в распространении микроорганизмов в воздухе. На коже и в ее более глубоких слоях (волосяные мешочки, просветы сальных и потовых желез) анаэробов в 3—10 раз больше, чем аэробов. Кожу колонизируют пропионибактерии, коринеформные бактерии, стафилококки, стрептококки, дрожжи Pityrosporum, дрож-жеподобные грибы Candida, редко микрококки, Мус. fortuitum. На 1 см2 кожи приходится менее 80 000 микроорганизмов. В норме это количество не увеличивается в результате действия бактерицидных стерилизующих факторов кожи. В верхние дыхательные пути попадают пылевые частицы, нагруженные микроорганизмами, большая часть которых задерживается в носо- и ротоглотке. Здесь растут бактероиды, ко-ринеформные бактерии, гемофильные палочки, пептококки, лактобактерии, стафилококки, стрептококки, непатогенные нейссерии и др. Трахея и бронхи обычно стерильны. Микрофлора пищеварительного тракта является наиболее представительной по своему качественному и количественному составу. При этом микроорганизмы свободно обитают в полости пищеварительного тракта, а также колонизируют слизистые оболочки. В полости рта обитают актиномицеты, бактероиды, бифи-цобактерии, эубактерии, фузобактерии, лактобактерии, гемофильные палочки, лептотрихии, нейссерии, спирохеты, стрептококки, стафилококки, вейлонеллы и др. Обнаруживаются также грибы рода Candida и простейшие. Ассоцианты нормальной микрофлоры и продукты их жизнедеятельности образуют зубной налет. Микрофлора желудка представлена лактобациллами и дрожжами, единичными грамотрицательными бактериями. Она не¬сколько беднее, чем, например, кишечника, так как желудочный сок имеет низкое значение рН, неблагоприятное для жизни многих микроорганизмов. При гастритах, язвенной болезни желудка обнаруживаются изогнутые формы бактерий — Helicobacter pylori, которые являются этиологическими факторами патологического процесса. В тонкой кишке микроорганизмов больше, чем в желуд¬ке; здесь обнаруживаются бифидобактерии, клостридии, эубактерии, лактобациллы, анаэробные кокки. Наибольшее количество микроорганизмов накапливается в толстой кишке. В 1 г фе¬калий содержится до 250 млрд микробных клеток. Около 95 % всех видов микроорганизмов составляют анаэробы. Основными представителями микрофлоры толстой кишки являются: грамположительные анаэробные палочки (бифидобактерии, лактобацил¬лы, эубактерии); грамположительные спорообразующие анаэроб¬ные палочки (клостридии, перфрингенс и др.); энтерококки; грамотрицательные анаэробные палочки (бактероиды); грамотрицательные факультативно-анаэробные палочки (кишечные палоч¬ки и сходные с ними бактерии. Микрофлора толстой кишки — своеобразный экстракорпоральный орган. Она является антагонистом гнилостной микрофлоры, так как продуцирует молочную, уксусную кислоты, антибиотики и др. Известна ее роль в водно-солевом обмене, регуляции газового состава кишечника, обмене белков, углеводов, жирных кислот, холестерина и нуклеиновых кислот, а также продукции биологически активных соединений — антибиотиков, витаминов, токсинов и др. Морфокинетическая роль микрофлоры заключается в ее участии в развитии органов и систем организма; она принимает участие также в физиологическом воспалении слизистой оболочки и смене эпителия, переваривании и детокси-кации экзогенных субстратов и метаболитов, что сравнимо с функцией печени. Нормальная микрофлора выполняет, кроме того, антимутагенную роль, разрушая канцерогенные вещества. Пристеночная микрофлора кишечника колонизирует слизистую оболочку в виде микроколоний, образуя своеобразную биологическую пленку, состоящую из микробных тел и экзополи-сахаридного матрикса. Экзополисахариды микроорганизмов, называемые гликокаликсом, защищают микробные клетки от разнообразных физико-химических и биологических воздействий. Слизистая оболочка кишечника также находится под защитой биологической пленки. Важнейшей функцией нормальной микрофлоры кишечника является ее участие в колонизационной резистентности, под которой понимают совокупность защитных факторов организма и конкурентных, антагонистических и других особенностей анаэробов кишечника, придающих стабильность микрофлоре и предотвращающих колонизацию слизистых оболочек посторонними микроорганизмами. Нормальная микрофлора влагалища включает бактероиды, лактобактерии, пептострептококки и клостридии. Представители нормальной микрофлоры при снижении сопротивляемости организма могут вызвать гнойно-воспалительные процессы, т.е. нормальная микрофлора может стать источником аутоинфекции, или эндогенной инфекции. Она также является источником генов, например генов лекарственной устойчивости к антибиотикам. Состояние эубиоза — динамического равновесия нормальной микрофлоры и организма человека — может нарушаться под влиянием факторов окружающей среды, стрессовых воздействий, широкого и бесконтрольного применения антимикробных препаратов, лучевой терапии и химотерапии, нерационального питания, оперативных вмешательств и т. д. В результате нарушается колонизационная резистентность. Аномально размножившиеся транзиторные микроорганизмы продуцируют токсичные продукты метаболизма — индол, скатол, аммиак, сероводород. Состояния, развивающиеся в результате утраты нормальных функций микрофлоры, называются дисбактериозом и дисбиозом. При дисбактериозе происходят стойкие количест¬венные и качественные изменения бактерий, входящих в состав нормальной микрофло¬ры. При дисбиозе изменения происходят и среди других групп микроорганизмов (виру¬сов, грибов и др.). Дисбиоз и дисбактериоз могут приводить к эндогенным инфекция¬ми. Дисбиозы классифицируют по этиологии (грибковый, стафилококковый, протейный и др.) и по локализации (дисбиоз рта, кишки, влагалища и т. д.). Изменения в составе и функциях нормальной микрофлоры сопро¬вождаются различными нарушениями: разви¬тием инфекций, диарей, запоров, синдрома мальабсорбции, гастритов, колитов, язвенной болезни, злокачественных новообразований, аллергий, мочекаменной болезни, гипо- и гиперхолестеринемии, гипо- и гипертензии, кариеса, артрита, поражений печени и др. Нарушения нормальной микрофлоры человека определяются следующим образом: 1. Выявление видового и количественного со¬става представителей микробиоценоза определенного биотопа (кишки, рта, влагалища, кожи и т. д.) — путем высева из разведений исследу¬емого материала или путем отпечатков, смыва на соответствующие питательные среды (среда Блаурокка — для бифидобактерий; среда МРС-2 — для лактобактерий; анаэробный кровя¬ной агар — для бактероидов; среда Левина или Эндо — для энтеробактерий; желчно-кровяной агар — для энтерококков; кровяной агар — для стрептококков и гемофилов; мясопептонный агар с фурагином — для синегнойной палочки, среда Сабуро — для грибов и др.). 2. Определение в исследуемом материале микробных метаболитов — маркеров дисбио-за (жирных кислот, гидроксижирных кислот, жирнокислотных альдегидов, ферментов и др.). Например, обнаружение в фекалиях бета-аспартил-глицина и бета-аспартиллизина свидетельствует о нарушении кишечного микробиоценоза, так как в норме эти дипеп-тиды метаболизируются кишечной анаэроб¬ной микрофлорой. Для восстановления нормальной микро¬флоры: а) проводят селективную деконтами-нацию; б) назначают препараты пробиотиков (эубиотиков), полученные из лиофильно вы¬сушенных живых бактерий — представителей нормальной микрофлоры кишечника — би¬фидобактерий (бифидумбактерин), кишеч¬ной палочки (колибактерин), лактобактерий (лактобактерин) и др. Пробиотики — препараты, оказывающие при приеме per os нормализирующее действие на организм человека и его микрофлору. Биопленки. Структура, значение. Интересен тот факт, что микроорганизмы существуют не изолированно, а в форме организованных сообществ — биопленок (biofilm). В состав биопленки могут входить несколько видов бактерий, простейшие, грибы, водоросли, которые успешно взаимодействуют между собой. Микроорганизмы находятся во внеклеточном полимерном веществе — внеклеточном матриксе, чаще всего представляющем собой слизь, при этом сами бактерии составляют примерно 5—25 % от общей массы биопленки. Обычно биопленки образуются на границе сред (жидкость-жидкость, жидкость-воздух, жидкость-твердое вещество). Прикрепиться бактерии могут как к неживой (камни, дерево), так и к живой субстанции (эпителий желудочно-кишечного тракта, мочеполовой системы, поверхность зубов, кожи). Биопленки обладают «коллективным интеллектом», что позволяет им успешно противостоять воздействию антибиотиков, высоких температур, ультрафиолетовому излучению, радиации, дегидратации, вирусам, фагоцитозу, изменению рН среды [2; 6]. Микробы в составе биопленки способны оценить поверхность (клеточное распознавание), наличие или отсутствие питательных веществ, кислорода, сероводорода. В природе биопленки нужны микробному миру для того, чтобы адаптироваться к меняющимся условиям окружающей среды, они выполняют защитную роль, участвуют в синтезе белков, полисахаридов, гликопротеидов. В развитии и формировании биопленки существует несколько этапов [4; 5]. 1. Адгезия — прикрепление отдельных микробных клеток к поверхности из окружающей среды. Хорошо прикрепиться могут только здоровые клетки. Бактерии с дефектами, мутанты не способны образовывать микробное сообщество. Эта стадия длится несколько секунд и отличается обратимостью. 2. Фиксация — в это время начинают активно работать клеточные структуры: жгутики, фимбрии, пили, с их помощью бактерии взаимодействуют с субстратом и друг с другом, синтезируя полимеры. На этом этапе происходит прочная адгезия, формируется многоклеточный слой, процесс необратим. 3. Созревание — первые одиночные клетки способствуют прикреплению новых клеток, структура укрепляется с помощью внеклеточного матрикса, начинается деление. Микроколонии постепенно превращаются в макроколонии. В них появляются особые структуры биопленки — поры, каналы, полости. 4. Рост — на этом этапе биопленка способна изменять размеры, форму, объем занимаемой территории, а внеклеточный матрикс служит надежной защитой от неблагоприятных внешних условий. 5. Дисперсия — от биопленки время от времени происходит отщепление бактерий, которые способны прикрепиться к поверхности и стать родоначальниками новых колоний. Клетки, которые покидают колонии, сохраняют приобретенные свойства (например, устойчивость к антибиотикам). Известно, что для биопленок характерен феномен кворумной сигнализации (Qvorum Sensis), который координирует экспрессию генов в зависимости от внешних условий. Часто биопленки ассоциируют как функциональный аналог многоклеточного организма. Каким образом предается сигнал от одной микробной клетки к другим до конца не известно. Возможно, связь между бактериями осуществляется с помощью электрического импульса (вероятно, подобного нервному), биохимических реакций или путем активизации сигнальных молекул. Сообщество микроорганизмов образует единую генетическую систему в форме плазмид-кольцевых ДНК, контролирующих поведенческий код и определяющих пищевые, мутационные, энергетические связи между собой и внешним миром. При этом бактерии получают преимущества, которые не может иметь одиночная клетка. Такая уникальная организация микробного сообщества позволяет обеспечить стабильность системы и является основой для противостояния неблагоприятным факторам внешней среды. Микробные инфекции человека, животных и растений сопровождаются формированием биопленок. Они препятствуют нормальному иммунному ответу макроорганизма, подавляют активность макрофагов, тем самым, приводят к затяжному течению болезни, неэффективности антибактериальной терапии [5]. Установлено, что устойчивые бипленки образуют Gardnerella vaginalis, вызывающие развитие бактериального вагиноза [1], Актиномицеты, Спирохеты, Fusobacterium nucleatum, Synergistetes принимают участие в образовании зубного налета, появлении кариеса, пародонтоза, Staphylococcus aureus, ответственные за инфекции сердечных клапанов и суставных протезов, E. coli, участвующие в развитии инфекций мочевых путей, кокковая флора является частой причиной мастита у коров, агробактерии вызывают опухолеобразование у растений. Кроме того, образующиеся биопленки на трубопроводах, корпусах судов, различном технологическом оборудовании, приводят к быстрому износу конструкций и возможности переноса и распространения различных заболеваний людей, животных и растений. Санитарно-показательные микроорганизмы. Классификация. Требования к СПМ. Значение для практического врача. |
