Основные понятия термодинамики
 Скачать 279.3 Kb. Скачать 279.3 Kb.
|
|
8. Катализ. Гомогенный и гетерогенный катализ. Осбенности каталитич.активности ферментов. Катализ-изменение скорости хим. реакций в присутствии веществ, которые после завершения реакции остаются в неизменном виде и количестве. Увеличение скорости реакции называют положительным катализом, уменьшение – отрицательным катализом (или ингибированием). Катализаторы - вещества, вызывающие положительный катализ; ингибиторы – вещества, замедляющие реакции. Катализаторы ускоряют только термодинамически возможные реакции! Различают гомогенный и гетерогенный катализ. Если катализатор образует одну фазу с реакционной смесью, то такой катализ называют гомогенным (пример- реакция H2O2 в водном растворе в присутствии дихромат-ионов). Если катализатор находится в разных фазах с реакционной смесью, то такой катализ называют гетерогенным (пример - H2O2 в водном растворе (жидкая фаза) в присутствии MnO2 (твердая фаза) Катализатор участвует в химической реакции, образуя промежуточные соединения. Катализаторы биохимических реакций имеют белковую природу и называются ферментами. Ферменты несколько отличаются от обычных катализаторов: 1) обладают значительно более высокой каталитической эффективностью; 2)высокая специфичность, т.е. избирательность действия; 3) многие ферменты проявляют каталитическую активность только по отношению к одному субстрату; 4)ферменты проявляют максимальную эффективность только в мягких условиях, характеризующихся небольшим интервалом температур и значений рН. Снижение активности фермента при температуре выше оптимальной связано с тепловой денатурацией белка, которая наступает при 50-60, а иногда и 400C Активность фермента равна скорости реакции нулевого порядка. 9. Роль воды и растворов в жизнедеятельности. Термодинамика растворения. Раствор-это гомогенная система переменного состава из двух и более веществ, находящаяся в состоянии равновесия. Классификация: 1) взвеси(грубо-дисперсная система): суспензии(тв.в-во в жидкости) и эмульсии(жидк. в жидк.) 2) коллоиды, золи(тонко-дисперсные системы). Значение растворов в жизнедеятельности: многие хим.процессы протекают лишь при условии, что участвующие в них вещества находятся в растворенном состоянии. Важнейшие биологические жидкости(кровь, лимфа, моча, слюна, пот) являются растворами солей, белков, углеводов, липидов в воде. Усвоение пищи связано с переходом питат.веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. Биожидкости участвуют в транспорте питат.веществ(жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов. В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ (концентрационный гомеостаз). Самым распространенным растворителем на нашей планете является вода. Особенности воды: по своей теплоемкости превосходит все вещества; аномальное поведение при охлаждении – вода уплотняется, начинает тонуть, потом поднимается(все др.вещества тонут при уплотнении); может возгоняться(возгонка воды) – сублимация(при определен.условиях лед может переходить в пар без предварительного превращения в жидкую воду, т.е. без плавления); вода растворяет все вещества(вопрос только сколько?); высокая диэлектрическая постоянная воды(величина, показывающая во сколько раз сила взаимодействия между двумя зарядами в данном веществе меньше, чем в вакууме); высокая критическая температура; вода является амфолитом(не кислота, не осн-е); участвует в создании полимерных структур организма(белок, липиды…); основа мембранного транспорта. Термодинамика растворения: согласно 2-му началу термодинамики при р, Т=constвещества самопроизвольно могут растворяться в каком-либо растворителе, если в результате этого процесса энергия Гиббса системы уменьшается, т.е. ∆G=(∆H - T∆S)<0. (∆H-энтальпийный фактор, T∆S-энтропийный фактор растворения). При растворении жидких и твердых веществ ∆S>0. При растворении газов в жидкости ∆S<0. Изменение энтальпии представляет собой алгебраическую сумму изменения энтальпии ∆Hкр в результате разрушения кристаллической решетки и изменения энтальпии ∆Hсол за счет сольватации частицами растворителя ∆Hраств= ∆Hкр + ∆Hсол . При растворении газов энтальпия∆Hкр =0, т.к. не надо затрачивать энергию на разрушение кристаллической решетки. При растворении может происходить изменение и энтропии, и энтальпии. 10. Понятие об идеальном растворе. Константа растворимости, условия образования и растворения осадка. Идеальный раствор- это разбавленный раствор неэлектролитов, который подчиняется законам Вант-Гоффа и Рауля. Энтальпия смешивания равна 0 (гомогенные смеси углеводородов; гипотетический раствор, где равенство всех сил межмолекулярного взаимодействия.) Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная. При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде: 11. Коллигативные свойства разбавленных растворов электролитов и неэлектролитов. Закон Рауля и следствия из него: понижение температуры кристаллизации, повышение температуры кипения растворов, осмос. Осмотическое давление, закон Вант-Гоффа. Осмотическое давление растворов электролитов. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. Понятие об изоосмии (электролитном гомеостазе). Роль осмоса в биологических системах. Плазмолиз и гемолиз. Коллигативные свойства растворов – такие их свойства, которые зависят в основном от концентрации растворенных частиц и гораздо меньше от их размера, молярной массы и других свойств. - понижение давления пара - повышение температуры кипения - понижение температуры замерзания - осмотическое давление Закон Рауля: Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя. Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе (другая формулировка: относительное понижение давления насыщенного пара растворителя над раствором нелетучего электролита равно молярной доле растворенного вещества). p = p0* Х1, где p — давление насыщенного пара растворителя над раствором; p0 — давление насыщенного пара над чистым растворителем; Х1 —мольная доля растворителя. p0-p=∆p – понижение давления насыщенного пара растворителя над раствором ∆p/p0=Х2, Х1+Х2=1 Для растворов электролитов используют несколько другую форму уравнения, позволяющую добавить в неё изотонический коэффициент: ∆p/p0=i*Х2, где Δp — собственно изменение давления по сравнению с чистым растворителем; Х2— мольная доля вещества в растворе, i– изотонический коэффициент, показывающий во сколько раз экспериментально найденная величина больше теоретической. Следствия: 1. температура кипения раствора выше температуры кипения растворителя. Это обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя. Повышение температуры кипения Ткип пропорционально моляльности раствора ..∆Ткип=Kэб*Сm, где Кэб – эбулиоскопическая константа растворителя, Сm – моляльность. . Сm=m (раств в-ва)*1000/М (раств в-ва)*q ( масса раст-ля) [моль/кг] 2, температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Разность между температурой кристаллизации растворителя и температурой начала кристаллизации раствора есть понижение температуры кристаллизации. Понижение температуры замерзания (кристаллизации) Тзам пропорционально моляльности раствора ∆Тзам=Kкр*Сm, где Ккр – криоскопическая константа растворителя. Осмос - самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя. Молекулы растворителя переходят из растворителя в раствор или из менее концентрированного раствора в более концентрированный. Осмотическое давление – сила, обусловливающая осмос (величина, измеряемая минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился). Оно равно внешнему давлению, при котором осмос видимо прекращается. За счет осмотического давления сила заставляет жидкость подниматься вверх, это осмотическое давление уравновешивается гидростатическим давлением. Когда скорости диффундирующих веществ станут равны, тогда осмос прекратится. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры и не зависит ни от природы растворенного вещества, ни от природы растворителя. Закон Вант-Гоффа. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа: pV = nRТ, или p=(n/V)RТ откуда Pосм = сRТ, где p - осмотическое давление (кПа), с – молярная концентрация раствора (моль/л) или Pосм=CmRT, где Cm – моляльность (моль/кг), R=0,082 [л*А*о/К*моль]. Осмотическое давление растворов электролитов. Pосм=i*Cm*R*T, где i – изотонический коэффициент (i=α *(n-1)+1, α – степень диссоциации, n – число ионов, обр-ся в результате диссоциации) Гипо-, гипер- и изотонические растворы. Растворы с одинаковым осмотическим давлением называются изотоническими. При помещении клеток в изотонический раствор они сохраняют свой размер и нормально функционируют. Плазма крови изотонична физраствору w(NaCl)=0,86%. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое – гипотоническим. Изотонический коэффициент. i– изотонический коэффициент, показывающий во сколько раз экспериментально найденная величина больше теоретической. i=α *(n-1)+1, α – степень диссоциации, n – число ионов, обр-ся в результате диссоциации. i=∑всех частиц/исходное число раств молекул. i=∆P’/∆P=∆P’осм/∆Pосм=∆T’зам/∆Tзам=∆T’кип/∆Tкип, где значения со штрихом – растворы электролитов, в знаменателях – теорет вычисления. Изоосмия - относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: электролитов, белков. Это одна из важнейших физиологических констант организма, обеспечиваемых механизмами саморегуляции (Гомеостаз) Роль осмоса в биологических системах. Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию. Плазмолиз - при помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор и наблюдается сморщивание клеток. Гемолиз - разрушение эритроцитов, сопровождающееся выходом из них гемоглобина. Если клетки красных кровяных телец поместить в гипотонический р-р, то выравнивание давления происходит за счет перехода воды из р-ра в клетку. Клетки набухают и лопаются. 12. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константа ионизации слабого электролита. Закон разведения Оствальда. Ионная сила раствора. Активность и коэффициент активности ионов. Электролиты в организме, слюна как электролит. Электролиты – это вещества с ионными или сильнополярными ковалентными связями в водных растворах, подвергающиеся электролитической диссоциации, в результат чего образуются катионы и анионы. Сильные электролиты – вещества, способные диссоциировать нацело. К ним относится большинство солей, а так же некоторые вещества молекулярного строения (HCl). Слабые электролиты диссоциируют в незначительно степени, и преобладающей формой их является молекулярная (H2S, органические кислоты). Количественно способность молекулярного электролита к диссоциации определяется степенью ионизации(она зависит от концентрации электролита): α= 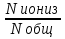 , где Nобщ – общее число молекул в растворе; N иониз – число молекул, распавшихся на ионы. , где Nобщ – общее число молекул в растворе; N иониз – число молекул, распавшихся на ионы.Константа ионизации: Kd= 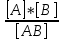 , Где [A],[B] – распавшиеся ионы [AB] – не распавшееся на ионы вещество. , Где [A],[B] – распавшиеся ионы [AB] – не распавшееся на ионы вещество.Закон разбавления Оствальда: K= α2c/1- α , Где α – степень ионизации С – молярная концентрация Ионная сила раствора: I=0.5∑сizi2, Где сi – молярная концентрация иона в растворе, моль/л, zi – заряд иона. Активность иона – это его эффективная концентрация. Активность связана с молярной концентрацией следующим образом: a=f*c, где f – коэффициент активности Электролиты в организме: Na и Cl участвуют в поддержании кислотно-щелочного баланса, осмотического равновесия в организме. Са играет большую роль в построении костной ткани и зубов, в регулировании кислотности крови и ее свертывании, в возбудимости мышечной и нервной ткани. К находится преимущественно в жидкостях тела и мягких тканях, где является необходимым элементом для поддержания осмотического давления, регуляции рН крови. Mg является кофактором многих ферментативных реакций, необходим на всех этапах синтеза белка. В живых организмах Fe является важным микроэлементом, катализирующим процессы обмена кислородом. Сo входит в состав витамина В12, задействован при кроветворении, функциях нервной системы и печени, ферментативных реакциях. Zn необходим для метаболизма витамина E, участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста. Mn оказывает влияние на рост, образование крови и функции половых желёз. Слюна как электролит является сложной биохимической средой. Количество ионов Н+ и ОН" определяет рН слюны, который в норме равен 6,9. Величина водородного показателя изменяется в зависимости от характера патологического процесса в полости рта. Так. при инфекционных заболеваниях реакция слюны кислая. Из неорганических веществ в слюне содержатся анионы хлора, брома, иода, фтора. Анионы фосфатов, фтора способствуют увеличению электрохимических потенциалов, анион хлора - переносу ионных зарядов и является деполяризатором (фактор, ускоряющий анодные и катодные процессы). В слюне определяются микроэлементы: железо, медь, серебро, марганец, алюминий и др. - и макроэлементы: кальций, калий, натрий, магний, фосфор. 13.Основные положения протолитической теории кислот и оснований Бренстеда-Лоури;Сопряженная протолитическая пара,амфолиты.Теория Льюиса. Теория Бренстеда-Лоури: кислотой называют всякое вещество, молекулярные частицы которого(в том числе и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют всякое вещество, молекулярные частицы которого(в том числе и ионы) способны присоединить протоны, т.е. быть акцептором протонов. Например: HNO3 + H2O= H3O+ + NO3- Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность). Например, вода при взаимодействии с сильными кислотами является основанием: H2O + H+ = H3О+, а реагируя с аммиаком, становится кислотой: NH3 + H2O=NH4+ + OH−. Молекула и ион, отличающиеся по составу на один протон, называются сопряженной кислотно-основной парой. Частицы, способные к взаимодействию как с кислотами, так и с основаниями, называются амфолитами. Теория Льюиса: кислотой называют вещество, принимающие электронные пары, - акцептор электронов; основанием называют вещество, поставляющее электроны для образования химической связи, - донор электронов. Например: NH3 + HCI=NH4CI PCl5 + Cl− → PCl6- 14. Автопротолиз –обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой. H2O + H2O= H3O+ + OH–. Это равновесие называется равновесием автопротолиза воды. Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как Kw. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись: 15. Типы протолитических реакций. Гидролтиз. К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим. протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием - вещество, способное присоединять протон, например: CH3COOH + H2O = CH3COO- + H3O+ кислотаI основаниеI основаниеI кислотаII NH3 + H2O = NH4+ + OH- основаниеIкислотаII кислотаII основаниеI К протолитическим реакциям относят реакции нейтрализации и гидролиза. Реакция 1 типа уксусная кислота с водой: 16. Буферными называют растворы, рН которых практически на изменяется от добавления к ним небольших количеств сильной кислоты или щелочи, а также при разведении. Простейший буферный раствор – это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион (например, смесь уксусной кислоты СН3СООН и ацетата натрия СН3СООNa), либо смесь слабого основания и соли, имеющей с этим основанием общий катион (например, смесь гидроксида аммония NH4OH с хлоридом аммония NH4Cl). С точки зрения протонной теории1 буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа: Воснование + Н+ Û ВН+сопряженная кислота НАкислота Û Н+ + А-сопряженное основание Сопряженные кислотно-основные пары В /ВН+ и А- /НА называют буферными системами. Классификация кислотно-основных буферных систем.Буферные системы могут быть четырех типов: 1. Слабая кислота и ее анион А-/НА: · ацетатная буферная система СН3СОО-/СН3СООН в растворе СН3СООNa и СН3СООН, область действия рН 3, 8 – 5, 8. · Водород-карбонатная система НСО3-/Н2СО3 в растворе NaНСО3 и Н2СО3, область её действия – рН 5, 4 – 7, 4. 2. Слабое основание и его катион В/ВН+: · аммиачная буферная система NH3/NH4+ в растворе NH3 и NH4Cl, область ее действия – рН 8, 2 – 10, 2. 3. Анионы кислой и среднейсоли или двух кислых солей: · карбонатная буферная системаСО32- /НСО3- в растворе Na2CO3 и NaHCO3, область ее действия рН 9, 3 – 11, 3. · фосфатная буферная системаНРО42-/Н2РО4- в растворе Nа2НРО4 и NаН2РО4, область ее действия рН 6, 2 – 8, 2. Эти солевые буферные системы можно отнести к 1-му типу, т. к. одна из солей этих буферных систем выполняет функцию слабой кислоты. Так, в фосфатной буферной системе анион Н2РО4- является слабой кислотой. 4. Ионы и молекулы амфолитов. К ним относят аминокислотные и белковые буферные системы. Если аминокислоты или белки находятся в изоэлектрическом состоянии (суммарный заряд молекулы равен нулю), то растворы этих соединений не являются буферными.Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из ИЭС в форму “белок-кислота” или соответственно в форму “белок-основание”. При этом образуется смесь двух форм белка: (R – макромолекулярный остаток белка) а) слабая “белок-кислота” + соль этой слабой кислоты: б) слабое “белок-основание” + соль этого слабого основания: Таким образом, и этот тип буферных систем может быть отнесен соответственно к буферным системам 1-го и 2-го типов. Механизм буферного действия можно понять на примере ацетатной буферной системы СН3СОО-/СН3СООН, в основе действия которой лежит кислотно-основное равновесие: СН3СООН Û СН3СОО- + Н+; (рКа = 4, 8) Главный источник ацетат-ионов – сильный электролит СН3СООNa: СН3СООNa ® СН3СОО- + Na+ При добавлении сильной кислоты сопряженное основание СН3СОО- связывает добавочные ионы Н+, превращаясь в слабую уксусную кислоту: СН3СОО- + Н+ Û СН3СООН (кислотно-основное равновесие смещается влево, по Ле Шателье) Уменьшение концентрации анионов СН3СОО- точно уравновешивается повышение концентрации молекул СН3СООН. В результате происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а следовательно, и незначительно изменяется рН. При добавлении щелочи протоны уксусной кислоты (резервная кислотность) высвобождаются и нейтрализуются добавочные ионы ОН-, связывая их в молекулы воды: СН3СООН + ОН- Û СН3СОО- + Н2О (кислотно-основное равновесие смещается вправо, по Ле Шателье) В этом случае также происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а следовательно, и незначительное изменение рН. Уменьшение концентрации слабой кислоты СН3СООН точно уравновешивается повышение концентрации анионов СН3СОО- Способность буферного раствора сохранять рН по мере прибавления сильной кислоты или приблизительно на постоянном уровне далеко небеспредельна и ограничена величиной так называемой буферной емкости В. За единицу буферной емкости обычно принимают емкость такого буферного раствора, для изменения рН которого на единицу требуется введение сильной кислоты или щелочи в количестве 1 моль эквивалента на 1л раствора. Т. е. это величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении сильных кислот или сильных оснований. Буферная емкость, как следует из ее определения, зависит от ряда факторов: 1. Чем больше количества компонентов кислотно-основной пары основание/ сопряженная кислота в растворе, тем выше буферная емкость этого раствора (следствие закона эквивалентов). 2. Буферная емкость зависит от соотношения концентраций компонентов буферного раствора, а следовательно, и от рН буферного раствора. главные буферные системы в организме человека Организм человека располагает тонкими механизмами координации происходящих в не физиологических и биохимических процессов и поддержания постоянства внутренней среды (оптимальных значений рН и уровней содержания различных веществ в жидкостях организма, температуры, кровяного давления и т. д.) Нередко отклонения рН крови от нормального для нее значения 7,36 всего лишь на несколько сотых приводят к неприятным последствиям. При отклонениях порядка 0,3 единицы в ту или другую сторону может наступит тяжелое коматозное состояние, а отклонения порядка 0,4 единицы могут повлечь даже смертельный исход. Впрочем, в некоторых случаях, при ослабленном иммунитете, для этого оказывается достаточными и отклонения порядка 0,1 единицы рН. Особенно большое значение буферных систем имеют в поддержании кислотно-основного равновесия организма. Внутриклеточные и внеклеточные жидкости всех живых организмов, как правило, характеризуются постоянным значением рН, которое поддерживается с помощью различных буферных систем. Значение рН большей части внутриклеточных жидкостей находится в интервале от 6,8 до 7,8. Кислотно-основное равновесие в крови человека обеспечивается водородкарбонатной, фосфатной и белковой буферными системами. Нормальное значение рН плазмы крови составляет 7,40 ± 0,05. Этому соответствует интервал значений активной кислотности а (Н+) от 3,7 до 4,0 ´ 10-8 моль/л. Так как в крови присутствуют различные электролиты - НСО3-, Н2СО3, НРО42-, Н2РО4-, белки, аминокислоты, это означает, что они диссоциируют в такой степени, чтобы активностьа (Н+) находилась в указанном интервале. 1. Водородкарбонатная (гидро-, бикарбонатная) буферная система НСО3-/Н2СО3 плазмы крови характеризуется равновесием молекул слабой угольной кислоты Н2СО3 с образующимися при ее диссоциации гидрокарбонат-ионами НСО3-(сопряженное основание): НСО3- + Н+ Û Н2СО3 НСО3- + Н2О Û Н2СО3 + ОН- В организме угольная кислота возникает в результате гидратации диоксида углерода – продукта окисления углеводов, белков и жиров. Причем процесс этот ускоряется под действием фермента карбоангидразы: СО2(р) + Н2О Û Н2СО3 2. Фосфатная буферная система НРО42-/Н2РО4- состоит из слабой кислоты Н2РО4-и сопряженного основания НРО42-. В основе ее действия лежит кислотно-основное равновесие, равновесие между гидрофофсфат- и дигидрофосфат-ионами: НРО42- + Н+ Û Н2РО4- , НРО42- + Н2О Û Н2РО4- + ОН- Фосфатная буферная система способа сопротивляться изменению рН в интервале 6, 2 – 8, 2, т. е. обеспечивает значительную долю буферной емкости крови. 3. Буферная система оксигемоглобин-гемоглобин, на долю которой приходится около 75% буферной емкости крови, характеризующаяся равновесием между ионами гемоглобина Hb- и самим гемоглобином HНb, являющимся очень слабой кислотой (КHНb = 6, 3 ´ 10-9; рКHНb = 8, 2). Hb- + Н+ Û HНb,,,Hb- + Н2О Û HНb + ОН- а также между ионами оксигемоглобина HbО2- и самим оксигемоглобином HНbО2, который является несколько более сильной, чем гемоглобин, кислотой (КHНbО2 = 1. 12 ´ 10-7; рКHНbО2 = 6, 95): HbО2- + Н+ Û HНbО2, HbО2- + Н2О Û HНbО2 + ОН-. Гемоглобин HНb, присоединяя кислород, образует оксигемоглобин HНbО2 , HНb + О2 Û HНbО2 и, таким образом, первые два равновесия взаимосвязаны со следующими двумя. Вопрос 17Комплексными соединениями называются вещества молекулы которых состоят из центрального атома(или иона) М, непосредственно связанного с определенным числом n других молекул (или ионов) L., называемых лигандами.Комплексные соединения можно рассматривать как сложные соединения высшего порядка, состоящие из простых молекул способных к самостоятельному существованию в растворе. По координационной теории Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферу. Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса. Ее обычно заключают в квадратные скобки. Все остальное в комплексном соединении составляет внешнюю сферу и пишется за квадратными скобками. Общая запись формулы комплексного соединения имеет вид [MLn]Xm где М центральный атом,L-лиганд, Х-внешнесферная частица (молекула или ион) в квадратн скобки заключены частицы внутренней сферы. Центральный атом координирует лиганды, геометрически правильно располагая их в пространстве. Поэтому комплексные соединения частно назыв координационными . Число n лигандов соответственно координац числом, а внутренняя сфера координационной. Например [Сu(NH3)4]SO4/ Сu-центральный атом. Лиганлами явл. Молекулы аммиака. NH3 координац число n=4. Во внешнюю сферу уходит сульфат анион. SO42- Вокруг центрального атома размещается определенное число лигандов, которое определяется координационным числом (кч). Число координированных лигандов чаще всего равно 6 или 4. Лиганд занимает около центрального атома координационное место. При координации изменяются свойства как лигандов, так и центрального атома. Более прочно связанные частицы внутренней сферы называются комплексом (комплексным ионом). Между центральным атомом и лигандами действуют силы притяжения (образуется ковалентная связь по обменному и (или) донорно–акцепторному механизму), между лигандами – силы отталкивания. Если заряд внутренней сферы равен 0, то внешняя координационная сфера отсутствует. Центральный атом (комплексообразователь) – атом или ион, который занимает центральное положение в комплексном соединении. Роль комплексообразователя чаще всего выполняют частицы, имеющие свободные орбитали и достаточно большой положительный заряд ядра, а следовательно могут быть акцепторами электронов. Это катионы переходных элементов. Наиболее сильные комплексообразователи – элементы IВ и VIIIВ групп. Редко в качестве комплексообразователей выступают нейтральные атомы d–элементов [Fe(CO)5] и атомы неметаллов в различной степени окисления [PF6]—. Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число. Величина координационного числа зависит от многих факторов, но обычно она равна удвоенному заряду иона комплексообразователя: Лиганды – ионы или молекулы, которые непосредственно связаны с комплексообразователем и являются донорами электронных пар. Это электроноизбыточные системы, имеющие свободные и подвижные электронные пары, могут быть донорами электронов, например: Cl— ¯; F—¯; ОН—¯; CN—¯; CNS—¯; Н2О¯; NH 3¯; СО¯. Число мест, занимаемых каждым лигандом во внутренней сфере комплексного соединения называется координационной емкостью (дентатностью) лиганда. Она определяется числом электронных пар лиганда, которые участвуют в образовании координационной связи с центральным атомом. Соединения р–элементов проявляют комплексообразующие свойства и выступают в комплексном соединении в качестве лигандов. Лигандами могут быть атомы и молекулы (белка, аминокислот, нуклеиновых кислот, углеводов). По числу связей, образуемых лигандами с комплексообразователем, лиганды делятся на моно-, би- и полидентатные лиганды. Вышеперечисленные лиганды – молекулы и анионы являются монодентатными, так как они доноры одной электронной пары. К бидентатным лигандам относятся молекулы или ионы, содержащие две функциональные группы, способные быть донором двух электронных пар( – ООС — СОО –). К полидентатные лигандам можно отнести 6–дентатный лиганд этилендиаминтетрауксусной кислоты. 18. Пространственное строение комплексных соединений. Классы комплексных соединений. Пространственное строение комплекса определяется типом гибридизации атомных орбиталей центрального атома. Комплексные соединения с координационным числом 2 встречаются редко(sp-гибридизация).пример:[Ag(NH3)2]+. Наиболее распространены комплексы с координационными числами 4 и 6. Для описания геометрии комплексных соединений пользуются понятием координационных полиэдров(многогранник.вершинами которого служат лиганды, связанные с центральным атомом-комплексообразователем. Комплексы с координационным числом 4 могут быть как тетраэдрическими(sp3-гибридизация)пример:[Zn(NH3)4]2+ , так и плоскоквадратными(dsp2-гибридизация)пример:[Pt(NH3)4]2+. Комплексы с координационным числом 6 имеют октаэдрическую конфигурацию(d2sp3-гибридизация).Пример:[Ni(NH3)6]3+. Реже встречаются комплексы с координационным числом 5(dsp3-гибридизация). Они образуют тригональную бипирамиду(пример:[CdCI5]3-) или квадратную пирамиду.( пример:[Ni(CN)5]3-). Координационному числу 12(очень редко) соответствует икосаэдр. Классы комплексных соединений: 1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.). [(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II) [Co(NH3)6]Cl3 — хлорид гексоамминкобальта(II) 2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы. K2[BeF4] — тетрафторобериллат(II) калия Li[AlH4] — тетрагидридоалюминат(III) лития K3[Fe(CN)6] — гексацианоферрат(III) калия 3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а так же при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул. [Ni(CO)4] — тетракарбонилникель [Pt(NH3)2Cl2] — дихлородиамминплатина(II) 4)Внутрикомплексные клешневидные соединения, хелатные соединения. Классический пример— гликоколят меди \ 19. Комплексоны, их применение в медицине. Ионные равновесия в растворах комплексных соединений. Константа нестойкости комплексного иона. Сложные органические лиганды. Представление о строении металлоферментов. Механизм токсического действия тяжёлых металлов на основе ЖМКО. Комплексоны - аминополикарбоновые кислоты и их производные, применяемые в методе комплексонометрии, а также для умягчения воды и др. технических целей. В аналитической практике используют нитрилотриуксусную кислоту N (CH2COOH)3 — комплексон I и двунатриевую соль этой кислоты — комплексон III, или трилон Б. Вещества, устраняющие последствия воздействия ядов на биологические структуры и инактивирующие яды, посредством химических реакций, называют антидотами. (Na3 СаДТПА) – пентацин и (NaCa2 ДТПФ) – тримефацин. Их применяют при острых и хронических отравлениях свинцом, радионуклидами, алюминием, цинком, церием и др, (Na2СаЭДТФ) фосфицин успешно используется для выведения из организма ртути, свинца, берилия, марганца, актиноидов и других металлов. В водных растворах комплексных соединений устанавливается равновесие, которое характеризуется константой устойчивости (Куст.) или величиной, обратной ей, константой нестойкости (Кн). Пользуясь величиной соответствующей константы, необходимо уметь рассчитывать равновесные концентрации ионов в растворе комплексных соединений в присутствии избытка лиганда и без избытка лиганда. константа равновесия - константа нестойкости комплексного иона [Ag(NH3)2]+ : У сложных белков, кроме белковой цепи, имеется дополнительная небелковая группа. Она называется лиганд, то есть молекула, связанная с белком. В роли лиганда могут выступать любые молекулы: молекулы, выполняющие в белке структурную функцию – липиды, углеводы, нуклеиновые кислоты, минеральные элементы, какие-либо другие органические соединения: гем в гемоглобине, углеводы в гликопротеинах, ДНК и РНК в нуклеопротеинах, медь в церулоплазмине, переносимые белками молекулы: железо в трансферрине, гемоглобин в гаптоглобине, гем в гемопексине, субстраты для ферментов – любые молекулы и даже другие белки. Металлоферменты — ферментоы, для функционирования которых необходимо присутствие катионов тех или иных металлов. В подобном ферменте могут присутствовать несколько различных ионов металла. Катион металла при этом обеспечивает правильную пространственную конфигурацию активного центра металлофермента. Примерами металлоферментов являются карбоксипептидаза, карбоангидраза, или селен-зависимая монодейодиназа, конвертирующая тироксин в трийодтиронин ЖМКО Мягкие кислоты предпочтительней координируют мягкие основания, а жёсткие – жёсткие. Таким образом, ионы ртути, свинца, таллия (мягкие кислоты) имеют большее сродство к серосодержащим лигандам, а ионы магния, кальция (жёсткие) – к кислород- и азотсодержащим лигандам. 20) Понятие биогенности химических элементов. Биосфера, круговорот биогенных элементов. Классификация биогенных элементов по их функциональной роли: органогены, элементы электролитного фона, микроэлементы, ксенобиотики. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. |
