Основные понятия термодинамики
 Скачать 279.3 Kb. Скачать 279.3 Kb.
|
|
23. К р – блоку относятся 30 элементов IIIA-VIIIA групп периодической системы и входят во второй и третий малые периоды, а также в четвертый – шестой большие периоды. У элементов IIIA группы появляется первый электрон на р – орбитали. В других группах IVA-VIIIA происходит последовательное заполнение р – подуровня до 6 электронов. Строение внешних электронных оболочек атомов элементов р – блока ns2npa , где а = 1÷6. На свойства р–элементов и их соединений оказывает влияние как появление новых подуровней на внешней электронной оболочке, так и заполнение внутренних электронных оболочек. р – Элементы второго периода (В, С, N, O, F) резко отличаются от элементов нижеследующих периодов, так как, начиная с р–элементов третьего периода, появляется низколежащий свободный d-подуровень, на который могут переходить электроны с р – подуровня при возбуждении атома. Полностью заполненный 3 d-подуровень у р–элементов четвертого периода (Ga, Ge, As, Se, Br) обуславливает отличие их свойств от элементов третьего периода. Максимальное заполнение 4f-подуровня в шестом периоде сказывается на различии свойств р–элементов шестого и пятого периодов. Вдоль периода у р–элементов падает способность к образованию положительно заряженных ионов с зарядом, отвечающим номеру группы, и наоборот, способность к образованию отрицательных ионов с зарядом, равным (8 – № группы) возрастает. р – элементы образуют двухатомные молекулы Э2, различающиеся по устойчивости. Наиболее устойчивы молекулы элементов второго периода (N2, O2, F2). При переходе от IIIA к IVA и VA группам устойчивость двухатомных молекул возрастает, а затем при переходе к VIIIА группе понижается. В группах сверху вниз прочность связи Э–Э уменьшается. Постоянные пломбировочные (реставрационные) материалы предназначены для восстановления анатомической формы, функции и внешнего вида зуба, а также предотвращения развития кариеса. Один из разновидностей таких материалов цементы: – цинк-фосфатные цементы; – силикатные цементы; – силикофосфатные цементы. Твердокристаллические материалы К этой группе слепочных материалов относятся гипс, цинкоксиэвгеноловые и цинкоксигваяколовые пасты. Характерной особенностью этих масс является то, что в отвердевшем состоянии они имеют четкое кристаллическое строение, лишены пластичности и упругих свойств. 26. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Поверхностное натяжение. Адсорбция. Поверхностноактивные, неактивные и инактивные вещества. Ориентация молекул в поверхностном слое и структура биомембран. Подвижные поверхности раздела между жидкостью и газом (ж – г) и двумя несмешивающимися жидкостями (ж – ж). для таких систем справедливы следующие понятия. Поверхностные явления – процессы, происходящие на границе раздела фаз и обусловленные особенностями состава и строения поверхностного (пограничного) слоя. Поверхностная энергия Гиббса. Gs = ơ * s, где Gs – поверхностная энергия Гиббса системы, Дж; ơ – коэффициент пропорциональности, называемый поверхностным натяжением, Дж/м2; s – межфазная поверхность, м2. Поверхностное натяжение (ơ) - величина, численно равная энергии Гиббса, приходящейся на единицу площади поверхностного слоя и численно равная работе, которую необходимо совершить для образования единицы поверхности раздела фаз при постоянной температуре. –Стремление в-ва (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию). ПН зависит от природы жидкости и температуры (уменьшается с ростом t). Вода имеет самое высокое значение ПН. Поверхностная активность (g)– способность растворенных веществ изменять поверхностное натяжение растворителя. [Дж] G= - 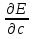 Адсорбция (Г) – самопроизвольное изменение концентрации растворенного вещества на границе раздела фаз. [моль/см2; моль/м2]. Адсорбция (Г) – самопроизвольное изменение концентрации растворенного вещества на границе раздела фаз. [моль/см2; моль/м2]. Классификация веществ по влиянию на поверхностное натяжение растворителя 1. Поверхностно-активные вещества (ПАВ) – понижают поверхностное натяжение растворителя g > 0, Г>0 (по отношению к воде – органические соединения дифильного строения). 2. Поверхностно-инактивные вещества (ПИВ) – незначительно повышают поверхностное натяжение растворителя g < 0, (неорганические кислоты, основания, соли, глицерин, и др). 3. Поверхностно-неактивные вещества (ПНВ) – практически не изменяют поверхностного натяжения растворителя g = 0, (по отношению к воде веществами являются сахароза и ряд других). Ориентация молекул в поверхностном слое и структура биомембран. Поскольку только полярная головка ПАВ растворима в воде, а гидрофобный хвост нет, то такие молекулы выталкиваются на поверхность, где и накапливаются - это пример положительной адсорбции. Пределом такой адсорбции служит полное насыщение поверхностного слоя адсорбируемыми веществами. Если вещество увеличивает поверхностное натяжение, то оно втягивается во внутренние слои жидкости. Это отрицательная адсорбция, поскольку поверхностные слои обедняются растворенным веществом. Лэнгмюр выдвинул предположение, что при максимальных величинах сорбции поверхность раствора покрыта слоем толщиной в одну молекулу ПАВ (мономолекулярным слоем), гидрофобные хвосты молекул ПАВ направлены перпендикулярно поверхности, образуя подобие частокола. При вертикальной ориентации длина цепи молекулы не влияет на площадь, занятую молекулой в поверхностном слое. Структура плазматической мембраны Все биомембраны построены одинаково; они состоят из двух слоев липидных молекул толщиной около 6 нм, в которые встроены белки. Некоторые мембраны содержат, кроме того, углеводы, связанные с липидами и белками. Соотношение липиды : белки : углеводы является характерным для клетки или мембраны и существенно варьирует в зависимости от типа клеток или мембран. Компоненты мембран удерживаются нековалентными связями, вследствие чего они обладают лишь относительной подвижностью, т. е. могут диффундировать в пределах липидного бислоя. Текучесть мембран зависит от липидного состава и температуры окружающей среды. С увеличением содержания ненасыщенных жирных кислот текучесть возрастает, так как наличие двойных связей способствует нарушению полукристаллической мембранной структуры. Подвижными являются и мембранные белки. Если белки не закреплены в мембране, они «плавают» в липидном бислое как в жидкости. Поэтому говорят, что биомембраны имеют жидкостно-мозаичную структуру. В то время как «дрейф» в плоскости мембраны происходит достаточно легко, переход белков с внешней стороны мембраны на внутреннюю невозможен, а переход липидов происходит крайне редко. Для «перескока» липидов необходимы специальные белки транслокаторы. Исключение составляет холестерин, который может легко переходить с одной стороны мембраны на другую. Мембранные липиды На рисунке схематически изображена биомембрана. В мембранах содержатся липиды трех классов: фосфолипиды, холестерин и гликолипиды. Холестерин присутствует во внутриклеточных мембранах животных клеток (за исключением внутренней мембраны митохондрий). Гликолипиды входят в состав многих мембран (например, во внешний слой плазматических мембран). В состав гликолипидов входят углеводные функциональные группы, которые ориентируются в водную фазу. 27. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. А. газов на твердых телах, а. из растворов, избирательная а., зависимость величины а. от различных факторов. Адсорбция на неподвижных поверхностях раздела твердое-жидкое, газ-жидкость, где удельная поверхность энергии гиббса поддается экспериментальному определения работает уравнение Фрейндлиха: a=k*c (в степени n) Если адсорбция на твердом теле происходит из раствора, то нужно учитывать,что кроме молекул растворенного вещества могут адсорбироваться и молекулы растворителя. Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т.е. экзотермичностью, причем тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата (10 – 80 кДж/моль). Таковой является, например, адсорбция инертных газов на угле. Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P: где k и k/ - константы. Для более широкого спектра концентраций изотерма мономолекулярной адсорбции описывается уравнением Ленгмюра; где Г∞ - емкость монослоя или предельная величина адсорбции, представ ляющая собой число молей ПАВ, приходящихся на 1 единицу по верхности в насыщенном адсорбционном слое; b, b/- константы адсорбционного взаимодействия, характеризующие энергию адсорбции. 28Дисперсные системы - гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностью раздела между ними. Обычно одна из фаз образует непрерывную дисперсионную среду, в объеме которой распределена дисперсная фаза (или несколько дисперсных фаз) в виде мелких кристаллов, твердых аморфных частиц, капель или пузырьков. По степени раздробленности (дисперсности) системы делятся на следующие классы: 1)грубодисперсные, размер частиц в которых более 10-5 м; 2)тонкодисперсные (микрогетерогенные) с размером частиц от 10-5 до 10-7 м; 3)коллоидно-дисперсные (ультрамикро-гетерогенные)с частицами размером от 10-7до 10-9м. Если фиксировать внимание на двух основных компонентах дисперсных систем, то одному из них следует приписать роль дисперсионной среды, а другому - роль дисперсной фазы. В этом случае все дисперсные системы можно классифицировать по агрегатным состояниям фаз. По агрегатным состояниям фаз- два класса: свободнодисперсные системы и сплошные (или связнодисперсные) системы .В свободнодисперсных системах дисперсная фаза не образует сплошных жестких структур (сеток, ферм или каркасов). Эти системы называют золями. В сплошных (связнодисперсных) системах частицы дисперсной фазы образуют жесткие пространственные структуры (сетки, каркасы, фермы). Такие системы оказывают сопротивление деформации сдвига. Классификация дисперсных систем по силе межмолекулярного взаимодействия: 1)лиофобные- слабое взаимодействие между дисперсной фазой и дисперсной средой 2)лиофильные- сильное взаимодействие Коллоидными системами называют двух или многофазные системы, в которых одна фаза находится в виде отдельных мелких частиц, распределенных в другой фазе. Такие ультрамикрогетерогенные системы с определенной (коллоидной) дисперсностью проявляют способность к интенсивному броуновскому движению и обладают высокой кинетической устойчивостью. Имея высокоразвитую поверхность раздела фаз и, следовательно, громадный избыток свободной поверхностной энергии, эти системы являются принципиально термодинамически неустойчивыми, что выражается в агрегации частиц, т.е. в отсутствии агрегативной устойчивости. Это системы с очень малой межфазовой энергией, они термодинамически устойчивы и образуются самопроизвольно. Мицеллы (уменьшительное от лат. mica — частица, крупинка) — частицы вколлоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекулрастворителя. Например, мицелла сульфида мышьяка имеет строение: {(As2S3)m•nHS−•(n-x)H+}x-•хН+ Средний размер мицелл от 10−5 до 10−7см. К мицеллам относят также частицы в растворах поверхностно-активных веществ (ПАВ), называемых лиофильными коллоидами. Например, мицеллы додецилсульфатав воде. В лиофильных золях мицелла представляет собой ассоциат молекул (агрегаты, состоящие из десятка и сотен амфильных молекул). В каждой молекуле длинный гидрофобный радикал связан с полярной (гидрофильной) группой. При образовании мицеллы несколько десятков или сотен молекул объединяются так, что гидрофобные радикалы образуют ядро (внутреннюю область), а гидрофильные группы — поверхностный слой мицеллы. Минимальную концентрацию поверхностно-активных веществ в растворе, при которой в системе образуются устойчивые мицеллы, находящиеся в равновесии с неассоциированными молекулами поверхностно-активного вещества, называют критической концентрацией мицеллоообразования. Если дисперсионной средой является органическая жидкость, ориентация молекул в мицелле может быть обратной: ядро содержит полярные группы, а гидрофобные радикалы обращены во внешнюю фазу (обратная мицелла)[1]. Мицеллы могут существовать в состояниях с различными равновесными структурами и в различных внешних формах, устойчивых при различных концентрациях ПАВ в мицеллярном растворе. Такая способность мицелл называется полиморфизмом мицелл. В лиофобных гидрозолях, стабилизованных электролитами, ядро мицеллы окружено двумя слоями противоположно заряженных ионов, то естьдвойным электрическим слоем. Диффузный слой ионов препятствует сближению и агрегированию (сцеплению) частиц. |
